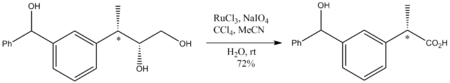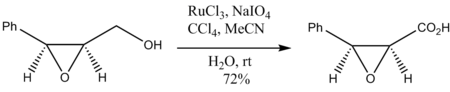Четырехокись рутения
| |||
| Имена | |||
|---|---|---|---|
| Название ИЮПАК Оксид рутения(VIII) | |||
| Идентификаторы | |||
3D model ( JSmol ) | |||
| ХимическийПаук | |||
| Информационная карта ECHA | 100.039.815 | ||
| Номер ЕС |
| ||
ПабХим CID | |||
| НЕКОТОРЫЙ | |||
Панель управления CompTox ( EPA ) | |||
| Характеристики | |||
| РуО 4 | |||
| Молярная масса | 165.07 g/mol | ||
| Появление | желтое, легко плавящееся твердое вещество | ||
| Запах | острый | ||
| Плотность | 3,29 г/см 3 | ||
| Точка кипения | 129.6 [1] ° С (265,3 ° F; 402,8 К) | ||
| 2% мас./об. при 20 °C | |||
| Растворимость в других растворителях | Растворим в Четыреххлористый углерод Хлороформ | ||
| Структура | |||
| четырехгранный | |||
| ноль | |||
| Опасности | |||
| NFPA 704 (огненный алмаз) | |||
| Паспорт безопасности (SDS) | внешний паспорт безопасности | ||
| Родственные соединения | |||
Родственные соединения | диоксид рутения трихлорид рутения | ||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |||
Четырехокись рутения – неорганическое соединение формулы RuO 4 . Это желтое летучее твердое вещество, которое плавится при комнатной температуре. [2] Имеет запах озона. [3] Образцы обычно черные из-за примесей. Аналогичный OsO 4 более широко используется и известен. Это также ангидрид гиперрутеновой кислоты (H 2 RuO 5 ). Одним из немногих растворителей, в которых RuO 4 образует устойчивые растворы, является CCl 4 . [4]
Подготовка
[ редактировать ]RuO 4 получают окислением хлорида рутения(III NaIO ) 4 . [2] Первоначально в результате реакции образуется дипериодигидроксорутенат натрия (VI), который затем разлагается в растворе кислоты до тетраоксида: [5]
- 8 Ру 3+ (водн.) + 5 ИО 4 − (вод) + 12 H 2 O(ж) → 8 RuO 4 (т) + 5 I − (водн.) + 24 ч. + (вода) [6]
Из-за своей сложной реакционной способности RuO 4 всегда образуется на месте и используется в каталитических количествах, по крайней мере, в органических реакциях. [4]
Структура
[ редактировать ]RuO 4 образует две кристаллические структуры: одну с кубической симметрией, а другую с моноклинной симметрией, изотипическую OsO 4 . Молекула имеет тетраэдрическую геометрию с расстояниями Ru–O от 169 до 170 пм. [7]
Использование
[ редактировать ]Выделение рутения из руд
[ редактировать ]Основное коммерческое значение RuO 4 имеет как промежуточный продукт при производстве соединений рутения и металлов из руд. Как и другие металлы платиновой группы (МПГ), рутений встречается в низких концентрациях и часто смешивается с другими МПГ. Вместе с OsO 4 его отделяют от других МПГ перегонкой хлорокисленного экстракта. Рутений отделяется от OsO 4 путем восстановления RuO 4 , соляной кислотой процесса, в котором используется весьма положительный потенциал восстановления [RuO 4 ] 0/- пара. [8] [9]
Органическая химия
[ редактировать ]RuO 4 представляет особую ценность в органической химии, поскольку окисляет практически любой углеводород. Например, он окислит адамантан до 1-адамантанола. Поскольку это очень агрессивный окислитель, условия реакции должны быть мягкими, обычно при комнатной температуре. является сильным окислителем, Несмотря на то, что RuO 4 окисление не нарушает стереоцентры неокисленные . Показательным является окисление следующего диола до карбоновой кислоты :
Окисление эпоксидных спиртов происходит также без разрушения эпоксидного кольца:
В более мягких условиях в результате окислительной реакции вместо этого образуются альдегиды . RuO 4 легко превращает вторичные спирты в кетоны . Хотя аналогичные результаты могут быть достигнуты с другими более дешевыми окислителями , такими как оксиданты на основе PCC или DMSO , RuO 4 идеален, когда необходим очень сильный окислитель, но необходимо поддерживать мягкие условия. Применяется в органическом синтезе для окисления внутренних алкинов до 1,2- дикетонов , а концевых алкинов вместе с первичными спиртами до карбоновых кислот . При таком использовании оксид рутения (VIII) используется в каталитических количествах и регенерируется добавлением периодата натрия к хлориду рутения (III) и смеси растворителей, состоящей из ацетонитрила , воды и четыреххлористого углерода . RuO 4 легко расщепляет двойные связи с образованием карбонильных продуктов аналогично озонолизу . OsO 4 , более известный окислитель, структурно похожий на RuO 4 , не расщепляет двойные связи, вместо этого образуя вицинальные диольные продукты. Однако при коротком времени реакции и тщательно контролируемых условиях RuO 4 также можно использовать для дигидроксилирования. [10]
Поскольку RuO 4 разрушает «двойные связи» аренов (особенно богатых электронами) путем дигидроксилирования и разрыва связи CC так, как это могут немногие другие реагенты, он полезен в качестве реагента для «снятия защиты» с карбоновых кислот, которые замаскированы под арильные группы (обычно фенил или п -метоксифенил). Поскольку образовавшиеся фрагменты сами по себе легко окисляются RuO 4 , значительная часть атомов углерода арена подвергается исчерпывающему окислению с образованием углекислого газа. Следовательно, для достижения полного превращения в карбоновую кислоту требуется несколько эквивалентов концевого окислителя (часто более 10 эквивалентов на арильное кольцо), что ограничивает практичность преобразования. [11] [12] [13]
Хотя RuO 4 используется в качестве прямого окислителя , из-за относительно высокой стоимости RuO 4 его также используют каталитически с соокислителем. При окислении циклических спиртов RuO 4 в качестве катализатора и бромата в качестве окислителя в основных условиях RuO 4 сначала активируется гидроксидом, превращаясь в гиперрутенат-анион:
- РуО 4 + ОН − → ХРУО 5 −
Реакция протекает через гликолатный комплекс.
Другое использование
[ редактировать ]Четырехокись рутения является потенциальным красителем. Он используется для выявления скрытых отпечатков пальцев путем превращения в коричневый/черный диоксид рутения при контакте с жирными маслами или жирами, содержащимися в сальных загрязнениях отпечатка. [14]
Выбросы газа в результате ядерных аварий
[ редактировать ]Из-за очень высокой летучести четырехокиси рутения ( RuO
4 ) радиоактивные изотопы рутения с их относительно коротким периодом полураспада считаются вторыми по опасности газообразными изотопами после йода-131 в случае выброса в результате ядерной аварии. [15] [3] [16] Два наиболее важных радиоактивных изотопа рутения : 103 Ру и 106 Ру. Их период полураспада составляет 39,6 дня и 373,6 дня соответственно. [3]
Ссылки
[ редактировать ]- ^ Кода, Ёсио (1986). «Температуры кипения и идеальные растворы тетраоксидов рутения и осмия». Журнал Химического общества, Химические коммуникации . 1986 (17): 1347–1348. дои : 10.1039/C39860001347 .
- ^ Jump up to: а б Х. Л. Грубе (1963). «Рутений (VIII) Оксид». В Г. Брауэре (ред.). Справочник по препаративной неорганической химии, 2-е изд . Том. 1. Нью-Йорк: Академик Пресс. стр. 1599–1600.
- ^ Jump up to: а б с Бэкман У., Липпонен М., Овинен А., Йокиниеми Дж. и Зиллиакус Р. (2004). Поведение рутения в условиях тяжелых ядерных аварий . Итоговый отчет (№ НКС–100). Северные исследования ядерной безопасности.
- ^ Jump up to: а б Мартин, В.С.; Паласон, Ж.М.; Родригес, CM; Невилл, ЧР (2006). «Оксид рутения (VIII)». Энциклопедия реагентов для органического синтеза . дои : 10.1002/047084289X.rr009.pub2 . ISBN 978-0471936237 .
- ^ Мерсер, Э.Э.; Мейер, С.М. (1972) [1 июля 1971 г.]. «Периодатный комплекс рутения (VI)». Дж. Неорг. Нукл. Хим . 34 (2). Великобритания: Пергам : 777–778 гг. дои : 10.1016/0022-1902(72)80466-4 .
- ^ Карлсен, Пер ХЮ; Кацуки, Цутому; Мартин, Виктор С.; Шарплесс, К. Барри (сентябрь 1981 г.). «Значительно улучшенная методика окисления органических соединений, катализируемого тетраоксидом рутения» . Журнал органической химии . 46 (19): 3936–3938. дои : 10.1021/jo00332a045 . ISSN 0022-3263 .
- ^ Плей, М.; Викледер, М.С. (2005). «Две кристаллические модификации RuO 4 ». Журнал химии твердого тела . 178 (10): 3206–3209. Бибкод : 2005JSSCh.178.3206P . дои : 10.1016/j.jssc.2005.07.021 .
- ^ Бернардис, Франческо Л.; Грант, Ричард А.; Шеррингтон, Дэвид К. (2005). «Обзор методов разделения металлов платиновой группы через их хлоркомплексы». Реактивные и функциональные полимеры . 65 (3): 205–217. doi : 10.1016/j.reactfunctpolym.2005.05.011 .
- ^ Суэйн, П.; Маллика, К.; Шринивасан, Р.; Мудали, Великобритания; Натараджан, Р. (2013). «Выделение и извлечение рутения: обзор». Журнал радиоаналитической и ядерной химии . 298 (2): 781–796. дои : 10.1007/s10967-013-2536-5 . S2CID 95804621 .
- ^ Плиткер, Бернд (2005). «Селективность против реакционной способности - последние достижения в окислении, катализируемом RuO4». Синтез . 5 (15): 2453–2472. дои : 10.1055/s-2005-872172 .
- ^ Нуньес, М. Тереза; Мартин, Виктор С. (март 1990 г.). «Эффективное окисление фенильных групп до карбоновых кислот тетраоксидом рутения. Простой синтез (R)-гамма-капролактона, феромона Trogoderma granarium». Журнал органической химии . 55 (6): 1928–1932. дои : 10.1021/jo00293a044 . ISSN 0022-3263 .
- ^ Наср, Халед; Панье, Надин; Франджиони, Джон В.; Мезон, Вольфганг (февраль 2008 г.). «Жесткие мультивалентные каркасы на основе адамантана» . Журнал органической химии . 73 (3): 1056–1060. дои : 10.1021/jo702310g . ISSN 0022-3263 . ПМК 2505186 . ПМИД 18179237 .
- ^ Мандер, Льюис Н.; Уильямс, Крейг М. (17 февраля 2003 г.). «Окислительная деградация бензольных колец». Тетраэдр . 59 (8): 1105–1136. дои : 10.1016/S0040-4020(02)01492-8 . ISSN 0040-4020 .
- ^ Машико, К.; Миямото, Т. (1998). «Обработка скрытых отпечатков пальцев методом тетраоксида рутения» . Журнал судебно-медицинской идентификации . 48 (3): 279–290. дои : 10.3408/jasti.2.21 .
- ^ Ронно, К.; Кара, Дж.; Римский-Корсаков, А. (1995). «Окислительная эмиссия рутения из ядерного топлива» . Журнал радиоактивности окружающей среды . 26 : 63–70. дои : 10.1016/0265-931X(95)91633-F .
- ^ Бёзе, Эмили; Лами, Жан-Сильвестр; Перрон, Адриан; Симони, Эрик; Дюкро, Жерар (2012). «Моделирование выбросов рутения в воздушную и паровую атмосферу в условиях тяжелых аварий с использованием кода MAAP4». Ядерная инженерия и дизайн . 246 : 157–162. doi : 10.1016/j.nucengdes.2011.08.025 .
Дальнейшее чтение
[ редактировать ]- Коттон, ЮАР (1997). Химия драгоценных металлов . Лондон: Чепмен и Холл. ISBN 978-0-7514-0413-5 .
- Фармер, В.; Велтон, Т. (2002). «Окисление спиртов в замещенных имидазолиевых ионных жидкостях с использованием рутениевых катализаторов». Зеленая химия . 4 (2): 97. дои : 10.1039/B109851A .
- Сингх, Б.; Шривастава, С. (1991). «Кинетика и механизм катализируемого четырехокисью рутения окисления циклических спиртов броматом в основании». Химия переходных металлов . 16 (4): 466. дои : 10.1007/BF01129466 . S2CID 95711945 .
- Кортни, Дж.Л.; Свансбор, К.Ф. (1972). «Окисление четырехокиси рутения». Обзоры по чистой и прикладной химии . 22:47 .