Сусид углерода
 | |
 | |
| Имена | |
|---|---|
| Предпочтительное название ИЮПАК Пропа-1,2-диен-1,3-дион | |
| Идентификаторы | |
3D model ( JSmol ) | |
| ЧЭБИ | |
| ХимическийПаук | |
| МеШ | Углерод+субоксид |
ПабХим CID | |
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA ) | |
| Характеристики | |
| C3OC3O2 | |
| Молярная масса | 68.031 g·mol −1 |
| Появление | бесцветный газ |
| Запах | сильный, резкий запах |
| Плотность | 3,0 кг/м 3 , газ [1] 1,114 г/см 3 , жидкость [2] |
| Температура плавления | -111,3 ° C (-168,3 ° F; 161,8 К) |
| Точка кипения | 6,8 ° C (44,2 ° F; 279,9 К) |
| реагирует | |
| Растворимость | растворим в 1,4-диоксане , эфире , ксилоле , CS 2 , тетрагидрофуране |
Показатель преломления ( n D ) | 1,4538 (6 °С) |
| 0 Д | |
| Структура | |
| ромбический | |
| квазилинейный (фазозависимый) | |
| Термохимия | |
Теплоемкость ( С ) | 66,99 Дж/моль К |
Стандартный моляр энтропия ( S ⦵ 298 ) | 276,1 Дж/моль К |
Стандартная энтальпия образование (Δ f H ⦵ 298 ) | −93,6 кДж/моль |
| Родственные соединения | |
Родственные оксиды | углекислый газ окись углерода окись углерода |
Родственные соединения | сероуглерод субнитрид углерода |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
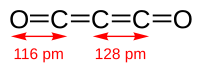
Суоксид углерода , или диоксид углерода , представляет собой кислородсодержащее химическое органическое соединение формулы C 3 O 2 и строение О=С=С=С=О . Его четыре совокупные двойные связи делают его кумуленом . Это один из стабильных представителей ряда линейных оксоуглеродов. O=C n =O , в состав которого также входит углекислый газ ( CO 2 ) и пентакарбон диоксид ( С 5 О 2 ). Хотя при тщательной очистке он может существовать при комнатной температуре в темноте, не разлагаясь, он полимеризуется при определенных условиях .
Вещество было открыто в 1873 году Бенджамином Броди путем воздействия на угарный газ электрическим током. Он утверждал, что продукт входит в серию «оксиуглеродов» с формулами C x +1 O x , а именно С 2 О , С 3 О 2 , С 4 О 3 , C 5 O 4 , … и идентифицировать два последних; [3] [4] однако, только C 3 O 2 известен. В 1891 году Марселлен Бертело заметил, что при нагревании чистого монооксида углерода при температуре около 550 ° C образуется небольшое количество углекислого газа, но не остается следов углерода, и предположил, что вместо этого образуется богатый углеродом оксид, который он назвал «субоксидом». Он предположил, что это тот же продукт, полученный электрическим разрядом, и предложил формулу С 2 О. [5] Позже Отто Дильс заявил, что более органические названия дикарбонилметан и диоксаллен также верны.
Его обычно описывают как маслянистую жидкость или газ при комнатной температуре с чрезвычайно неприятным запахом. [6]
Синтез
[ редактировать ]Его синтезируют нагреванием сухой смеси пятиокиси фосфора ( P 4 O 10 ) и малоновая кислота или ее эфиры . [7] Следовательно, его также можно рассматривать как ангидрид малонового ангидрида , т.е. «второй ангидрид» малоновой кислоты. [8]
Несколько других способов синтеза и реакций перекиси углерода можно найти в обзоре Рейерсона 1930 года. [6]
Полимеризация
[ редактировать ]Суоксид углерода самопроизвольно полимеризуется с образованием красного, желтого или черного твердого вещества. Предполагается, что структура является поли(α-пироновой), аналогичной структуре 2-пирона (α-пирона). [9] [10] Число мономеров в полимерах варьируется (см. Оксоуглерод#Полимерные оксиды углерода ).В 1969 году была выдвинута гипотеза, что цвет поверхности Марса обусловлен этим соединением; это было опровергнуто марсианскими зондами «Викинг» (красный цвет обусловлен оксидом железа ). [11]
Использование
[ редактировать ]Перекись углерода используется при получении малонатов ; и в качестве вспомогательного средства для улучшения красителей меха.
В химическом синтезе субоксид углерода представляет собой 1,3-диполь , реагируя с алкенами с образованием 1,3-циклопентадионов. Поскольку он настолько нестабилен, это реагент последней инстанции. [12]
Биологическая роль
[ редактировать ]
Суоксид углерода, C 3 O 2 , может быть произведен в небольших количествах в любом биохимическом процессе, который обычно производит оксид углерода , CO, например, во время окисления гема гемоксигеназой-1. Он также может быть образован из малоновой кислоты. Показано, что субоксид углерода в организме способен быстро полимеризоваться в макроциклические полиуглеродные структуры общей формулы ( C 3 O 2 ) n (в основном (C 3 O 2 ) 6 и (C 3 O 2 ) 8 ), и что эти макроциклические соединения являются мощными ингибиторами Na. + /К + -АТФ-аза и Са-зависимая АТФ-аза обладают дигоксиноподобными физиологическими свойствами, а также натрийуретическим и антигипертензивным действием. Считается, что эти макроциклические полимерные соединения субоксида углерода являются эндогенными дигоксиноподобными регуляторами Na. + /К + -АТФ-азы и Са-зависимые АТФ-азы, а также эндогенные натриуретики и антигипертензивные средства. [13] [14] [15] Помимо этого, некоторые авторы также полагают, что эти макроциклические соединения субоксида углерода могут уменьшать образование свободных радикалов и окислительный стресс, а также играть роль в эндогенных противораковых защитных механизмах, например, в сетчатке . [16]
Структура и связь
[ редактировать ]Структура перекиси углерода является предметом экспериментов и расчетов с 1970-х годов. Центральным вопросом является вопрос о том, является ли молекула линейной или изогнутой (т.е. ). Исследования в целом сходятся во мнении, что молекула очень нежёсткая, с очень неглубоким барьером для изгиба. Согласно одному исследованию, геометрия молекул описывается двухямным потенциалом с минимумом при θ C 2 ~ 160°, инверсионным барьером 20 см. −1 (0,057 ккал/моль), а полное изменение энергии 80 см-1. −1 (0,23 ккал/моль) для 140° ≤ θ C 2 ≤ 180°. [17] Небольшой энергетический барьер изгибу примерно того же порядка, что и энергия нулевой точки вибрации . Поэтому молекулу лучше всего описать как квазилинейную. В то время как инфракрасный [18] и дифракция электронов [19] исследования показали, что C 3 O 2 имеет изогнутую структуру в газовой фазе, с помощью рентгеновской кристаллографии было обнаружено, что соединение обладает по крайней мере средней линейной геометрией в твердой фазе, хотя большие термические эллипсоиды атомов кислорода и C 2 были интерпретированы чтобы соответствовать быстрому изгибу (минимум θ C 2 ~ 170°), даже в твердом состоянии. [10]
Гетерокумуленовая резонансная форма субоксида углерода, основанная на минимизации формальных зарядов, с трудом объясняет нежесткость молекулы и отклонение от линейности. Чтобы объяснить квазилинейную структуру субоксида углерода, Френкинг предложил рассматривать субоксид углерода как «координационный комплекс» углерода (0), несущий два карбонильных лиганда и две неподеленные пары: . [20] Однако вклад дательной связи в C 3 O 2 и подобные виды подвергались критике со стороны других как химически необоснованные. [21]

Ссылки
[ редактировать ]- ^ «Углекислый газ» . Периодическая таблица WebElements . Проверено 19 февраля 2019 г.
- ^ West RC, Astle MJ, ред. (1983). Справочник CRC по химии и физике (64-е изд.). Бока-Ратон: CRC Press. п. Б-82. ISBN 9780849304637 .
- ^ Броди, Британская Колумбия (1873 г.). «Заметка о синтезе болотного газа и муравьиной кислоты и об электрическом разложении окиси углерода» . Учеб. Р. Сок. Лонд. 21 (139–147): 245–247. дои : 10.1098/rspl.1872.0052 . JSTOR 113037 .
Когда чистый и сухой оксид углерода [= окись углерода] циркулирует через индукционную трубку и подвергается там воздействию электричества, происходит разложение газа [...] образуется угольная кислота [= диоксид углерода], и одновременно с его образованием в индукционной трубке может наблюдаться твердый осадок. Этот осадок выглядит как прозрачная пленка красно-коричневого цвета, выстилающая стенки пробирки. Он прекрасно растворяется в воде, которая сильно окрашивается им. Раствор имеет сильно кислую реакцию. Твердый осадок в сухом состоянии до контакта с водой представляет собой оксид углерода.
- ^ Броди, Британская Колумбия (1873 г.). «О синтезе болотного газа и муравьиной кислоты и электрическом разложении оксида углерода» . Анна Либиха. 169 (1–2): 270–271. дои : 10.1002/jlac.18731690119 .
- ^ Бертло М. (1891). «Действие тепла на угарный газ» . Анналы химии и физики . 6 (24): 126–132. Архивировано из оригинала 17 февраля 2012 года . Проверено 21 февраля 2007 г.
- ^ Перейти обратно: а б Рейерсон Л.Х., Кобе К. (1930). «Углекислый газ». хим. Откр. 7 (4): 479–492. дои : 10.1021/cr60028a002 .
- ^ Дильс О , Вольф Б (1906). «О угарном газе. Я» . Хим. Бер. 39 :689-697. дои : 10.1002/cber.190603901103 .
- ^ Перкс Х.М., Либман Дж.Ф. (2000). «Парадигмы и парадоксы: аспекты энергетики карбоновых кислот и их ангидридов». Структурная химия . 11 (4): 265–269. дои : 10.1023/А:1009270411806 . S2CID 92816468 .
- ^ Баллауф М. , Ли Л., Розенфельдт С. и др. (2004). «Анализ поли(субооксида углерода) методом малоуглового рентгеновского рассеяния». Angewandte Chemie, международное издание . 43 (43): 5843–5846. дои : 10.1002/anie.200460263 . ПМИД 15523711 .
- ^ Перейти обратно: а б Эллерн А., Дрюс Т., Сеппельт К. (2001). «Структура субоксида углерода C 3 O 2 в твердом состоянии». З. Анорг. Аллг. хим. 627 (1): 73–76. doi : 10.1002/1521-3749(200101)627:1<73::AID-ZAAC73>3.0.CO;2-A .
- ^ Пламмер В.Т., Карсонт Р.К. (1969). «Марс: поверхность окрашена углекислым газом?». Наука . 166 (3909): 1141–1142. Бибкод : 1969Sci...166.1141P . дои : 10.1126/science.166.3909.1141 . ПМИД 17775571 . S2CID 31568906 .
- ^ «Углекислый газ». Энциклопедия реагентов для органического синтеза . дои : 10.1002/047084289X.rc015 .
- ^ Керек Ф (2000). «Структура дигиталисоподобных и натрийуретических факторов, идентифицированных как макроциклические производные неорганического субоксида углерода» . Исследования гипертонии . 23 (Приложение S33): S33–38. doi : 10.1291/hypres.23.Supplement_S33 . ПМИД 11016817 .
- ^ Стимак Р., Керек Ф., Апелл Х.Дж. (2003). «Макроциклические олигомеры субоксида углерода как мощные ингибиторы Na,K-АТФазы» . Энн. Н-Й акад. наук. 986 (1): 327–329. Бибкод : 2003NYASA.986..327S . дои : 10.1111/j.1749-6632.2003.tb07204.x . ПМИД 12763840 .
- ^ Керек Ф., Стимак Р., Апелл Х.Дж. и др. (2002). «Характеристика макроциклических факторов субоксида углерода как мощных ингибиторов Na,K-АТФазы и SR Ca-АТФазы» . Biochimica et Biophysical Acta (BBA) – Биомембраны . 1567 (1–2): 213–220. дои : 10.1016/S0005-2736(02)00609-0 . ПМИД 12488055 .
- ^ Тубаро Э (1966). «Перекись углерода, вероятный предшественник противоопухолевого клеточного вещества: сетчатки». Боллеттино Химико Фармасьютико (на итальянском языке). 105 (6): 415–416. ПМИД 6005012 .
- ^ Браун Р.Д. (1993). «Структурная информация о движениях большой амплитуды». В деле Лаане Дж., Даккури М., Veken Bv и др. (ред.). Структуры и конформации нежестких молекул . Серия НАТО ASI. Том. 410. Спрингер Нидерланды. стр. 99–112. дои : 10.1007/978-94-011-2074-6_5 . ISBN 9789401049207 .
- ^ Дженсен П., Джонс Дж.В. (1986). «Инфракрасный спектр субоксида углерода в фундаментальной области ν6: экспериментальное наблюдение и анализ полужесткого изгиба». Дж. Мол. Спектроск. 118 (1): 248–266. Бибкод : 1986JMoSp.118..248J . дои : 10.1016/0022-2852(86)90239-0 .
- ^ Кларк А. (1970). «Потенциальная функция изгиба CCC в субоксиде углерода». хим. Физ. Летт. 6 (5): 452–456. Бибкод : 1970CPL.....6..452C . дои : 10.1016/0009-2614(70)85190-9 .
- ^ Френкинг Г., Тоннер Р. (2009). «Соединения двухвалентного углерода (0)» . Чистое приложение. хим. 81 (4): 597–614. doi : 10.1351/pac-con-08-11-03 . ISSN 1365-3075 . S2CID 98257123 .
- ^ Химмель Д., Кроссинг И., Шнепф А. (2014). «Дативные связи в соединениях главной группы: аргумент в пользу меньшего количества стрел!». Angewandte Chemie, международное издание . 53 (2): 370–374. дои : 10.1002/anie.201300461 . ISSN 1521-3773 . ПМИД 24243854 .
Внешние ссылки
[ редактировать ]- Страница WebElements со свойствами соединения
- «Каталог Немецкой национальной библиотеки» [Каталог Немецкой национальной библиотеки]. Немецкая национальная библиотека | dnb.de (на немецком языке).

