Железо
 | ||||||||||||||||||||||||||||||||||||||||||||||
| Железо | ||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Произношение | / ˈ aɪ ə r n / | |||||||||||||||||||||||||||||||||||||||||||||
| Аллотропы | см . Аллотропы железа | |||||||||||||||||||||||||||||||||||||||||||||
| Появление | блестящий металлик с сероватым оттенком | |||||||||||||||||||||||||||||||||||||||||||||
| Стандартный атомный вес А р °(Fe) | ||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||
| Железо в таблице Менделеева | ||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||
| Atomic number (Z) | 26 | |||||||||||||||||||||||||||||||||||||||||||||
| Group | group 8 | |||||||||||||||||||||||||||||||||||||||||||||
| Period | period 4 | |||||||||||||||||||||||||||||||||||||||||||||
| Block | d-block | |||||||||||||||||||||||||||||||||||||||||||||
| Electron configuration | [Ar] 3d6 4s2 | |||||||||||||||||||||||||||||||||||||||||||||
| Electrons per shell | 2, 8, 14, 2 | |||||||||||||||||||||||||||||||||||||||||||||
| Physical properties | ||||||||||||||||||||||||||||||||||||||||||||||
| Phase at STP | solid | |||||||||||||||||||||||||||||||||||||||||||||
| Melting point | 1811 K (1538 °C, 2800 °F) | |||||||||||||||||||||||||||||||||||||||||||||
| Boiling point | 3134 K (2861 °C, 5182 °F) | |||||||||||||||||||||||||||||||||||||||||||||
| Density (at 20° C) | 7.874 g/cm3 [3] | |||||||||||||||||||||||||||||||||||||||||||||
| when liquid (at m.p.) | 6.98 g/cm3 | |||||||||||||||||||||||||||||||||||||||||||||
| Heat of fusion | 13.81 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||
| Heat of vaporization | 340 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||
| Molar heat capacity | 25.10 J/(mol·K) | |||||||||||||||||||||||||||||||||||||||||||||
Vapor pressure
| ||||||||||||||||||||||||||||||||||||||||||||||
| Atomic properties | ||||||||||||||||||||||||||||||||||||||||||||||
| Oxidation states | −4, −2, −1, 0, +1,[4] +2, +3, +4, +5,[5] +6, +7[6] (an amphoteric oxide) | |||||||||||||||||||||||||||||||||||||||||||||
| Electronegativity | Pauling scale: 1.83 | |||||||||||||||||||||||||||||||||||||||||||||
| Ionization energies |
| |||||||||||||||||||||||||||||||||||||||||||||
| Atomic radius | empirical: 126 pm | |||||||||||||||||||||||||||||||||||||||||||||
| Covalent radius | Low spin: 132±3 pm High spin: 152±6 pm | |||||||||||||||||||||||||||||||||||||||||||||
| Van der Waals radius | 194 [1] pm | |||||||||||||||||||||||||||||||||||||||||||||
| Other properties | ||||||||||||||||||||||||||||||||||||||||||||||
| Natural occurrence | primordial | |||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | α-Fe: body-centered cubic (bcc) (cI2) | |||||||||||||||||||||||||||||||||||||||||||||
| Lattice constant | a = 286.65 pm (at 20 °C)[3] | |||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | γ-Fe (912–1394 °C): face-centered cubic (fcc) (cF4) | |||||||||||||||||||||||||||||||||||||||||||||
| Lattice constant | a = 364.68 pm (at 916 °C)[7] | |||||||||||||||||||||||||||||||||||||||||||||
| Thermal expansion | 12.07×10−6/K (at 20 °C)[3] | |||||||||||||||||||||||||||||||||||||||||||||
| Thermal conductivity | 80.4 W/(m⋅K) | |||||||||||||||||||||||||||||||||||||||||||||
| Electrical resistivity | 96.1 nΩ⋅m (at 20 °C) | |||||||||||||||||||||||||||||||||||||||||||||
| Curie point | 1043 K | |||||||||||||||||||||||||||||||||||||||||||||
| Magnetic ordering | ferromagnetic | |||||||||||||||||||||||||||||||||||||||||||||
| Young's modulus | 211 GPa | |||||||||||||||||||||||||||||||||||||||||||||
| Shear modulus | 82 GPa | |||||||||||||||||||||||||||||||||||||||||||||
| Bulk modulus | 170 GPa | |||||||||||||||||||||||||||||||||||||||||||||
| Speed of sound thin rod | 5120 m/s (at r.t.) (electrolytic) | |||||||||||||||||||||||||||||||||||||||||||||
| Poisson ratio | 0.29 | |||||||||||||||||||||||||||||||||||||||||||||
| Mohs hardness | 4 | |||||||||||||||||||||||||||||||||||||||||||||
| Vickers hardness | 608 MPa | |||||||||||||||||||||||||||||||||||||||||||||
| Brinell hardness | 200–1180 MPa | |||||||||||||||||||||||||||||||||||||||||||||
| CAS Number | 7439-89-6 | |||||||||||||||||||||||||||||||||||||||||||||
| History | ||||||||||||||||||||||||||||||||||||||||||||||
| Discovery | before 5000 BC | |||||||||||||||||||||||||||||||||||||||||||||
| Symbol | "Fe": from Latin ferrum | |||||||||||||||||||||||||||||||||||||||||||||
| Isotopes of iron | ||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||
Железо – химический элемент . Он имеет символ Fe (от латинского Ferrum «железо») и атомный номер 26. Это металл , принадлежащий к первому переходному ряду и 8-й группе периодической таблицы . По массе это самый распространенный элемент на Земле Земли , образующий большую часть внешнего и внутреннего ядра . Это четвертый по распространенности элемент в земной коре , который в основном откладывается метеоритами в металлическом состоянии.
Для извлечения полезного металла из железной руды требуются печи или печи , способные достигать температуры 1500 ° C (2730 ° F), что примерно на 500 ° C (932 ° F) выше, чем температура, необходимая для выплавки меди . Люди начали осваивать этот процесс в Евразии во 2-м тысячелетии до нашей эры , и использование железных инструментов и оружия начало вытеснять медные сплавы – в некоторых регионах только около 1200 года до нашей эры. Это событие считается переходом от бронзового века к железному веку . В современном мире сплавы железа, такие как сталь , нержавеющая сталь , чугун и специальные стали , на сегодняшний день являются наиболее распространенными промышленными металлами благодаря своим механическим свойствам и низкой стоимости. Таким образом, черная и сталелитейная промышленность очень важна с экономической точки зрения, а железо является самым дешевым металлом, цена которого составляет несколько долларов за килограмм или фунт.
Pristine and smooth pure iron surfaces are a mirror-like silvery-gray. Iron reacts readily with oxygen and water to produce brown-to-black hydrated iron oxides, commonly known as rust. Unlike the oxides of some other metals that form passivating layers, rust occupies more volume than the metal and thus flakes off, exposing more fresh surfaces for corrosion. Chemically, the most common oxidation states of iron are iron(II) and iron(III). Iron shares many properties of other transition metals, including the other group 8 elements, ruthenium and osmium. Iron forms compounds in a wide range of oxidation states, −4 to +7. Iron also forms many coordination compounds; some of them, such as ferrocene, ferrioxalate, and Prussian blue have substantial industrial, medical, or research applications.
The body of an adult human contains about 4 grams (0.005% body weight) of iron, mostly in hemoglobin and myoglobin. These two proteins play essential roles in oxygen transport by blood and oxygen storage in muscles. To maintain the necessary levels, human iron metabolism requires a minimum of iron in the diet. Iron is also the metal at the active site of many important redox enzymes dealing with cellular respiration and oxidation and reduction in plants and animals.[9]
Characteristics
Allotropes

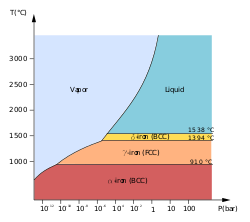
At least four allotropes of iron (differing atom arrangements in the solid) are known, conventionally denoted α, γ, δ, and ε.
The first three forms are observed at ordinary pressures. As molten iron cools past its freezing point of 1538 °C, it crystallizes into its δ allotrope, which has a body-centered cubic (bcc) crystal structure. As it cools further to 1394 °C, it changes to its γ-iron allotrope, a face-centered cubic (fcc) crystal structure, or austenite. At 912 °C and below, the crystal structure again becomes the bcc α-iron allotrope.[10]
The physical properties of iron at very high pressures and temperatures have also been studied extensively,[11][12] because of their relevance to theories about the cores of the Earth and other planets. Above approximately 10 GPa and temperatures of a few hundred kelvin or less, α-iron changes into another hexagonal close-packed (hcp) structure, which is also known as ε-iron. The higher-temperature γ-phase also changes into ε-iron, but does so at higher pressure.
Some controversial experimental evidence exists for a stable β phase at pressures above 50 GPa and temperatures of at least 1500 K. It is supposed to have an orthorhombic or a double hcp structure.[13] (Confusingly, the term "β-iron" is sometimes also used to refer to α-iron above its Curie point, when it changes from being ferromagnetic to paramagnetic, even though its crystal structure has not changed.[10])
The inner core of the Earth is generally presumed to consist of an iron-nickel alloy with ε (or β) structure.[14]
Melting and boiling points
The melting and boiling points of iron, along with its enthalpy of atomization, are lower than those of the earlier 3d elements from scandium to chromium, showing the lessened contribution of the 3d electrons to metallic bonding as they are attracted more and more into the inert core by the nucleus;[15] however, they are higher than the values for the previous element manganese because that element has a half-filled 3d sub-shell and consequently its d-electrons are not easily delocalized. This same trend appears for ruthenium but not osmium.[16]
The melting point of iron is experimentally well defined for pressures less than 50 GPa. For greater pressures, published data (as of 2007) still varies by tens of gigapascals and over a thousand kelvin.[17]
Magnetic properties

Below its Curie point of 770 °C (1,420 °F; 1,040 K), α-iron changes from paramagnetic to ferromagnetic: the spins of the two unpaired electrons in each atom generally align with the spins of its neighbors, creating an overall magnetic field.[19] This happens because the orbitals of those two electrons (dz2 and dx2 − y2) do not point toward neighboring atoms in the lattice, and therefore are not involved in metallic bonding.[10]
In the absence of an external source of magnetic field, the atoms get spontaneously partitioned into magnetic domains, about 10 micrometers across,[20] such that the atoms in each domain have parallel spins, but some domains have other orientations. Thus a macroscopic piece of iron will have a nearly zero overall magnetic field.
Application of an external magnetic field causes the domains that are magnetized in the same general direction to grow at the expense of adjacent ones that point in other directions, reinforcing the external field. This effect is exploited in devices that need to channel magnetic fields to fulfill design function, such as electrical transformers, magnetic recording heads, and electric motors. Impurities, lattice defects, or grain and particle boundaries can "pin" the domains in the new positions, so that the effect persists even after the external field is removed – thus turning the iron object into a (permanent) magnet.[19]
Similar behavior is exhibited by some iron compounds, such as the ferrites including the mineral magnetite, a crystalline form of the mixed iron(II,III) oxide Fe3O4 (although the atomic-scale mechanism, ferrimagnetism, is somewhat different). Pieces of magnetite with natural permanent magnetization (lodestones) provided the earliest compasses for navigation. Particles of magnetite were extensively used in magnetic recording media such as core memories, magnetic tapes, floppies, and disks, until they were replaced by cobalt-based materials.
Isotopes
Iron has four stable isotopes: 54Fe (5.845% of natural iron), 56Fe (91.754%), 57Fe (2.119%) and 58Fe (0.282%). Twenty-four artificial isotopes have also been created. Of these stable isotopes, only 57Fe has a nuclear spin (−1⁄2). The nuclide 54Fe theoretically can undergo double electron capture to 54Cr, but the process has never been observed and only a lower limit on the half-life of 3.1×1022 years has been established.[21]
60Fe is an extinct radionuclide of long half-life (2.6 million years).[22] It is not found on Earth, but its ultimate decay product is its granddaughter, the stable nuclide 60Ni.[21] Much of the past work on isotopic composition of iron has focused on the nucleosynthesis of 60Fe through studies of meteorites and ore formation. In the last decade, advances in mass spectrometry have allowed the detection and quantification of minute, naturally occurring variations in the ratios of the stable isotopes of iron. Much of this work is driven by the Earth and planetary science communities, although applications to biological and industrial systems are emerging.[23]
In phases of the meteorites Semarkona and Chervony Kut, a correlation between the concentration of 60Ni, the granddaughter of 60Fe, and the abundance of the stable iron isotopes provided evidence for the existence of 60Fe at the time of formation of the Solar System. Possibly the energy released by the decay of 60Fe, along with that released by 26Al, contributed to the remelting and differentiation of asteroids after their formation 4.6 billion years ago. The abundance of 60Ni present in extraterrestrial material may bring further insight into the origin and early history of the Solar System.[24]
The most abundant iron isotope 56Fe is of particular interest to nuclear scientists because it represents the most common endpoint of nucleosynthesis.[25] Since 56Ni (14 alpha particles) is easily produced from lighter nuclei in the alpha process in nuclear reactions in supernovae (see silicon burning process), it is the endpoint of fusion chains inside extremely massive stars, since addition of another alpha particle, resulting in 60Zn, requires a great deal more energy. This 56Ni, which has a half-life of about 6 days, is created in quantity in these stars, but soon decays by two successive positron emissions within supernova decay products in the supernova remnant gas cloud, first to radioactive 56Co, and then to stable 56Fe. As such, iron is the most abundant element in the core of red giants, and is the most abundant metal in iron meteorites and in the dense metal cores of planets such as Earth.[26] It is also very common in the universe, relative to other stable metals of approximately the same atomic weight.[26][27] Iron is the sixth most abundant element in the universe, and the most common refractory element.[28]

Although a further tiny energy gain could be extracted by synthesizing 62Ni, which has a marginally higher binding energy than 56Fe, conditions in stars are unsuitable for this process. Element production in supernovas greatly favor iron over nickel, and in any case, 56Fe still has a lower mass per nucleon than 62Ni due to its higher fraction of lighter protons.[29] Hence, elements heavier than iron require a supernova for their formation, involving rapid neutron capture by starting 56Fe nuclei.[26]
In the far future of the universe, assuming that proton decay does not occur, cold fusion occurring via quantum tunnelling would cause the light nuclei in ordinary matter to fuse into 56Fe nuclei. Fission and alpha-particle emission would then make heavy nuclei decay into iron, converting all stellar-mass objects to cold spheres of pure iron.[30]
Origin and occurrence in nature
Cosmogenesis
Iron's abundance in rocky planets like Earth is due to its abundant production during the runaway fusion and explosion of type Ia supernovae, which scatters the iron into space.[31][32]
Metallic iron

Metallic or native iron is rarely found on the surface of the Earth because it tends to oxidize. However, both the Earth's inner and outer core, which together account for 35% of the mass of the whole Earth, are believed to consist largely of an iron alloy, possibly with nickel. Electric currents in the liquid outer core are believed to be the origin of the Earth's magnetic field. The other terrestrial planets (Mercury, Venus, and Mars) as well as the Moon are believed to have a metallic core consisting mostly of iron. The M-type asteroids are also believed to be partly or mostly made of metallic iron alloy.
The rare iron meteorites are the main form of natural metallic iron on the Earth's surface. Items made of cold-worked meteoritic iron have been found in various archaeological sites dating from a time when iron smelting had not yet been developed; and the Inuit in Greenland have been reported to use iron from the Cape York meteorite for tools and hunting weapons.[33] About 1 in 20 meteorites consist of the unique iron-nickel minerals taenite (35–80% iron) and kamacite (90–95% iron).[34] Native iron is also rarely found in basalts that have formed from magmas that have come into contact with carbon-rich sedimentary rocks, which have reduced the oxygen fugacity sufficiently for iron to crystallize. This is known as telluric iron and is described from a few localities, such as Disko Island in West Greenland, Yakutia in Russia and Bühl in Germany.[35]
Mantle minerals
Ferropericlase (Mg,Fe)O, a solid solution of periclase (MgO) and wüstite (FeO), makes up about 20% of the volume of the lower mantle of the Earth, which makes it the second most abundant mineral phase in that region after silicate perovskite (Mg,Fe)SiO3; it also is the major host for iron in the lower mantle.[36] At the bottom of the transition zone of the mantle, the reaction γ-(Mg,Fe)2[SiO4] ↔ (Mg,Fe)[SiO3] + (Mg,Fe)O transforms γ-olivine into a mixture of silicate perovskite and ferropericlase and vice versa. In the literature, this mineral phase of the lower mantle is also often called magnesiowüstite.[37] Silicate perovskite may form up to 93% of the lower mantle,[38] and the magnesium iron form, (Mg,Fe)SiO3, is considered to be the most abundant mineral in the Earth, making up 38% of its volume.[39]
Earth's crust

While iron is the most abundant element on Earth, most of this iron is concentrated in the inner and outer cores.[40][41] The fraction of iron that is in Earth's crust only amounts to about 5% of the overall mass of the crust and is thus only the fourth most abundant element in that layer (after oxygen, silicon, and aluminium).[42]
Most of the iron in the crust is combined with various other elements to form many iron minerals. An important class is the iron oxide minerals such as hematite (Fe2O3), magnetite (Fe3O4), and siderite (FeCO3), which are the major ores of iron. Many igneous rocks also contain the sulfide minerals pyrrhotite and pentlandite.[43][44] During weathering, iron tends to leach from sulfide deposits as the sulfate and from silicate deposits as the bicarbonate. Both of these are oxidized in aqueous solution and precipitate in even mildly elevated pH as iron(III) oxide.[45]

Large deposits of iron are banded iron formations, a type of rock consisting of repeated thin layers of iron oxides alternating with bands of iron-poor shale and chert. The banded iron formations were laid down in the time between 3,700 million years ago and 1,800 million years ago.[46][47]
Materials containing finely ground iron(III) oxides or oxide-hydroxides, such as ochre, have been used as yellow, red, and brown pigments since pre-historical times. They contribute as well to the color of various rocks and clays, including entire geological formations like the Painted Hills in Oregon and the Buntsandstein ("colored sandstone", British Bunter).[48] Through Eisensandstein (a jurassic 'iron sandstone', e.g. from Donzdorf in Germany)[49] and Bath stone in the UK, iron compounds are responsible for the yellowish color of many historical buildings and sculptures.[50] The proverbial red color of the surface of Mars is derived from an iron oxide-rich regolith.[51]
Significant amounts of iron occur in the iron sulfide mineral pyrite (FeS2), but it is difficult to extract iron from it and it is therefore not exploited.[52] In fact, iron is so common that production generally focuses only on ores with very high quantities of it.[53]
According to the International Resource Panel's Metal Stocks in Society report, the global stock of iron in use in society is 2,200 kg per capita. More-developed countries differ in this respect from less-developed countries (7,000–14,000 vs 2,000 kg per capita).[54]
Oceans
Ocean science demonstrated the role of the iron in the ancient seas in both marine biota and climate.[55]
Chemistry and compounds
| Oxidation state | Representative compound |
|---|---|
| −4 (d10s2) | [FeIn6−xSnx][56] |
| −2 (d10) | Disodium tetracarbonylferrate (Collman's reagent) |
| −1 (d9) | Fe 2(CO)2− 8 |
| 0 (d8) | Iron pentacarbonyl |
| 1 (d7) | Cyclopentadienyliron dicarbonyl dimer ("Fp2") |
| 2 (d6) | Ferrous sulfate, Ferrocene |
| 3 (d5) | Ferric chloride, Ferrocenium tetrafluoroborate |
| 4 (d4) | Fe(diars) 2Cl2+ 2, FeO(BF4)2 |
| 5 (d3) | FeO3− 4 |
| 6 (d2) | Potassium ferrate |
| 7 (d1) | [FeO4]– (matrix isolation, 4K) |
Iron shows the characteristic chemical properties of the transition metals, namely the ability to form variable oxidation states differing by steps of one and a very large coordination and organometallic chemistry: indeed, it was the discovery of an iron compound, ferrocene, that revolutionalized the latter field in the 1950s.[57] Iron is sometimes considered as a prototype for the entire block of transition metals, due to its abundance and the immense role it has played in the technological progress of humanity.[58] Its 26 electrons are arranged in the configuration [Ar]3d64s2, of which the 3d and 4s electrons are relatively close in energy, and thus a number of electrons can be ionized.[16]
Iron forms compounds mainly in the oxidation states +2 (iron(II), "ferrous") and +3 (iron(III), "ferric"). Iron also occurs in higher oxidation states, e.g., the purple potassium ferrate (K2FeO4), which contains iron in its +6 oxidation state. The anion [FeO4]– with iron in its +7 oxidation state, along with an iron(V)-peroxo isomer, has been detected by infrared spectroscopy at 4 K after cocondensation of laser-ablated Fe atoms with a mixture of O2/Ar.[59] Iron(IV) is a common intermediate in many biochemical oxidation reactions.[60][61] Numerous organoiron compounds contain formal oxidation states of +1, 0, −1, or even −2. The oxidation states and other bonding properties are often assessed using the technique of Mössbauer spectroscopy.[62] Many mixed valence compounds contain both iron(II) and iron(III) centers, such as magnetite and Prussian blue (Fe4(Fe[CN]6)3).[61] The latter is used as the traditional "blue" in blueprints.[63]
Iron is the first of the transition metals that cannot reach its group oxidation state of +8, although its heavier congeners ruthenium and osmium can, with ruthenium having more difficulty than osmium.[10] Ruthenium exhibits an aqueous cationic chemistry in its low oxidation states similar to that of iron, but osmium does not, favoring high oxidation states in which it forms anionic complexes.[10] In the second half of the 3d transition series, vertical similarities down the groups compete with the horizontal similarities of iron with its neighbors cobalt and nickel in the periodic table, which are also ferromagnetic at room temperature and share similar chemistry. As such, iron, cobalt, and nickel are sometimes grouped together as the iron triad.[58]
Unlike many other metals, iron does not form amalgams with mercury. As a result, mercury is traded in standardized 76 pound flasks (34 kg) made of iron.[64]
Iron is by far the most reactive element in its group; it is pyrophoric when finely divided and dissolves easily in dilute acids, giving Fe2+. However, it does not react with concentrated nitric acid and other oxidizing acids due to the formation of an impervious oxide layer, which can nevertheless react with hydrochloric acid.[10] High-purity iron, called electrolytic iron, is considered to be resistant to rust, due to its oxide layer.
Binary compounds
Oxides and sulfides
Iron forms various oxide and hydroxide compounds; the most common are iron(II,III) oxide (Fe3O4), and iron(III) oxide (Fe2O3). Iron(II) oxide also exists, though it is unstable at room temperature. Despite their names, they are actually all non-stoichiometric compounds whose compositions may vary.[65] These oxides are the principal ores for the production of iron (see bloomery and blast furnace). They are also used in the production of ferrites, useful magnetic storage media in computers, and pigments. The best known sulfide is iron pyrite (FeS2), also known as fool's gold owing to its golden luster.[61] It is not an iron(IV) compound, but is actually an iron(II) polysulfide containing Fe2+ and S2−
2 ions in a distorted sodium chloride structure.[65]

Halides

The binary ferrous and ferric halides are well-known. The ferrous halides typically arise from treating iron metal with the corresponding hydrohalic acid to give the corresponding hydrated salts.[61]
- Fe + 2 HX → FeX2 + H2 (X = F, Cl, Br, I)
Iron reacts with fluorine, chlorine, and bromine to give the corresponding ferric halides, ferric chloride being the most common.[66]
- 2 Fe + 3 X2 → 2 FeX3 (X = F, Cl, Br)
Ferric iodide is an exception, being thermodynamically unstable due to the oxidizing power of Fe3+ and the high reducing power of I−:[66]
- 2 I− + 2 Fe3+ → I2 + 2 Fe2+ (E0 = +0.23 V)
Ferric iodide, a black solid, is not stable in ordinary conditions, but can be prepared through the reaction of iron pentacarbonyl with iodine and carbon monoxide in the presence of hexane and light at the temperature of −20 °C, with oxygen and water excluded.[66] Complexes of ferric iodide with some soft bases are known to be stable compounds.[67][68]
Solution chemistry

The standard reduction potentials in acidic aqueous solution for some common iron ions are given below:[10]
[Fe(H2O)6]2+ + 2 e− ⇌ Fe E0 = −0.447 V [Fe(H2O)6]3+ + e− ⇌ [Fe(H2O)6]2+ E0 = +0.77 V FeO2−
4 + 8 H3O+ + 3 e−⇌ [Fe(H2O)6]3+ + 6 H2O E0 = +2.20 V
The red-purple tetrahedral ferrate(VI) anion is such a strong oxidizing agent that it oxidizes ammonia to nitrogen (N2) and water to oxygen:[66]
- 4 FeO2−
4 + 34 H
2O → 4 [Fe(H2O)6]3+ + 20 OH−
+ 3 O2
The pale-violet hexaquo complex [Fe(H2O)6]3+ is an acid such that above pH 0 it is fully hydrolyzed:[69]
[Fe(H2O)6]3+ ⇌ [Fe(H2O)5(OH)]2+ + H+ K = 10−3.05 mol dm−3 [Fe(H2O)5(OH)]2+ ⇌ [Fe(H2O)4(OH)2]+ + H+ K = 10−3.26 mol dm−3 2[Fe(H2O)6]3+ ⇌ [Fe(H2O)4(OH)]4+2 + 2H+ + 2H2O K = 10−2.91 mol dm−3

As pH rises above 0 the above yellow hydrolyzed species form and as it rises above 2–3, reddish-brown hydrous iron(III) oxide precipitates out of solution. Although Fe3+ has a d5 configuration, its absorption spectrum is not like that of Mn2+ with its weak, spin-forbidden d–d bands, because Fe3+ has higher positive charge and is more polarizing, lowering the energy of its ligand-to-metal charge transfer absorptions. Thus, all the above complexes are rather strongly colored, with the single exception of the hexaquo ion – and even that has a spectrum dominated by charge transfer in the near ultraviolet region.[69] On the other hand, the pale green iron(II) hexaquo ion [Fe(H2O)6]2+ does not undergo appreciable hydrolysis. Carbon dioxide is not evolved when carbonate anions are added, which instead results in white iron(II) carbonate being precipitated out. In excess carbon dioxide this forms the slightly soluble bicarbonate, which occurs commonly in groundwater, but it oxidises quickly in air to form iron(III) oxide that accounts for the brown deposits present in a sizeable number of streams.[70]
Coordination compounds
Due to its electronic structure, iron has a very large coordination and organometallic chemistry.

Many coordination compounds of iron are known. A typical six-coordinate anion is hexachloroferrate(III), [FeCl6]3−, found in the mixed salt tetrakis(methylammonium) hexachloroferrate(III) chloride.[71][72] Complexes with multiple bidentate ligands have geometric isomers. For example, the trans-chlorohydridobis(bis-1,2-(diphenylphosphino)ethane)iron(II) complex is used as a starting material for compounds with the Fe(dppe)2 moiety.[73][74] The ferrioxalate ion with three oxalate ligands displays helical chirality with its two non-superposable geometries labelled Λ (lambda) for the left-handed screw axis and Δ (delta) for the right-handed screw axis, in line with IUPAC conventions.[69] Potassium ferrioxalate is used in chemical actinometry and along with its sodium salt undergoes photoreduction applied in old-style photographic processes. The dihydrate of iron(II) oxalate has a polymeric structure with co-planar oxalate ions bridging between iron centres with the water of crystallisation located forming the caps of each octahedron, as illustrated below.[75]


Iron(III) complexes are quite similar to those of chromium(III) with the exception of iron(III)'s preference for O-donor instead of N-donor ligands. The latter tend to be rather more unstable than iron(II) complexes and often dissociate in water. Many Fe–O complexes show intense colors and are used as tests for phenols or enols. For example, in the ferric chloride test, used to determine the presence of phenols, iron(III) chloride reacts with a phenol to form a deep violet complex:[69]
- 3 ArOH + FeCl3 → Fe(OAr)3 + 3 HCl (Ar = aryl)
Among the halide and pseudohalide complexes, fluoro complexes of iron(III) are the most stable, with the colorless [FeF5(H2O)]2− being the most stable in aqueous solution. Chloro complexes are less stable and favor tetrahedral coordination as in [FeCl4]−; [FeBr4]− and [FeI4]− are reduced easily to iron(II). Thiocyanate is a common test for the presence of iron(III) as it forms the blood-red [Fe(SCN)(H2O)5]2+. Like manganese(II), most iron(III) complexes are high-spin, the exceptions being those with ligands that are high in the spectrochemical series such as cyanide. An example of a low-spin iron(III) complex is [Fe(CN)6]3−. Iron shows a great variety of electronic spin states, including every possible spin quantum number value for a d-block element from 0 (diamagnetic) to 5⁄2 (5 unpaired electrons). This value is always half the number of unpaired electrons. Complexes with zero to two unpaired electrons are considered low-spin and those with four or five are considered high-spin.[65]
Iron(II) complexes are less stable than iron(III) complexes but the preference for O-donor ligands is less marked, so that for example [Fe(NH3)6]2+ is known while [Fe(NH3)6]3+ is not. They have a tendency to be oxidized to iron(III) but this can be moderated by low pH and the specific ligands used.[70]
Organometallic compounds

carbonyl
Organoiron chemistry is the study of organometallic compounds of iron, where carbon atoms are covalently bound to the metal atom. They are many and varied, including cyanide complexes, carbonyl complexes, sandwich and half-sandwich compounds.

Prussian blue or "ferric ferrocyanide", Fe4[Fe(CN)6]3, is an old and well-known iron-cyanide complex, extensively used as pigment and in several other applications. Its formation can be used as a simple wet chemistry test to distinguish between aqueous solutions of Fe2+ and Fe3+ as they react (respectively) with potassium ferricyanide and potassium ferrocyanide to form Prussian blue.[61]
Another old example of an organoiron compound is iron pentacarbonyl, Fe(CO)5, in which a neutral iron atom is bound to the carbon atoms of five carbon monoxide molecules. The compound can be used to make carbonyl iron powder, a highly reactive form of metallic iron. Thermolysis of iron pentacarbonyl gives triiron dodecacarbonyl, Fe3(CO)12, a complex with a cluster of three iron atoms at its core. Collman's reagent, disodium tetracarbonylferrate, is a useful reagent for organic chemistry; it contains iron in the −2 oxidation state. Cyclopentadienyliron dicarbonyl dimer contains iron in the rare +1 oxidation state.[76]
A landmark in this field was the discovery in 1951 of the remarkably stable sandwich compound ferrocene Fe(C5H5)2, by Pauson and Kealy[77] and independently by Miller and colleagues,[78] whose surprising molecular structure was determined only a year later by Woodward and Wilkinson[79] and Fischer.[80]Ferrocene is still one of the most important tools and models in this class.[81]
Iron-centered organometallic species are used as catalysts. The Knölker complex, for example, is a transfer hydrogenation catalyst for ketones.[82]
Industrial uses
The iron compounds produced on the largest scale in industry are iron(II) sulfate (FeSO4·7H2O) and iron(III) chloride (FeCl3). The former is one of the most readily available sources of iron(II), but is less stable to aerial oxidation than Mohr's salt ((NH4)2Fe(SO4)2·6H2O). Iron(II) compounds tend to be oxidized to iron(III) compounds in the air.[61]
History
Development of iron metallurgy
Iron is one of the elements undoubtedly known to the ancient world.[83] It has been worked, or wrought, for millennia. However, iron artefacts of great age are much rarer than objects made of gold or silver due to the ease with which iron corrodes.[84] The technology developed slowly, and even after the discovery of smelting it took many centuries for iron to replace bronze as the metal of choice for tools and weapons.
Meteoritic iron

Beads made from meteoric iron in 3500 BC or earlier were found in Gerzeh, Egypt by G. A. Wainwright.[85] The beads contain 7.5% nickel, which is a signature of meteoric origin since iron found in the Earth's crust generally has only minuscule nickel impurities.
Meteoric iron was highly regarded due to its origin in the heavens and was often used to forge weapons and tools.[85] For example, a dagger made of meteoric iron was found in the tomb of Tutankhamun, containing similar proportions of iron, cobalt, and nickel to a meteorite discovered in the area, deposited by an ancient meteor shower.[86][87][88] Items that were likely made of iron by Egyptians date from 3000 to 2500 BC.[84]
Meteoritic iron is comparably soft and ductile and easily cold forged but may get brittle when heated because of the nickel content.[89]
Wrought iron

The first iron production started in the Middle Bronze Age, but it took several centuries before iron displaced bronze. Samples of smelted iron from Asmar, Mesopotamia and Tall Chagar Bazaar in northern Syria were made sometime between 3000 and 2700 BC.[90] The Hittites established an empire in north-central Anatolia around 1600 BC. They appear to be the first to understand the production of iron from its ores and regard it highly in their society.[91] The Hittites began to smelt iron between 1500 and 1200 BC and the practice spread to the rest of the Near East after their empire fell in 1180 BC.[90] The subsequent period is called the Iron Age.
Artifacts of smelted iron are found in India dating from 1800 to 1200 BC,[92] and in the Levant from about 1500 BC (suggesting smelting in Anatolia or the Caucasus).[93][94] Alleged references (compare history of metallurgy in South Asia) to iron in the Indian Vedas have been used for claims of a very early usage of iron in India respectively to date the texts as such. The rigveda term ayas (metal) refers to copper, while iron which is called as śyāma ayas, literally "black copper", first is mentioned in the post-rigvedic Atharvaveda.[95]
Some archaeological evidence suggests iron was smelted in Zimbabwe and southeast Africa as early as the eighth century BC.[96] Iron working was introduced to Greece in the late 11th century BC, from which it spread quickly throughout Europe.[97]

The spread of ironworking in Central and Western Europe is associated with Celtic expansion. According to Pliny the Elder, iron use was common in the Roman era.[85] In the lands of what is now considered China, iron appears approximately 700–500 BC.[98] Iron smelting may have been introduced into China through Central Asia.[99] The earliest evidence of the use of a blast furnace in China dates to the 1st century AD,[100] and cupola furnaces were used as early as the Warring States period (403–221 BC).[101] Usage of the blast and cupola furnace remained widespread during the Tang and Song dynasties.[102]
During the Industrial Revolution in Britain, Henry Cort began refining iron from pig iron to wrought iron (or bar iron) using innovative production systems. In 1783 he patented the puddling process for refining iron ore. It was later improved by others, including Joseph Hall.[103]
Cast iron
Cast iron was first produced in China during 5th century BC,[104] but was hardly in Europe until the medieval period.[105][106] The earliest cast iron artifacts were discovered by archaeologists in what is now modern Luhe County, Jiangsu in China. Cast iron was used in ancient China for warfare, agriculture, and architecture.[107] During the medieval period, means were found in Europe of producing wrought iron from cast iron (in this context known as pig iron) using finery forges. For all these processes, charcoal was required as fuel.[108]

Medieval blast furnaces were about 10 feet (3.0 m) tall and made of fireproof brick; forced air was usually provided by hand-operated bellows.[106] Modern blast furnaces have grown much bigger, with hearths fourteen meters in diameter that allow them to produce thousands of tons of iron each day, but essentially operate in much the same way as they did during medieval times.[108]
In 1709, Abraham Darby I established a coke-fired blast furnace to produce cast iron, replacing charcoal, although continuing to use blast furnaces. The ensuing availability of inexpensive iron was one of the factors leading to the Industrial Revolution. Toward the end of the 18th century, cast iron began to replace wrought iron for certain purposes, because it was cheaper. Carbon content in iron was not implicated as the reason for the differences in properties of wrought iron, cast iron, and steel until the 18th century.[90]
Since iron was becoming cheaper and more plentiful, it also became a major structural material following the building of the innovative first iron bridge in 1778. This bridge still stands today as a monument to the role iron played in the Industrial Revolution. Following this, iron was used in rails, boats, ships, aqueducts, and buildings, as well as in iron cylinders in steam engines.[108] Railways have been central to the formation of modernity and ideas of progress[109] and various languages refer to railways as iron road (e.g. French chemin de fer, German Eisenbahn, Turkish demiryolu, Russian железная дорога, Chinese, Japanese, and Korean 鐵道, Vietnamese đường sắt).
Steel
Steel (with smaller carbon content than pig iron but more than wrought iron) was first produced in antiquity by using a bloomery. Blacksmiths in Luristan in western Persia were making good steel by 1000 BC.[90] Then improved versions, Wootz steel by India and Damascus steel were developed around 300 BC and AD 500 respectively. These methods were specialized, and so steel did not become a major commodity until the 1850s.[110]
New methods of producing it by carburizing bars of iron in the cementation process were devised in the 17th century. In the Industrial Revolution, new methods of producing bar iron without charcoal were devised and these were later applied to produce steel. In the late 1850s, Henry Bessemer invented a new steelmaking process, involving blowing air through molten pig iron, to produce mild steel. This made steel much more economical, thereby leading to wrought iron no longer being produced in large quantities.[111]
Foundations of modern chemistry
In 1774, Antoine Lavoisier used the reaction of water steam with metallic iron inside an incandescent iron tube to produce hydrogen in his experiments leading to the demonstration of the conservation of mass, which was instrumental in changing chemistry from a qualitative science to a quantitative one.[112]
Symbolic role

Iron plays a certain role in mythology and has found various usage as a metaphor and in folklore. The Greek poet Hesiod's Works and Days (lines 109–201) lists different ages of man named after metals like gold, silver, bronze and iron to account for successive ages of humanity.[113] The Iron Age was closely related with Rome, and in Ovid's Metamorphoses
The Virtues, in despair, quit the earth; and the depravity of man becomes universal and complete. Hard steel succeeded then.
— Ovid, Metamorphoses, Book I, Iron age, line 160 ff
An example of the importance of iron's symbolic role may be found in the German Campaign of 1813. Frederick William III commissioned then the first Iron Cross as military decoration. Berlin iron jewellery reached its peak production between 1813 and 1815, when the Prussian royal family urged citizens to donate gold and silver jewellery for military funding. The inscription Ich gab Gold für Eisen (I gave gold for iron) was used as well in later war efforts.[114]
Production of metallic iron

Laboratory routes
For a few limited purposes when it is needed, pure iron is produced in the laboratory in small quantities by reducing the pure oxide or hydroxide with hydrogen, or forming iron pentacarbonyl and heating it to 250 °C so that it decomposes to form pure iron powder.[45] Another method is electrolysis of ferrous chloride onto an iron cathode.[115]
Main industrial route
| Country | Iron ore | Pig iron | Direct iron | Steel |
|---|---|---|---|---|
| 1,114.9 | 549.4 | 573.6 | ||
| 393.9 | 4.4 | 5.2 | ||
| 305.0 | 25.1 | 0.011 | 26.5 | |
| 66.9 | 87.5 | |||
| 257.4 | 38.2 | 23.4 | 63.5 | |
| 92.1 | 43.9 | 4.7 | 60.0 | |
| 65.8 | 25.7 | 29.9 | ||
| 0.1 | 27.3 | 48.6 | ||
| 0.4 | 20.1 | 0.38 | 32.7 | |
| World | 1,594.9 | 914.0 | 64.5 | 1,232.4 |
Nowadays, the industrial production of iron or steel consists of two main stages. In the first stage, iron ore is reduced with coke in a blast furnace, and the molten metal is separated from gross impurities such as silicate minerals. This stage yields an alloy – pig iron – that contains relatively large amounts of carbon. In the second stage, the amount of carbon in the pig iron is lowered by oxidation to yield wrought iron, steel, or cast iron.[117] Other metals can be added at this stage to form alloy steels.
Blast furnace processing
The blast furnace is loaded with iron ores, usually hematite Fe2O3 or magnetite Fe3O4, along with coke (coal that has been separately baked to remove volatile components) and flux (limestone or dolomite). "Blasts" of air pre-heated to 900 °C (sometimes with oxygen enrichment) is blown through the mixture, in sufficient amount to turn the carbon into carbon monoxide:[117]
- 2 C + O2 → 2 CO
This reaction raises the temperature to about 2000 °C. The carbon monoxide reduces the iron ore to metallic iron:[117]
- Fe2O3 + 3 CO → 2 Fe + 3 CO2
Some iron in the high-temperature lower region of the furnace reacts directly with the coke:[117]
- 2 Fe2O3 + 3 C → 4 Fe + 3 CO2
The flux removes silicaceous minerals in the ore, which would otherwise clog the furnace: The heat of the furnace decomposes the carbonates to calcium oxide, which reacts with any excess silica to form a slag composed of calcium silicate CaSiO3 or other products. At the furnace's temperature, the metal and the slag are both molten. They collect at the bottom as two immiscible liquid layers (with the slag on top), that are then easily separated.[117] The slag can be used as a material in road construction or to improve mineral-poor soils for agriculture.[106]
Steelmaking thus remains one of the largest industrial contributors of CO2 emissions in the world.[118]
- 17th century Chinese illustration of workers at a blast furnace, making wrought iron from pig iron[119]
- How iron was extracted in the 19th century
- Iron furnace in Columbus, Ohio, 1922
Steelmaking
The pig iron produced by the blast furnace process contains up to 4–5% carbon (by mass), with small amounts of other impurities like sulfur, magnesium, phosphorus, and manganese. This high level of carbon makes it relatively weak and brittle. Reducing the amount of carbon to 0.002–2.1% produces steel, which may be up to 1000 times harder than pure iron. A great variety of steel articles can then be made by cold working, hot rolling, forging, machining, etc. Removing the impurities from pig iron, but leaving 2–4% carbon, results in cast iron, which is cast by foundries into articles such as stoves, pipes, radiators, lamp-posts, and rails.[117]
Steel products often undergo various heat treatments after they are forged to shape. Annealing consists of heating them to 700–800 °C for several hours and then gradual cooling. It makes the steel softer and more workable.[120]
- This heap of iron ore pellets will be used in steel production.
- A pot of molten iron being used to make steel
Direct iron reduction
Owing to environmental concerns, alternative methods of processing iron have been developed. "Direct iron reduction" reduces iron ore to a ferrous lump called "sponge" iron or "direct" iron that is suitable for steelmaking.[106] Two main reactions comprise the direct reduction process:
Natural gas is partially oxidized (with heat and a catalyst):[106]
- 2 CH4 + O2 → 2 CO + 4 H2
Iron ore is then treated with these gases in a furnace, producing solid sponge iron:[106]
- Fe2O3 + CO + 2 H2 → 2 Fe + CO2 + 2 H2O
Silica is removed by adding a limestone flux as described above.[106]
Thermite process
Ignition of a mixture of aluminium powder and iron oxide yields metallic iron via the thermite reaction:
- Fe2O3 + 2 Al → 2 Fe + Al2O3
Alternatively pig iron may be made into steel (with up to about 2% carbon) or wrought iron (commercially pure iron). Various processes have been used for this, including finery forges, puddling furnaces, Bessemer converters, open hearth furnaces, basic oxygen furnaces, and electric arc furnaces. In all cases, the objective is to oxidize some or all of the carbon, together with other impurities. On the other hand, other metals may be added to make alloy steels.[108]
Molten oxide electrolysis
Molten oxide electrolysis (MOE) uses electrolysis of molten iron oxide to yield metallic iron. It is studied in laboratory-scale experiments and is proposed as a method for industrial iron production that has no direct emissions of carbon dioxide. It uses a liquid iron cathode, an anode formed from an alloy of chromium, aluminium and iron,[121] and the electrolyte is a mixture of molten metal oxides into which iron ore is dissolved. The current keeps the electrolyte molten and reduces the iron oxide. Oxygen gas is produced in addition to liquid iron. The only carbon dioxide emissions come from any fossil fuel-generated electricity used to heat and reduce the metal.[122][123][124]
Applications
| Material | TS (MPa) | BH (Brinell) |
|---|---|---|
| Iron whiskers | 11000 | |
| Ausformed (hardened) steel | 2930 | 850–1200 |
| Martensitic steel | 2070 | 600 |
| Bainitic steel | 1380 | 400 |
| Pearlitic steel | 1200 | 350 |
| Cold-worked iron | 690 | 200 |
| Small-grain iron | 340 | 100 |
| Carbon-containing iron | 140 | 40 |
| Pure, single-crystal iron | 10 | 3 |
As structural material
Iron is the most widely used of all the metals, accounting for over 90% of worldwide metal production. Its low cost and high strength often make it the material of choice to withstand stress or transmit forces, such as the construction of machinery and machine tools, rails, automobiles, ship hulls, concrete reinforcing bars, and the load-carrying framework of buildings. Since pure iron is quite soft, it is most commonly combined with alloying elements to make steel.[127]
Mechanical properties
The mechanical properties of iron and its alloys are extremely relevant to their structural applications. Those properties can be evaluated in various ways, including the Brinell test, the Rockwell test and the Vickers hardness test.
The properties of pure iron are often used to calibrate measurements or to compare tests.[126][128] However, the mechanical properties of iron are significantly affected by the sample's purity: pure, single crystals of iron are actually softer than aluminium,[125] and the purest industrially produced iron (99.99%) has a hardness of 20–30 Brinell.[129] The pure iron (99.9%~99.999%), especially called electrolytic iron, is industrially produced by electrolytic refining.
An increase in the carbon content will cause a significant increase in the hardness and tensile strength of iron. Maximum hardness of 65 Rc is achieved with a 0.6% carbon content, although the alloy has low tensile strength.[130] Because of the softness of iron, it is much easier to work with than its heavier congeners ruthenium and osmium.[16]
Types of steels and alloys

α-Iron is a fairly soft metal that can dissolve only a small concentration of carbon (no more than 0.021% by mass at 910 °C).[131] Austenite (γ-iron) is similarly soft and metallic but can dissolve considerably more carbon (as much as 2.04% by mass at 1146 °C). This form of iron is used in the type of stainless steel used for making cutlery, and hospital and food-service equipment.[20]
Commercially available iron is classified based on purity and the abundance of additives. Pig iron has 3.5–4.5% carbon[132] and contains varying amounts of contaminants such as sulfur, silicon and phosphorus. Pig iron is not a saleable product, but rather an intermediate step in the production of cast iron and steel. The reduction of contaminants in pig iron that negatively affect material properties, such as sulfur and phosphorus, yields cast iron containing 2–4% carbon, 1–6% silicon, and small amounts of manganese.[117] Pig iron has a melting point in the range of 1420–1470 K, which is lower than either of its two main components, and makes it the first product to be melted when carbon and iron are heated together.[10] Its mechanical properties vary greatly and depend on the form the carbon takes in the alloy.[16]
"White" cast irons contain their carbon in the form of cementite, or iron carbide (Fe3C).[16] This hard, brittle compound dominates the mechanical properties of white cast irons, rendering them hard, but unresistant to shock. The broken surface of a white cast iron is full of fine facets of the broken iron carbide, a very pale, silvery, shiny material, hence the appellation. Cooling a mixture of iron with 0.8% carbon slowly below 723 °C to room temperature results in separate, alternating layers of cementite and α-iron, which is soft and malleable and is called pearlite for its appearance. Rapid cooling, on the other hand, does not allow time for this separation and creates hard and brittle martensite. The steel can then be tempered by reheating to a temperature in between, changing the proportions of pearlite and martensite. The end product below 0.8% carbon content is a pearlite-αFe mixture, and that above 0.8% carbon content is a pearlite-cementite mixture.[16]
In gray iron the carbon exists as separate, fine flakes of graphite, and also renders the material brittle due to the sharp edged flakes of graphite that produce stress concentration sites within the material.[133] A newer variant of gray iron, referred to as ductile iron, is specially treated with trace amounts of magnesium to alter the shape of graphite to spheroids, or nodules, reducing the stress concentrations and vastly increasing the toughness and strength of the material.[133]
Wrought iron contains less than 0.25% carbon but large amounts of slag that give it a fibrous characteristic.[132] Wrought iron is more corrosion resistant than steel. It has been almost completely replaced by mild steel, which corrodes more readily than wrought iron, but is cheaper and more widely available. Carbon steel contains 2.0% carbon or less,[134] with small amounts of manganese, sulfur, phosphorus, and silicon. Alloy steels contain varying amounts of carbon as well as other metals, such as chromium, vanadium, molybdenum, nickel, tungsten, etc. Their alloy content raises their cost, and so they are usually only employed for specialist uses. One common alloy steel, though, is stainless steel. Recent developments in ferrous metallurgy have produced a growing range of microalloyed steels, also termed 'HSLA' or high-strength, low alloy steels, containing tiny additions to produce high strengths and often spectacular toughness at minimal cost.[134][135][136]
Alloys with high purity elemental makeups (such as alloys of electrolytic iron) have specifically enhanced properties such as ductility, tensile strength, toughness, fatigue strength, heat resistance, and corrosion resistance.
Apart from traditional applications, iron is also used for protection from ionizing radiation. Although it is lighter than another traditional protection material, lead, it is much stronger mechanically.[137]
The main disadvantage of iron and steel is that pure iron, and most of its alloys, suffer badly from rust if not protected in some way, a cost amounting to over 1% of the world's economy.[138] Painting, galvanization, passivation, plastic coating and bluing are all used to protect iron from rust by excluding water and oxygen or by cathodic protection. The mechanism of the rusting of iron is as follows:[138]
- Cathode: 3 O2 + 6 H2O + 12 e− → 12 OH−
- Anode: 4 Fe → 4 Fe2+ + 8 e−; 4 Fe2+ → 4 Fe3+ + 4 e−
- Overall: 4 Fe + 3 O2 + 6 H2O → 4 Fe3+ + 12 OH− → 4 Fe(OH)3 or 4 FeO(OH) + 4 H2O
The electrolyte is usually iron(II) sulfate in urban areas (formed when atmospheric sulfur dioxide attacks iron), and salt particles in the atmosphere in seaside areas.[138]
Catalysts and reagents
Because Fe is inexpensive and nontoxic, much effort has been devoted to the development of Fe-based catalysts and reagents. Iron is however less common as a catalyst in commercial processes than more expensive metals.[139] In biology, Fe-containing enzymes are pervasive.[140]
Iron catalysts are traditionally used in the Haber–Bosch process for the production of ammonia and the Fischer–Tropsch process for conversion of carbon monoxide to hydrocarbons for fuels and lubricants.[141] Powdered iron in an acidic medium is used in the Bechamp reduction, the conversion of nitrobenzene to aniline.[142]
Iron compounds
Iron(III) oxide mixed with aluminium powder can be ignited to create a thermite reaction, used in welding large iron parts (like rails) and purifying ores. Iron(III) oxide and oxyhydroxide are used as reddish and ocher pigments.
Iron(III) chloride finds use in water purification and sewage treatment, in the dyeing of cloth, as a coloring agent in paints, as an additive in animal feed, and as an etchant for copper in the manufacture of printed circuit boards.[143] It can also be dissolved in alcohol to form tincture of iron, which is used as a medicine to stop bleeding in canaries.[144]
Iron(II) sulfate is used as a precursor to other iron compounds. It is also used to reduce chromate in cement. It is used to fortify foods and treat iron deficiency anemia. Iron(III) sulfate is used in settling minute sewage particles in tank water. Iron(II) chloride is used as a reducing flocculating agent, in the formation of iron complexes and magnetic iron oxides, and as a reducing agent in organic synthesis.[143]
Sodium nitroprusside is a drug used as a vasodilator. It is on the World Health Organization's List of Essential Medicines.[145]
Biological and pathological role
Iron is required for life.[9][146][147] The iron–sulfur clusters are pervasive and include nitrogenase, the enzymes responsible for biological nitrogen fixation. Iron-containing proteins participate in transport, storage and use of oxygen.[9] Iron proteins are involved in electron transfer.[148]

Examples of iron-containing proteins in higher organisms include hemoglobin, cytochrome (see high-valent iron), and catalase.[9][149] The average adult human contains about 0.005% body weight of iron, or about four grams, of which three quarters is in hemoglobin—a level that remains constant despite only about one milligram of iron being absorbed each day,[148] because the human body recycles its hemoglobin for the iron content.[150]
Microbial growth may be assisted by oxidation of iron(II) or by reduction of iron(III).[151]
Biochemistry
Iron acquisition poses a problem for aerobic organisms because ferric iron is poorly soluble near neutral pH. Thus, these organisms have developed means to absorb iron as complexes, sometimes taking up ferrous iron before oxidising it back to ferric iron.[9] In particular, bacteria have evolved very high-affinity sequestering agents called siderophores.[152][153][154]
After uptake in human cells, iron storage is precisely regulated.[9][155] A major component of this regulation is the protein transferrin, which binds iron ions absorbed from the duodenum and carries it in the blood to cells.[9][156] Transferrin contains Fe3+ in the middle of a distorted octahedron, bonded to one nitrogen, three oxygens and a chelating carbonate anion that traps the Fe3+ ion: it has such a high stability constant that it is very effective at taking up Fe3+ ions even from the most stable complexes. At the bone marrow, transferrin is reduced from Fe3+ to Fe2+ and stored as ferritin to be incorporated into hemoglobin.[148]
The most commonly known and studied bioinorganic iron compounds (biological iron molecules) are the heme proteins: examples are hemoglobin, myoglobin, and cytochrome P450.[9] These compounds participate in transporting gases, building enzymes, and transferring electrons.[148] Metalloproteins are a group of proteins with metal ion cofactors. Some examples of iron metalloproteins are ferritin and rubredoxin.[148] Many enzymes vital to life contain iron, such as catalase,[157] lipoxygenases,[158] and IRE-BP.[159]
Hemoglobin is an oxygen carrier that occurs in red blood cells and contributes their color, transporting oxygen in the arteries from the lungs to the muscles where it is transferred to myoglobin, which stores it until it is needed for the metabolic oxidation of glucose, generating energy.[9] Here the hemoglobin binds to carbon dioxide, produced when glucose is oxidized, which is transported through the veins by hemoglobin (predominantly as bicarbonate anions) back to the lungs where it is exhaled.[148] In hemoglobin, the iron is in one of four heme groups and has six possible coordination sites; four are occupied by nitrogen atoms in a porphyrin ring, the fifth by an imidazole nitrogen in a histidine residue of one of the protein chains attached to the heme group, and the sixth is reserved for the oxygen molecule it can reversibly bind to.[148] When hemoglobin is not attached to oxygen (and is then called deoxyhemoglobin), the Fe2+ ion at the center of the heme group (in the hydrophobic protein interior) is in a high-spin configuration. It is thus too large to fit inside the porphyrin ring, which bends instead into a dome with the Fe2+ ion about 55 picometers above it. In this configuration, the sixth coordination site reserved for the oxygen is blocked by another histidine residue.[148]
Когда дезоксигемоглобин захватывает молекулу кислорода, этот остаток гистидина удаляется и возвращается, как только кислород надежно присоединяется, образуя с ним водородную связь . Это приводит к тому, что Fe 2+ переключение иона в низкоспиновую конфигурацию, что приводит к уменьшению ионного радиуса на 20%, так что теперь он может вписаться в порфириновое кольцо, которое становится плоским. [148] Кроме того, эта водородная связь приводит к наклону молекулы кислорода, в результате чего валентный угол Fe-O-O составляет около 120 °, что позволяет избежать образования Fe-O-Fe или Fe-O 2 мостиков -Fe, которые могли бы привести к перенос электрона, окисление Fe 2+ в Фе 3+ и разрушение гемоглобина. Это приводит к перемещению всех белковых цепей, что приводит к тому, что другие субъединицы гемоглобина меняют форму на форму с большим сродством к кислороду. Таким образом, когда дезоксигемоглобин поглощает кислород, его сродство к большему количеству кислорода увеличивается, и наоборот. [148] С другой стороны, миоглобин содержит только одну гемовую группу, и, следовательно, этот кооперативный эффект не может возникнуть. Таким образом, хотя гемоглобин почти насыщен кислородом при высоких парциальных давлениях кислорода, обнаруженных в легких, его сродство к кислороду намного ниже, чем у миоглобина, который насыщает кислород даже при низких парциальных давлениях кислорода, обнаруженного в мышечной ткани. [148] Как описывает эффект Бора (названный в честь Кристиана Бора , отца Нильса Бора ), сродство гемоглобина к кислороду уменьшается в присутствии углекислого газа. [148]

Угарный газ и трифторид фосфора ядовиты для человека, поскольку они связываются с гемоглобином так же, как кислород, но с гораздо большей силой, так что кислород больше не может транспортироваться по организму. Гемоглобин, связанный с окисью углерода, известен как карбоксигемоглобин . Этот эффект также играет незначительную роль в токсичности цианида , но основным эффектом является его вмешательство в правильное функционирование белка транспорта электронов цитохрома а . [148] Белки цитохрома также включают гемовые группы и участвуют в метаболическом окислении глюкозы кислородом. Шестое координационное место тогда занимает либо другой азот имидазола, либо сера метионина , так что эти белки в значительной степени инертны по отношению к кислороду - за исключением цитохрома а, который напрямую связывается с кислородом и, таким образом, очень легко отравляется цианидом. [148] Здесь происходит перенос электрона, поскольку железо остается в низкоспиновом состоянии, но меняется между степенями окисления +2 и +3. Поскольку потенциал восстановления на каждом этапе немного больше, чем на предыдущем, энергия высвобождается шаг за шагом и, таким образом, может храниться в аденозинтрифосфате . Цитохром а немного отличается, так как он встречается на митохондриальной мембране, напрямую связывается с кислородом и переносит как протоны, так и электроны следующим образом: [148]
- 4 Цитк 2+ +О2 + 8Н +
внутри → 4 Cytc 3+ + 2 Н 2 О + 4 Н +
снаружи
Хотя гем-белки являются наиболее важным классом железосодержащих белков, железо-серные белки также очень важны, поскольку они участвуют в переносе электронов, что возможно, поскольку железо может стабильно существовать как в +2, так и в +3 степени окисления. Они имеют один, два, четыре или восемь атомов железа, каждый из которых примерно тетраэдрически координирован с четырьмя атомами серы; из-за этой тетраэдрической координации они всегда имеют высокоспиновое железо. Простейшим из таких соединений является рубредоксин , у которого только один атом железа координирован с четырьмя атомами серы от остатков цистеина в окружающих пептидных цепях. Другим важным классом железо-серных белков являются ферредоксины , которые имеют несколько атомов железа. Трансферрин не принадлежит ни к одному из этих классов. [148]
Способность морских мидий удерживать камни в океане обеспечивается использованием металлоорганических связей на основе железа в их богатых белком кутикулах . Судя по синтетическим аналогам, присутствие железа в этих структурах увеличило модуль упругости в 770 раз, прочность на разрыв в 58 раз и ударную вязкость в 92 раза. Уровень стресса, необходимый для их необратимого повреждения, увеличился в 76 раз. [161]
Питание
Диета
Железо широко распространено, но особенно богатые источники диетического железа включают красное мясо , устрицы , бобы , птицу , рыбу , листовые овощи , кресс-салат , тофу и патоку . [9] Хлеб и хлопья для завтрака иногда специально обогащают железом. [9] [162]
Железо, содержащееся в пищевых добавках, часто встречается в виде фумарата железа (II) , хотя сульфат железа (II) дешевле и усваивается одинаково хорошо. [143] Элементарное железо, или восстановленное железо, несмотря на то, что эффективность его всасывания составляет всего от одной до двух третей (по сравнению с сульфатом железа), [163] часто добавляют в такие продукты, как хлопья для завтрака или обогащенную пшеничную муку. Железо наиболее доступно организму в виде хелатного соединения с аминокислотами. [164] а также доступен для использования в качестве обычной добавки железа . Глицин , самая дешевая аминокислота, чаще всего используется для производства добавок глицината железа. [165]
Диетические рекомендации
Институт медицины США (IOM) обновил расчетные средние потребности (EAR) и рекомендуемые диетические нормы (RDA) по железу в 2001 году. [9] Текущая EAR для железа для женщин в возрасте 14–18 лет составляет 7,9 мг/день, 8,1 мг/день для детей в возрасте 19–50 лет и 5,0 мг/день в последующий период (после менопаузы). Для мужчин EAR составляет 6,0 мг/день в возрасте от 19 лет и старше. Рекомендуемая суточная доза составляет 15,0 мг/день для женщин в возрасте 15–18 лет, 18,0 мг/день для женщин в возрасте 19–50 лет и 8,0 мг/день в дальнейшем. Мужчинам: 8,0 мг/день в возрасте от 19 лет и старше. RDA выше, чем EAR, чтобы определить суммы, которые покроют людей с потребностями выше среднего. Рекомендуемая суточная доза при беременности составляет 27 мг/день, а при лактации – 9 мг/день. [9] Детям в возрасте 1–3 лет 7 мг/день, 10 мг/день для детей 4–8 лет и 8 мг/день для детей 9–13 лет. Что касается безопасности, МОМ также устанавливает допустимые верхние уровни потребления (UL) для витаминов и минералов, когда есть достаточные доказательства. В случае железа UL устанавливается на уровне 45 мг/день. В совокупности EAR, RDA и UL называются эталонными диетическими нормами потребления . [166]
Европейское управление по безопасности пищевых продуктов (EFSA) называет совокупный набор информации эталонными диетическими значениями, с эталонным потреблением для населения (PRI) вместо RDA и средней потребностью вместо EAR. AI и UL определены так же, как и в США. Для женщин PRI составляет 13 мг/день в возрасте 15–17 лет, 16 мг/день для женщин в возрасте 18 лет и старше в пременопаузе и 11 мг/день в постменопаузе. При беременности и лактации — 16 мг/сут. Для мужчин PRI составляет 11 мг/день в возрасте от 15 лет и старше. Для детей в возрасте от 1 до 14 лет доза PRI увеличивается с 7 до 11 мг/день. PRI выше, чем RDA в США, за исключением беременности. [167] EFSA рассмотрело тот же вопрос безопасности и не установило UL. [168]
Младенцам могут потребоваться добавки железа, если их кормят коровьим молоком из бутылочки. [169] Частые доноры крови подвергаются риску низкого уровня железа, и им часто рекомендуется дополнять потребление железа. [170]
Для целей маркировки пищевых продуктов и пищевых добавок в США количество в порции выражается в процентах от дневной нормы (% ДВ). Для целей маркировки железа 100% дневной нормы составляло 18 мг, а по состоянию на 27 мая 2016 г. [update] осталась неизменной на уровне 18 мг. [171] [172] Таблица старых и новых дневных норм для взрослых представлена в разделе «Справочная суточная норма» .
Дефицит
Дефицит железа является наиболее распространенным дефицитом питания в мире. [9] [173] [174] [175] Когда потеря железа не компенсируется в достаточной мере адекватным потреблением железа с пищей, возникает состояние латентного дефицита железа , которое со временем при отсутствии лечения приводит к железодефицитной анемии , которая характеризуется недостаточным количеством эритроцитов и недостаточным их количеством. гемоглобина. [176] Наиболее подвержены заболеванию дети, женщины в пременопаузе (женщины детородного возраста) и люди с неправильным питанием. В большинстве случаев железодефицитная анемия протекает в легкой форме, но если ее не лечить, она может вызвать такие проблемы, как учащенное или нерегулярное сердцебиение, осложнения во время беременности и задержку роста у младенцев и детей. [177]
Мозг устойчив к острому дефициту железа из-за медленного транспорта железа через гематоэнцефалический барьер. [178] Резкие колебания уровня железа (отмеченные уровнем ферритина в сыворотке) не отражают состояние железа в мозге, но предполагается, что длительный дефицит железа в питании приводит к снижению концентрации железа в мозге с течением времени. [179] [180] В мозге железо играет роль в транспортировке кислорода, синтезе миелина, митохондриальном дыхании, а также является кофактором синтеза и метаболизма нейромедиаторов. [181] Животные модели пищевого дефицита железа сообщают о биомолекулярных изменениях, напоминающих те, которые наблюдаются при болезни Паркинсона и Хантингтона. [182] [183] Однако возрастное накопление железа в мозге также связано с развитием болезни Паркинсона. [184]
Избыток
Поглощение железа жестко регулируется организмом человека, у которого нет регулируемых физиологических способов выведения железа. Лишь небольшое количество железа теряется ежедневно из-за отслаивания эпителиальных клеток слизистых оболочек и кожи, поэтому контроль уровня железа в первую очередь достигается за счет регулирования его поглощения. [185] У некоторых людей регуляция поглощения железа нарушается в результате генетического дефекта , который картируется в области гена HLA-H на хромосоме 6 и приводит к аномально низким уровням гепсидина , ключевого регулятора поступления железа в систему кровообращения у людей. млекопитающие. [186] У этих людей чрезмерное потребление железа может привести к расстройствам, связанным с перегрузкой железом , известным в медицине как гемохроматоз . [9] Многие люди имеют недиагностированную генетическую предрасположенность к перегрузке железом и не знают о семейном анамнезе этой проблемы. По этой причине людям не следует принимать добавки железа, если они не страдают дефицитом железа и не проконсультировались с врачом. По оценкам, гемохроматоз является причиной 0,3–0,8% всех метаболических заболеваний европеоидов. [187]
Передозировка проглоченного железа может вызвать чрезмерный уровень свободного железа в крови. Высокий уровень свободного двухвалентного железа в крови реагирует с пероксидами, образуя высокореактивные свободные радикалы , которые могут повредить ДНК , белки , липиды и другие клеточные компоненты. Токсичность железа возникает, когда клетка содержит свободное железо, что обычно происходит, когда уровень железа превышает доступность трансферрина для связывания железа. Повреждение клеток желудочно-кишечного тракта также может помешать им регулировать всасывание железа, что приводит к дальнейшему повышению его уровня в крови. Железо обычно повреждает клетки сердца , печени и других органов, вызывая побочные эффекты, включая кому , метаболический ацидоз , шок , печеночную недостаточность , коагулопатию , долговременное повреждение органов и даже смерть. [188] Люди испытывают токсичность железа, когда содержание железа превышает 20 миллиграммов на каждый килограмм массы тела; считается 60 миллиграмм на килограмм Смертельной дозой . [189] Чрезмерное потребление железа, часто являющееся результатом употребления детьми большого количества таблеток сульфата железа , предназначенных для употребления взрослыми, является одной из наиболее частых токсикологических причин смерти детей в возрасте до шести лет. [189] Эталонная диетическая доза (DRI) устанавливает допустимый верхний уровень потребления (UL) для взрослых на уровне 45 мг/день. Для детей до четырнадцати лет UL составляет 40 мг/день. [190]
Медицинское лечение токсичности железа сложно и может включать использование специального хелатирующего агента, называемого дефероксамином, для связывания и выведения избытка железа из организма. [188] [191] [192]
СДВГ
Некоторые исследования показали, что низкий уровень таламического железа может играть роль в патофизиологии СДВГ . [193] Некоторые исследователи обнаружили, что добавки железа могут быть эффективны, особенно при невнимательном подтипе расстройства. [194]
Некоторые исследователи в 2000-х годах предположили связь между низким уровнем железа в крови и СДВГ. Исследование 2012 года не обнаружило такой корреляции. [195]
Рак
Роль железа в защите от рака можно охарактеризовать как «палку о двух концах» из-за его повсеместного присутствия в непатологических процессах. [196] У людей, проходящих химиотерапию, может развиться дефицит железа и анемия , при которой внутривенная терапия железом . для восстановления уровня железа используется [197] Перегрузка железом, которая может возникнуть из-за чрезмерного потребления красного мяса. [9] может инициировать рост опухоли и повысить предрасположенность к возникновению рака, [197] особенно при колоректальном раке . [9]
Морские системы
Железо играет важную роль в морских системах и может выступать в качестве питательного вещества, ограничивающего планктонную активность. [198] Из-за этого слишком сильное снижение содержания железа может привести к снижению скорости роста фитопланктонных организмов, таких как диатомовые водоросли. [199] Железо также может окисляться морскими микробами в условиях с высоким содержанием железа и низким содержанием кислорода. [200]
Железо может попадать в морские системы через прилегающие реки и непосредственно из атмосферы. Когда железо попадает в океан, оно может распределяться по толще воды посредством смешивания океана и переработки на клеточном уровне. [201] В Арктике морской лед играет важную роль в хранении и распределении железа в океане, истощая океаническое железо при замерзании зимой и выпуская его обратно в воду при оттаивании летом. [202] Цикл железа может изменять форму железа от водной к форме частиц, изменяя доступность железа для первичных производителей. [203] Увеличение количества света и тепла увеличивает количество железа, которое находится в формах, пригодных для использования первичными производителями. [204]
См. также
- Экономически важные месторождения железа включают:
- Рудник Караяс в штате Пара, Бразилия, считается крупнейшим месторождением железа в мире.
- Эль-Мутун в Боливии, где находится 10% доступной в мире железной руды.
- Бассейн Хамерсли — крупнейшее месторождение железной руды в Австралии .
- Киирунаваара в Швеции, где расположено одно из крупнейших в мире месторождений железной руды.
- — Железный хребет Месаби главный район добычи железной руды в США.
- Металлургическая промышленность
- Железный цикл
- Наночастица железа
- Железо-платиновая наночастица
- Удобрение железом - предлагаемое удобрение океанов для стимулирования фитопланктона. роста
- Железоокисляющие бактерии
- Список стран по производству железа
- Окомкование – процесс создания железорудных окатышей.
- Нержавеющее железо
- Сталь
Ссылки
- ^ «Стандартные атомные массы: железо» . ЦИАВ . 1993.
- ^ Прохаска, Томас; Ирргехер, Йоханна; Бенефилд, Жаклин; Бёлке, Джон К.; Чессон, Лесли А.; Коплен, Тайлер Б.; Дин, Типинг; Данн, Филип Дж. Х.; Грёнинг, Манфред; Холден, Норман Э.; Мейер, Харро Эй Джей (4 мая 2022 г.). «Стандартные атомные веса элементов 2021 (Технический отчет ИЮПАК)» . Чистая и прикладная химия . дои : 10.1515/pac-2019-0603 . ISSN 1365-3075 .
- ↑ Перейти обратно: Перейти обратно: а б с Арбластер, Джон В. (2018). Некоторые значения кристаллографических свойств элементов . Парк материалов, Огайо: ASM International. ISBN 978-1-62708-155-9 .
- ^ Рам, РС; Бернат, ПФ (2003). «Фурье-эмиссионная спектроскопия g 4 Д – а 4 Δ система FeCl». Журнал молекулярной спектроскопии . 221 (2): 261. Bibcode : 2003JMoSp.221..261R . doi : 10.1016/S0022-2852(03)00225-X .
- ^ Демазо, Ж.; Бюффа, Б.; Паучард, М.; Хагенмюллер, П. (1982). «Последние разработки в области высоких степеней окисления переходных элементов при стабилизации оксидов шестикоординированного железа(V)». Журнал неорганической и общей химии . 491 :60-66. дои : 10.1002/zaac.19824910109 .
- ^ Лу, Дж.; Цзян, Дж.; Хуанг, В.; Лин, Х.; Ли, Дж; Чжоу, М. (2016). «Экспериментальная и теоретическая идентификация степени окисления Fe(VII) в FeO 4 − ". Физическая химия Химическая физика . 18 (45): 31125–31131. Бибкод : 2016PCCP...1831125L . doi : 10.1039/C6CP06753K . PMID 27812577 .
- ^ Кардарелли, Франсуа (2008). Справочник материалов: краткий настольный справочник . Лондон: Спрингер. п. 65. ИСБН 1-84628-668-9 .
- ^ Кондев, ФГ; Ван, М.; Хуанг, WJ; Наими, С.; Ауди, Г. (2021). «Оценка ядерных свойств NUBASE2020» (PDF) . Китайская физика C . 45 (3): 030001. doi : 10.1088/1674-1137/abddae .
- ↑ Перейти обратно: Перейти обратно: а б с д и ж г час я дж к л м н тот п д "Железо" . Информационный центр по микроэлементам, Институт Лайнуса Полинга, Университет штата Орегон, Корваллис, Орегон. Апрель 2016 года . Проверено 6 марта 2018 г.
- ↑ Перейти обратно: Перейти обратно: а б с д и ж г час Гринвуд и Эрншоу 1997 , стр. 1075–79.
- ^ Татено С., Хиросе К. (2010). «Структура железа во внутреннем ядре Земли». Наука . 330 (6002). Американская ассоциация содействия развитию науки: 359–361. Бибкод : 2010Sci...330..359T . дои : 10.1126/science.1194662 . ПМИД 20947762 . S2CID 206528628 .
- ^ Чамати, Гаминчев (2014). «Динамическая стабильность Fe под высоким давлением» . Журнал физики . 558 (1). Издание IOP: 012013. Бибкод : 2014JPhCS.558a2013G . дои : 10.1088/1742-6596/558/1/012013 .
- ^ Бёлер, Рейнхард (2000). «Эксперименты при высоких давлениях и фазовая диаграмма материалов нижней мантии и ядра» . Обзоры геофизики . 38 (2). Американский геофизический союз: 221–45. Бибкод : 2000RvGeo..38..221B . дои : 10.1029/1998RG000053 . S2CID 33458168 .
- ^ Стиксруд, Ларс; Вассерман, Евгений; Коэн, Рональд Э. (10 ноября 1997 г.). «Состав и температура внутреннего ядра Земли» . Журнал геофизических исследований: Solid Earth . 102 (Б11): 24729–39. Бибкод : 1997JGR...10224729S . дои : 10.1029/97JB02125 .
- ^ Гринвуд и Эрншоу 1997 , с. 1116.
- ↑ Перейти обратно: Перейти обратно: а б с д и ж Гринвуд и Эрншоу 1997 , стр. 1074–75.
- ^ Бёлер, Рейнхард; Росс, М. (2007). «Свойства горных пород и минералов_Плавка под высоким давлением». Минеральная физика . Трактат по геофизике. Том. 2. Эльзевир. стр. 527–41. дои : 10.1016/B978-044452748-6.00047-X . ISBN 9780444527486 .
- ^ Стейнмец, Чарльз (1917). «рис. 42». Теория и расчет электрических цепей . МакГроу-Хилл.
- ↑ Перейти обратно: Перейти обратно: а б Безнравственность; Компакт-диск Грэм (2008). Введение в магнитные материалы, 2-е . Нью-Йорк: Wiley – IEEE. п. 116. ИСБН 978-0-471-47741-9 .
- ↑ Перейти обратно: Перейти обратно: а б Брамфитт, БЛ; Бенскотер, Арлан О. (2002). «Фазовая диаграмма железа и углерода» . Руководство металлографа: практика и технологии обработки чугуна и стали . АСМ Интернешнл. стр. 24–28. ISBN 978-0-87170-748-2 .
- ↑ Перейти обратно: Перейти обратно: а б Ауди, Жорж; Берсильон, Оливье; Блашо, Жан; Вапстра, Аалдерт Хендрик (2003), « Оценка NUBASE свойств ядра и распада» , Nuclear Physics A , 729 : 3–128, Бибкод : 2003NuPhA.729....3A , doi : 10.1016/j.nuclphysa.2003.11 .001
- ^ Ругель, Г.; Фастерманн, Т.; Кни, К.; Корщинек, Г.; Путивцев М.; Шуман, Д.; Кивель, Н.; Гюнтер-Леопольд, И.; Вайнрайх, Р.; Вольмутер, М. (2009). «Новое измерение 60 Fe Half-Life» . Physical Review Letters . 103 (7): 072502. Bibcode : 2009PhRvL.103g2502R . doi : 10.1103/PhysRevLett.103.072502 . PMID 19792637 .
- ^ Дауфас, Н.; Руксель, О. (2006). «Масс-спектрометрия и естественные вариации изотопов железа» (PDF) . Обзоры масс-спектрометрии . 25 (4): 515–50. Бибкод : 2006MSRv...25..515D . дои : 10.1002/mas.20078 . ПМИД 16463281 . Архивировано из оригинала (PDF) 10 июня 2010 года.
- ^ Мостефауи, С.; Лугмайр, Джорджия; Хоппе, П.; Эль Гореси, А. (2004). «Доказательства наличия живого 60Fe в метеоритах». Новые обзоры астрономии . 48 (1–4): 155–59. Бибкод : 2004НовыйAR..48..155M . дои : 10.1016/j.newar.2003.11.022 .
- ^ Фьюэлл, член парламента (1995). «Атомный нуклид с самой высокой средней энергией связи». Американский журнал физики . 63 (7): 653. Бибкод : 1995AmJPh..63..653F . дои : 10.1119/1.17828 .
- ↑ Перейти обратно: Перейти обратно: а б с Гринвуд и Эрншоу 1997 , с. 12.
- ^ Вусли, С.; Янка, Т. (2006). «Физика коллапса ядра сверхновой». Физика природы . 1 (3): 147–54. arXiv : astro-ph/0601261 . Бибкод : 2005NatPh...1..147W . дои : 10.1038/nphys172 . S2CID 118974639 .
- ^ Макдональд, И.; Слоан, GC; Зийлстра, А.А.; Мацунага, Н.; Мацуура, М.; Кремер, Кентукки; Бернар-Салас, Ж.; Марквик, Эй Джей (2010). «Ржавые старые звезды: источник недостающего межзвездного железа?». Письма астрофизического журнала . 717 (2): L92–L97. arXiv : 1005.3489 . Бибкод : 2010ApJ...717L..92M . дои : 10.1088/2041-8205/717/2/L92 . S2CID 14437704 .
- ^ Баутиста, Мануэль А.; Прадхан, Анил К. (1995). «Изобилие железа и никеля в регионах H ~ II и остатках сверхновых». Бюллетень Американского астрономического общества . 27 : 865. Бибкод : 1995AAS...186.3707B .
- ^ Дайсон, Фриман Дж. (1979). «Время без конца: Физика и биология в открытой вселенной». Обзоры современной физики . 51 (3): 447–60. Бибкод : 1979РвМП...51..447Д . дои : 10.1103/RevModPhys.51.447 .
- ^ Арон, Джейкоб. «Космические пули сверхновых могли посеять железное ядро Земли» . Новый учёный . Проверено 2 октября 2020 г. .
- ^ Кросвелл, Кен. «Железо в огне: сверхновые маленькие звезды, которые могли бы» . Научный американец . Проверено 3 января 2021 г.
- ^ Бухвальд, В.Ф. (1992). «Об использовании железа эскимосами в Гренландии». Характеристика материалов . 29 (2): 139–176. дои : 10.1016/1044-5803(92)90112-У .
- ^ Эмилиани, Чезаре (1992). Планета Земля: космология, геология и эволюция жизни и окружающей среды . Издательство Кембриджского университета. п. 152. Бибкод : 1992pecg.book.....E . ISBN 978-0-521-40949-0 .
- ^ Пернет-Фишер, Дж.; Дэй, JMD; Ховарт, GH; Рябов В.В.; Тейлор, Луизиана (2017). «Дегазация атмосферы и образование самородного железа при взаимодействии углеродистых отложений и базальтового расплава» . Письма о Земле и планетологии . 460 : 201–212. Бибкод : 2017E&PSL.460..201P . дои : 10.1016/j.epsl.2016.12.022 .
- ↑ Старк, Энн М. (20 сентября 2007 г.) Исследователи обнаруживают зону перехода вращения мантии, что приводит к разгадке структуры Земли . Ливерморская национальная лаборатория Лоуренса
- ^ Ферропериклаз . Mindat.org
- ^ Мураками, М.; Охиши Ю.; Хирао Н.; Хиросе К. (2012). «Перовскитовая нижняя мантия, полученная на основе данных о скорости звука при высоком давлении и высокой температуре». Природа . 485 (7396): 90–94. Бибкод : 2012Природа.485...90М . дои : 10.1038/nature11004 . ПМИД 22552097 . S2CID 4387193 .
- ^ Шарп, Т. (27 ноября 2014 г.). «Бриджманит – назван наконец». Наука . 346 (6213): 1057–58. Бибкод : 2014Sci...346.1057S . дои : 10.1126/science.1261887 . ПМИД 25430755 . S2CID 206563252 .
- ^ Конг, Литва; Ли, Дж. Ф.; Ши, QW; Хуанг, HJ; Чжао, К. (6 марта 2012 г.). «Динамическая стабильность железа в условиях высоких температур и высокого давления». ЭПЛ . 97 (5): 56004п1–56004п5. Бибкод : 2012EL.....9756004K . дои : 10.1209/0295-5075/97/56004 . S2CID 121861429 .
- ^ Гаминчев, К.Г.; Чамати, Х. (3 декабря 2014 г.). «Динамическая стабильность Fe под высоким давлением» . Дж. Физ . 558 (1): 012013(1–7). Бибкод : 2014JPhCS.558a2013G . дои : 10.1088/1742-6596/558/1/012013 .
- ^ Морган, Джон В. и Андерс, Эдвард (1980). «Химический состав Земли, Венеры и Меркурия» . Учеб. Натл. акад. наук. 77 (12): 6973–77. Бибкод : 1980PNAS...77.6973M . дои : 10.1073/pnas.77.12.6973 . ПМК 350422 . ПМИД 16592930 .
- ^ «Пирротин» . Mindat.org . Проверено 7 июля 2009 г.
- ^ Кляйн, Корнелис и Корнелиус С. Херлбат-младший (1985) Руководство по минералогии, Wiley, 20-е изд., стр. 278–79 ISBN 0-471-80580-7
- ↑ Перейти обратно: Перейти обратно: а б Гринвуд и Эрншоу 1997 , с. 1071.
- ^ Лайонс, ТВ; Рейнхард, Коннектикут (2009). «Ранняя Земля: Кислород для поклонников хэви-метала» . Природа . 461 (7261): 179–181. Бибкод : 2009Natur.461..179L . дои : 10.1038/461179а . ПМИД 19741692 . S2CID 205049360 .
- ^ Клауд, П. (1973). «Палеоэкологическое значение полосчатой железистой формации». Экономическая геология . 68 (7): 1135–43. Бибкод : 1973EcGeo..68.1135C . дои : 10.2113/gsecongeo.68.7.1135 .
- ^ Дикинсон, Роберт Э. (1964). Германия: Региональная и экономическая география (2-е изд.). Лондон: Метуэн.
- ^ Натуральные камни в Баден-Вюртемберге. Государственное управление геологии, сырья и горнодобывающей промышленности, Баден-Вюртемберг
- ^ «Сказки на берегу реки» . Сохранение камня Минервы. Архивировано из оригинала 28 сентября 2015 года . Проверено 22 сентября 2015 г.
- ^ Клингельхёфер, Г.; Моррис, Р.В.; Соуза, Пенсильвания; Родионов Д.; Шредер, К. (2007). «Два земных года мессбауэровских исследований поверхности Марса с помощью MIMOS II». Сверхтонкие взаимодействия . 170 (1–3): 169–77. Бибкод : 2006HyInt.170..169K . дои : 10.1007/s10751-007-9508-5 . S2CID 98227499 .
- ^ Виндерлих, Р.; Питер, В. (1954). Учебник химии для высших учебных заведений: стандартное издание для младших и старших уровней (на немецком языке). Висбаден: Vieweg+Teubner Verlag. п. 75. ИСБН 978-3-663-04370-6 . OCLC 913701506 .
- ^ Бертау, Мартин (2013). Промышленная неорганическая химия (на немецком языке). Вайнхайм: Wiley-VCH. п. 696. ИСБН 978-3-527-64956-3 . OCLC 855858511 .
- ^ Запасы металлов в обществе: научный синтез , 2010, Международная группа ресурсов , ЮНЕП.
- ^ Столл, Хизер (17 февраля 2020 г.). «30 лет железной гипотезы ледниковых периодов». Природа . 578 (7795). ООО «Спрингер Сайенс энд Бизнес Медиа»: 370–371. Бибкод : 2020Natur.578..370S . дои : 10.1038/d41586-020-00393-x . ISSN 0028-0836 . ПМИД 32066927 . S2CID 211139074 .
- ^ Fe (-4), Ru (-4) и Os (-4) наблюдались в богатых металлами соединениях, содержащих октаэдрические комплексы [MIN 6- x Sn x ]; Pt(−3) (как димерный анион [Pt–Pt] 6− ), Cu(-2), Zn(-2), Ag(-2), Cd(-2), Au(-2) и Hg(-2) наблюдались (в виде димерных и мономерных анионов; димерные ионы первоначально сообщалось, что это [T – T] 2− для Zn, Cd, Hg, но позже было показано, что это [T – T] 4− для всех этих элементов) в La 2 Pt 2 In, La 2 Cu 2 In, Ca 5 Au 3 , Ca 5 Ag 3 , Ca 5 Hg 3 , Sr 5 Cd 3 , Ca 5 Zn 3 (строение (АЭ 2+ ) 5 (Т – Т) 4− Т 2− ⋅4e − ), Yb 3 Ag 2 , Ca 5 Au 4 и Ca 3 Hg 2 ; Au(–3) наблюдался в ScAuSn и других 18-электронных полугейслеровских соединениях. Видеть Чанхун Ли; Мён Хван Вангбо (2008). «Анионы поздних переходных металлов, действующие как элементы p-металлов». Науки о твердом теле . 10 (4): 444–449. Бибкод : 2008SSSci..10..444K . doi : 10.1016/j.solidstatesciences.2007.12.001 . и Чанхун Ли; Мён Хван Вангбо; Юрген Кёлер (2010). «Анализ электронной структуры и химической связи металлосодержащих соединений. 2. Наличие димера (Т – Т)». 4– и изолированный Т 2– Анионы в полярных интерметаллидах Cr 5 B 3 -соединения типа AE 5 T 3 (AE = Ca, Sr; T = Au, Ag, Hg, Cd, Zn)". Журнал неорганической и общей химии . 636 (1): 36 –40 дои : 10.1002/zaac.200900421 .
- ^ Гринвуд и Эрншоу 1997 , с. 905.
- ↑ Перейти обратно: Перейти обратно: а б Гринвуд и Эрншоу 1997 , с. 1070.
- ^ Лу, Джун-Бо; Цзянь, Дживэнь; Хуан, Вэй; Лин, Хайлу; Ли, Цзюнь; Чжоу, Минфэй (16 ноября 2016 г.). «Экспериментальная и теоретическая идентификация степени окисления Fe(VII) в FeO 4 − ". Phys. Chem. Chem. Phys . 18 (45): 31125–31131. Bibcode : 2016PCCP...1831125L . doi : 10.1039/c6cp06753k . PMID 27812577 .
- ^ Нам, Вону (2007). «Высоковалентное железо (IV) – оксокомплексы гема и негемовых лигандов в реакциях оксигенации» (PDF) . Отчеты о химических исследованиях . 40 (7): 522–531. дои : 10.1021/ar700027f . ПМИД 17469792 . Архивировано из оригинала (PDF) 15 июня 2021 года . Проверено 22 февраля 2022 г.
- ↑ Перейти обратно: Перейти обратно: а б с д и ж Холлеман, Арнольд Ф.; Виберг, Эгон; Виберг, Нильс (1985). "Железо". Учебник неорганической химии (на немецком языке) (91–100 изд.). Вальтер де Грюйтер. стр. 1125–46. ISBN 3-11-007511-3 .
- ^ Рейфф, Уильям Майкл; Лонг, Гэри Дж. (1984). «Мессбауэровская спектроскопия и координационная химия железа». Мессбауэровская спектроскопия в применении к неорганической химии . Спрингер. стр. 245–83. ISBN 978-0-306-41647-7 .
- ^ Уэр, Майк (1999). «Введение в монохром» . Цианотипия: история, наука и искусство фотопечати берлинской лазурью . NMSI Trading Ltd., стр. 11–19. ISBN 978-1-900747-07-3 .
- ^ Гмелин, Леопольд (1852). «Ртуть и железо» . Справочник по химии . Том. 6. Кавендишское общество. стр. 128–29.
- ↑ Перейти обратно: Перейти обратно: а б с Гринвуд и Эрншоу 1997 , с. 1079.
- ↑ Перейти обратно: Перейти обратно: а б с д Гринвуд и Эрншоу 1997 , стр. 1082–84.
- ^ Зигфрид Поль, Ульрих Бирбах, Вольфганг Саак; «FeI3SC(NMe2)2, нейтральный тиомочевинный комплекс йодида железа (III), Angewandte Chemie International Edition на английском языке (1989) 28 (6), 776-777. https://doi.org/10.1002/anie.198907761
- ^ Николас А. Барнс, Стивен М. Годфри, Николас Хо, Чарльз А. Маколифф, Робин Г. Притчард; «Простой синтез редкого примера комплекса йодида железа (III) [FeI3(AsMe3)2] из реакции Me3AsI2 с неактивированным порошком железа», Polyhedron (2013) 55, 67-72. https://doi.org/10.1016/j.poly.2013.02.066
- ↑ Перейти обратно: Перейти обратно: а б с д Гринвуд и Эрншоу 1997 , стр. 1088–91.
- ↑ Перейти обратно: Перейти обратно: а б Гринвуд и Эрншоу 1997 , стр. 1091–97.
- ^ Клаузен, Калифорния; Хорошо, МЛ (1968). «Стабилизация аниона гексахлорферрата (III) катионом метиламмония». Неорганическая химия . 7 (12): 2662–63. дои : 10.1021/ic50070a047 .
- ^ Джеймс, Б.Д.; Бакалова М.; Лизеганга, Дж.; Райфф, ВМ; Хоклесс, округ Колумбия; Скелтон, BW; Уайт, АХ (1996). «Анион гексахлорферрата (III), стабилизированный в упаковках с водородными связями. Сравнение рентгеновских кристаллических структур и низкотемпературного магнетизма хлорида ( I) гексахлорферрата (III) тетракис (метиламмония) гексахлорферрата (III) и тетрахлорферрата тетракис (гексаметилендиаммония) гексахлорферрата (III)». (III) тетрахлорид (II) ». Неорганика Химика Акта . 247 (2): 169–74. дои : 10.1016/0020-1693(95)04955-X .
- ^ Джанноккаро, П.; Сакко, А. (1977). «Комплексы бис[этиленбис(дифенилфосфин)]-гидридожелезо». Неорганические синтезы . Том. 17. С. 69–72. дои : 10.1002/9780470132487.ch19 . ISBN 978-0-470-13248-7 .
- ^ Ли, Дж.; Юнг, Г.; Ли, Юго-Запад (1998). «Структура транс-хлоргидридобис(дифенилфосфиноэтана) железа(II)» . Бык. Корейская хим. Соц . 19 (2): 267–69. дои : 10.1007/BF02698412 . S2CID 35665289 .
- ^ Этиго, Такуя; Кимата, Мицуёси (2008). «Монокристаллическая рентгеновская дифракция и спектроскопические исследования гумбольдтина и линдбергита: слабый эффект Яна – Теллера Fe. 2+ ion». Phys. Chem. Minerals . 35 (8): 467–75. Bibcode : 2008PCM....35..467E . doi : 10.1007/s00269-008-0241-7 . S2CID 98739882 .
- ^ Гринвуд, Норман Н .; Эрншоу, Алан (1984). Химия элементов . Оксфорд: Пергамон Пресс . стр. 1282–86. ISBN 978-0-08-022057-4 . .
- ^ Кили, Ти Джей; Паусон, Польша (1951). «Новый тип железоорганических соединений». Природа . 168 (4285): 1039–40. Бибкод : 1951Natur.168.1039K . дои : 10.1038/1681039b0 . S2CID 4181383 .
- ^ Миллер, ЮАР; Теббот, Дж.А.; Тремейн, Дж. Ф. (1952). «114. Дициклопентадиенилирон». Дж. Хим. Соц. : 632–635. дои : 10.1039/JR9520000632 .
- ^ Уилкинсон, Г .; Розенблюм, М.; Уайтинг, MC; Вудворд, РБ (1952). «Структура бис-циклопентадиенила железа». Дж. Ам. хим. Соц. 74 (8): 2125–2126. дои : 10.1021/ja01128a527 .
- ^ Окуда, июнь (28 декабря 2016 г.). «Ферроцен – 65 лет спустя» . Европейский журнал неорганической химии . 2017 (2): 217–219. дои : 10.1002/ejic.201601323 . ISSN 1434-1948 .
- ^ Гринвуд и Эрншоу 1997 , с. 1104.
- ^ Буллок, РМ (11 сентября 2007 г.). «Железный катализатор гидрирования кетонов в мягких условиях» . Энджью. хим. Межд. Эд. 46 (39): 7360–63. дои : 10.1002/anie.200703053 . ПМИД 17847139 .
- ^ Уикс 1968 , с. 4.
- ↑ Перейти обратно: Перейти обратно: а б Уикс 1968 , с. 29.
- ↑ Перейти обратно: Перейти обратно: а б с Уикс 1968 , с. 31.
- ^ Бьоркман, Джудит Кингстон (1973). «Метеоры и метеориты на древнем Ближнем Востоке». Метеоритика . 8 (2): 91–132. Бибкод : 1973Metic...8...91B . дои : 10.1111/j.1945-5100.1973.tb00146.x .
- ^ Комелли, Даниэла; д'Орацио, Массимо; Фолько, Луиджи; Эль-Халваги, Махмуд; Фриззи, Томмазо; Альберти, Роберто; Капогроссо, Валентина; Эльнаггар, Абдельразек; Хасан, Хала; Невин, Остин; Порчелли, Франко; Рашед, Мохамед Дж; Валентини, Джанлука (2016). «Метеоритное происхождение лезвия железного кинжала Тутанхамона» . Метеоритика и планетология . 51 (7): 1301–09. Бибкод : 2016M&PS...51.1301C . дои : 10.1111/maps.12664 .
- ^ Уолш, Деклан (2 июня 2016 г.). «Кинжал Тутанхамона сделан из «небесного железа», говорят исследователи» . Нью-Йорк Таймс . Архивировано из оригинала 3 января 2022 года . Проверено 4 июня 2016 г.
состав лезвия из железа, никеля и кобальта примерно соответствовал составу метеорита, упавшего в северном Египте. Результат «убедительно предполагает внеземное происхождение».
- ^ Юр, Эндрю (1843). Технический словарь или справочник по промышленным исследованиям...: Под редакцией доктора Д. Словарь искусств, производства и шахт Эндрю Юра (на немецком языке). Г. Хаазе. п. 492.
- ↑ Перейти обратно: Перейти обратно: а б с д Уикс 1968 , с. 32.
- ^ МакНатт, Паула (1990 1). Ковка Израиля: технология железа, символизм и традиции в древнем обществе. А&С Черный.
- ^ Тевари, Ракеш. «Истоки обработки железа в Индии: новые свидетельства из равнины Центральной Ганги и восточных Виндхья» (PDF) . Государственный археологический департамент . Проверено 23 мая 2010 г.
- ^ Фотографии Э. (1989). «Вопрос о метеоритном и выплавленном никелевом железе: археологические данные и результаты экспериментов». Мировая археология . 20 (3). Тейлор и Фрэнсис, ООО: 403–21. дои : 10.1080/00438243.1989.9980081 . JSTOR 124562 .
- ^ Мули, Джеймс Д. (2003). «Металлообработка/горное дело в Леванте». В озере, Ричард Вайнона (ред.). Ближневосточная археология IN: Eisenbrauns . Том. 180. стр. 174–83.
- ^ Витцель, Майкл (2001), «Автохтонные арийцы? Свидетельства из древнеиндийских и иранских текстов» , в Электронном журнале ведических исследований (EJVS) 7-3, стр. 1–93.
- ^ Недели, с. 33, цитируя Клайна, Уолтера (1937) «Горное дело и металлургия в негритянской Африке», George Banta Publishing Co., Менаша, Висконсин, стр. 17–23.
- ^ Ридерер, Йозеф; Вартке, Ральф Б. (2009) «Железо», Канчик, Юбер; Шнайдер, Хельмут (ред.): New Pauly Brill , Brill.
- ^ Сойер, Ральф Д. и Сойер, Мэй-чун (1993). Семь военных классиков Древнего Китая. Боулдер: Вествью. ISBN 0-465-00304-4 . п. 10.
- ^ Пиготт, Винсент К. (1999). Археометаллургия азиатского Старого Света . Филадельфия: Музей археологии и антропологии Пенсильванского университета. ISBN 0-924171-34-0 , с. 8.
- ^ Голас, Питер Дж. (1999). Наука и цивилизация в Китае: Том 5, Химия и химическая технология, Часть 13, Горное дело . Издательство Кембриджского университета. п. 152. ИСБН 978-0-521-58000-7 .
Самая ранняя доменная печь, обнаруженная в Китае примерно в первом веке нашей эры.
- ^ Пиготт, Винсент К. (1999). Археометаллургия азиатского Старого Света . Филадельфия: Музей археологии и антропологии Пенсильванского университета. ISBN 0-924171-34-0 , с. 191.
- ^ Наступление стального века . Архив Брилла. 1961. с. 54.
- ^ Мотт, РА (2014). «Сухая и мокрая лужа». Труды Общества Ньюкомена . 49 : 156–57. дои : 10.1179/tns.1977.011 .
- ^ Вагнер, Дональд Б. (2003). «Китайские доменные печи X-XIV веков» (PDF) . Историческая металлургия . 37 (1): 25–37. Архивировано из оригинала (PDF) 7 января 2018 года . Проверено 7 января 2018 г. первоначально опубликовано в Вагнер, Дональд Б. (2001). «Китайские доменные печи X-XIV веков». Западноазиатская наука, технология и медицина . 18 : 41–74. дои : 10.1163/26669323-01801008 .
- ^ Джанничедда, Энрико (2007): «Производство металлов в поздней античности» , в книге «Технологии переходного периода», 300–650 гг. нашей эры Лаван, Л.; Занини Э. и Сарантис А. (ред.), Брилл, Лейден; ISBN 90-04-16549-5 , стр. 200.
- ↑ Перейти обратно: Перейти обратно: а б с д и ж г Биддл, Верн; Паркер, Грегори. Химия, точность и дизайн . Книга Бека, Inc.
- ^ Вагнер, Дональд Б. (1993). Железо и сталь в Древнем Китае . Брилл. стр. 335–340. ISBN 978-90-04-09632-5 .
- ↑ Перейти обратно: Перейти обратно: а б с д Гринвуд и Эрншоу 1997 , с. 1072.
- ^ Шивельбуш, Г. (1986) Железнодорожное путешествие: индустриализация и восприятие времени и пространства в 19 веке. Оксфорд: Берг.
- ^ Сперл, Джозеф С. Краткая история производства железа и стали. Архивировано 2 июня 2010 года в Wayback Machine . Колледж Святого Ансельма
- ^ Энхаг, Пер (8 января 2008 г.). Энциклопедия элементов: Технические данные – История – Обработка – Применения . Джон Уайли и сыновья. стр. 190–91. ISBN 978-3-527-61234-5 .
- ^ Уитакер, Роберт Д. (1975). «Историческая справка о сохранении массы». Журнал химического образования . 52 (10): 658. Бибкод : 1975ЖЧЭд..52..658В . дои : 10.1021/ed052p658 .
- ^ Фонтенроуз, Джозеф (1974). «Работа, справедливость и пять веков Гесиода». Классическая филология . 69 (1): 1–16. дои : 10.1086/366027 . JSTOR 268960 . S2CID 161808359 .
- ^ Шмидт, Ева (1981) Художественное литье из прусского железа. (Искусство прусского чугуна) технология, история, творчество, художники . Издательство Манн, Берлин, ISBN 3-7861-1130-8
- ^ Люкс, Х. (1963) «Металлическое железо» в Справочнике по препаративной неорганической химии , 2-е изд. Г. Брауэр (редактор), Academic Press, Нью-Йорк. Том. 2. стр. 1490–91.
- ^ Статистический ежегодник стали, 2010 год . Всемирная ассоциация производителей стали
- ↑ Перейти обратно: Перейти обратно: а б с д и ж г Гринвуд и Эрншоу 1997 , с. 1073.
- ^ Ван, Пэн; Райберг, Мортен; Ян, Йи; Фэн, Куйшуан; Кара, Сами; Хаушильд, Майкл; Чен, Вэй-Цян (6 апреля 2021 г.). «Стагнация эффективности мирового производства стали требует совместных усилий по смягчению последствий со стороны предложения и спроса» . Природные коммуникации . 12 (1): 2066. Бибкод : 2021NatCo..12.2066W . дои : 10.1038/s41467-021-22245-6 . ISSN 2041-1723 . ПМК 8024266 . ПМИД 33824307 .
- ^ Сун Инсин (1637): Энциклопедия Тяньгун Кайу .
- ^ Верховен, JD (1975) Основы физической металлургии , Wiley, Нью-Йорк, стр. 326
- ^ Алланор, Антуан; Инь, Лан; Садовей, Дональд Р. (2013). «Новый анодный материал для выделения кислорода при электролизе расплавленных оксидов». Природа . 497 (7449): 353–356. Бибкод : 2013Natur.497..353A . дои : 10.1038/nature12134 . hdl : 1721.1/82073 . ISSN 0028-0836 . ПМИД 23657254 .
- ^ Винке, Ян; Лавелейн, Эрве; Пантеикс, Пьер-Жан; Петижан, Карин; Рапен, Кристоф (2018). «Электролиз железа в расплавленном оксидном электролите». Журнал прикладной электрохимии . 48 (1): 115–126. дои : 10.1007/s10800-017-1143-5 . ISSN 0021-891X .
- ^ Фань, Чжиюань; Фридманн, С. Хулио (2021). «Низкоуглеродное производство железа и стали: варианты технологий, экономическая оценка и политика» . Джоуль . 5 (4): 829–862. Бибкод : 2021Джоуль...5..829F . дои : 10.1016/j.joule.2021.02.018 .
- ^ Галлуччи, Мария (7 сентября 2023 г.). «Boston Metal получает значительное финансирование для производства экологически чистой стали» . Канарские СМИ . Институт Роки Маунтин . Проверено 11 марта 2024 г.
- ↑ Перейти обратно: Перейти обратно: а б Коль, Уолтер Х. (1995). Справочник материалов и технологий для вакуумных приборов . Спрингер. стр. 164–67. ISBN 1-56396-387-6 .
- ↑ Перейти обратно: Перейти обратно: а б Кун, Ховард; Медлин, Дана; и др., ред. (2000). Справочник ASM – Механические испытания и оценка (PDF) . Том. 8. АСМ Интернэшнл. п. 275. ИСБН 0-87170-389-0 . Архивировано из оригинала (PDF) 9 февраля 2019 года . Проверено 22 февраля 2022 г.
- ^ Гринвуд и Эрншоу 1997 , стр. 1070–71.
- ^ «Таблица преобразования твердости» . Мэрилендские метрики. Архивировано из оригинала 18 июня 2015 года . Проверено 23 мая 2010 г.
- ^ Отани (1964). исследование чистого железа I» . Хагане . Такаджи , Кусакава ; Тецу-то - Тошикацу , « Свойства различных чистых железа :
- ^ Рагхаван, В. (2004). Материаловедение и инженерия . PHI Learning Pvt. ООО с. 218. ИСБН 81-203-2455-2 .
- ^ Мартин, Джон Уилсон (2007). Краткая энциклопедия строения материалов . Эльзевир. п. 183. ИСБН 978-0-08-045127-5 .
- ↑ Перейти обратно: Перейти обратно: а б Кэмп, Джеймс Макинтайр; Фрэнсис, Чарльз Блейн (1920). Изготовление, обработка и обработка стали . Питтсбург: Carnegie Steel Company. стр. 173–74. ISBN 1-147-64423-3 .
- ↑ Перейти обратно: Перейти обратно: а б Смит, Уильям Ф.; Хашеми, Джавад (2006), Основы материаловедения и инженерии (4-е изд.), McGraw-Hill, стр. 431, ISBN 0-07-295358-6 .
- ↑ Перейти обратно: Перейти обратно: а б «Классификация углеродистых и низколегированных сталей» . Архивировано из оригинала 2 января 2011 года . Проверено 5 января 2008 г.
- ^ «ХСЛА Сталь» . 15 ноября 2002 г. Архивировано из оригинала 30 декабря 2009 г. Проверено 11 октября 2008 г.
- ^ Оберг, Э.; и др. (1996). Справочник по машинам (25-е изд.). Нью-Йорк: Промышленная пресса. стр. 440–42. Бибкод : 1984msh..book.....R .
- ^ Рокни, Сайед Х.; Коссер, Дж. Дональд; Лю, Джеймс К. (январь 2008 г.). «Радиационная защита на ускорителях электронов и протонов высоких энергий» (PDF) . Проверено 6 августа 2016 г.
- ↑ Перейти обратно: Перейти обратно: а б с Гринвуд и Эрншоу 1997 , с. 1076.
- ^ Фюрстнер, Алоис (2016). «Железный катализ в органическом синтезе: критическая оценка того, что нужно, чтобы сделать этот недрагоценный металл чемпионом многозадачности» . Центральная научная служба ACS . 2 (11): 778–789. дои : 10.1021/accentsci.6b00272 . ПМК 5140022 . ПМИД 27981231 .
- ^ Баллок, Р. Моррис; и др. (2020). «Использование природного проекта для расширения катализа с помощью металлов, изобилующих на Земле» . Наука . 369 (6505): eabc3183. дои : 10.1126/science.abc3183 . ПМЦ 7875315 . ПМИД 32792370 .
- ^ Коласински, Курт В. (2002). «Где важны гетерогенные реакции» . Наука о поверхности: основы катализа и нанонауки . Джон Уайли и сыновья. стр. 15–16. ISBN 978-0-471-49244-3 .
- ^ МакКетта, Джон Дж. (1989). «Нитробензол и нитротолуол» . Энциклопедия химической обработки и проектирования: Том 31 – Природный газ, сжиженный газ и природный бензин для морских технологических трубопроводов: высокоэффективные сплавы . ЦРК Пресс. стр. 166–67. ISBN 978-0-8247-2481-8 .
- ↑ Перейти обратно: Перейти обратно: а б с Вильдермут, Эгон; Старк, Ганс; Фридрих, Габриэле; Эбенхёх, Франц Людвиг; Кюборт, Бриджит; Сильвер, Джек; Ритупер, Рафаэль (2000). «Соединения железа». Энциклопедия промышленной химии Ульмана . дои : 10.1002/14356007.a14_591 . ISBN 3-527-30673-0 .
- ^ Страуд, Роберт (1933). Болезни канареек . Канарская издательская компания. п. 203. ИСБН 978-1-4465-4656-7 .
- ^ Всемирная организация здравоохранения (2021 г.). Примерный список основных лекарственных средств Всемирной организации здравоохранения: 22-й список (2021 г.) . Женева: Всемирная организация здравоохранения. hdl : 10665/345533 . ВОЗ/MHP/HPS/EML/2021.02.
- ^ Длоуи, Адриенн К.; Ауттен, Кэрин Э. (2013). «Железный металлом в эукариотических организмах». В Банки, Люсия (ред.). Металломика и клетка . Ионы металлов в науках о жизни. Том. 12. Спрингер. стр. 241–78. дои : 10.1007/978-94-007-5561-1_8 . ISBN 978-94-007-5560-4 . ПМЦ 3924584 . ПМИД 23595675 . электронная книга ISBN 978-94-007-5561-1
- ^ Да, Гереон М.; Толман, Уильям Б. (2015). «Комплексы переходных металлов и активация дикислорода». У Питера М.Х. Кронека; Марта Э. Соса Торрес (ред.). Поддержание жизни на планете Земля: металлоферменты, усваивающие дикислород и другие жевательные газы . Ионы металлов в науках о жизни. Том. 15. Спрингер. стр. 131–204. дои : 10.1007/978-3-319-12415-5_5 . ISBN 978-3-319-12414-8 . ПМИД 25707468 .
- ↑ Перейти обратно: Перейти обратно: а б с д и ж г час я дж к л м н тот п Гринвуд и Эрншоу 1997 , стр. 1098–104.
- ^ Липпард, С.Дж.; Берг, Дж. М. (1994). Основы бионеорганической химии . Милл-Вэлли: Университетские научные книги. ISBN 0-935702-73-3 .
- ^ Кикучи, Г.; Ёсида, Т.; Ногучи, М. (2005). «Гемоксигеназа и деградация гема». Связь с биохимическими и биофизическими исследованиями . 338 (1): 558–67. дои : 10.1016/j.bbrc.2005.08.020 . ПМИД 16115609 .
- ^ «Содержание томов в серии «Ионы металлов в науках о жизни». Металлы, микробы и минералы – биогеохимическая сторона жизни . Де Грютер. 2021. стр. xxv – xlvi. дои : 10.1515/9783110589771-006 . ISBN 9783110589771 . S2CID 196704759 .
- ^ Нейландс, Дж. Б. (1995). «Сидерофоры: строение и функции микробных соединений-переносчиков железа» . Журнал биологической химии . 270 (45): 26723–26. дои : 10.1074/jbc.270.45.26723 . ПМИД 7592901 .
- ^ Нейландс, Дж. Б. (1981). «Микробные соединения железа». Ежегодный обзор биохимии . 50 (1): 715–31. дои : 10.1146/annurev.bi.50.070181.003435 . ПМИД 6455965 .
- ^ Бухалфа, Хаким; Крамблис, Элвин Л. (2002). «Химические аспекты транспорта железа, опосредованного сидерофорами». Биометаллы . 15 (4): 325–39. дои : 10.1023/А:1020218608266 . ПМИД 12405526 . S2CID 19697776 .
- ^ Нанами, М.; Оокавара, Т.; Отаки, Ю.; Ито, К.; Моригучи, Р.; Миягава, К.; Хасуике, Ю.; Идзуми, М.; Эгучи, Х.; Сузуки, К.; Наканиши, Т. (2005). «Секвестрация железа, индуцированная фактором некроза опухоли-α, и окислительный стресс в эндотелиальных клетках человека» . Атеросклероз, тромбоз и сосудистая биология . 25 (12): 2495–501. дои : 10.1161/01.ATV.0000190610.63878.20 . ПМИД 16224057 .
- ^ Руо, Трейси А. (2003). «Как млекопитающие приобретают и распределяют железо, необходимое для кислородного метаболизма» . ПЛОС Биология . 1 (3): e9. дои : 10.1371/journal.pbio.0000079 . ПМК 300689 . ПМИД 14691550 .
- ^ Бун Э.М., Даунс А., Марси Д. «Предлагаемый механизм каталазы» . Каталаза: H 2 O 2 : H 2 O 2 Оксидоредуктаза: Учебное пособие по структуре каталазы . Проверено 11 февраля 2007 г.
- ^ Бойингтон Дж.К., Гаффни Б.Дж., Амзель Л.М. (1993). «Трехмерная структура 15-липоксигеназы арахидоновой кислоты». Наука . 260 (5113): 1482–86. Бибкод : 1993Sci...260.1482B . дои : 10.1126/science.8502991 . ПМИД 8502991 .
- ^ Грей, Северная Каролина; Хентце, М.В. (август 1994 г.). «Железорегуляторный белок предотвращает связывание комплекса преинициации трансляции 43S с мРНК ферритина и eALAS» . ЭМБО Дж . 13 (16): 3882–91. дои : 10.1002/j.1460-2075.1994.tb06699.x . ПМЦ 395301 . ПМИД 8070415 .
- ^ Грегори Б. Васкес; Синьхуа Цзи; Клара Фронтичелли; Гэри Л. Гиллиланд (1998). «Человеческий карбоксигемоглобин с разрешением 2,2 Å: сравнение структуры и растворителей гемоглобинов в R-состоянии, R2-состоянии и Т-состоянии» . Акта Кристаллогр. Д. 54 (3): 355–66. Бибкод : 1998AcCrD..54..355V . дои : 10.1107/S0907444997012250 . ПМИД 9761903 .
- ^ Сандерсон, К. (2017). «Железная хватка мидий вдохновляет на создание прочного и эластичного полимера» . Новости химии и техники . 95 (44). Американское химическое общество: 8. doi : 10.1021/cen-09544-notw3 . Проверено 2 ноября 2017 г.
- ^ Агентство по пищевым стандартам - Ешьте хорошо, будьте здоровы - Дефицит железа. Архивировано 8 августа 2006 г. в Wayback Machine . Eatwell.gov.uk (5 марта 2012 г.). Проверено 27 июня 2012 г.
- ^ Хоппе, М.; Хюльтен, Л.; Халлберг, Л. (2005). «Относительная биодоступность у людей порошков элементарного железа для использования в обогащении пищевых продуктов». Европейский журнал питания . 45 (1): 37–44. дои : 10.1007/s00394-005-0560-0 . ПМИД 15864409 . S2CID 42983904 .
- ^ Пинеда, О.; Эшмид, HD (2001). «Эффективность лечения железодефицитной анемии у детей грудного и раннего возраста хелатом бис-глицината железа». Питание . 17 (5): 381–4. дои : 10.1016/S0899-9007(01)00519-6 . ПМИД 11377130 .
- ^ Эшмид, Х. ДеУэйн (1989). Беседы о хелировании и минеральном питании . Издательство Китс. ISBN 0-87983-501-Х .
- ^ Группа экспертов Института медицины (США) по микроэлементам (2001 г.). «Железо» (PDF) . Рекомендуемая диетическая норма витамина А, витамина К, мышьяка, бора, хрома, меди, йода, железа, марганца, молибдена, никеля, кремния, ванадия и железа . Национальная Академия Пресс. стр. 290–393. ISBN 0-309-07279-4 . ПМИД 25057538 . Архивировано из оригинала (PDF) 9 сентября 2017 года . Проверено 9 марта 2017 г.
- ^ «Обзор диетических эталонных значений для населения ЕС, составленный Группой EFSA по диетическим продуктам, питанию и аллергиям» (PDF) . Европейское агентство по безопасности пищевых продуктов . 2017.
- ^ «Верхние допустимые уровни потребления витаминов и минералов» (PDF) . Европейское агентство по безопасности пищевых продуктов. 2006.
- ^ «Железодефицитная анемия» . МедиРесурс. Архивировано из оригинала 16 декабря 2008 года . Проверено 17 декабря 2008 г.
- ^ Милман, Н. (1996). «Сывороточный ферритин у датчан: исследования статуса железа от младенчества до старости, во время сдачи крови и беременности» . Международный журнал гематологии . 63 (2): 103–35. дои : 10.1016/0925-5710(95)00426-2 . ПМИД 8867722 .
- ^ «Федеральный реестр, 27 мая 2016 г. Маркировка пищевых продуктов: пересмотренная версия этикеток с информацией о пищевой ценности и пищевых добавках. Страница FR 33982» (PDF) .
- ^ «Справочник по дневной норме базы данных этикеток пищевых добавок (DSLD)» . База данных этикеток пищевых добавок (DSLD) . Архивировано из оригинала 7 апреля 2020 года . Проверено 16 мая 2020 г.
- ^ Центры по контролю и профилактике заболеваний (2002). «Дефицит железа – США, 1999–2000 гг.» . ММВР . 51 (40): 897–99. ПМИД 12418542 .
- ^ Хидер, Роберт С.; Конг, Сяоле (2013). «Глава 8. Железо: влияние перегрузки и дефицита». В Астрид Сигель, Хельмут Сигель и Роланд К.О. Сигель (ред.). Взаимосвязь между ионами незаменимых металлов и заболеваниями человека . Ионы металлов в науках о жизни. Том. 13. Спрингер. стр. 229–94. дои : 10.1007/978-94-007-7500-8_8 . ISBN 978-94-007-7499-5 . ПМИД 24470094 .
- ^ Длоуи, Адриенн К.; Ауттен, Кэрин Э. (2013). «Железный металлом в эукариотических организмах». В Банки, Люсия (ред.). Металломика и клетка . Ионы металлов в науках о жизни. Том. 12. Спрингер. стр. 241–78. дои : 10.1007/978-94-007-5561-1_8 . ISBN 978-94-007-5560-4 . ПМЦ 3924584 . ПМИД 23595675 . электронная книга ISBN 978-94-007-5561-1
- ^ Центры CDC по контролю и профилактике заболеваний (3 апреля 1998 г.). «Рекомендации по предотвращению и контролю дефицита железа в Соединенных Штатах» . Еженедельный отчет о заболеваемости и смертности . 47 (RR3): 1 . Проверено 12 августа 2014 г.
- ^ Центры по контролю и профилактике заболеваний. «Железо и железодефицит» . Проверено 12 августа 2014 г.
- ^ Юдим, МБ; Бен-Шачар, Д.; Иегуда, С. (сентябрь 1989 г.). «Предполагаемые биологические механизмы влияния дефицита железа на биохимию и поведение мозга» . Американский журнал клинического питания . 50 (3 приложения): 607–615, обсуждение 615–617. дои : 10.1093/ajcn/50.3.607 . ISSN 0002-9165 . ПМИД 2773840 .
- ^ Эриксон, К.М.; Пинеро, диджей; Коннор-младший; Борода, JL (октябрь 1997 г.). «Региональные концентрации железа, ферритина и трансферрина в мозге во время дефицита железа и избытка железа у развивающихся крыс» . Журнал питания . 127 (10): 2030–2038. дои : 10.1093/jn/127.10.2030 . ISSN 0022-3166 . ПМИД 9311961 .
- ^ Унгер, Эрика Л.; Бьянко, Лаура Э.; Джонс, Байрон С.; Аллен, Ричард П.; Эрли, Кристофер Дж. (ноябрь 2014 г.). «Влияние низкого уровня железа в мозге и обратимость на динамику дофамина в полосатом теле» . Экспериментальная неврология . 261 : 462–468. дои : 10.1016/j.expneurol.2014.06.023 . ПМЦ 4318655 . ПМИД 24999026 .
- ^ Уорд, Роберта Дж.; Зукка, Фабио А.; Дуйн, Джефф Х.; Крайтон, Роберт Р.; Зекка, Луиджи (октябрь 2014 г.). «Роль железа в старении мозга и нейродегенеративных расстройствах» . «Ланцет». Неврология . 13 (10): 1045–1060. дои : 10.1016/S1474-4422(14)70117-6 . ISSN 1474-4465 . ПМЦ 5672917 . ПМИД 25231526 .
- ^ Пино, Джессика М.В.; да Луш, Марсио Х.М.; Антунес, Ханна К.М.; Джампа, Сара К. де Кампос; Мартинс, Вилма Р.; Ли, Кил С. (17 мая 2017 г.). «Диета с ограничением железа влияет на уровень ферритина в мозге, метаболизм дофамина и клеточный прионный белок в зависимости от региона» . Границы молекулярной нейронауки . 10 : 145. дои : 10.3389/fnmol.2017.00145 . ISSN 1662-5099 . ПМЦ 5434142 . ПМИД 28567002 .
- ^ Борода, Джон; Эриксон, Кейт М.; Джонс, Байрон К. (1 апреля 2003 г.). «Неонатальный дефицит железа приводит к необратимым изменениям функции дофамина у крыс» . Журнал питания . 133 (4): 1174–1179. дои : 10.1093/jn/133.4.1174 . ISSN 0022-3166 . ПМИД 12672939 .
- ^ Доминик Дж. Хэйр; Кей Л. Дабл (апрель 2016 г.). «Железо и дофамин: токсичная пара» . Мозг . 139 (4): 1026–1035. дои : 10.1093/brain/aww022 . ПМИД 26962053 .
- ^ Рамзи С. Котран; Винай Кумар; Такер Коллинз; Стэнли Леонард Роббинс (1999). Патологическая основа болезни Роббинса . Сондерс. ISBN 978-0-7216-7335-6 . Проверено 27 июня 2012 г.
- ^ Ганц Т. (август 2003 г.). «Гепцидин — ключевой регулятор обмена железа и медиатор анемии воспаления» . Кровь . 102 (3): 783–8. дои : 10.1182/кровь-2003-03-0672 . ПМИД 12663437 . S2CID 28909635 .
- ^ Дурупт, С.; Дюрье, И.; Нове-Жоссеран, Р.; Бенчариф, Л.; Руссе, Х.; Виталь Дюран, Д. (2000). Наследственный гемохроматоз. Преподобный Внутренний Мед . 21 (11): 961–71. дои : 10.1016/S0248-8663(00)00252-6 . ПМИД 11109593 .
- ↑ Перейти обратно: Перейти обратно: а б Чейни, К.; Гумбинер, К.; Бенсон, Б.; Тененбейн, М. (1995). «Выживание после тяжелого отравления железом, обработанного периодическими инфузиями дефероксамина». J Токсикол Клин Токсикол . 33 (1): 61–66. дои : 10.3109/15563659509020217 . ПМИД 7837315 .
- ↑ Перейти обратно: Перейти обратно: а б «Токсичность, железо» . Медскейп . Проверено 23 мая 2010 г.
- ^ Рекомендуемая норма потребления пищи (DRI): Рекомендуемая норма потребления для отдельных лиц (PDF) , Совет по продовольствию и питанию, Институт медицины, Национальные академии, 2004 г., заархивировано из оригинала (PDF) 14 марта 2013 г. , получено 9 июня 2009 г.
- ^ Тененбейн, М. (1996). «Польза парентерального дефероксамина при остром отравлении железом». J Токсикол Клин Токсикол . 34 (5): 485–89. дои : 10.3109/15563659609028005 . ПМИД 8800185 .
- ^ Ву Х, Ву Т, Сюй Икс, Ван Дж, Ван Дж (май 2011 г.). «Токсичность железа у мышей с внутримозговым кровоизлиянием, вызванным коллагеназой» . J Метаболия кровотока головного мозга . 31 (5): 1243–50. дои : 10.1038/jcbfm.2010.209 . ПМК 3099628 . ПМИД 21102602 .
- ^ Робберехт, Гарри; и др. (2020). «Состояние магния, железа, цинка, меди и селена при синдроме дефицита внимания и гиперактивности (СДВГ)» . Молекулы . 25 (19): 4440. doi : 10,3390/molecules25194440 . ПМЦ 7583976 . ПМИД 32992575 .
- ^ Сото-Инсуга, В; и др. (2013). «[Роль железа в лечении синдрома дефицита внимания и гиперактивности]». Педиатр (Барк) . 79 (4): 230–235. дои : 10.1016/j.anpedi.2013.02.008 . ПМИД 23582950 .
- ^ Донфранческо, Ренато; Паризи, Паскуале; Ванакор, Никола; Мартинес, Франческа; Сарджентини, Витторио; Кортезе, Самуэле (май 2013 г.). «Железо и СДВГ: время выйти за рамки уровня сывороточного ферритина». Журнал расстройств внимания . 17 (4): 347–357. дои : 10.1177/1087054711430712 . ISSN 1087-0547 . ПМИД 22290693 . S2CID 22445593 .
- ^ Тевенод, Франк (2018). «Глава 15. Железо и его роль в защите от рака: палка о двух концах». В Сигеле, Астрид; Сигель, Хельмут; Фрайзингер, Ева; Сигел, Роланд КО (ред.). Металло-лекарства: разработка и действие противораковых средств . Ионы металлов в науках о жизни 18. Том. 18. Берлин: де Грюйтер ГмбХ. стр. 437–67. дои : 10.1515/9783110470734-021 . ПМИД 29394034 .
- ↑ Перейти обратно: Перейти обратно: а б Бегин, Ю; Аапро, М; Людвиг, Х; Миззен, Л; Остерборг, А (2014). «Эпидемиологические и доклинические исследования по изучению влияния железа на канцерогенез - критический обзор» . Критические обзоры по онкологии/гематологии . 89 (1): 1–15. дои : 10.1016/j.critrevonc.2013.10.008 . ПМИД 24275533 .
- ^ Морель, FMM, Хадсон, RJM, и Прайс, Нью-Мексико (1991). Ограничение продуктивности из-за следов металлов в море. Лимнология и океанография, 36 (8), 1742–1755. дои : 10.4319/lo.1991.36.8.1742
- ^ Брезезински, М.А., Бэйнс, С.Б., Балч, В.М., Бойчер, К.П., Чай, Ф., Дагдейл, Р.К., Краузе, Дж.В., Лэндри, М.Р., Марчи, А., Мерс, CI, Нельсон, Д.М., Паркер, А.Е. , Поултон, А.Дж., Селф, К.Е., Стреттон, П.Г., Тейлор, А.Г. и Твининг, Б.С. (2011). Совместное ограничение диатомей железом и кремниевой кислотой в экваториальной части Тихого океана. Глубоководные исследования, часть II: Актуальные исследования в океанографии, 58 (3-4), 493-511. дои : 10.1016/j.dsr2.2010.08.005
- ^ Филд, EK, Като, С., Финдли, AJ, Макдональд, DJ, Чиу, БК, Лютер, GW, и Чан, CS (2016). Планктонные морские окислители железа способствуют минерализации железа в условиях низкого содержания кислорода. Геобиология, 14(5), 499-508. два : 10.1111/gbi.12189
- ^ Уэллс, М.Л., Прайс, Н.М., и Бруланд, К.В. (1995). Химия железа в морской воде и ее связь с фитопланктоном: отчет семинара. Морская химия, 48 (2), 157–182. два : 10.1016/0304-4203(94)00055-I
- ^ Ланнузель Д., Ванкоппенолле М., ван дер Мерве П., де Йонг Дж., Майнерс К.М., Гротти М., Нишиоска Дж. и Шеманн. (2016). Железо в морском льду: обзор и новые идеи. Элемента: Наука антропоцена, 4 000130. doi : 10.12952/journal.elementa.000130
- ^ Рэйсуэлл, Р. 2011. Транспорт железа с континентов в открытый океан: цикл старения-омоложения. Элементы, 7 (2), 101–106. doi : 10.2113/gselements.7.2.101
- ^ Тальябу, А., Бопп, Л., Омон, О., и Арриго, КР (2009). Влияние света и температуры на цикл морского железа: от теоретического к глобальному моделированию. Глобальные биогеохимические циклы, 23. дои : 10.1029/2008GB003214
Библиография
- Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . ISBN 978-0-08-037941-8 .
- Уикс, Мэри Эльвира ; Лечестер, Генри М. (1968). «Элементы, известные древним». Открытие элементов . Истон, Пенсильвания: Журнал химического образования. стр. 29–40 . ISBN 0-7661-3872-0 . LCCN 68-15217 .
Дальнейшее чтение
- Х. Р. Шуберт, История британской черной металлургии ... до 1775 г. н.э. (Рутледж, Лондон, 1957 г.)
- Р. Ф. Тайлекот, История металлургии (Институт материалов, Лондон, 1992).
- Р.Ф. Тайлекот, «Железо в промышленной революции» в Дж. Дэй и Р.Ф. Тайлекот, Промышленная революция в металлах (Институт материалов, 1991), 200–60.
Внешние ссылки
- Это элементарно – железо
- Железо в периодической таблице видео (Ноттингемский университет)
- Металлургия для неметаллурга
- Утюг от JB Calvert
- Железо
- Строительные материалы
- Химические элементы с объемноцентрированной кубической структурой
- Химические элементы
- Кубические минералы
- Диетические минералы
- Ферромагнитные материалы
- Минералы пространственной группы 225
- Минералы пространственной группы 229
- Минералы самородных элементов
- Пиротехническое топливо
- Переходные металлы








![17th century Chinese illustration of workers at a blast furnace, making wrought iron from pig iron[119]](http://upload.wikimedia.org/wikipedia/commons/thumb/8/8c/Chinese_Fining_and_Blast_Furnace.jpg/191px-Chinese_Fining_and_Blast_Furnace.jpg)



