Ржавчина
Эта статья нуждается в дополнительных цитатах для проверки . ( июнь 2012 г. ) |
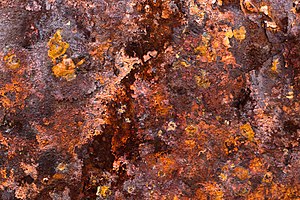
| Стали |
|---|
 |
| Фазы |
| Микроструктуры |
| Классы |
| Другие материалы на основе железа |
Ржавчина — это оксид железа , обычно красновато-коричневый оксид, образующийся в результате реакции железа и кислорода в каталитическом присутствии воды или влаги воздуха . Ржавчина состоит из водных оксидов железа(III) (Fe 2 O 3 ·nH 2 O) и оксида-гидроксида железа(III) (FeO(OH), Fe(OH) 3 ) и обычно связана с коррозией рафинированного железа. .
При наличии достаточного времени любая масса железа в присутствии воды и кислорода может в конечном итоге полностью превратиться в ржавчину. Поверхностная ржавчина обычно шелушащаяся и рыхлая и не обеспечивает пассивной защиты основного железа, в отличие от образования патины на медных поверхностях. Ржавчина – это общий термин, обозначающий коррозию элементарного железа и его сплавов, таких как сталь . Многие другие металлы подвергаются подобной коррозии, но образующиеся оксиды обычно не называют «ржавчиной». [1]
Несколько форм ржавчины различимы как визуально, так и с помощью спектроскопии и образуются при разных обстоятельствах. [2] Другие формы ржавчины возникают в результате реакций между железом и хлоридом в среде, лишенной кислорода. арматура, используемая в подводных бетонных столбах , которая образует зеленую ржавчину Примером может служить . Хотя ржавчина, как правило, является негативным аспектом железа, особая форма ржавчины, известная как стабильная ржавчина , приводит к тому, что предмет покрывается тонким слоем ржавчины сверху. При хранении в условиях низкой относительной влажности «стабильный» слой защищает железо под ним, но не в такой степени, как другие оксиды, такие как оксид алюминия на алюминии . [3]
История
[ редактировать ]Предполагалось, что ржавчина, образованная растворенным кислородом и железом в океанах, начала опускаться под морское дно, образуя полосчатые железные образования 2,5–2,2 миллиарда лет назад. После этого ржавчина вскоре подняла железные металлы к поверхности океана. Впоследствии они превратились в основу из железа и стали , которая фактически подпитывала промышленную революцию . [ нужна ссылка ]
Химические реакции
[ редактировать ]

Ржавчина – общее название комплекса оксидов и гидроксидов железа. [4] которые возникают, когда железо или некоторые сплавы, содержащие железо, подвергаются воздействию кислорода и влаги в течение длительного периода времени. Со временем кислород соединяется с металлом, образуя новые соединения, называемые ржавчиной, в процессе, называемом ржавлением. Ржавление — это реакция окисления, происходящая конкретно с железом. Другие металлы также подвергаются коррозии посредством аналогичного окисления, но такая коррозия не называется ржавлением.
Основным катализатором процесса ржавления является вода. Железные или стальные конструкции могут казаться твердыми, но молекулы воды могут проникать в микроскопические ямки и трещины в любом открытом металле. Атомы водорода, присутствующие в молекулах воды, могут объединяться с другими элементами с образованием кислот, что в конечном итоге приведет к обнажению большего количества металла. Если присутствуют ионы хлорида, как в случае с соленой водой, коррозия может произойти быстрее. Тем временем атомы кислорода соединяются с атомами металлов, образуя разрушительное оксидное соединение. Эти соединения железа хрупкие и рассыпчатые и заменяют прочное металлическое железо, снижая прочность объекта.
Окисление железа
[ редактировать ]Когда железо контактирует с водой и кислородом, оно ржавеет. [5] Если соль присутствует, например, в морской воде или соленых брызгах , железо имеет тенденцию ржаветь быстрее в результате химических реакций. Металлическое железо относительно не подвержено влиянию чистой воды или сухого кислорода. Как и в случае с другими металлами, такими как алюминий, плотно прилегающее оксидное покрытие, пассивирующий слой , защищает объемное железо от дальнейшего окисления. Превращение пассивирующего слоя оксида железа в ржавчину происходит в результате совместного действия двух агентов, обычно кислорода и воды.
Другими разлагающими растворами являются диоксид серы в воде и диоксид углерода в воде. В этих агрессивных условиях гидроксида железа образуются разновидности . В отличие от оксидов железа, гидроксиды не прилипают к объему металла. По мере того, как они формируются и отслаиваются с поверхности, обнажается свежее железо, и процесс коррозии продолжается до тех пор, пока либо все железо не будет израсходовано, либо весь кислород, вода, диоксид углерода или диоксид серы в системе не будут удалены или израсходованы. [6]
Когда железо ржавеет, оксиды занимают больший объем, чем исходный металл; это расширение может создать огромные силы, повреждающие конструкции, сделанные из железа. см. Экономический эффект Подробнее .
Сопутствующие реакции
[ редактировать ]Ржавление железа — это электрохимический процесс, который начинается с переноса электронов от железа к кислороду. [7] Железо является восстановителем (отдает электроны), а кислород является окислителем (приобретает электроны). На скорость коррозии влияет вода, а электролиты ускоряют ее , о чем свидетельствует влияние дорожной соли на коррозию автомобилей. Ключевой реакцией является восстановление кислорода:
Поскольку он образует гидроксид -ионы , на этот процесс сильно влияет присутствие кислоты. Аналогично, коррозия большинства металлов кислородом ускоряется при низком pH . Обеспечение электронов для вышеуказанной реакции представляет собой окисление железа, которое можно описать следующим образом:
- Фе → Фе 2+ + 2 и −
Следующая окислительно-восстановительная реакция также происходит в присутствии воды и имеет решающее значение для образования ржавчины:
- 4 Фе 2+ + О 2 → 4 Fe 3+ + 2 О 2−
следующие многоступенчатые кислотно-основные реакции Кроме того, на ход образования ржавчины влияют :
как и следующие равновесия дегидратации :
Из приведенных выше уравнений также видно, что продукты коррозии определяются наличием воды и кислорода. При ограниченном растворенном кислороде предпочтительны материалы, содержащие железо(II), включая FeO и черный магнит или магнетит (Fe 3 O 4 ). Высокие концентрации кислорода благоприятствуют материалам на основе железа с номинальной формулой Fe(OH) 3− x O. х ⁄ 2 . Характер ржавчины меняется со временем, отражая медленные скорости реакций твердых веществ. [5]
Кроме того, на эти сложные процессы влияет присутствие других ионов, таких как Ca 2+ , которые служат электролитами, ускоряющими образование ржавчины, или соединяются с гидроксидами и оксидами железа, образуя осаждение различных видов Ca, Fe, O, OH.
Начало ржавления можно обнаружить и в лаборатории с помощью индикаторного раствора ферроксила . Раствор обнаруживает как Fe 2+ ионы и гидроксильные ионы. Образование Fe 2+ ионы и гидроксильные ионы обозначены синими и розовыми пятнами соответственно.
Профилактика
[ редактировать ]
Из-за широкого использования и важности изделий из железа и стали предотвращение или замедление ржавчины является основой основной экономической деятельности в ряде специализированных технологий. Здесь представлен краткий обзор методов; Подробное описание см. в статьях с перекрестными ссылками.
Ржавчина проницаема для воздуха и воды, поэтому внутреннее металлическое железо под слоем ржавчины продолжает корродировать. Таким образом, для предотвращения ржавчины необходимы покрытия, предотвращающие образование ржавчины.
Нержавеющие сплавы
[ редактировать ]
Нержавеющая сталь образует пассивирующий слой оксида хрома (III) . [8] [9] Аналогичное поведение пассивации происходит с магнием , титаном , цинком , оксидами цинка , алюминием , полианилином и другими электроактивными проводящими полимерами. [10]
Специальные сплавы атмосферостойкой стали, такие как Cor-Ten, ржавеют гораздо медленнее, чем обычные, потому что ржавчина прилипает к поверхности металла в виде защитного слоя. Проекты, использующие этот материал, должны включать меры, позволяющие избежать наихудшего воздействия, поскольку материал продолжает медленно ржаветь даже в условиях, близких к идеальным. [11]
Гальванизация
[ редактировать ]
Гальванизация заключается в нанесении на защищаемый объект слоя металлического цинка путем горячего цинкования или гальваники . Цинк традиционно используется, поскольку он дешев, хорошо прилипает к стали и обеспечивает катодную защиту поверхности стали в случае повреждения слоя цинка. В более агрессивных средах (например, соленой воде) предпочтительнее использовать кадмиевое покрытие вместо основного защищенного металла. В результате этого действия защитный слой цинка разрушается, поэтому гальванизация обеспечивает защиту только на ограниченный период времени.
В более современных покрытиях алюминий добавляется в виде алюмоцинка ; алюминий будет мигрировать, чтобы покрыть царапины и, таким образом, обеспечить защиту на более длительный период. Эти подходы основаны на том, что оксиды алюминия и цинка защищают однажды поцарапанную поверхность, а не окисляются в качестве жертвенного анода , как в традиционных гальванических покрытиях. В некоторых случаях, например, в очень агрессивных средах или при длительном сроке службы, как цинк, так и покрытие для обеспечения усиленной защиты от коррозии наносится .
Типичная гальванизация стальных изделий, которые подвергаются нормальным ежедневным атмосферным воздействиям во внешней среде, состоит из горячего толщиной 85 мкм цинкования . При нормальных погодных условиях оно будет ухудшаться со скоростью 1 мкм в год, что обеспечивает защиту примерно на 85 лет. [12]
Катодная защита
[ редактировать ]Катодная защита — это метод, используемый для предотвращения коррозии заглубленных или погруженных в воду конструкций путем подачи электрического заряда, подавляющего электрохимическую реакцию. При правильном применении коррозию можно полностью остановить. В простейшей форме это достигается путем прикрепления расходуемого анода, в результате чего железо или сталь становятся катодом в образующейся ячейке. Жертвенный анод должен быть изготовлен из материала с более отрицательным электродным потенциалом , чем железо или сталь, обычно из цинка, алюминия или магния. Жертвенный анод со временем подвергается коррозии, прекращая свое защитное действие, если его не заменить своевременно.
Катодная защита также может быть обеспечена с помощью приложенного электрического тока. Тогда это будет известно как катодная защита наложенным током ICCP. [13]
Покрытия и покраска
[ редактировать ]
Образование ржавчины можно контролировать с помощью покрытий, таких как краска , лак , лак или восковые ленты. [14] которые изолируют железо от окружающей среды. [15] Большие конструкции с закрытыми коробчатыми секциями, такие как корабли и современные автомобили, часто содержат продукт на основе воска (технически «промывочное масло»), впрыскиваемый в эти секции. Такие обработки обычно также содержат ингибиторы ржавчины. Покрытие стали бетоном может обеспечить некоторую защиту стали из-за щелочного pH на границе раздела сталь-бетон. Однако ржавление стали в бетоне по-прежнему может быть проблемой, поскольку расширяющаяся ржавчина может разрушить бетон изнутри. [16] [17]
В качестве близкого примера можно привести железные зажимы, которые использовались для соединения мраморных блоков во время попытки реставрации Парфенона в Афинах , Греция , в 1898 году, но они нанесли мрамору значительный ущерб из-за ржавчины и разбухания незащищенного железа. Древнегреческие строители при строительстве использовали аналогичную систему крепления мраморных блоков, однако железные соединения заливали расплавленным свинцом для защиты от сейсмических потрясений, а также от коррозии. Этот метод оказался успешным для 2500-летнего сооружения, но менее чем через столетие грубому ремонту грозила неминуемая опасность обрушения. [18] Когда при хранении или транспортировке требуется только временная защита, тонкий слой масла, смазки или специальной смеси, например Cosmoline на поверхность утюга можно нанести . Такие обработки широко используются при « консервации » стального корабля, автомобиля или другого оборудования для длительного хранения.
Доступны специальные противозадирные смазочные смеси, которые наносятся на металлическую резьбу и другие прецизионные поверхности, чтобы защитить их от ржавчины. Эти составы обычно содержат смазку, смешанную с медным, цинковым или алюминиевым порошком и другими запатентованными ингредиентами. [19]
Воронение
[ редактировать ]Воронение – это метод, который может обеспечить ограниченное [ нужна ссылка ] устойчивость к ржавлению мелких стальных предметов, например огнестрельного оружия; Для достижения успеха вороненую сталь и другую сталь натирают водовытесняющим маслом. [ нужна ссылка ] .
Ингибиторы
[ редактировать ]Ингибиторы коррозии, такие как газофазные или летучие ингибиторы, можно использовать для предотвращения коррозии внутри герметичных систем. Они неэффективны, когда циркуляция воздуха рассеивает их и приносит свежий кислород и влагу.
Контроль влажности
[ редактировать ]Ржавчины можно избежать, контролируя влажность воздуха. [20] Примером этого является использование пакетов с силикагелем для контроля влажности в оборудовании, доставляемом морским транспортом.
Уход
[ редактировать ]Удаление ржавчины с небольших железных или стальных предметов с помощью электролиза можно выполнить в домашней мастерской с использованием простых материалов, таких как пластиковое ведро, наполненное электролитом, состоящим из стиральной соды, растворенной в водопроводной воде , отрезок арматуры, подвешенный вертикально в растворе, который действует как анод , другой , проложенный через верхнюю часть ведра и служащий опорой для подвешивания объекта, проволока для подвешивания объекта в растворе на горизонтальной арматуре, а также зарядное устройство для аккумулятора в качестве источника питания, в котором зажимается положительная клемма. к аноду, а отрицательная клемма прикрепляется к обрабатываемому объекту, который становится катодом . [21] На катоде и анноде образуются газообразные водород и кислород соответственно. Эта смесь огнеопасна/взрывоопасна. [22] Следует также соблюдать осторожность, чтобы избежать водородного охрупчивания . Перенапряжение также производит небольшое количество озона, который очень токсичен, поэтому зарядное устройство для телефона низкого напряжения является гораздо более безопасным источником постоянного тока. Влияние водорода на глобальное потепление также недавно стало объектом пристального внимания. [23]
Ржавчину можно лечить с помощью коммерческих продуктов, известных как преобразователи ржавчины , которые содержат дубильную кислоту или фосфорную кислоту , которая соединяется с ржавчиной; удаляется органическими кислотами, такими как лимонная кислота и уксус или более сильная соляная кислота ; или удаляется с помощью хелатирующих агентов, как в некоторых коммерческих составах, или даже с помощью раствора патоки . [24]
Экономический эффект
[ редактировать ]
Ржавчина связана с разрушением инструментов и конструкций на основе железа. Поскольку объем ржавчины гораздо больше, чем исходная масса железа, ее накопление также может привести к разрушению из-за раздвигания соседних частей - явление, которое иногда называют «набивкой ржавчины». Это стало причиной обрушения моста через реку Мианус в 1983 году, когда подшипники проржавели изнутри и оттолкнули один угол дорожной плиты от ее опоры.
Ржавчина была важным фактором катастрофы на Серебряном мосту в 1967 году в Западной Вирджинии , когда стальной подвесной мост рухнул менее чем за минуту, в результате чего погибли 46 водителей и пассажиров, находившихся на мосту. Мост Кинзуа в Пенсильвании был разрушен торнадо в 2003 году, главным образом потому, что центральные болты основания, удерживающие конструкцию на земле, проржавели, и мост остался стоять на якоре под действием силы тяжести.
Железобетон также уязвим к ржавчине. Внутреннее давление, вызванное расширяющейся коррозией стали и железа, покрытых бетоном, может привести к растрескиванию бетона , создавая серьезные структурные проблемы. Это один из наиболее распространенных видов разрушения железобетонных мостов и зданий.
- Структурные разрушения, вызванные ржавчиной
- Обрушившийся Серебряный мост , вид со Огайо. стороны
- Мост Кинзуа после обрушения
- Ржавые и изрытые стойки 70-летнего железного моста через реку Нанду.
Культурный символизм
[ редактировать ]Ржавчина — часто используемая метафора медленного распада из-за пренебрежения, поскольку она постепенно превращает прочное железо и сталь в мягкий рассыпающийся порошок. Обширная часть промышленно развитых Среднего Запада и Северо-Востока Америки , где когда-то доминировали сталелитейные заводы , автомобильная промышленность и другие производители, пережила резкий экономический спад, из-за которого этот регион получил название « Ржавый пояс ».
В музыке, литературе и искусстве ржавчина ассоциируется с образами увядшей славы, запустения, упадка и разрушения.
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ «Ржавчина, №1 и прил.» . ОЭД онлайн . Издательство Оксфордского университета. Июнь 2018 года . Проверено 7 июля 2018 г.
- ^ «Интервью, Давид Де Марэ» . НАСА . 2003. Архивировано из оригинала 13 ноября 2007 г.
- ^ Анкерсмит, Барт; Гриссер-Штермшег, Мартина; Селвин, Линдси; Сазерленд, Сюзанна. «Ржавчина никогда не спит: распознавание металлов и продуктов их коррозии» (PDF) . депотвейзер . Парки Канады. Архивировано (PDF) из оригинала 9 августа 2016 года . Проверено 23 июля 2016 г.
- ^ Сунд, Роберт Б.; Бишоп, Жанна (1980). Акцент на науку . CE Меррилл. ISBN 9780675075695 . Архивировано из оригинала 30 ноября 2017 г.
- ^ Перейти обратно: а б «Реакции окисления-восстановления» . Сеть исследований Боднера . Проверено 28 апреля 2020 г.
- ^ Холлеман, А.Ф.; Виберг, Э. (2001). Неорганическая химия . Сан-Диего: Академическая пресса. ISBN 0-12-352651-5 .
- ^ Грефен, Х.; Хорн, Э.М.; Шлекер, Х.; Шиндлер, Х. (2000). «Коррозия». Энциклопедия промышленной химии Ульмана . Вайли-ВЧ. дои : 10.1002/14356007.b01_08 . ISBN 3527306730 .
- ^ Рамасвами, Хосахалли С.; Маркотт, Мишель; Шастри, Судхир; Абдельрахим, Халид (14 февраля 2014 г.). Омический нагрев в пищевой промышленности . ЦРК Пресс. ISBN 9781420071092 . Архивировано из оригинала 2 мая 2018 г.
- ^ Хайнц, Норберт. «Профилактика коррозии – HomoFaciens» . www.homofaciens.de . Архивировано из оригинала 1 декабря 2017 г. Проверено 30 ноября 2017 г.
- ^ «Формирование стабильной пассивной пленки на нержавеющей стали электрохимическим осаждением полипиррола» . Электрохимика Акта .
- ^ «Выветривание стали» . azom.com . АЗом. 28 июня 2016 г. Проверено 13 сентября 2022 г.
Сталь может ржаветь, и из-за состава ее сплава ржавеет медленнее, чем обычная сталь, а ржавчина образует защитное покрытие, замедляющее скорость будущей коррозии.
- ^ «Защита стали от коррозии – Долговечность – Конструкционная сталь» . greenspec.co.uk . зеленыйспец . Проверено 13 сентября 2022 г.
Информацию об атмосферной коррозии см. на Карте тысячелетия Ассоциации гальванизаторов со средними скоростями коррозии цинка. Около 50% Англии и Уэльса имеют показатель менее 1 мкм/год.
- ^ «Системы катодной защиты – Matcor, Inc» . Маткор, Инк . Архивировано из оригинала 30 марта 2017 г. Проверено 29 марта 2017 г.
- ^ «Системы антикоррозионного покрытия восковой лентой» (PDF) . Трентон Корпорейшн. Архивировано из оригинала (PDF) 23 марта 2018 г. Проверено 22 марта 2018 г.
- ^ Швейцер, Филип А. (2007). Справочник по коррозионной инженерии . Бока-Ратон: CRC Press. ISBN 978-0-8493-8246-8 . OCLC 137248977 .
- ^ «Коррозия закладных металлов» . цемент.орг . Ассоциация портландцемента . Проверено 9 июля 2021 г.
- ^ «Ржавый клин: расширяющаяся ржавчина — это сила, достаточно сильная, чтобы разрушить бетон» . exploratorium.edu . 17 апреля 2018 года . Проверено 9 июля 2021 г.
- ^ Хадингем, Эван. «Разгадка тайн Парфенона» . Смитсонианмаг.com . Проверено 9 июля 2021 г.
- ^ «Информация о противозадирных соединениях» . globalspec.com . Инженерия 360 . Проверено 9 июля 2021 г.
- ^ Мирза, Лоррейн; Гупта, Кришнакали. Серия «Молодой учёный» ICSE «Химия» 7 . Пирсон Образовательная Индия. ISBN 9788131756591 . Архивировано из оригинала 30 ноября 2017 г.
- ^ «Удаление ржавчины электролизом» . antik-engines.com . Архивировано из оригинала 30 марта 2015 года . Проверено 1 апреля 2015 г.
- ^ Смит, Пол. «Взрывающиеся водородные шарики с разным количеством кислорода» . Ютуб . Проверено 29 декабря 2023 г.
- ^ Дервент, Ричард. «Потенциал глобального потепления (ПГП) для водорода: чувствительность, неопределенности и метаанализ» . Наука Директ . Наука Директ . Проверено 9 декабря 2023 г.
- ^ «Удаление ржавчины патокой» . 6 июля 2005 г. Архивировано из оригинала 25 сентября 2016 г. Проверено 29 ноября 2017 г.
Дальнейшее чтение
[ редактировать ]- Уолдман Дж. (2015): Ржавчина – самая долгая война. Саймон и Шустер, Нью-Йорк. ISBN 978-1-4516-9159-7
- Швейцер, Филип А. (2007). Справочник по коррозионной инженерии. Основы коррозии металлов : атмосферная и средняя коррозия металлов (2-е изд.). Бока-Ратон: CRC Press. ISBN 978-0-8493-8244-4 . OCLC 137248972 .
- Коррозия арматуры в бетонных конструкциях . К.Л. Пейдж, П.Б. Бэмфорт, Дж.В. Фигг, Международный симпозиум по коррозии арматуры в бетонных конструкциях. Кембридж: Королевское химическое общество, информационные службы. 1996. ISBN 0-85404-731-Х . OCLC 35233292 .
{{cite book}}: CS1 maint: другие ( ссылка ) - Коррозия – 2-е издание ( elsevier.com ), том 1 и 2; Монтажер: Л. Л. Шрейр ISBN 9781483164106



