Редокс
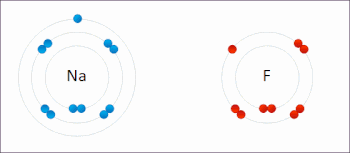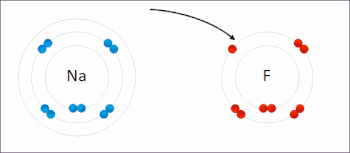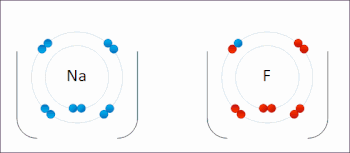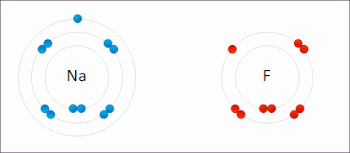
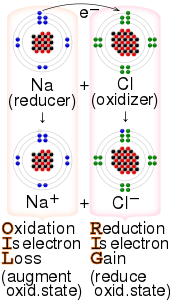
Redox ( / ˈ r ɛ d ɒ k s / RED -oks , / ˈ r iː d ɒ k s / REE -doks , восстановление –окисление [2] или окислительно-восстановительный [3] : 150 ) — тип химической реакции в которой изменяются степени окисления реагентов , . [4] Окисление — это потеря электронов или повышение степени окисления, а восстановление — это прирост электронов или понижение степени окисления. В химической реакции процессы окисления и восстановления происходят одновременно.
Существует два класса окислительно-восстановительных реакций:
- Перенос электрона . Только один (обычно) электрон переходит от окисляемого атома, иона или молекулы к восстанавливаемому атому, иону или молекуле. Этот тип окислительно-восстановительной реакции часто обсуждается с точки зрения окислительно-восстановительных пар и электродных потенциалов.
- Перенос атома . Атом переносится с одной подложки на другую. Например, при ржавлении железа , и одновременно степень окисления кислорода снижается , степень окисления атомов железа увеличивается по мере того, как железо превращается в оксид поскольку он принимает электроны, выпущенные железом. Хотя реакции окисления обычно связаны с образованием оксидов, ту же функцию могут выполнять и другие химические соединения. [5] При гидрировании связи типа C=C восстанавливаются за счет переноса атомов водорода .
Терминология [ править ]
«Редокс» — это сочетание слов «восстановление» и «окисление». Термин «редокс» впервые был использован в 1928 году. [6]
Окисление – это процесс, при котором вещество теряет электроны. Восстановление – это процесс, при котором вещество приобретает электроны.
Процессы окисления и восстановления происходят одновременно и не могут происходить независимо. [5] В окислительно-восстановительных процессах восстановитель передает электроны окислителю. Таким образом, в реакции восстановитель или восстановитель теряет электроны и окисляется, а окислитель или окислитель приобретает электроны и восстанавливается. Пара окислителя и восстановителя, участвующая в той или иной реакции, называется окислительно-восстановительной парой. Окислительно-восстановительная пара представляет собой восстановительную разновидность и соответствующую ей окислительную форму. [7] например, Фе 2+
/ Фе 3+
.Окисление и восстановление сами по себе называются полуреакцией, поскольку две полуреакции всегда протекают вместе, образуя целую реакцию. [5]
Окислители [ править ]
Первоначально окисление подразумевало реакцию с кислородом с образованием оксида. Позже этот термин был расширен и теперь включает вещества , вступающие в химические реакции, аналогичные реакциям с кислородом. В конечном итоге это значение было обобщено и включило все процессы, связанные с потерей электронов или увеличением степени окисления химических веществ. [8] : А49 Вещества, которые обладают способностью окислять другие вещества (заставлять их терять электроны), называются окислительными или окисляющими и известны как окислители , окислители или окислители. Окислитель отбирает электроны у другого вещества и таким образом сам восстанавливается. [8] : А50 Поскольку окислитель «принимает» электроны, его еще называют акцептором электронов . Окислители обычно представляют собой химические вещества, содержащие элементы в высоких степенях окисления. [3] : 159 (например, Н
22О
4 , МnО −
4 , КрО
3 , Кр
22О 2−
7 , ОсО
4 ), или же сильно электроотрицательные элементы (например, O 2 , F 2 , Cl 2 , Br 2 , I 2 ), которые могут приобретать дополнительные электроны за счет окисления другого вещества. [3] : 909
Окислители являются окислителями, но этот термин в основном используется для источников кислорода, особенно в контексте взрывов. Азотная кислота является сильным окислителем. [9]

Восстановители [ править ]
Вещества, которые обладают способностью восстанавливать другие вещества (заставлять их присоединять электроны), называются восстановителями или восстановителями и известны как восстановители , восстановители или восстановители. Восстановитель передает электроны другому веществу и таким образом сам окисляется. [3] : 159 Поскольку восстановитель отдает электроны, его еще называют донором электронов . Доноры электронов также могут образовывать комплексы с переносом заряда с акцепторами электронов. Слово «восстановление» первоначально относилось к потере веса при нагревании металлической руды, такой как оксид металла, для извлечения металла. Другими словами, руда «превратилась» в металл. [10] Антуан Лавуазье продемонстрировал, что эта потеря веса произошла из-за потери кислорода в виде газа. Позже ученые поняли, что в этом процессе атом металла приобретает электроны. Затем понятие восстановления стало обобщенным и включило все процессы, связанные с приобретением электронов. [10] Восстановительный эквивалент относится к химическим соединениям , которые переносят эквивалент одного электрона в окислительно-восстановительных реакциях. Этот термин распространен в биохимии . [11] Восстанавливающим эквивалентом может быть электрон или атом водорода в виде иона гидрида . [12]
Восстановители в химии весьма разнообразны. Электроположительные элементарные металлы , такие как литий , натрий , магний , железо , цинк и алюминий , являются хорошими восстановителями. Эти металлы относительно легко отдают электроны. [ нужна ссылка ]
Реагенты для переноса гидрида , такие как NaBH 4 и LiAlH 4 , восстанавливаются за счет переноса атома: они переносят эквивалент гидрида или H. − . Эти реагенты широко используются при восстановлении карбонильных соединений в спирты . [13] [14] Родственный метод восстановления включает использование газообразного водорода (H 2 ) в качестве источников атомов H. [3] : 288
Электронация и деэлектронизация [ править ]
Электрохимик предложил слова «электронизация » Джон Бокрис и «деэлектронизация» для описания процессов восстановления и окисления соответственно, когда они происходят на электродах . [15] Эти слова аналогичны протонированию и депротонированию . [16] Они не получили широкого распространения среди химиков во всем мире. [ нужна ссылка ] хотя ИЮПАК признал термины «электронизация» [17] и деэлектронизация. [18]
и энергии Темпы , механизмы
Этот раздел нуждается в расширении . Вы можете помочь, добавив к нему . ( апрель 2023 г. ) |
Окислительно-восстановительные реакции могут протекать медленно, как при образовании ржавчины , или быстро, как при горении топлива . Реакции переноса электрона обычно протекают быстро и происходят во время смешивания. [ нужна ссылка ]
Механизмы реакций переноса атомов весьма разнообразны, поскольку могут переноситься многие виды атомов. Такие реакции также могут быть весьма сложными, состоящими из многих стадий. Механизмы реакций переноса электрона происходят по двум различным путям: перенос электронов внутренней сферы и перенос электронов внешней сферы . [ нужна ссылка ]
Анализ энергий связи и энергий ионизации в воде позволяет рассчитать термодинамические аспекты окислительно-восстановительных реакций. [ нужна ссылка ]
Стандартные электродные потенциалы ( восстановительные потенциалы )
Этот раздел нуждается в дополнительных цитатах для проверки . ( декабрь 2023 г. ) |
Каждая полуреакция имеет стандартный электродный потенциал ( E тот
ячейка ), которая равна разности потенциалов или напряжению в равновесии при стандартных условиях , электрохимической ячейки в которой катодной реакцией является рассматриваемая полуреакция , а анодом — стандартный водородный электрод, в котором окисляется водород:
- 1 ⁄ 2 Ч 2 → Ч + + и −
Электродный потенциал каждой полуреакции также известен как потенциал восстановления ( E тот
красный ), или потенциальный, когда полуреакция происходит на катоде. Восстановительный потенциал является мерой тенденции окислителя к восстановлению. Его значение равно нулю для H + + и − → 1 ⁄ 2 H 2 по определению положителен для окислителей сильнее H + (например, +2,866 В для F 2 ) и отрицательный для окислителей, более слабых, чем H. + (например, −0,763 В для Zn 2+ ). [8] : 873
Для окислительно-восстановительной реакции, протекающей в клетке, разность потенциалов равна:
- И тот
ячейка = E тот
катод – Е тот
анод
Однако потенциал реакции на аноде иногда выражают как окислительный потенциал :
- И тот
ох = – E тот
красный
Окислительный потенциал является мерой склонности восстановителя к окислению, но не отражает физический потенциал на электроде. В таких обозначениях уравнение напряжения ячейки записывается со знаком плюс
- И тот
ячейка = E тот
красный(катод) + E тот
бык (анод)
Примеры окислительно-восстановительных реакций [ править ]

В реакции между водородом и фтором водород окисляется, а фтор восстанавливается:
- Ч 2 + Ж 2 → 2 ВЧ
Эта реакция является самопроизвольной и выделяет 542 кДж на 2 г водорода, поскольку связь HF намного прочнее связи FF. Эту реакцию можно рассматривать как две полуреакции . Реакция окисления превращает водород в протоны :
Реакция восстановления превращает фтор во фторид-анион:
- Ф 2 + 2 е − → 2 Ф −
Полуреакции объединяются так, что электроны сокращаются:
ЧАС
2→ 2 часа + + 2 и − Ф
2 + 2 и −→ 2 Ж − H2 + F2 → 2 часа + + 2 Ж −
Протоны и фторид объединяются с образованием фторида водорода в неокислительно-восстановительной реакции:
- 2 часа + + 2 Ж − → 2 ВЧ
Общая реакция такая:
- Ч 2 + Ж 2 → 2 ВЧ
Смещение металла [ править ]

В реакциях этого типа атом металла в соединении или растворе заменяется атомом другого металла. Например, медь осаждается, когда металлический цинк помещается в раствор сульфата меди (II) :
- Zn(s) + CuSO4 ( водн.) → ZnSO4 ( водн.) + Cu(тв)
В приведенной выше реакции металлический цинк вытесняет ион меди (II) из раствора сульфата меди и, таким образом, высвобождает свободную металлическую медь. Реакция протекает самопроизвольно и выделяет 213 кДж на 65 г цинка.
Ионное уравнение этой реакции:
- Цинк + Си 2+ → Цинк 2+ + С
По двум полуреакциям видно, что цинк окисляется:
- Цинк → Цинк 2+ + 2 и −
И медь восстанавливается:
- С 2+ + 2 и − → С
Другие примеры [ править ]
- Восстановление нитратов до азота в присутствии кислоты ( денитрификация ):
- 2 НО − 3 + 10 е − + 12 ч. + → Н 2 + 6 Н 2 О
- Сгорание некоторых частично окисленных форм , углеводородов , , например, в двигателе внутреннего сгорания , приводит к образованию воды , двуокиси углерода таких как окись углерода , и тепловой энергии . Полное окисление материалов, содержащих углерод, приводит к образованию углекислого газа.
- Поэтапное окисление углеводорода кислородом в органической химии приводит к образованию воды и последовательно: спирта , альдегида или кетона , карбоновой кислоты и затем пероксида .
Коррозия и ржавление [ править ]


- Термин «коррозия» относится к электрохимическому окислению металлов в реакции с окислителем, например кислородом. Ржавчина , образование оксидов железа , является известным примером электрохимической коррозии: она образуется в результате окисления металлического железа . Обыкновенная ржавчина часто относится к оксиду железа(III) , образующемуся в результате следующей химической реакции:
- 4Fe 3O2 → 2Fe2O3 +
- Окисление железа(II) до железа(III) перекисью водорода в присутствии кислоты :
- Фе 2+ → Фе 3+ + и −
- Н 2 О 2 + 2 е − → 2 ОН −
- Здесь общее уравнение включает в себя добавление уравнения восстановления к удвоенному уравнению окисления, так что электроны сокращаются:
- 2 Фе 2+ + Н 2 О 2 + 2 Н + → 2 Фе 3+ + 2 Н 2 О
Диспропорция [ править ]
Реакция диспропорционирования – это реакция, при которой одно и то же вещество одновременно окисляется и восстанавливается. Например, тиосульфат- ион с серой в степени окисления +2 может реагировать в присутствии кислоты с образованием элементарной серы (степень окисления 0) и диоксида серы (степень окисления +4).
- С 2 О 2- 3 + 2 Ч + → S + SO 2 + H 2 O
При этом один атом серы восстанавливается с +2 до 0, а другой окисляется с +2 до +4. [8] : 176
Окислительно-восстановительные реакции в промышленности [ править ]
Катодная защита — это метод, используемый для борьбы с коррозией металлической поверхности путем превращения ее в катод электрохимической ячейки. Простой метод защиты соединяет защищаемый металл с более легко подверженным коррозии « жертвенным анодом », который действует как анод . Жертвенный металл вместо защищаемого металла затем подвергается коррозии. Катодная защита обычно применяется в оцинкованной стали, где жертвенное цинковое покрытие на стальных деталях защищает их от ржавчины. [ нужна ссылка ]
Окисление используется в самых разных отраслях промышленности, например, при производстве чистящих средств и при окислении аммиака для получения азотной кислоты . [ нужна ссылка ]
Окислительно-восстановительные реакции лежат в основе электрохимических ячеек , которые могут генерировать электрическую энергию или поддерживать электросинтез . Металлические руды часто содержат металлы в окисленном состоянии, такие как оксиды или сульфиды, из которых чистые металлы извлекаются путем плавки при высокой температуре в присутствии восстановителя. В процессе гальванического покрытия используются окислительно-восстановительные реакции для покрытия объектов тонким слоем материала, например, в хромированных автомобильных деталях, с серебряным покрытием столовых приборах , гальванизации и позолоченных ювелирных изделиях . [ нужна ссылка ]
Окислительно-восстановительные реакции в биологии [ править ]
 |
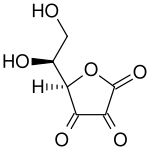 |
Внизу: дегидроаскорбиновая кислота ( окисленная форма витамина С ).

Многие важные биологические процессы включают окислительно-восстановительные реакции. Прежде чем некоторые из этих процессов начнутся, железо должно быть ассимилировано из окружающей среды. [19]
Клеточное дыхание , например, представляет собой окисление глюкозы (C 6 H 12 O 6 ) до CO 2 и восстановление кислорода до воды . Итоговое уравнение клеточного дыхания:
- C 6 H 12 O 6 + 6 O 2 → 6 CO 2 + 6 H 2 O + Энергия
Процесс клеточного дыхания также во многом зависит от снижения НАД. + до НАДН и обратная реакция (окисление НАДН до НАД + ). Фотосинтез и клеточное дыхание дополняют друг друга, но фотосинтез не является противоположностью окислительно-восстановительной реакции клеточного дыхания:
- 6 CO 2 + 6 H 2 O + энергия света → C 6 H 12 O 6 + 6 O 2
Биологическая энергия часто сохраняется и высвобождается посредством окислительно-восстановительных реакций. Фотосинтез включает восстановление углекислого газа до сахаров и окисление воды до молекулярного кислорода. Обратная реакция — дыхание — окисляет сахара с образованием углекислого газа и воды. В качестве промежуточных этапов восстановленные углеродные соединения используются для восстановления никотинамидадениндинуклеотида (НАД + ) в НАДН, который затем способствует созданию протонного градиента , который управляет синтезом аденозинтрифосфата (АТФ) и поддерживается за счет восстановления кислорода. В клетках животных митохондрии выполняют сходные функции.
Свободнорадикальные реакции — это окислительно-восстановительные реакции, которые происходят как часть гомеостаза и уничтожения микроорганизмов , когда электрон отрывается от молекулы, а затем почти мгновенно снова присоединяется. Свободные радикалы являются частью окислительно-восстановительных молекул и могут нанести вред человеческому организму, если они не присоединятся к окислительно-восстановительной молекуле или антиоксиданту .
Термин «окислительно-восстановительное состояние» часто используется для описания баланса GSH/GSSG , НАД. + /НАДН и НАДФ + /НАДФН в биологической системе, такой как клетка или орган . Окислительно-восстановительное состояние отражается на балансе нескольких наборов метаболитов (например, лактата и пирувата , бета-гидроксибутират и ацетоацетат ), взаимное превращение которых зависит от этих соотношений. Редокс-механизмы также контролируют некоторые клеточные процессы. окислительно-восстановительные белки и их гены должны быть расположены рядом для окислительно-восстановительной регуляции В соответствии с гипотезой CoRR о функции ДНК в митохондриях и хлоропластах .
Редокс-циклинг [ править ]
Множество ароматических соединений восстанавливаются ферментативно с образованием свободных радикалов , которые содержат на один электрон больше, чем их исходные соединения. В общем, донором электронов является любой из множества флавоферментов и их коферментов . После образования эти анионные свободные радикалы восстанавливают молекулярный кислород до супероксида и регенерируют неизмененное исходное соединение. Конечная реакция представляет собой окисление коферментов флавофермента и восстановление молекулярного кислорода с образованием супероксида. Такое каталитическое поведение было описано как бесполезный цикл или окислительно-восстановительный цикл.
Окислительно-восстановительные реакции в геологии [ править ]

Минералы обычно представляют собой окисленные производные металлов. Железо добывают в виде магнетита (Fe 3 O 4 ). Титан добывают в виде его диоксида, обычно в виде рутила (TiO 2 ). Для получения соответствующих металлов эти оксиды необходимо восстановить, что часто достигается нагреванием этих оксидов с углеродом или окисью углерода в качестве восстановителей. Доменные печи — это реакторы, в которых оксиды железа и кокс (форма углерода) объединяются для производства расплавленного железа. Основная химическая реакция с образованием расплавленного железа: [20]
- Fe 2 O 3 + 3 CO → 2 Fe + 3 CO 2
Окислительно-восстановительные реакции в почвах [ править ]
Реакции переноса электрона играют центральную роль во множестве процессов и свойств в почвах, а окислительно-восстановительный потенциал , количественно определяемый как Eh (потенциал ( напряжение ) платинового электрода относительно стандартного водородного электрода) или pe (аналог pH как -log активности электронов), является главным переменная, наряду с pH, которая контролирует и регулируется химическими реакциями и биологическими процессами. Ранние теоретические исследования с применением к затопленным почвам и производству риса-сырца были плодотворными для последующих работ по термодинамическим аспектам окислительно-восстановительного процесса и роста корней растений в почвах. [21] Более поздние работы основывались на этом фундаменте и расширили его для понимания окислительно-восстановительных реакций, связанных с изменениями степени окисления тяжелых металлов, педогенезом и морфологией, деградацией и образованием органических соединений, свободных радикалов химией водно-болотных угодий , разграничением , восстановлением почвы и различными методологическими подходами к характеристике окислительно-восстановительного процесса. состояние почв. [22] [23]
Мнемоника [ править ]
Ключевые термины, связанные с окислительно-восстановительным процессом, могут сбивать с толку. [24] [25] Например, окисляющийся реагент теряет электроны; однако этот реагент называется восстановителем. Аналогично, восстановленный реагент приобретает электроны и называется окислителем. [26] Эти мнемоники обычно используются студентами, чтобы помочь запомнить терминологию: [27]
- « ВЫШКА » — окисление — это потеря НЕФТЯНАЯ электронов, восстановление — это прирост . электронов [24] [25] [26] [27]
- Лев говорит ГЕР [грр]» — потеря электронов . — это окисление , прирост электронов — это восстановление « Лев [24] [25] [26] [27]
- «ЛЕОРА говорит ГЕРОА» — потеря электронов называется окислением (восстановителем); присоединение электронов называется восстановлением (окислителем). [26]
- «RED CAT» и «AN OX», или «AnOx RedCat» («волово-рыжий кот») — восстановление происходит на катоде, а анод — на окислении.
- «RED CAT получает то, что теряет AN OX» - восстановление на катоде приобретает (электроны) то, что теряет анодное окисление (электроны)
- «ПАНИКА» — положительный анод, отрицательный — катод. Это относится к электролитическим элементам , которые выделяют накопленное электричество и могут заряжаться электричеством. ПАНИКА не распространяется на элементы, которые можно перезарядить окислительно-восстановительными материалами. Эти гальванические или гальванические элементы , такие как топливные элементы , производят электричество в результате внутренних окислительно-восстановительных реакций. Здесь положительный электрод является катодом, а отрицательный – анодом.
См. также [ править ]
- Анаэробное дыхание
- Бессемеровский процесс
- Биоремедиация
- Цикл Кальвина
- Химическое уравнение
- Химическое петлевое горение
- Цикл лимонной кислоты
- Электрохимическая серия
- Электрохимия
- Электролиз
- Электронный эквивалент
- Электронно-транспортная цепь
- Электросинтез
- Гальванический элемент
- гидрирование
- Мембранный потенциал
- Микробный топливный элемент
- Концепция Мерберна
- Нуклеофильная абстракция
- Органическая окислительно-восстановительная реакция
- Окислительное присоединение и восстановительное элиминирование
- Окислительное фосфорилирование
- Частичное окисление
- Прооксидант
- Редокс-градиент
- Редокс-потенциал
- Восстановитель
- Восстановительная атмосфера
- Потенциал сокращения
- Термическая реакция
- Трансметаллация
- Цикл серы
Ссылки [ править ]
- ^ «Металлы» . Размер укуса . Би-би-си. Архивировано из оригинала 3 ноября 2022 года.
- ^ «окислительно-восстановительный потенциал – определение окислительно-восстановительного потенциала на английском языке | Оксфордские словари» . Оксфордские словари | Английский . Архивировано из оригинала 1 октября 2017 года . Проверено 15 мая 2017 г.
- ↑ Перейти обратно: Перейти обратно: а б с д и Петруччи, Ральф Х.; Харвуд, Уильям С.; Херринг, Ф. Джеффри (2002). Общая химия (8-е изд.). Прентис-Холл. ISBN 0-13-014329-4 .
- ^ «Окислительно-восстановительные реакции» . Wiley.com. Архивировано из оригинала 30 мая 2012 года . Проверено 9 мая 2012 г.
- ↑ Перейти обратно: Перейти обратно: а б с Хауштайн, Кэтрин Хинга (2014). «Окислительно-восстановительная реакция» . У К. Ли Лернера; Бренда Уилмот Лернер (ред.). Научная энциклопедия Гейла (5-е изд.). Фармингтон-Хиллз, Мичиган: Gale Group.
- ^ Харпер, Дуглас. «окислительно-восстановительный» . Интернет-словарь этимологии .
- ^ Пингаррон, Хосе М.; Лабуда, Ян; Барек, Иржи; Бретт, Кристофер Массачусетс; Камоэнс, Мария Филомена; Фойта, Мирослав; Хибберт, Д. Бринн (2020). «Терминология электрохимических методов анализа (Рекомендации ИЮПАК 2019)» . Чистая и прикладная химия . 92 (4): 641–694. дои : 10.1515/pac-2018-0109 .
- ↑ Перейти обратно: Перейти обратно: а б с д Петруччи, Ральф Х.; Харвуд, Уильям С.; Херринг, Ф. Джеффри (2017). Общая химия: принципы и современные приложения (11-е изд.). Торонто: Пирсон. ISBN 978-0-13-293128-1 .
- ^ «Информационный бюллетень по азотной кислоте» (PDF) . Департамент экологической безопасности, устойчивого развития и рисков . Университет Мэриленда . Проверено 12 февраля 2024 г.
- ↑ Перейти обратно: Перейти обратно: а б Уиттен, Кеннет В.; Гейли, Кеннет Д.; Дэвис, Раймонд Э. (1992). Общая химия (4-е изд.). Издательство Колледжа Сондерса. п. 147. ИСБН 0-03-072373-6 .
- ^ Джайн Дж.Л. (2004). Основы биохимии . С. Чанд. ISBN 81-219-2453-7 .
- ^ Ленингер А.Л., Нельсон Д.Л., Кокс М.М. (1 января 2017 г.). Ленингерские принципы биохимии (Седьмое изд.). Нью-Йорк, штат Нью-Йорк. ISBN 9781464126116 . OCLC 986827885 .
{{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка ) - ^ Гудлицкий, Милош (1996). Редукции в органической химии . Вашингтон, округ Колумбия: Американское химическое общество. п. 429. ИСБН 978-0-8412-3344-7 .
- ^ Гудлицкий, Милош (1990). Окисления в органической химии . Вашингтон, округ Колумбия: Американское химическое общество. стр. 456 . ISBN 978-0-8412-1780-5 .
- ^ Бокрис, Джон О'М.; Редди, Амуля К.Н. (1970). Современная электрохимия . Пленум Пресс. стр. 352–3.
- ^ Бокрис, Джон О'М.; Редди, Амуля К.Н. (2013) [1970]. Современная электрохимия . Том. 1. Springer Science & Business Media. п. 494. ИСБН 9781461574675 . Проверено 29 марта 2020 г.
Описанные гомогенные реакции переноса протона подобны гомогенным реакциям переноса электрона в том, что общую реакцию переноса электрона можно разложить на одну реакцию электрона и одну реакцию деэлектронизации.
- ^ ИЮПАК. Сборник химической терминологии, 2-е изд. («Золотая книга»). Составлено А.Д. Макнотом и А. Уилкинсоном. Научные публикации Блэквелла, Оксфорд (1997). Онлайн-версия (2019-), созданная С. Дж. Чоком. ISBN 0-9678550-9-8 . https://goldbook.iupac.org/terms/view/R05222
- ^ ИЮПАК. Сборник химической терминологии, 2-е изд. («Золотая книга»). Составлено А.Д. Макнотом и А. Уилкинсоном. Научные публикации Блэквелла, Оксфорд (1997). Онлайн-версия (2019-), созданная С. Дж. Чоком. ISBN 0-9678550-9-8 . https://goldbook.iupac.org/terms/view/O04362
- ^ «Названия томов 1–44 серии «Ионы металлов в биологических системах»» . Металлы, микробы и минералы – биогеохимическая сторона жизни . Де Грюйтер. 2021. стр. xxiii–xxiv. дои : 10.1515/9783110589771-005 . ISBN 9783110588903 . S2CID 242013948 .
- ^ Отерс, Франц; Оттоу, Манфред; Мейлер, Генрих; Люнген, Ханс Бодо; Колтерманн, Манфред; Бур, Андреас; Яги, Дзюн Ичиро; Форманек, Лотар; Роуз, Фриц; Фликеншильд, Юрген; Хаук, Рольф; Штеффен, Рольф; Скрок, Райнер; Майер-Швиннинг, Гернот; Бюннагель, Хайнц-Лотар; Хофф, Ханс-Георг (2006). "Железо". Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a14_461.pub2 . ISBN 978-3527306732 .
- ^ Поннамперума, Феликс Нельсон (1992). «Химия подводных грунтов» . Достижения в агрономии . 24 : 29–96. дои : 10.1016/S0065-2113(08)60633-1 . ISBN 9780120007240 . Проверено 10 сентября 2023 г.
- ^ Бартлетт, Ричмонд Дж.; Джеймс, Брюс Р. (1991). «Окислительно-восстановительная химия почв». Достижения в агрономии . 39 : 151–208.
- ^ Джеймс, Брюс Р.; Броуз, Доминик А. (2012). «Окислительно-восстановительные явления». В Хуане Пань Мин; Ли, Юньконг; Самнер, Малкольм Э. (ред.). Справочник почвоведения: свойства и процессы (второе изд.). Бока-Ратон, Флорида: CRC Press . стр. 14-1 -- 14-24. ISBN 978-1-4398-0305-9 .
- ↑ Перейти обратно: Перейти обратно: а б с Робертсон, Уильям (2010). Еще основы химии . Национальная ассоциация учителей естественных наук. п. 82. ИСБН 978-1-936137-74-9 .
- ↑ Перейти обратно: Перейти обратно: а б с Филлипс, Джон; Строзак, Виктор; Вистром, Шерил (2000). Химия: понятия и приложения . Гленко МакГроу-Хилл. п. 558. ИСБН 978-0-02-828210-7 .
- ↑ Перейти обратно: Перейти обратно: а б с д Роджерс, Глен (2012). Описательная неорганическая, координационная химия и химия твердого тела . Брукс/Коул, Cengage Learning. п. 330. ИСБН 978-0-8400-6846-0 .
- ↑ Перейти обратно: Перейти обратно: а б с Зумдал, Стивен; Зумдал, Сьюзен (2009). Химия . Хоутон Миффлин. п. 160. ИСБН 978-0-547-05405-6 .
Дальнейшее чтение [ править ]
- Шуринг, Дж.; Шульц, HD; Фишер, В.Р.; Бетчер, Дж.; Дуйнисвельд, WH, ред. (1999). Redox: основы, процессы и приложения . Гейдельберг: Springer Verlag. п. 246. hdl : 10013/epic.31694.d001 . ISBN 978-3-540-66528-1 .
- Тратник, Пол Г.; Грундл, Тимоти Дж.; Хадерляйн, Стефан Б., ред. (2011). Водная окислительно-восстановительная химия . Серия симпозиумов ACS. Том. 1071. дои : 10.1021/bk-2011-1071 . ISBN 978-0-8412-2652-4 .