Э я механизм
В органической химии механизм E i , ( внутреннее/внутримолекулярное элиминирование ), также известный как термическое син-элиминирование или перициклическое син-элиминирование представляет собой особый тип реакции элиминирования , при которой два вицинальных (соседних) заместителя на алкановом каркасе уходят одновременно через циклическое переходное состояние с образованием алкена при син- элиминировании . [1] Этот тип элиминирования уникален, поскольку он активируется термически и не требует дополнительных реагентов, в отличие от обычного элиминирования, для которого требуется кислота или основание или во многих случаях вовлекаются заряженные промежуточные соединения . Этот механизм реакции часто встречается при пиролизе .
Общие характеристики
[ редактировать ]Соединения, которые подвергаются элиминированию через циклические переходные состояния при нагревании в отсутствие других реагентов, называются Ei реакциями . В зависимости от соединения элиминирование происходит через четырех-, пяти- или шестичленное переходное состояние. [1] [2]
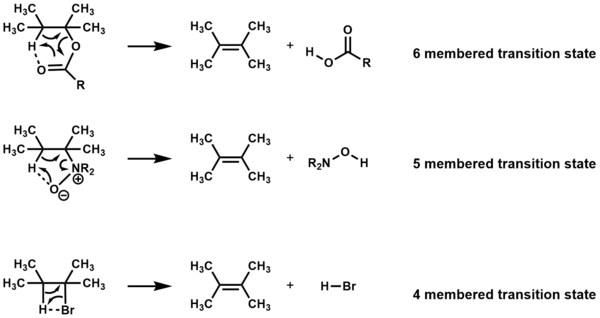
удаление должно быть син- , а атомы - компланарными. Для четырех- и пятичленных переходных состояний [3] но компланарность не требуется для шестичленных переходных состояний. [1]
Существует значительное количество доказательств в поддержку существования механизма E i, таких как: 1) кинетика реакций оказалась первого порядка, [4] 2) применение ингибиторов свободных радикалов не повлияло на скорость реакций, что указывает на отсутствие участия свободнорадикальных механизмов. [5] [6] 3) изотопные исследования показывают элиминирования Коупа , что связи CH и CN частично разорваны в переходном состоянии, [7] это также подтверждается расчетами , показывающими удлинение связи в переходном состоянии. [8] и 4) без вмешательства других механизмов механизм E i дает исключительно продукты элиминации син.
Существует множество факторов, которые влияют на состав продуктов реакций E i , но обычно они следуют правилу Гофмана и теряют β-водород из наименее замещенного положения, давая менее замещенный алкен (противоположность правилу Зайцева ). [1] Некоторые факторы, влияющие на состав продукта, включают стерические эффекты , сопряжение и стабильность образующегося алкена.
Для ациклических субстратов Z -изомер обычно является второстепенным продуктом из-за дестабилизирующего гош-взаимодействия в переходном состоянии, но селективность обычно не высока. [2]

Пиролиз N,N -диметил-2-фенилциклогексиламин-N-оксида показывает, как конформационные эффекты и стабильность переходного состояния влияют на состав продуктов циклических субстратов. [2]
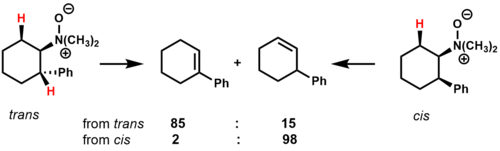
В транс- изомере есть два цис -β-водорода, которые могут элиминироваться. Основным продуктом является алкен, находящийся в сопряжении с фенильным кольцом, предположительно вследствие стабилизирующего влияния на переходное состояние. В цис- изомере есть только один цис - B образуется несопряженный региоизомер -водород, который может элиминироваться, в результате чего в качестве основного продукта .
Эфирный (ацетатный) пиролиз
[ редактировать ]Пиролитическое разложение сложных эфиров является примером термического синэлиминирования . При воздействии температур выше 400 °C сложные эфиры, содержащие β-водороды, могут отщеплять карбоновую кислоту через 6-членное переходное состояние, в результате чего образуется алкен. [2] [6]

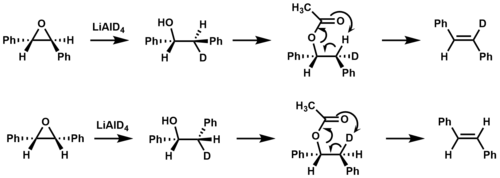
Изотопная маркировка использовалась для подтверждения того, что отщепление син происходит во время пиролиза эфиров с образованием стильбена . [9]
на основе серы
[ редактировать ]Удаление сульфоксида
[ редактировать ]Было обнаружено, что β-гидроксифенилсульфоксиды подвергаются термическому элиминированию через 5-членное циклическое переходное состояние, образуя β-кетоэфиры и метилкетоны после таутомеризации и сульфеновую кислоту . [10]

Аллиловые спирты могут образовываться из β-гидроксифенилсульфоксидов, содержащих β’-водород, по механизму E i , склонному к образованию β,γ- ненасыщенности . [11]

Установлено, что 1,3-диены образуются при обработке аллилового спирта арилсульфидом в присутствии триэтиламина . [12] Первоначально образуется сульфенатный эфир с последующей [2,3]-сигматропной перегруппировкой с образованием аллильного сульфоксида, который подвергается термическому синэлиминированию с образованием 1,3-диена.

Устранение Чугаева
[ редактировать ]Элиминация Чугаева представляет собой пиролиз ксантогенового эфира с образованием олефина . [1] [13] Для образования сложного эфира ксантогената спирт реагирует с сероуглеродом в присутствии основания, в результате чего образуется ксантогенат металла, который улавливается алкилирующим агентом (обычно метилиодидом ). Олефин образуется в результате термического синэлиминирования β-водорода и сложного ксантогенатного эфира. Реакция необратима, поскольку образующиеся побочные продукты — карбонилсульфид и метантиол — очень стабильны.

Элиминирование Чугаева очень похоже на пиролиз эфиров, но для достижения элиминирования требуются значительно более низкие температуры, что делает его ценным для , склонных к перегруппировке субстратов .
Реакция дегидратации Берджесса
[ редактировать ]Дегидратация вторичных и третичных спиртов с образованием олефина через промежуточный эфир сульфаматной кислоты называется реакцией дегидратации Берджесса . [13] [14] [15] Используемые условия реакции обычно очень мягкие, что дает ей некоторое преимущество перед другими методами дегидратации чувствительных субстратов. Эту реакцию использовали во время первого полного синтеза таксола для установки экзо-метиленовой группы в C-кольце. [16]

Во-первых, спирт вытесняет триэтиламин в реагенте Берджесса , образуя промежуточный эфир сульфаматной кислоты. Отщепление β-водорода и удаление сульфаматного эфира через 6-членное циклическое переходное состояние дает алкен.
Удаление тиосульфината
[ редактировать ]Тиосульфинаты могут удаляться аналогично сульфоксидам. Характерным примером является фрагментация аллицина до тиоакролеина, который затем образует винилдитиины . Такие реакции важны для антиоксидантной химии чеснока и других растений рода Allium .

на основе селена
[ редактировать ]Удаление селеноксида
[ редактировать ]использовалось Удаление селеноксида для превращения кетонов, сложных эфиров и альдегидов в их α,β-ненасыщенные производные. [1] [17]

Механизм этой реакции аналогичен отщеплению сульфоксида, которое представляет собой термическое отщепление син через 5-членное циклическое переходное состояние. Селеноксиды предпочтительнее для этого типа превращения по сравнению с сульфоксидами из-за их повышенной реакционной способности в отношении β-элиминирования, что в некоторых случаях позволяет проводить элиминирование при комнатной температуре. [2]
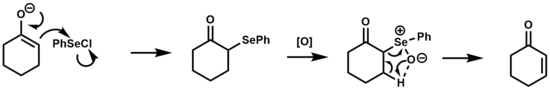
Аренселеновая кислота, образующаяся после стадии элиминирования, находится в равновесии с дифенилдиселенидом , который может реагировать с олефинами с образованием β-гидроксиселенидов в кислых или нейтральных условиях. В основных условиях эта побочная реакция подавляется. [18]
Выбывание Греко
[ редактировать ]Дегидратация первичного спирта в одном котле с образованием алкена через промежуточный продукт о -нитрофенилселеноксида называется элиминированием Греко . [19] [20]

Реакция начинается с образования соли селенофосфония, которая реагирует со спиртом с образованием соли оксафосфония. Анион арилселена замещает оксид трибутилфосфина, образуя разновидности алкиларилселенида. Затем селенид обрабатывают избытком перекиси водорода, что приводит к образованию селеноксида, который удаляет β-водород через 5-членное циклическое переходное состояние, образуя алкен.
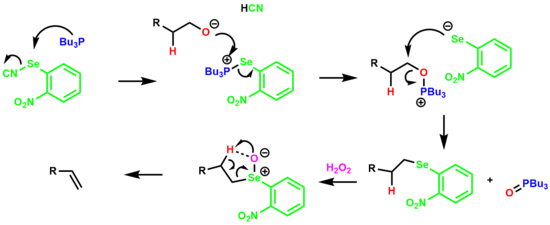
нитрогруппа Было обнаружено, что электроноакцепторная увеличивает как скорость элиминирования, так и конечный выход олефина.
на основе азота
[ редактировать ]Справиться с устранением
[ редактировать ]Элиминирование Коупа (реакция Коупа) представляет собой отщепление оксида третичного амина с образованием алкена и гидроксиламина по механизму E i . [13] [21] Элиминирование Коупа было использовано при синтезе имитатора маннопиранозиламина. [22] Третичный амин был окислен до оксида амина с использованием м -хлорпероксибензойной кислоты ( м- ХПБА) и подвергнут воздействию высоких температур для термического син- элиминирования β-водорода и оксида амина через циклическое переходное состояние, в результате чего получился алкен. Стоит отметить, что указанный водород (зеленым цветом) является единственным водородом, доступным для синэлиминирования .

Циклические аминооксиды (5, 7-10-членные азотсодержащие кольца) также могут подвергаться внутреннему син -элиминированию с образованием ациклических гидроксиламинов, содержащих концевые алкены. [13]
Особые случаи исключения Хофмана
[ редактировать ]Механизм элиминации Хофмана обычно представляет собой E2 , но при определенных обстоятельствах может идти и по пути Ei . Для некоторых стерически затрудненных молекул основание непосредственно депротонирует метильную группу амина вместо β-водорода, образуя промежуточный илид , который удаляет триметиламин через 5-членное переходное состояние, образуя алкен. Исследования по мечению дейтерием подтвердили этот механизм, наблюдая за образованием дейтерированного триметиламина (а не дейтерированной воды, которая могла бы образоваться по механизму E2). [23]
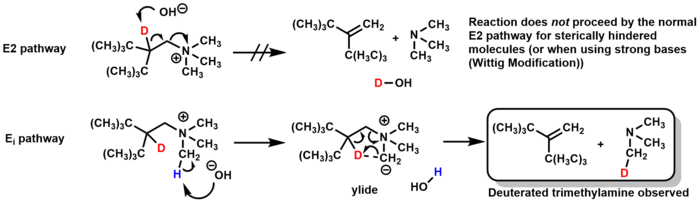
Модифицированное Виттигом элиминирование Хофмана происходит по тому же механизму E i , но вместо использования оксида серебра и воды в качестве основания модификация Виттига использует сильные основания, такие как алкиллитий или KNH2/жидкий NH3. [24] [25]
Элиминация Йодосо
[ редактировать ]Было обнаружено , что вторичные и третичные алкилиодиды с сильно электроноакцепторными группами при α-углероде подвергаются перициклическому синэлиминированию при воздействии м -хлорпербензойной кислоты ( м - ХПБА). [26] Предполагается, что реакция идет через йодозо-интермедиат перед син- элиминированием иодистой кислоты .

В объем этой реакции не входят первичные алкилйодиды, поскольку промежуточное соединение йодозо перегруппировывается в промежуточное соединение гипойодита, которое в условиях реакции превращается в спирт. Сильно электроноакцепторные группы подавляют путь перегруппировки, позволяя перициклического син- преобладать пути элиминирования.
Ссылки
[ редактировать ]- ^ Jump up to: а б с д и ж Марч, Джерри (2007). Продвинутая органическая химия (6-е изд.). Нью-Йорк: Уайли. ISBN 0471720917 .
- ^ Jump up to: а б с д и Кэри, ФА; Санбург, Р. Дж. Передовая органическая химия: реакция и синтез , 5-е изд.; Часть Б; Спрингер: Нью-Йорк, 2010 г.
- ^ Бранко, Дж. (1997). «Теоретические исследования реакции термического синэлиминирования органических аминооксидов, сульфоксидов и фосфоксидов неэмпирическими методами и методами функционала плотности». Тео. хим. 389 257-263.
- ^ О'Коннор, GL; Нэйс, HR (1953). «Дальнейшие исследования реакции Чугаева и родственных реакций». Дж. Ам. хим. Соц. 75 2118-.
- ^ Бартон, DHR; Руководитель, Эй Джей; Уильямс, Р.Дж. (1953). «Стереоспецифичность в реакциях термического элиминирования. Часть III. Пиролиз (-)-ментилбензоата». J. Chem Soc. 453 1715- .
- ^ Jump up to: а б Анслин, Э.В.; Догерти, Д.А. Современная физико-органическая химия , Мурдзек, Дж., Под ред. Университетские научные книги, 2006.
- ^ Райт, доктор медицинских наук; Симс, Л.Б.; Фрай, А. (1983). «Кинетические эффекты изотопа углерода-14 и кинетические исследования в реакциях синэлиминирования оксидов (2-фенилэтил)диметиламина». Дж. Ам. хим. Соц. 105 3714-.
- ^ Кан, С.Д.; Эриксон, Дж. А. (1994). «Теоретические исследования реакций термического элиминирования син. Относительные скорости элиминирования этилформиата, этилксантогената и этилфосфината». Дж. Ам. хим. Соц. 116 6271-6276.
- ^ Кертин, Д.Ю.; Келлом, Д.Б. (1953). «Реакции элиминирования и замещения dl-эритро- и dl-трео-2-дейтеро-1,2-дифенилэтанола и его производных». Дж. Ам. хим. Соц. 75 6011-.
- ^ Киношита, М.; Куниеда, Н.; Ноками, Дж. (1975). «Пиролиз B-гидроксисульфоксидов до кетонов». Тетраэдр Летт. 33 2841-2844.
- ^ Окавара, Р.; Уэта, К.; Ноками, Дж. (1978). «Пиролиз B-гидроксисульфоксидов II. Синтез аллиловых спиртов». Тетраэдр Летт. 49 4903-4904.
- ^ Волловиц, С.; Райх, HJ (1982). «Превращение аллиловых спиртов в 1,3-диены путем последовательной сульфенат-сульфоксидной [2,3] сигматропной перегруппировки и отщепления син». Дж. Ам. хим. Соц. 104 7051-7059.
- ^ Jump up to: а б с д Курти, Л.; Чако, Б. Стратегическое применение названных реакций в органическом синтезе , Academic Press, 2005.
- ^ Тейлор, EA; Пентон, HR-младший; Берджесс, Э.М. (1970). «Синтетическое применение сложных эфиров N-карбоалкоксисульфамата». Дж. Ам. хим. Соц. 92 5224-5226.
- ^ Тейлор, EA; Пентон, HR-младший; Берджесс, Э.М. (1973). «Термические реакции алкиловых эфиров N-карбометоксисульфамата». Дж. Орг. хим. 38 26-.
- ^ Холтон, РА; и др. (1994). «Первый полный синтез таксола. 2. Завершение колец C и D». Дж. Ам. хим. Соц. 116 1599-1600.
- ^ Лауэр, РФ; Янг, М.В.; Шарплесс, КБ (1973). «Реакции селеноксидов: термическое устранение син и обмен H2O-18». Тетраэдр Летт. 22 1979–1982 гг.
- ^ Райх, HJ; Волловиц, С.; Тренд, JE; Чоу, Ф.; Вендельборн, Д.Ф. (1978). «Син-элиминирование алкилселеноксидов. Побочные реакции с участием селененовых кислот. Влияние структуры и растворителя на скорость». Дж. Орг. хим. 43 1697-.
- ^ Грико, Пенсильвания; Гилман, С.; Нисидзава, М. (1976). «Селеорганическая химия. Простой одностадийный синтез алкиларилселенидов из спиртов». Дж. Орг. хим. 41 1485-.
- ^ Янг, МВт; Шарплесс, Б.К. (1975). «Синтез олефинов. Повышение скорости элиминирования алкиларилселеноксидов электроноакцепторными заместителями». Дж. Орг. хим. 40 947-.
- ^ Коуп, AC; Фостер, ТТ; Таул, штат Пенсильвания (1949). «Термическое разложение оксидов аминов до олефинов и диалкилгидроксиламинов». Дж. Ам. хим. Соц. 71 3929-.
- ^ Васелла, А.; Ремен, Л. (2002). «Конформационно-предвзятые имитаторы маннопиранозиламинов: ингибиторы B-маннозидаз?». Хелв. Хим. Акта. 85 1118-.
- ^ Коуп, AC; Мехта, А.С. (1963). «Механизм реакции элиминирования Гофмана: илидный промежуточный продукт при пиролизе сильно разветвленного четвертичного гидроксида». Дж. Ам. хим. Соц. 85 1949-.
- ^ Wittig, G.; Polster, R. (1957). Ann. Chem. 102 612-.
- ^ Бах, РД; Баир, КВ; Анджеевский, Д. (1972). «Модификация Виттига реакции элиминирования Гофмана. Доказательства альфа-, бета-механизма». Дж. Ам. хим. Соц. 94 8608-.
- ^ Райх, HJ, Пик, SL (1978). «Химия гипервалентного йода. Синэлиминация алкилйодозосоединений». Дж. Ам. хим. Соц. 100 4888-.