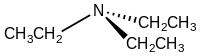
Триэтиламин
 | |||
| |||
| Имена | |||
|---|---|---|---|
| Предпочтительное название ИЮПАК N , N -Диэтилэтанамин | |||
| Другие имена (Триэтил)амин Триэтиламин (больше не название IUPAC) [1] ) | |||
| Идентификаторы | |||
3D model ( JSmol ) | |||
| Сокращения | ЧАЙ [2] | ||
| 605283 | |||
| ЧЭБИ | |||
| ЧЕМБЛ | |||
| ХимическийПаук | |||
| Информационная карта ECHA | 100.004.064 | ||
| Номер ЕС |
| ||
| КЕГГ | |||
| МеШ | триэтиламин | ||
ПабХим CID | |||
| номер РТЭКС |
| ||
| НЕКОТОРЫЙ | |||
| Число | 1296 | ||
Панель управления CompTox ( EPA ) | |||
| Характеристики [5] | |||
| С 6 Ч 15 Н | |||
| Молярная масса | 101.193 g·mol −1 | ||
| Появление | Бесцветная жидкость | ||
| Запах | Рыбный, аммиачный | ||
| Плотность | 0,7255 г мл −1 | ||
| Температура плавления | −114,70 °С; −174,46 ° F; 158,45 К | ||
| Точка кипения | от 88,6 до 89,8°С; от 191,4 до 193,5 °F; от 361,7 до 362,9 К | ||
| 112,4 г/л при 20 °C [3] | |||
| Растворимость | смешивается с органическими растворителями | ||
| войти P | 1.647 | ||
| Давление пара | 6,899–8,506 кПа | ||
Закон Генри постоянная ( k H ) | 66 мкмоль Па −1 кг −1 | ||
| Кислотность ( pKa ) | 10,75 (для сопряженной кислоты) (H 2 O), 9,00 (ДМСО) [4] | ||
| -81.4·10 −6 см 3 /моль | |||
Показатель преломления ( n D ) | 1.401 | ||
| Термохимия | |||
Теплоемкость ( С ) | 216,43 Дж.К. −1 моль −1 | ||
Стандартная энтальпия образование (Δ f H ⦵ 298 ) | −169 кДж моль −1 | ||
Стандартная энтальпия горение (Δ c H ⦵ 298 ) | от -4,37763 до -4,37655 МДж моль −1 | ||
| Опасности | |||
| СГС Маркировка : | |||
   | |||
| Опасность | |||
| Х225 , Х302 , Х312 , Х314 , Х332 | |||
| П210 , П280 , П305+П351+П338 , П310 | |||
| NFPA 704 (огненный алмаз) | |||
| точка возгорания | −15 ° C (5 ° F; 258 К) | ||
| 312 ° С (594 ° F; 585 К) | |||
| Взрывоопасные пределы | 1.2–8% | ||
| 2 ppm (8 мг/м 3 ) (ДВА), 4 ppm (17 мг/м 3 ) (НАБОР) | |||
| Летальная доза или концентрация (LD, LC): | |||
ЛД 50 ( средняя доза ) |
| ||
LC Lo ( самый низкий из опубликованных ) | 1425 частей на миллион (мышь, 2 часа) [7] | ||
| NIOSH (пределы воздействия на здоровье в США): | |||
МЕХ (Допускается) | СВВ 25 частей на миллион (100 мг/м 3 ) [6] | ||
РЕЛ (рекомендуется) | Не установлено [6] | ||
IDLH (Непосредственная опасность) | 200 частей на миллион [6] | ||
| Родственные соединения | |||
Родственные амины | |||
Родственные соединения | |||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |||
Триэтиламин представляет собой химическое соединение с формулой N(CH 2 CH 3 ) 3 , обычно сокращенно Et 3 N. Это также сокращенно TEA, однако эту аббревиатуру следует использовать осторожно, чтобы избежать путаницы с триэтаноламином или тетраэтиламмонием , для которых TEA также является распространенное сокращение. [8] [9] Это бесцветная летучая жидкость с сильным рыбным запахом, напоминающим аммиак . Как и диизопропилэтиламин (основание Хюнига), триэтиламин обычно используется в органическом синтезе , обычно в качестве основания .
Синтез и свойства [ править ]
Триэтиламин получают алкилированием аммиака этанолом : [10]
- NH 3 + 3 C 2 H 5 OH → N(C 2 H 5 ) 3 + 3 H 2 O
PK a протонированного триэтиламина составляет 10,75, [4] и его можно использовать для приготовления буферных растворов с таким pH. Гидрохлоридная гигроскопичный соль триэтиламина гидрохлорид (хлорид триэтиламмония) представляет собой бесцветный, не имеющий запаха и порошок , который разлагается при нагревании до 261 °C.
Триэтиламин растворим в воде в концентрации 112,4 г/л при 20 °С. [3] Он также смешивается с обычными органическими растворителями, такими как ацетон, этанол и диэтиловый эфир.
Лабораторные образцы триэтиламина можно очистить перегонкой из гидрида кальция . [11]
В алкановых растворителях триэтиламин представляет собой основание Льюиса , которое образует аддукты с различными кислотами Льюиса, такими как I 2 и фенолы . Благодаря своей стерической массе он неохотно образует комплексы с переходными металлами. [12] [13] [14]
Приложения [ править ]
Триэтиламин обычно используется в органическом синтезе в качестве основания . Например, его обычно используют в качестве основания при получении сложных эфиров и амидов из ацилхлоридов . [15] Такие реакции приводят к образованию хлористого водорода , который соединяется с триэтиламином с образованием гидрохлорида триэтиламина, обычно называемого хлоридом триэтиламмония. (R, R' = алкил , арил ):
- R 2 NH + R'C(O)Cl + Et 3 N → R'C(O)NR 2 + Et 3 NH + кл. −
Как и другие третичные амины, он катализирует образование пеноуретанов и эпоксидных смол. Он также полезен в реакциях дегидрогалогенирования и окислении Сверна .
Триэтиламин легко алкилируется с образованием соответствующей четвертичной аммониевой соли :
- RI + Et 3 N → Et 3 NR + я −
Триэтиламин в основном используется в производстве четвертичных аммониевых соединений для текстильных вспомогательных средств и четвертичных аммониевых солей красителей . Он также является катализатором и нейтрализатором кислоты в реакциях конденсации и используется в качестве промежуточного продукта для производства лекарств, пестицидов и других химикатов.
Соли триэтиламина, как и любые другие соли третичного аммония, используются в качестве реагента ионного взаимодействия в хроматографии ионного взаимодействия из-за их амфифильных свойств . В отличие от солей четвертичного аммония, соли третичного аммония гораздо более летучи, поэтому масс-спектрометрию при проведении анализа можно использовать .
Ниша использует [ править ]
Триэтиламин обычно используется при производстве анионных ПУД . Полиуретановый преполимер получают с использованием изоцианата и полиола с диметилолпропионовой кислотой (ДМПА). Эта молекула содержит две гидроксигруппы и группу карбоновой кислоты . Этот преполимер затем диспергируют в воде с триэтиламином или другим нейтрализующим агентом. ТЭА реагирует с карбоновой кислотой, образуя водорастворимую соль. Обычно затем добавляют удлинитель диаминовой цепи для получения полиуретана, диспергированного в воде, без свободных групп NCO, но с полиуретана и полимочевины . сегментами [16] [17] [18] Dytek A обычно используется в качестве удлинителя цепи. [19]
Триэтиламин используется для получения солей различных пестицидов, содержащих карбоновые кислоты, например триклопира и 2,4-дихлорфеноксиуксусной кислоты . [ нужна ссылка ]
Триэтиламин является активным ингредиентом FlyNap , препарата для обезболивания Drosophila melanogaster . [ нужна ссылка ] Триэтиламин используется в лабораториях по борьбе с комарами и переносчиками болезней для обезболивания комаров. Это делается для сохранения любого вирусного материала, который может присутствовать во время идентификации вида.
Бикарбонатная , часто в градиенте соль триэтиламина (часто сокращенно TEAB, бикарбонат триэтиламмония) полезна в обращенно-фазовой хроматографии , для очистки нуклеотидов и других биомолекул. [ нужна ссылка ]
В начале 1940-х годов было обнаружено, что триэтиламин в сочетании с азотной кислотой является гиперголическим , и его считали возможным топливом для первых гиперголических ракетных двигателей. [20] Советская ракета «Скад» использовала ТГ-02 («Тонка-250»), смесь 50% ксилидина и 50% триэтиламина, в качестве стартовой жидкости для зажигания ракетного двигателя. [21]
Естественное явление [ править ]
Цветки боярышника имеют тяжелый, сложный аромат, отличительной частью которого является триэтиламин, который также является одним из первых химических веществ, вырабатываемых мертвым человеческим телом, когда оно начинает разлагаться . считается несчастливым Из-за запаха в британской культуре приносить боярышник в дом. гангрена и сперма также имеют схожий запах. Говорят, что [22]
Ссылки [ править ]
- ^ «Фронт материи». Номенклатура органической химии: Рекомендации ИЮПАК и предпочтительные названия 2013 (Синяя книга) . Кембридж: Королевское химическое общество . 2014. с. 671. дои : 10.1039/9781849733069-FP001 . ISBN 978-0-85404-182-4 .
- ^ X. Бори-Азо, С.П. Армс и Х.Дж.В. ван ден Хаак, Макромолекулы 2004, 37, 2348 PDF
- ↑ Перейти обратно: Перейти обратно: а б «Паспорт безопасности – 471283» . www.sigmaaldrich.com . Проверено 17 июня 2020 г.
- ↑ Перейти обратно: Перейти обратно: а б Исследовательская группа Дэвида Эванса. Архивировано 21 января 2012 г. в Wayback Machine.
- ^ Индекс Merck (11-е изд.). 9582.
- ↑ Перейти обратно: Перейти обратно: а б с Карманный справочник NIOSH по химическим опасностям. «#0633» . Национальный институт охраны труда и здоровья (NIOSH).
- ^ «Триэтиламин» . Непосредственно опасные для жизни и здоровья концентрации (IDLH) . Национальный институт охраны труда и здоровья (NIOSH).
- ^ «Соединения этаноламина (МЭА, ДЭА, ЧАЙ и другие)» . Безопасная косметика . Проверено 17 июня 2020 г.
- ^ «Тетраэтиламмоний | Страница лигандов | Руководство IUPHAR/BPS по ФАРМАКОЛОГИИ» . www.guidetopharmacology.org . Проверено 17 июня 2020 г.
- ^ Эллер, Карстен; Хенкес, Эрхард; Россбахер, Роланд; Хёке, Хартмут (2000). Амины Алифатические . дои : 10.1002/14356007.a02_001 . ISBN 3-527-30673-0 .
- ^ Ф., Армарего, WL (17 октября 2012 г.). Очистка лабораторных химикатов . Чай, Кристина Ли Линь (Седьмое изд.). Амстердам. ISBN 978-0-12-382162-1 . OCLC 820853648 .
{{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка ) CS1 maint: несколько имен: список авторов ( ссылка ) - ^ ДеЛэйв, Патрисия Дж.; Салливан, BP; Мейер, Ти Джей; Уиттен, генеральный директор (июль 1979 г.). «Применение светоиндуцированных реакций переноса электрона. Сочетание генерации водорода с фотовосстановлением комплексов рутения (II) триэтиламином» . Журнал Американского химического общества . 101 (14): 4007–4008. дои : 10.1021/ja00508a070 . ISSN 0002-7863 .
- ^ ДеЛэйв, Патрисия Дж.; Форман, Томас К.; Джаннотти, Чарльз; Уиттен, Дэвид Г. (август 1980 г.). «Реакции фотоиндуцированного переноса электрона комплексов переходных металлов с аминами. Механистические исследования альтернативных путей обратного переноса электронов» . Журнал Американского химического общества . 102 (17): 5627–5631. дои : 10.1021/ja00537a037 . ISSN 0002-7863 .
- ^ Селигсон, Аллен Л.; Троглер, Уильям К. (март 1991 г.). «Углы конуса аминных лигандов. Рентгеновские кристаллические структуры и измерения равновесия комплексов аммиака, этиламина, диэтиламина и триэтиламина с катионом [бис (диметилфосфино)этан] метилпалладия (II)» . Журнал Американского химического общества . 113 (7): 2520–2527. дои : 10.1021/ja00007a028 . ISSN 0002-7863 .
- ^ Сорги, КЛ (2001). «Триэтиламин». Энциклопедия реагентов для органического синтеза . Нью-Йорк: Джон Уайли и сыновья. дои : 10.1002/047084289X.rt217 . ISBN 978-0-471-93623-7 .
- ^ Пубхим. «Диметилолпропионовая кислота» . pubchem.ncbi.nlm.nih.gov . Проверено 21 августа 2018 г.
- ^ Джанг, JY; Джон, ЮК; Чеонг, Иллинойс; Ким, Дж. Х. (1 января 2002 г.). «Коллоиды и поверхности А: Физикохимия» . англ. Аспекты . 196 : 135–143.
- ^ Ховарт, Джорджия (1 июня 2003 г.). «Полиуретаны, полиуретановые дисперсии и полимочевины: прошлое, настоящее и будущее» . Surface Coatings International Часть B: Операции с покрытиями . 86 (2): 111–118. дои : 10.1007/BF02699621 . ISSN 1476-4865 . S2CID 93574741 .
- ^ Мэдбули, Сэми А.; Отайгбе, Джошуа У.; Нанда, Аджая К.; Уикс, Дуглас А. (1 мая 2005 г.). «Реологическое поведение водных полиуретановых дисперсий: влияние содержания твердых веществ, степени нейтрализации, удлинения цепи и температуры» . Макромолекулы . 38 (9): 4014–4023. Бибкод : 2005МаМол..38.4014М . дои : 10.1021/ma050453u . ISSN 0024-9297 .
- ^ Кларк, Джон Друри (23 мая 2018 г.). Зажигание!: Неофициальная история жидкого ракетного топлива . Издательство Университета Рутгерса. п. 302. ИСБН 978-0-8135-9918-2 .
- ^ Брюгге, Норберт (24 февраля 2020 г.). «Советское семейство ракет «Скад» . b14643.de . Проверено 29 июля 2022 г.
- ^ Книга всеобщего невежества. Джон Ллойд и Джон Митчинсон. Фабер и Фабер 2006, Боярышник , BBC


