Ацилхлорид
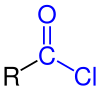
В органической химии ацилхлорид . (или хлорангидрид ) — органическое соединение с функциональной группой −C(=O)Cl . Их формулу обычно записывают R-COCl , где R — боковая цепь . Они являются реакционноспособными производными карбоновых кислот ( R-C(=O)OH ). Конкретным примером ацилхлорида является ацетилхлорид . СН 3 COCl . Ацилхлориды являются наиболее важной подгруппой ацилгалогенидов .
Номенклатура [ править ]
Там, где ацилхлоридный фрагмент имеет приоритет, ацилхлориды называются по названию исходной карбоновой кислоты и заменяют -илхлорид на -ic кислоту . Таким образом:
- уксусная кислота (CH 3 COOH ) → ( ацетилхлорид CH 3 COCl )
- бензойная кислота (C 6 H 5 COOH ) → ( COCl C 6 H 5 ) бензоилхлорид
- масляная кислота (C 3 H 7 COOH ) → ( бутирилхлорид C3H7 COCl )
(Как ни странно, для некоторых тривиальных названий -оилхлорид заменяет -ic кислоту . Например, пиваловая кислота становится пивалоилхлоридом , а акриловая кислота становится акрилоилхлоридом . Названия пивалилхлорид и акрилилхлорид используются реже, хотя они пожалуй, логичнее.)
Когда другие функциональные группы имеют приоритет, ацилхлориды считаются префиксами — хлоркарбонил- : [1]
- уксусная кислота (CH 3 COOH) → ( хлоркарбонил )уксусная кислота ( ClOC CH 2 COOH)
Свойства [ править ]
Не обладая способностью образовывать водородные связи , ацилхлориды имеют более низкие температуры кипения и плавления, чем аналогичные карбоновые кислоты . Например, уксусная кислота кипит при 118 °С, а ацетилхлорид — при 51 °С. Как и большинство карбонильных соединений , инфракрасная спектроскопия обнаруживает полосу около 1750 см-1. −1 .
Простейшим стабильным ацилхлоридом является ацетилхлорид; формилхлорид нестабилен при комнатной температуре, хотя его можно получить при температуре –60 °C или ниже. [2] [3]
Ацилхлориды гидролизуются (реагируют с водой) с образованием соответствующей карбоновой кислоты и соляной кислоты :

Синтез [ править ]
Промышленные маршруты [ править ]
Промышленный путь получения ацетилхлорида включает реакцию уксусного ангидрида с хлористым водородом : [5]
Пропионилхлорид получают хлорированием кислоты фосгеном : пропионовой [6]
Бензоилхлорид получают частичным гидролизом бензотрихлорида : [7]
Аналогично бензотрихлориды реагируют с карбоновыми кислотами с образованием хлорангидрида. Это преобразование практикуется для реакции 1,4-бис(трихлорметил)бензола с образованием терефталоилхлорида :
тионилхлорид Лабораторные методы :
В лаборатории ацилхлориды обычно получают обработкой карбоновых кислот тионилхлоридом ( SOCl2 ) . [8] Реакцию катализируют диметилформамид и другие добавки. [9] [10]

Тионилхлорид [11] является хорошо подходящим реагентом, поскольку побочные продукты (HCl, SO 2 ) представляют собой газы, а остаточный тионилхлорид легко удаляется благодаря его низкой температуре кипения (76 °C).
методы: хлориды Лабораторные фосфора
трихлорид фосфора ( PCl 3 ) популярен, [12] хотя требуется избыток реагента. [9] Пентахлорид фосфора ( PCl 5 ) также эффективен, [13] [14] но переносится только один хлорид:
Лабораторные методы: оксалилхлорид [ править ]
Другой метод предполагает использование оксалилхлорида :
Реакция катализируется диметилформамидом ( ДМФ), который реагирует с оксалилхлоридом с образованием реагента Вильсмайера иминия , промежуточного , который реагирует с карбоновой кислотой с образованием смешанного иминоангидрида. Эта структура претерпевает ацильное замещение высвободившимся хлоридом, образуя ангидрид кислоты и высвобождая регенерированную молекулу ДМФ. [10] По сравнению с тионилхлоридом оксалилхлорид является более дорогим, но также более мягким реагентом и, следовательно, более селективным.
Другие лабораторные методы [ править ]
В качестве источника хлоридов можно использовать хлорангидриды кислот. [15] Таким образом, ацетилхлорид можно перегнать из смеси бензоилхлорида и уксусной кислоты : [9]
Другие методы, которые не образуют HCl, включают реакцию Аппеля : [16]
Другой вариант использования цианурхлорида : [17]
Реакция [ править ]
Ацилхлорид — реактивные и универсальные реагенты. [18] Ацилхлориды обладают большей реакционной способностью, чем другие производные карбоновых кислот, такие как ангидриды кислот , сложные эфиры или амиды :
Нуклеофильные реакции [ править ]
Хлорангидриды кислот полезны для получения амидов, эфиров, ангидридов. В результате этих реакций образуется хлорид, что может быть нежелательно. Ацилхлориды гидролизуются с образованием карбоновой кислоты:
Этот гидролиз обычно является скорее неприятным, чем преднамеренным. Ацилхлориды используются для получения ангидридов кислот , амидов и сложных эфиров путем взаимодействия хлорангидридов с солью карбоновой кислоты , амином или спиртом соответственно.
Механизм [ править ]
Полагают, что алкоголиз ацилгалогенидов (алкоксидегалогенирование) протекает по S N 2 -механизму (схема 10). [19] Однако механизм может быть также тетраэдрическим или S N 1 в сильнополярных растворителях. [20] (хотя реакция S N 2 включает в себя согласованную реакцию, тетраэдрический путь присоединения-элиминирования включает заметный промежуточный продукт). [21]
Основания, такие как пиридин или N,N -диметилформамид, катализируют ацилирование . [14] [10] Эти реагенты активируют ацилхлорид по механизму нуклеофильного катализа. Амин атакует карбонильную связь и предположительно [22] сначала образует временный тетраэдрический промежуточный продукт, затем образует четвертичную ациламмониевую соль за счет смещения уходящей группы. Эта четвертичная ациламмониевая соль более восприимчива к атаке спиртов или других нуклеофилов.
Использование двух фаз (водной для амина и органической для ацилхлорида) называется реакцией Шоттена-Баумана . Этот подход используется при изготовлении нейлона с помощью так называемого трюка с нейлоновой веревкой . [23]
Преобразование в кетоны [ править ]
Углеродные нуклеофилы, такие как реактивы Гриньяра , преобразуют ацилхлориды в кетоны , которые, в свою очередь, чувствительны к атаке второго эквивалента с образованием третичного спирта . Реакция ацилгалогенидов с некоторыми кадмийорганическими реагентами прекращается на кетоновой стадии. [24] Реакция с реагентами Гилмана также приводит к образованию кетонов, что отражает низкую нуклеофильность этих медьорганических соединений лития. [14]
Сокращение [ править ]
Ацилхлориды восстанавливают алюмогидридом лития и диизобутилалюминийгидридом с образованием первичных спиртов. Три-трет-бутоксиалюминийгидрид лития , объемистый донор гидрида, восстанавливает ацилхлориды до альдегидов, как и восстановление Розенмунда с использованием газообразного водорода над отравленным палладиевым катализатором. [25]

Ацилирование аренов [ править ]
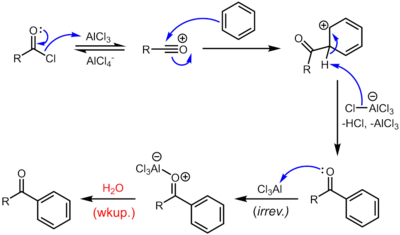
В случае Льюиса, кислотных катализаторов таких как хлорид железа или хлорид алюминия , ацилхлориды участвуют в ацилировании Фриделя-Крафтса с образованием арилкетонов: [12] [14]
Из-за суровых условий и реакционной способности промежуточных продуктов эта весьма полезная реакция имеет тенденцию быть беспорядочной и небезопасной для окружающей среды.
Окислительное присоединение [ править ]
Ацилхлориды реагируют с центрами низковалентных металлов с образованием ацильных комплексов переходных металлов . Показательным является окислительное присоединение ацетилхлорида : к комплексу Васки , превращающее плоский квадратный Ir(I) в октаэдрический Ir(III) [26]
Опасности [ править ]
Низкомолекулярные ацилхлориды часто являются слезоточивыми веществами и бурно реагируют с водой, спиртами и аминами.
Ссылки [ править ]
- ^ Номенклатура органической химии , R-5.7.6 Галогенангидриды
- ^ Сих, Джон К. (15 апреля 2001 г.), «Формилхлорид», в John Wiley & Sons, Ltd (ред.), Энциклопедия реагентов для органического синтеза , John Wiley & Sons, Ltd, doi : 10.1002/047084289x. RF026 , ISBN 9780471936237
- ^ Ричард О.К. Норман; Джеймс М. Коксон (16 сентября 1993 г.). Принципы органического синтеза, 3-е издание . ЦРК Пресс. п. 371. ИСБН 978-0-7487-6162-3 .
- ^ Ван, Хун-Ён; Се, Минь-Хао; Ло, Ши-Нэн; Цзоу, Пей; Лю, Я-Лин (2009). «3,5-Динитробензоилхлорид» . Acta Crystallographica Раздел E. 65 (10): о2460. Бибкод : 2009AcCrE..65o2460W . дои : 10.1107/S1600536809036228 . ПМК 2970283 . ПМИД 21577915 .
- ^ Патент США 5672749 , Филип Р. ДеВру, У. Брайан Уэйтс, Роберт Э. Янг, «Способ получения ацетилхлорида».
- ^ Самель, Ульф Райнер; Колер, Уолтер; Геймер, Армин Отто; Койзер, Ульрих (2005). «Пропионовая кислота и производные». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a22_223 . ISBN 978-3527306732 .
- ^ Маки, Такао; Такеда, Кадзуо (2002). «Бензойная кислота и производные». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a03_555 . ISBN 978-3527306732 .
- ^ Хелферих, Б.; Шефер, В. (1929). «н-Бутирлхлорид». Органические синтезы . 9:32 . дои : 10.15227/orgsyn.009.0032 .
- ^ Jump up to: Перейти обратно: а б с Мартин Анселл (1972). «Получение ацилгалогенидов». У Саула Патая (ред.). Ацилгалогениды . Химия функциональных групп ПАТАИ. стр. 35–68. дои : 10.1002/9780470771273.ch2 . ISBN 9780470771273 .
- ^ Jump up to: Перейти обратно: а б с Клейден, Джонатан (2001). Органическая химия . Оксфорд: Издательство Оксфордского университета. стр. 276–296 . ISBN 0-19-850346-6 .
- ^ Дж. С. Пизи, Синтетические реагенты, Vol. 1, Холстед Пресс, Нью-Йорк, 1974.
- ^ Jump up to: Перейти обратно: а б Аллен, CFH; Баркер, МЫ (1932). «Дезоксибензоин». Органические синтезы . 12:16 . дои : 10.15227/orgsyn.012.0016 .
- ^ Адамс, Роджер (1923). «п-нитробензоилхлорид». Органические синтезы . 3 : 75. дои : 10.15227/orgsyn.003.0075 .
- ^ Jump up to: Перейти обратно: а б с д Бойд, Роберт В.; Моррисон, Роберт (1992). Органическая химия . Энглвуд Клиффс, Нью-Джерси: Прентис Холл. стр. 666–762. ISBN 0-13-643669-2 .
- ^ Л. П. Киридес (1940). «Фумарилхлорид». Органические синтезы . 20:51 . дои : 10.15227/orgsyn.020.0051 .
- ^ " Тетрахлорид трифенилфосфина углерода Ташнер, Майкл Дж. e-EROS: Энциклопедия реагентов для органического синтеза , 2001
- ^ К. Венкатараман; Д. Р. Вагл (1979). «Цианурхлорид: полезный реагент для превращения карбоновых кислот в хлориды, сложные эфиры, амиды и пептиды». Тетраэдр Летт. 20 (32): 3037–3040. дои : 10.1016/S0040-4039(00)71006-9 .
- ^ Зоннтаг, Норман О.В. (1 апреля 1953 г.). «Реакции хлоридов алифатических кислот». Химические обзоры . 52 (2): 237–416. дои : 10.1021/cr60162a001 . ISSN 0009-2665 .
- ^ Бентли, Т. Уильям; Ллевеллин, Гарет; Макалистер, Дж. Энтони (январь 1996 г.). «Механизм SN2 алкоголиза, аминолиза и гидролиза ацетилхлорида» . Журнал органической химии . 61 (22): 7927–7932. дои : 10.1021/jo9609844 . ISSN 0022-3263 . ПМИД 11667754 .
- ^ CH Бэмфорд и CFH Типпер, Комплексная химическая кинетика: образование эфиров, гидролиз и родственные реакции, Elsevier, Амстердам, 1972.
- ^ Фокс, Джозеф М.; Дмитренко Ольга; Ляо, Лянь-ань; Бах, Роберт Д. (октябрь 2004 г.). «Вычислительные исследования нуклеофильного замещения карбонильного углерода: механизм SN 2 в сравнении с тетраэдрическим промежуточным продуктом в органическом синтезе» . Журнал органической химии . 69 (21): 7317–7328. дои : 10.1021/jo049494z . ISSN 0022-3263 . ПМИД 15471486 .
- ^ Хаббард, Патрисия; Бриттен, Уильям Дж. (февраль 1998 г.). «Механизм катализируемого амином образования сложного эфира из хлорангидрида и спирта» . Журнал органической химии . 63 (3): 677–683. дои : 10.1021/jo9716643 . ISSN 0022-3263 . ПМИД 11672060 .
- ^ Морган, Пол В.; Кволек, Стефани Л. (апрель 1959 г.). «Трюк с нейлоновой веревкой: демонстрация конденсационной полимеризации» . Журнал химического образования . 36 (4): 182. Бибкод : 1959ЖЧЭд..36..182М . дои : 10.1021/ed036p182 . ISSN 0021-9584 .
- ^ Дэвид А. Ширли (2011). «Синтез кетонов из галогенангидридов и металлоорганических соединений магния, цинка и кадмия». Орг. Реакции : 28–58. дои : 10.1002/0471264180.или008.02 . ISBN 978-0471264187 .
- ^ Уильям Ройш. «Производные карбоновой кислоты» . Виртуальный текст органической химии . Мичиганский государственный университет . Архивировано из оригинала 16 мая 2016 г. Проверено 19 февраля 2009 г.
- ^ Хартвиг, Джон (2010). Химия органопереходных металлов: от связывания к катализу . Нью-Йорк: Университетские научные книги. п. 1160. ИСБН 978-1-938787-15-7 .






![{\displaystyle {\ce {RCO2H + ClCOCOCl ->[ДМФ] RCOCl + CO + CO2 + HCl}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1969c220dc60ca7914048d44ef74af6f890340d8)