Фосген
 | |
 | |
 Образец токсичных газов, используемых в химической войне; крайний левый содержит фосген в запечатанном капилляре | |
| Имена | |
|---|---|
| Предпочтительное название ИЮПАК Карбонилдихлорид [2] | |
Другие имена
| |
| Идентификаторы | |
3D model ( JSmol ) | |
| ЧЭБИ | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.000.792 |
| Номер ЕС |
|
ПабХим CID | |
| номер РТЭКС |
|
| НЕКОТОРЫЙ | |
| Число | 1076 |
Панель управления CompTox ( EPA ) | |
| Характеристики | |
| КОСl 2 | |
| Молярная масса | 98.91 g·mol −1 |
| Появление | Бесцветный газ |
| Запах | Удушливый, как заплесневелое сено или трава. [3] |
| Плотность | 4,248 г/л (15 °C, газ) 1,432 г/см 3 (0 °C, жидкость) |
| Температура плавления | -118 ° C (-180 ° F; 155 К) |
| Точка кипения | 8,3 ° C (46,9 ° F; 281,4 К) |
| Нерастворим, реагирует [4] | |
| Растворимость | Растворим в бензоле , толуоле , уксусной кислоте. Разлагается в спирте и кислоте |
| Давление пара | 1,6 атм (20°С) [3] |
| −48·10 −6 см 3 /моль | |
| Структура | |
| Тригональная плоская | |
| 1,17 Д | |
| Опасности | |
| СГС Маркировка : | |
   [5] [5] | |
| Опасность | |
| Х280 , Х314 , Х330 [5] | |
| P260 , P280 , P303+P361+P353+P315 , P304+P340+P315 , P305+P351+P338+P315 , P403 , P405 [5] | |
| NFPA 704 (огненный алмаз) | |
| точка возгорания | Невоспламеняющийся |
| 0,1 ppm (1 ppm = 4 мг /м 3 ) | |
| Летальная доза или концентрация (LD, LC): | |
ЛК 50 ( средняя концентрация ) |
|
LC Lo ( самый низкий из опубликованных ) |
|
| NIOSH (пределы воздействия на здоровье в США): | |
МЕХ (Допускается) | TWA 0,1 ppm (0,4 мг/м 3 ) [3] |
РЕЛ (рекомендуется) | TWA 0,1 ppm (0,4 мг/м 3 ) C 0,2 ppm (0,8 мг/м 3 ) [15 минут] [3] |
IDLH (Непосредственная опасность) | 2 частей на миллион [3] 1 ppm = 4 мг/м 3 |
| Паспорт безопасности (SDS) | [1] |
| Родственные соединения | |
Родственные соединения | |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Фосген – химическое соединение формулы органическое COCl 2 . Это токсичный бесцветный газ; в низких концентрациях его затхлый запах напоминает запах свежескошенного сена или травы. [7] Его можно рассматривать химически как двойной ацилхлоридный аналог угольной кислоты или структурно как формальдегид с атомами водорода, замененными атомами хлора. Фосген является ценным и важным промышленным строительным материалом, особенно для производства предшественников полиуретанов и поликарбонатных пластиков.
Фосген чрезвычайно ядовит и использовался в качестве химического оружия во время Первой мировой войны , где он стал причиной гибели 85 000 человек . Это сильнодействующий раздражитель легких, который быстро заполняет окопы противника, поскольку является тяжелым газом.
он классифицируется как вещество Списка 3 В соответствии с Конвенцией о химическом оружии . Помимо промышленного производства, небольшие количества происходят в результате распада и сжигания хлорорганических соединений , таких как хлороформ . [8]
Структура и основные свойства
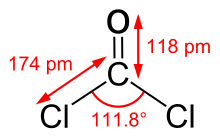
[ редактировать ]Фосген представляет собой плоскую молекулу, как предсказывает теория VSEPR . Расстояние C=O составляет 1,18 Å , расстояние C-Cl составляет 1,74 Å, а угол Cl-C-Cl составляет 111,8 °. [9] Фосген представляет собой оксогалогенид углерода , и его можно считать одним из простейших ацилхлоридов, формально производным от угольной кислоты .
Производство
[ редактировать ]В промышленности фосген производят путем пропускания очищенного угарного газа и газообразного хлора через слой пористого активированного угля , который служит катализатором : [8]
- CO + Cl 2 → COCl 2 (Δ H rxn = −107,6 кДж/моль)
Эта реакция является экзотермической и обычно проводится при температуре от 50 до 150 °C. При температуре выше 200 °C фосген превращается в окись углерода и хлор, K экв (300 К) = 0,05. Мировое производство этого соединения оценивалось в 2,74 миллиона тонн в 1989 году. [8]
Фосген довольно просто производить, но он внесен в список веществ Списка 3 Конвенции о химическом оружии . обычно считается слишком опасной По этой причине транспортировка в больших количествах . Вместо этого фосген обычно производится и потребляется на одном и том же заводе в рамках процесса «по требованию». Это предполагает поддержание эквивалентных темпов производства и потребления, что позволяет поддерживать достаточно низкое количество фосгена в системе в любой момент времени, снижая риски в случае аварии. Некоторое серийное производство все еще осуществляется, но предпринимаются усилия по сокращению количества хранимого фосгена. [10]
Непреднамеренное поколение
[ редактировать ]Химия атмосферы
[ редактировать ]Простые хлорорганические соединения медленно превращаются в фосген под воздействием ультрафиолетового (УФ) облучения в присутствии кислорода . [11] До открытия озоновой дыры в конце 1970-х годов большие количества хлорорганических соединений регулярно использовались промышленностью, что неизбежно приводило к их попаданию в атмосферу. В 1970-80-е годы уровни фосгена в тропосфере составляли около 20-30 pptv (пик 60 pptv). [11] Однако почти 30 лет спустя эти уровни существенно не снизились. [12] несмотря на то, что производство хлорорганических соединений ограничивается Монреальским протоколом .
Фосген в тропосфере может сохраняться примерно до 70 дней и удаляется в основном путем гидролиза с влажностью окружающей среды или облачной водой. [13] Менее 1% попадает в стратосферу , где его срок жизни, как ожидается, составит несколько лет, поскольку этот слой намного суше, а фосген медленно разлагается в результате УФ- фотолиза . Следовательно, он играет незначительную роль в разрушении озона .
Горение
[ редактировать ]Четыреххлористый углерод ( CCl 4 ) может превращаться в фосген при воздействии тепла на воздухе. Это было проблемой, поскольку четыреххлористый углерод является эффективным средством подавления огня и раньше широко использовался в огнетушителях . [14] Имеются сообщения о смертельных случаях в результате его использования для тушения пожаров в замкнутых пространствах . [15] Образование фосгена четыреххлористым углеродом и его собственная токсичность означают, что он больше не используется для этой цели. [14]
Биологически
[ редактировать ]Фосген также образуется как метаболит хлороформа , вероятно, под действием цитохрома Р-450 . [16]
История
[ редактировать ]Фосген был синтезирован химиком Корнуолла из Джоном Дэви на смесь окиси углерода и хлора (1790–1868) в 1812 году путем воздействия солнечного света . Он назвал его «фосгеном» от греческого φῶς ( фос , свет) и γεννάω ( gennaō , рождать) в связи с использованием света для ускорения реакции. [17] По мере развития XIX века он постепенно приобретал важное значение в химической промышленности, особенно в производстве красителей.
Реакции и использование
[ редактировать ]Реакция органического субстрата с фосгеном называется фосгенированием . [8] Фосгенирование диолов дает карбонаты (R = H , алкил , арил ), которые могут быть как линейными, так и циклическими:
- n HO-CR 2 -X-CR 2 -OH + n COCl 2 → [-O-CR 2 -X-CR 2 -O-C(=O)-] n + 2 n HCl
Примером может служить реакция фосгена с бисфенолом А с образованием поликарбонатов . [8] Фосгенирование диаминов дает диизоцианаты, такие как толуолдиизоцианат (ТДИ), метилендифенилдиизоцианат (МДИ), гексаметилендиизоцианат (ГДИ) и изофорондиизоцианат (ИПДИ). В этих преобразованиях фосген используется в избытке, чтобы увеличить выход и минимизировать побочные реакции. Избыток фосгена отделяется во время переработки конечных продуктов и рециркулируется в процесс, при этом оставшийся фосген разлагается в воде с использованием активированного угля в качестве катализатора. Диизоцианаты являются предшественниками полиуретанов . В этих процессах используется более 90% фосгена, при этом крупнейшие производственные мощности расположены в США (Техас и Луизиана), Германии, Шанхае, Японии и Южной Корее. Наиболее важными производителями являются Dow Chemical , Covestro и BASF . Фосген также используется для производства моноизоцианатов, используемых в качестве предшественников пестицидов ( например, метилизоцианата (МИК).
Помимо широко используемых реакций, описанных выше, фосген также используется для получения ацилхлоридов из карбоновых кислот :
- R−C(=O)−OH + COCl 2 → R−C(=O)−Cl + HCl + CO 2
В этом случае тионилхлорид вместо фосгена обычно используется .
Лабораторное использование
[ редактировать ]Синтез изоцианатов из аминов иллюстрирует электрофильный характер этого реагента и его использование для введения эквивалентного синтона «CO». 2+ ": [18]
Такие реакции проводятся в лабораторном масштабе в присутствии такого основания, как пиридин , которое нейтрализует хлороводород побочный продукт .
Фосген используется для производства хлорформиатов, таких как бензилхлорформиат :
- R−OH + COCl 2 → R−O−C(=O)−Cl + HCl
В этих синтезах фосген используется в избытке, чтобы предотвратить образование соответствующего эфира карбоната .
С аминокислотами фосген (или его тример) реагирует с образованием N-карбоксиангидридов аминокислот . В более общем плане фосген связывает два нуклеофила карбонильной группой. Для этой цели альтернативы фосгену, такие как карбонилдиимидазол (CDI), более безопасны, хотя и дороги. [19] Сам CDI получают путем реакции фосгена с имидазолом .
Фосген хранят в металлических баллонах . В США выходное отверстие клапана баллона представляет собой коническую резьбу, известную как « CGA 160», которая используется только для фосгена.
Альтернативы фосгену
[ редактировать ]В исследовательских лабораториях из соображений безопасности фосген в настоящее время находит ограниченное применение в органическом синтезе . Были разработаны различные заменители, в частности трихлорметилхлорформиат (« дифосген »), жидкость при комнатной температуре, и бис (трихлорметил)карбонат (« трифосген »), кристаллическое вещество. [20]
Другие реакции
[ редактировать ]Фосген реагирует с водой с выделением хлористого водорода и углекислого газа :
- COCl 2 + H 2 O → CO 2 + 2 HCl
Аналогично при контакте с аммиаком он превращается в мочевину :
- COCl 2 + 4 NH 3 → CO(NH 2 ) 2 + 2 [NH 4 ]Cl
Обмен галогенидов с трифторидом азота и трибромидом алюминия дает КОФ 2 и COBr 2 соответственно. [8]
Химическая война
[ редактировать ]
Он внесен в Список 3 Конвенции по химическому оружию : Все производственные площадки, производящие более 30 тонн в год, должны быть задекларированы в ОЗХО . [21] Хотя фосген менее токсичен, чем многие другие виды химического оружия, такие как зарин , он по-прежнему считается жизнеспособным боевым химическим веществом из-за более простых требований к его производству по сравнению с требованиями к более технически совершенному химическому оружию, такому как табун первого поколения , нервно-паралитический агент . [22]
Впервые фосген был использован в качестве химического оружия французами в 1915 году во время Первой мировой войны. [23] Его также использовали в смеси с равным объемом хлора, при этом хлор помогал распространять более плотный фосген. [24] [25] Фосген был более мощным, чем хлор, хотя для проявления некоторых симптомов потребовалось 24 часа и более.
После широкого использования фосгена во время Первой мировой войны его запасы накопились в различных странах. [26] [27] [28]
Тогда фосген лишь изредка использовался Императорской японской армией против китайцев во время Второй китайско-японской войны . [29] IJA Газовое оружие, такое как фосген, производилось подразделением 731 .
Токсикология и безопасность
[ редактировать ]Фосген — коварный яд, поскольку его запах может быть незаметен, а симптомы могут проявляться медленно. [30]
Фосген в низких концентрациях может иметь приятный запах свежескошенного сена или зеленой кукурузы. [31] но его также описывали как сладкий, как гнилую банановую кожуру. Порог обнаружения запаха фосгена составляет 0,4 частей на миллион, что в четыре раза превышает пороговое предельное значение (средневзвешенное по времени). Его высокая токсичность обусловлена действием фосгена на −Ой , −NH 2 и -SH- группы белков в легочных альвеолах (место газообмена), образующие соответственно сложноэфирные, амидные и тиоэфирные функциональные группы в соответствии с реакциями, обсуждавшимися выше. Это приводит к нарушению гематовоздушного барьера , что в конечном итоге приводит к отеку легких . Степень повреждения альвеол в первую очередь не зависит от концентрации фосгена во вдыхаемом воздухе, причем решающим фактором является доза (количество вдыхаемого фосгена). [32] Дозу можно приблизительно рассчитать как «концентрация» × «продолжительность воздействия». [32] [33] Поэтому люди на рабочих местах, где существует риск случайного выброса фосгена, обычно носят индикаторные значки близко к носу и рту. [34] На таких значках указана приблизительная ингаляционная доза, которая позволяет немедленно начать лечение, если контролируемая доза превысит безопасные пределы. [34]
В случае низкого или умеренного количества вдыхаемого фосгена за пострадавшим следует наблюдать и подвергать его профилактической терапии, а затем отпустить через несколько часов. При более высоких дозах ингаляционного фосгена (более 150 ppm × мин) часто развивается отек легких , который можно обнаружить с помощью рентгенографии и регрессивной концентрации кислорода в крови . Вдыхание таких высоких доз может в конечном итоге привести к летальному исходу в течение нескольких часов или 2–3 дней после воздействия.
Риск, связанный с вдыханием фосгена, основан не столько на его токсичности (которая намного ниже по сравнению с современным химическим оружием, таким как зарин или табун ), сколько на его типичных эффектах: у пострадавшего человека могут не проявляться никакие симптомы в течение нескольких часов, пока не появляется отек, и в этот момент может быть уже слишком поздно лечиться. [35] Почти все смертельные случаи в результате случайных выбросов при промышленном обращении с фосгеном произошли именно таким образом. С другой стороны, отек легких, лечение которого проводится своевременно, обычно проходит в среднесрочной и долгосрочной перспективе, без серьезных последствий, по прошествии нескольких дней или недель после воздействия. [36] [37] Тем не менее, не следует игнорировать пагубное воздействие на здоровье легочной функции в результате нелеченного хронического воздействия низких уровней фосгена; хотя они и не подвергались воздействию достаточно высоких концентраций, чтобы немедленно вызвать отек, многие химики-синтетики ( например, Леонидас Зервас ), работавшие с этим соединением, как сообщалось, испытывали хронические проблемы со здоровьем дыхательных путей и, в конечном итоге, дыхательную недостаточность из-за постоянного воздействия низких уровней.
Если случайный выброс фосгена происходит в промышленных или лабораторных условиях, его можно смягчить с помощью аммиака газообразного ; в случае разлива жидкости ( например , дифосгена или растворов фосгена) можно применить абсорбент и карбонат натрия. [38]
Несчастные случаи
[ редактировать ]- Первый крупный инцидент, связанный с фосгеном, произошел в мае 1928 года, когда одиннадцать тонн фосгена вырвались из склада военных излишков в центре Гамбурга . [39] Отравились триста человек, из них десять умерли. [39]
- Во второй половине 20-го века в Европе, Азии и США произошло несколько смертельных инцидентов, связанных с фосгеном. Большинство из них были расследованы властями, и результаты стали доступны общественности. Например, первоначально обвиняли в катастрофе в Бхопале фосген , но расследование доказало, что метилизоцианат ответственен за многочисленные отравления и смертельные случаи.
- Последние крупные инциденты произошли в январе 2010 года и мае 2016 года. В 2010 году в результате случайного выброса фосгена на предприятии DuPont в Западной Вирджинии погиб один сотрудник. [40] Совет по химической безопасности США опубликовал видео с подробным описанием аварии. [41] произошла утечка фосгена Шесть лет спустя на заводе BASF в Южной Корее , где подрядчик вдохнул смертельную дозу фосгена. [42]
- Крушение поезда в Огайо в 2023 году : грузовой поезд с винилхлоридом сошел с рельсов и сгорел в Восточной Палестине, штат Огайо были выброшены фосген и хлористый водород , в результате чего в воздух , а река Огайо загрязнилась . [43]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Индекс Merck , 11-е издание, 7310 .
- ^ Номенклатура органической химии: рекомендации ИЮПАК и предпочтительные названия 2013 г. (Синяя книга) . Кембридж: Королевское химическое общество . 2014. с. 798. doi : 10.1039/9781849733069-FP001 (неактивен 9 мая 2024 г.). ISBN 978-0-85404-182-4 .
{{cite book}}: CS1 maint: DOI неактивен по состоянию на май 2024 г. ( ссылка ) - ^ Перейти обратно: а б с д и Карманный справочник NIOSH по химическим опасностям. «#0504» . Национальный институт охраны труда и здоровья (NIOSH).
- ^ «ФОСГЕН (цилиндр)» . Inchem (Информация о химической безопасности от межправительственных организаций) . Международная программа по химической безопасности и Европейская комиссия.
- ^ Перейти обратно: а б с Запись о фосгене в базе данных веществ GESTIS Института безопасности и гигиены труда , доступ осуществлен 16 марта 2021 г.
- ^ Перейти обратно: а б «Фосген» . Непосредственно опасные для жизни и здоровья концентрации (IDLH) . Национальный институт охраны труда и здоровья (NIOSH).
- ^ CBRNE - Агенты, повреждающие легкие, Фосген, 27 мая 2009 г.
- ^ Перейти обратно: а б с д и ж Вольфганг Шнайдер; Вернер Диллер. «Фосген». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a19_411 . ISBN 978-3527306732 .
- ^ Наката, М.; Кохата, К.; Фукуяма, Т.; Кучицу, К. (1980). «Молекулярная структура фосгена, изученная методами газовой электронографии и микроволновой спектроскопии. Структура r z и изотопный эффект». Журнал молекулярной спектроскопии . 83 : 105–117. дои : 10.1016/0022-2852(80)90314-8 .
- ^ Гоуленд, Ричард (1996). «Применение более безопасных концепций к приобретению завода по производству фосгена». Прогресс в области технологической безопасности . 15 (1): 52–57. дои : 10.1002/прс.680150113 . S2CID 110707551 .
- ^ Перейти обратно: а б Сингх, Ханвант Бир (декабрь 1976 г.). «Фосген в атмосферном воздухе». Природа . 264 (5585): 428–429. Бибкод : 1976Natur.264..428S . дои : 10.1038/264428a0 . ПМИД 1004568 . S2CID 4209599 .
- ^ Фу, Децзянь; Бун, Крис Д.; Бернат, Питер Ф.; Уокер, Кейли А.; Нассар, Рэй; Мэнни, Глория Л.; Маклеод, Шон Д. (14 сентября 2007 г.). «Глобальные наблюдения за фосгеном в рамках миссии «Атмосферный химический эксперимент (ACE)» . Письма о геофизических исследованиях . 34 (17): L17815. Бибкод : 2007GeoRL..3417815F . дои : 10.1029/2007GL029942 . S2CID 44164908 .
- ^ Киндлер, Т.П.; Хамидес, WL; Вино, PH; Каннольд, DM; Алия, ФН; Франклин, Дж. А. (20 января 1995 г.). «Судьба атмосферного фосгена и содержание в стратосфере хлора его исходных соединений: CCl 4, C 2 Cl 4, C 2 HCl 3, CH 3 CCl 3 и CHCl 3». Журнал геофизических исследований: Атмосфера . 100 (Д1): 1235–1251. Бибкод : 1995JGR...100.1235K . дои : 10.1029/94JD02518 .
- ^ Перейти обратно: а б Берк, Роберт (6 ноября 2007 г.). Противопожарная защита: системы и реагирование . ЦРК Пресс. п. 209. ИСБН 978-0-203-48499-9 .
- ^ Филднер, AC; Кац, С.Х.; Кинни, СП; Лонгфелло, ES (1 октября 1920 г.). «Ядовитые газы из четыреххлоруглеродных огнетушителей» . Журнал Института Франклина . 190 (4): 543–565. дои : 10.1016/S0016-0032(20)91494-1 . Проверено 3 февраля 2022 г.
- ^ Пол, Лэнс Р.; Бхушан, Б.; Уиттакер, Ноэль Ф.; Кришна, Гопал (декабрь 1977 г.). «Фосген: метаболит хлороформа». Связь с биохимическими и биофизическими исследованиями . 79 (3): 684–691. дои : 10.1016/0006-291X(77)91166-4 . ПМИД 597296 .
- ^ Джон Дэви (1812 г.). «О газообразном соединении оксида углерода и хлора» . Философские труды Лондонского королевского общества . 102 : 144–151. дои : 10.1098/rstl.1812.0008 . JSTOR 107310 . Фосген был назван на с. 151: «...нужно будет обозначить его каким-нибудь простым именем. Я рискну предложить название фосгена, или фосгенного газа; от φως , свет, γινομαι , производить, что означает образованный светом; ...»
- ^ Р.Л. Шрайнер, У.Х. Хорн и РФБ Кокс (1943). «п-нитрофенил изоцианат» . Органические синтезы
{{cite journal}}: CS1 maint: multiple names: authors list (link); Сборник томов , т. 2, с. 453 . - ^ Биджи, Франка; Магги, Раймондо; Сартори, Джованни (2000). «Избранные синтезы мочевины через заменители фосгена». Зеленая химия . 2 (4): 140–148. дои : 10.1039/B002127J .
- ^ «Фосген» Хэмли, П. Энциклопедия реагентов для органического синтеза , 2001 Джон Уайли, Нью-Йорк. дои : 10.1002/047084289X.rp149
- ^ Приложение по внедрению и проверке («Приложение по проверке»). Архивировано 15 мая 2006 г. в Wayback Machine .
- ^ https://itportal.decc.gov.uk/cwc_files/S2AAD_guidance.pdf . Архивировано 4 марта 2016 г. в Wayback Machine .
- ^ Най, Мэри Джо (1999). До большой науки: занятия современной химией и физикой, 1800–1940 гг . Издательство Гарвардского университета. п. 193. ИСБН 0-674-06382-1 .
- ^ Персонал (2004). «Агент удушья: CG» . CBWИнфо. Архивировано из оригинала 18 февраля 2006 г. Проверено 30 июля 2007 г.
- ^ Кистер, Эдвин; и др. (2007). Неполная история Первой мировой войны . Том. 1. Книги Мердока. п. 74. ИСБН 978-1-74045-970-9 .
- ↑ Призрачная война Базы раскрывает свои тайны , Литгоу Меркьюри , 08.07.2008
- ↑ Химическая война оставила свое наследие. Архивировано 5 декабря 2008 г. в Wayback Machine , Литгоу-Меркурий , 09.09.2008.
- ↑ Химические бомбы находятся в нескольких метрах от семей Литгоу в течение 60 лет , The Daily Telegraph , 22 сентября 2008 г.
- ^ Юки Танака, «Ядовитый газ, история, которую Япония хотела бы забыть», Бюллетень ученых-атомщиков , октябрь 1988 г., стр. 16–17.
- ^ Борак Дж.; Диллер В.Ф. (2001). «Воздействие фосгена: механизмы повреждения и стратегии лечения». Журнал профессиональной и экологической медицины . 43 (2): 110–9. дои : 10.1097/00043764-200102000-00008 . ПМИД 11227628 . S2CID 41169682 .
- ^ CDC (31 августа 2023 г.). «Факты о фосгене» . Emergency.cdc.gov . Проверено 28 июня 2024 г.
- ^ Перейти обратно: а б Вернер Ф. Диллер, Ранняя диагностика чрезмерного воздействия фосгена. Токсикология и промышленное здоровье, Том 1, № 2, апрель 1985 г., стр. 73 -80
- ^ В. Ф. Диллер, Р. Занте: Zentralbl. Профессиональная Мед. Профилактика охраны труда. Эргон. 32, (1982) 60 -368
- ^ Перейти обратно: а б В.Ф.Диллер, Э. Дропе, Э. Райхольд: Бер. Межд. разговорный. Профилактика несчастных случаев на производстве и профессиональных заболеваний Хим. 6-й (1979) Хим. 92 (1980) 168366x
- ^ В. Ф. Диллер: Радиологические исследования для улучшения ранней диагностики промышленных ингаляционных отравлений с отсроченным началом, Verlag für Medizin Dr. Э. Фишер, Гейдельберг. Главное управление медицины труда, безопасности труда и эргономики, № 3, май 2013 г., с. 160 - 163
- ^ В. Ф. Диллер, Ф. Шнельбахер, Ф. Вюстефельд: Zentralbl. Профессиональная Мед. Профилактика охраны труда. 29 (1979) с.5-16
- ^ Результаты общеотраслевого наблюдения за фосгеном в США «Реестр Диллера»: Journal of Occ. и окр. Мед., март 2011 г.-Т.53-вып. 3 с.239- 244
- ^ «Фосген: Руководство по охране труда и технике безопасности» . Международная программа по химической безопасности . 1998.
- ^ Перейти обратно: а б Райан, Т. Энтони (1996). Фосген и родственные карбонилгалогениды . Эльзевир. стр. 154–155 . ISBN 0444824456 .
- ^ «Выбросы токсичных химических веществ DuPont Corporation | CSB» .
- ^ Фатальное разоблачение: трагедия в DuPont , 22 сентября 2011 г. , получено 2 июля 2021 г.
- ^ Архивировано в Ghostarchive и Wayback Machine : «Смертельное разоблачение: трагедия в DuPont» . Ютуб . 22 сентября 2011 г.
- ^ «Катастрофа в Огайо — это тревожный сигнал об опасностях смертоносных сходов поездов» . Хранитель . 11 февраля 2023 года. Архивировано из оригинала 13 февраля 2023 года . Проверено 13 февраля 2023 г.
Внешние ссылки
[ редактировать ]- Отчет Дэви об открытии фосгена
- Международная карта химической безопасности 0007
- CDC - Фосген - Тема NIOSH по безопасности и гигиене труда на рабочем месте
- Карманный справочник NIOSH по химическим опасностям
- Центр по контролю и профилактике заболеваний США: готовность и реагирование на чрезвычайные ситуации
- Рекомендуемые уровни острого воздействия Агентства по охране окружающей среды США
- Режим для химикатов Списка 3 и объектов, связанных с такими химикатами , веб-сайт ОЗХО
- Веб-сайт CBWInfo
- Использование фосгена во Второй мировой войне и в современной войне
- Видео Совета по химической безопасности США о случайном выбросе на заводе DuPont в Западной Вирджинии
