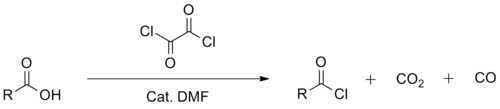Оксалилхлорид
| |||
| |||

| |||
| Имена | |||
|---|---|---|---|
| Предпочтительное название ИЮПАК
Оксалил дихлорид [ 1 ] | |||
| Систематическое название ИЮПАК
Этандиоил дихлорид [ 1 ] | |||
Другие имена
| |||
| Идентификаторы | |||
3D model ( JSmol )
|
|||
| ХимическийПаук | |||
| Информационная карта ECHA | 100.001.092 | ||
| Номер ЕС |
| ||
ПабХим CID
|
|||
| номер РТЭКС |
| ||
| НЕКОТОРЫЙ | |||
Панель управления CompTox ( EPA )
|
|||
| Характеристики | |||
| С 2 О 2 Cl 2 | |||
| Молярная масса | 126.92 g·mol −1 | ||
| Появление | Бесцветная жидкость | ||
| Запах | Фосгеноподобный [ 2 ] | ||
| Плотность | 1,4785 г/мл | ||
| Температура плавления | −16 ° C (3 ° F; 257 К) | ||
| Точка кипения | От 63 до 64 °C (от 145 до 147 °F; от 336 до 337 К) при 1,017 бар | ||
| Реагирует | |||
Показатель преломления ( n D )
|
1.429 | ||
| Опасности | |||
| Безопасность и гигиена труда (OHS/OSH): | |||
Основные опасности
|
Токсичное, едкое, слезоточивое. [ 3 ] | ||
| СГС Маркировка : | |||
  [ 3 ] [ 3 ]
| |||
| Опасность [ 3 ] | |||
| Х314 , Х331 [ 3 ] | |||
| П261 , П280 , П305+П351+П338 , П310 [ 3 ] | |||
| NFPA 704 (огненный алмаз) | |||
| Паспорт безопасности (SDS) | Внешний паспорт безопасности материалов | ||
| Родственные соединения | |||
Родственные ацилхлориды
|
|||
Родственные соединения
|
|||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |||
Оксалилхлорид — органическое химическое формулы соединение Cl-C(=O)-C(=O)-Cl . Эта бесцветная жидкость с резким запахом — диацилхлорид щавелевой — кислоты полезный реагент в органическом синтезе . [ 4 ]
Подготовка
[ редактировать ]Оксалилхлорид был впервые получен в 1892 году французским химиком Адрианом Фоконье, который провел реакцию диэтилоксалата с пентахлоридом фосфора. [ 5 ] Его также можно получить обработкой щавелевой кислоты пентахлоридом фосфора . [ 6 ]
Оксалилхлорид производится в промышленных масштабах из этиленкарбоната . Фотохлорирование дает перхлорэтиленкарбонат. C 2 Cl 4 O 2 CO и хлороводород HCl, который впоследствии разлагается до оксалилхлорида и фосгена. COCl 2 : [ 7 ]
- C 2 H 4 O 2 CO + 4 Cl 2 → C 2 Cl 4 O 2 CO + 4 HCl
- C 2 Cl 4 O 2 CO → C 2 O 2 Cl 2 + COCl 2
Реакции
[ редактировать ]Оксалилхлорид реагирует с водой с выделением только газообразных продуктов: хлористого водорода (HCl), углекислого газа ( CO 2 ) и окись углерода (CO).
- (COCl) 2 + H 2 O → 2 HCl + CO 2 + CO
В этом он сильно отличается от других ацилхлоридов , которые гидролизуются с образованием хлористого водорода и исходной карбоновой кислоты .
Применение в органическом синтезе
[ редактировать ]Окисление спиртов
[ редактировать ]Раствор, содержащий ДМСО и оксалилхлорид, с последующим гашением триэтиламином, превращает спирты в соответствующие альдегиды и кетоны посредством процесса, известного как окисление Сверна . [ 8 ] [ 9 ] [ 10 ]
Синтез ацилхлоридов
[ редактировать ]Оксалилхлорид применяют главным образом вместе с N , N -диметилформамидным катализатором в органическом синтезе для получения ацилхлоридов из соответствующих карбоновых кислот . Как и тионилхлорид , в этом применении реагент разлагается на летучие побочные продукты, что упрощает обработку. Один из второстепенных побочных продуктов N , N реакции, катализируемой -диметилформамидом, диметилкарбамоилхлорид , является сильным канцерогеном, возникающим в результате разложения N , N -диметилформамида. [ 11 ] [ 12 ] По сравнению с тионилхлоридом оксалилхлорид является более мягким и селективным реагентом . Он также дороже, чем тионилхлорид , поэтому его обычно используют в меньших масштабах.
Эта реакция включает превращение N , N -диметилформамида в производное имидоилхлорида (ион хлорметилен(диметил)аммония). (СН 3 ) 2 Н + =CHCl ), что соответствует первой стадии реакции Вильсмайера-Хаака . Активным хлорирующим агентом является имидоилхлорид.
Формилирование аренов
[ редактировать ]Оксалилхлорид реагирует с ароматическими соединениями в присутствии хлорида алюминия с образованием соответствующего ацилхлорида в процессе, известном как ацилирование Фриделя-Крафтса . [ 13 ] [ 14 ] Полученный ацилхлорид может быть гидролизован с образованием соответствующей карбоновой кислоты .
Получение диэфиров оксалата
[ редактировать ]Как и другие ацилхлориды, оксалилхлорид реагирует со спиртами с образованием сложных эфиров:
- 2 R-CH 2 -OH + Cl-C(=O)-C(=O)Cl → R-CH 2 -O-C(=O)-C(=O)-O-CH 2 -R + 2 HCl
Обычно такие реакции проводятся в присутствии такого основания, как пиридин . Диэфир, полученный из фенола , фенилоксалатный эфир , представляет собой циалум, активный ингредиент светящихся палочек .
Другой
[ редактировать ]Сообщается, что оксалилхлорид использовался при первом синтезе диоксантетракетона ( C 4 O 6 ), оксид углерода . [ 15 ]
Меры предосторожности
[ редактировать ]В марте 2000 года Malaysia Airlines самолет Airbus A330-300 груз запрещенного оксалилхлорида (ложно заявленного как гидроксихинолин ). был поврежден и не подлежал ремонту после того, как в грузовой отсек просочился [ 16 ] Он токсичен при вдыхании, хотя он более чем на порядок менее токсичен, чем родственное соединение фосген . [ 17 ]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а б Номенклатура органической химии: рекомендации ИЮПАК и предпочтительные названия 2013 г. (Синяя книга) . Кембридж: Королевское химическое общество . 2014. с. 797. doi : 10.1039/9781849733069-FP001 (неактивен 29 июня 2024 г.). ISBN 978-0-85404-182-4 .
{{cite book}}: CS1 maint: DOI неактивен по состоянию на июнь 2024 г. ( ссылка ) - ^ Оксалилхлорид: запах
- ^ Jump up to: а б с д и Оксалилхлорид, MSDS
- ^ Салмон, Р. (2001). «Оксалилхлорид». Энциклопедия реагентов для органического синтеза . Нью-Йорк: Джон Уайли и сыновья. дои : 10.1002/047084289X.ro015 . ISBN 0471936235 .
- ^ Фальконье, Адриан (1892). «Действие перхлорида фосфора на этилоксалат» [Действие пентахлорида фосфора на диэтилоксалат]. Еженедельные отчеты сессий Академии наук (на французском языке). 114 : 122–123.
- ^ патент DE 2840435 , Фогель А.; Стеффан, Г.; Маннес, К.; Трешер, В., «Способ получения оксалилхлорида», выпущено 27 марта 1980 г., передано компании Bayer.
- ^ Пфоертнер, Карл-Хайнц (2000). «Фотохимия». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a19_573 . ISBN 3527306730 .
- ^ Дондони, А.; Перроне, Д. (2004). «Синтез 1,1-диметилэтил-( S )-4-формил-2,2-диметил-3-оксазолидинкарбоксилата окислением спирта» . Органические синтезы ; Сборник томов , т. 10, с. 320 .
- ^ Бишоп, Р. (1998). «9-Тиабицикло[3.3.1]нонан-2,6-дион» . Органические синтезы ; Сборник томов , т. 9, с. 692 .
- ^ Леопольд, Э.Дж. (1990). «Селективное гидроборирование 1,3,7-триена: гомогераниол» . Органические синтезы ; Сборник томов , т. 7, с. 258 .
- ^ Клейден, Джонатан (2005). Органическая химия (Перепечатано (с исправлениями) под ред.). Оксфорд [ua]: Oxford Univ. Нажимать. стр. 296 . ISBN 978-0-19-850346-0 .
- ^ Левин, Д. (1997). «Потенциальные токсикологические проблемы, связанные с хлорированием карбоновой кислоты и другими реакциями». Исследования и разработки органических процессов . 1 (2). Американское химическое общество : 182. doi : 10.1021/op970206t .
- ^ Нойберт, Мэн; Фишел, Д.Л. (1983). «Получение 4-алкил- и 4-галогенбензоилхлоридов: 4-пентилбензоилхлорид» . Органические синтезы . 61 :8 ; Сборник томов , т. 7, с. 420 .
- ^ Сокол, ЧП (1964). «Мезитоевая кислота» . Органические синтезы . 44:69 ; Сборник томов , т. 5, с. 706 .
- ^ Страццолини, П.; Гамби, А.; Джуманини, АГ; Ванчик, Х. (1998). «Реакция между этандиоил (оксалил) дигалогенидами и Ag 2 C 2 O 4 : путь к неуловимому ангидриду этандиовой (щавелевой) кислоты Штаудингера». Журнал Химического общества, Perkin Transactions 1 . 1998 (16): 2553–2558. дои : 10.1039/a803430c .
- ^ "Фирма обязала выплатить $65 млн за разрушение самолета" . Рейтер . 06.12.2007 . Проверено 6 декабря 2007 г.
- ^ Барби, С.Дж.; Стоун, Джей-Джей; Хиласки, Р.Дж. (январь 1995 г.). «Острая ингаляционная токсикология оксалилхлорида». Журнал Американской ассоциации промышленной гигиены . 56 (1): 74–76. дои : 10.1080/15428119591017358 . ISSN 0002-8894 . ПМИД 7872205 .