Хлороводород
| |||
| Имена | |||
|---|---|---|---|
| Название ИЮПАК Хлороводород [1] | |||
| Систематическое название ИЮПАК Хлоран [2] | |||
| Другие имена Солянокислый газ Соляный газ гидрохлорид | |||
| Идентификаторы | |||
3D model ( JSmol ) | |||
| 1098214 | |||
| ЧЭБИ | |||
| ЧЕМБЛ | |||
| ХимическийПаук | |||
| Информационная карта ECHA | 100.028.723 | ||
| Номер ЕС |
| ||
| 322 | |||
| КЕГГ | |||
| МеШ | Соляная+кислота | ||
ПабХим CID | |||
| номер РТЭКС |
| ||
| НЕКОТОРЫЙ | |||
| Число | 1050 | ||
Панель управления CompTox ( EPA ) | |||
| Характеристики | |||
| HCl | |||
| Молярная масса | 36.46 g/mol | ||
| Появление | Бесцветный газ | ||
| Запах | острый; острый и жгучий | ||
| Плотность | 1,49 г/л [3] | ||
| Температура плавления | -114,22 ° C (-173,60 ° F; 158,93 К) | ||
| Точка кипения | -85,05 ° C (-121,09 ° F; 188,10 К) | ||
| 823 г/л (0 °С) 720 г/л (20 °С) 561 г/л (60 °С) | |||
| Растворимость | растворим в метаноле , этаноле , эфире и воде | ||
| Давление пара | 4352 кПа (при 21,1 °С) [4] | ||
| Кислотность ( pKa ) | −3.0; [5] −5.9 (±0.4) [6] | ||
| Основность (p K b ) | 17.0 | ||
| Конъюгатная кислота | хлороний | ||
| Сопряженная база | Хлористый | ||
Показатель преломления ( n D ) | 1.0004456 (газ) 1,254 (жидкость) | ||
| Вязкость | 0,311 сП (-100 ° С) | ||
| Структура | |||
| линейный | |||
| 1,05 Д | |||
| Термохимия | |||
Теплоемкость ( С ) | 0,7981 Дж/(К·г) | ||
Стандартный моляр энтропия ( S ⦵ 298 ) | 186,902 Дж/(К·моль) | ||
Стандартная энтальпия образование (Δ f H ⦵ 298 ) | −92,31 кДж/моль | ||
Стандартная энтальпия горение (Δ c H ⦵ 298 ) | −95,31 кДж/моль | ||
| Фармакология | |||
| A09AB03 ( ВОЗ ) B05XA13 ( ВОЗ ) | |||
| Опасности | |||
| Безопасность и гигиена труда (OHS/OSH): | |||
Основные опасности | Токсичный, коррозионный | ||
| СГС Маркировка : | |||
  | |||
| Опасность | |||
| Х280 , Х314 , Х331 | |||
| П261 , П280 , П305+П351+П338 , П310 , П410+П403 | |||
| NFPA 704 (огненный алмаз) | |||
| Летальная доза или концентрация (LD, LC): | |||
ЛД 50 ( средняя доза ) | 238 мг/кг (крыса, перорально) | ||
ЛК 50 ( средняя концентрация ) | 3124 частей на миллион (крыса, 1 час ) 1108 частей на миллион (мышь, 1 час) [8] | ||
LC Lo ( самый низкий из опубликованных ) | 1300 ppm (человек, 30 мин ) 4416 ppm (кролик, 30 мин) 4416 ppm (морская свинка, 30 мин) 3000 частей на миллион (человек, 5 мин) [8] | ||
| NIOSH (пределы воздействия на здоровье в США): | |||
МЕХ (Допускается) | C 5 ppm (7 мг/м 3 ) [7] | ||
РЕЛ (рекомендуется) | C 5 ppm (7 мг/м 3 ) [7] | ||
IDLH (Непосредственная опасность) | 50 частей на миллион [7] | ||
| Паспорт безопасности (SDS) | Джей Ти Бейкер Паспорт безопасности | ||
| Родственные соединения | |||
Родственные соединения | фтороводород Бромистый водород Йодоводород Астатид водорода | ||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |||
Соединение хлористый водород имеет химическую формулу HCl и как таковой является галогеноводородом . При комнатной температуре представляет собой бесцветный газ , образующий атмосферы белые пары соляной кислоты при контакте с водяными парами . Газообразный хлороводород и соляная кислота имеют важное значение в технике и промышленности. Соляная кислота, водный раствор хлористого водорода, также обычно имеет формулу HCl.
Реакции
[ редактировать ]
Хлороводород — двухатомная молекула , состоящая из водорода атома H и атома хлора Cl, соединенных полярной ковалентной связью . Атом хлора гораздо более электроотрицательен , чем атом водорода, что делает эту связь полярной. Следовательно, молекула имеет большой дипольный момент с отрицательным парциальным зарядом (δ−) на атоме хлора и положительным парциальным зарядом (δ+) на атоме водорода. [9] Частично из-за своей высокой полярности HCl хорошо растворим в воде (и других полярных растворителях ).
При контакте, H 2 O и HCl объединяются, образуя гидроксония. катионы [ Н3О ] + и хлорид- анионы кл. − в результате обратимой химической реакции :
- HCl + H 2 O → [H 3 O] + + Cl −
Полученный раствор называется соляной кислотой и является сильной кислотой . Константа кислотной диссоциации или ионизации K a велика, что означает, что HCl практически полностью диссоциирует или ионизируется в воде. Даже в отсутствие воды хлористый водород может действовать как кислота. Например, хлористый водород может растворяться в некоторых других растворителях, таких как метанол :
- HCl + CH 3 OH → [CH 3 OH 2 ] + + Cl −
Хлороводород может протонировать молекулы или ионы, а также может служить кислотным катализатором химических реакций, где желательны безводные (безводные) условия.
Из-за своей кислой природы хлористый водород является коррозионным веществом , особенно в присутствии влаги.
Структура и свойства
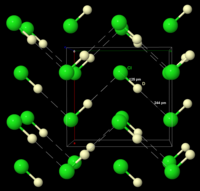
[ редактировать ]Замороженный HCl претерпевает фазовый переход при 98,4 К. Порошковая рентгеновская дифракция замороженного материала показывает, что структура материала меняется от ромбической к кубической во время этого перехода . В обеих структурах атомы хлора расположены в гранецентрированном массиве . Однако атомы водорода обнаружить не удалось. [10] Анализ спектроскопических и диэлектрических данных, а также определение структуры DCl (хлорида дейтерия) показывают, что HCl образует в твердом теле зигзагообразные цепочки, как и HF (см. рисунок справа). [11]
| Температура (°С) | 0 | 20 | 30 | 50 |
|---|---|---|---|---|
| Вода | 823 | 720 | 673 | 596 |
| Метанол | 513 | 470 | 430 | |
| Этанол | 454 | 410 | 381 | |
| Эфир | 356 | 249 | 195 |


Инфракрасный спектр газообразного хлористого водорода, показанный слева, состоит из ряда резких линий поглощения, сгруппированных около 2886 см. −1 (длина волны ~3,47 мкм). При комнатной температуре почти все молекулы находятся в основном колебательном состоянии v = 0. С учетом ангармонизма колебательную энергию можно записать как.
Чтобы перевести молекулу HCl из состояния v = 0 в состояние v = 1, мы ожидаем увидеть инфракрасное поглощение около ν o = ν e + 2 x e ν e = 2880 см. −1 . Однако это поглощение, соответствующее Q-ветви, не наблюдается, поскольку оно запрещено симметрией. Вместо этого наблюдаются два набора сигналов (P- и R-ветви) вследствие одновременного изменения вращательного состояния молекул. Из-за квантово-механических правил отбора разрешены только определенные вращательные переходы. Состояния характеризуются вращательным квантовым числом J = 0, 1, 2, 3, ... правила отбора гласят, что Δ J может принимать только значения ±1.
Значение вращательной постоянной B намного меньше колебательной ν o , так что для вращения молекулы требуется гораздо меньшее количество энергии; для типичной молекулы это лежит в микроволновой области. Однако колебательная энергия молекулы HCl помещает ее поглощение в инфракрасную область, что позволяет легко получить спектр, показывающий колебательно-колебательные переходы этой молекулы, с помощью инфракрасного спектрометра с газовой ячейкой. Последний может быть изготовлен даже из кварца, поскольку поглощение HCl лежит в окне прозрачности для этого материала.
В природе широко распространен хлор, состоящий из двух изотопов: 35 кл и 37 Cl, в соотношении примерно 3:1. Хотя жесткость пружины почти идентична, несопоставимые приведенные массы H 35 Cl и H 37 Cl вызывает измеримые различия в энергии вращения, поэтому при внимательном рассмотрении каждой линии поглощения наблюдаются дублеты, взвешенные в том же соотношении 3:1.
Производство
[ редактировать ]Большая часть хлористого водорода, производимого в промышленных масштабах, используется для производства соляной кислоты . [13]
Исторические маршруты
[ редактировать ]В 17 веке Иоганн Рудольф Глаубер из Карлштадта-на-Майне, Германия, использовал хлорид натрия и серную кислоту для получения сульфата натрия в Мангеймском процессе , выделяя хлористый водород. Джозеф Пристли из Лидса, Англия, получил чистый хлористый водород в 1772 году. [14] а к 1808 году Хамфри Дэви из Пензанса, Англия, доказал, что химический состав включает водород и хлор . [15]
Прямой синтез
[ редактировать ]Хлороводород получают соединением хлора и водорода :
- Cl 2 + H 2 → 2 HCl
Поскольку реакция экзотермическая , установка называется HCl- печью или HCl-горелкой. Образующийся газообразный хлористый водород абсорбируется , деионизированной водой в результате чего образуется химически чистая соляная кислота. Эта реакция может дать очень чистый продукт, например, для использования в пищевой промышленности.
Реакцию также может вызвать синий свет. [16]
Органический синтез
[ редактировать ]Промышленное производство хлористого водорода часто сопряжено с образованием хлорированных и фторированных органических соединений, например тефлона , фреона и других ХФУ , а также хлоруксусной кислоты и ПВХ . Часто производство соляной кислоты совмещается с ее использованием на месте. В химических реакциях водорода атомы в углеводороде заменяются атомами хлора, после чего высвободившийся атом водорода рекомбинируется с запасным атомом молекулы хлора, образуя хлористый водород. Фторирование - это последующая реакция замещения хлора, в результате которой снова образуется хлористый водород:
- RH + Cl 2 → RCl + HCl
- RCl + HF → RF + HCl
Полученный хлористый водород либо используется повторно напрямую, либо абсорбируется водой, в результате чего получается соляная кислота технической или промышленной чистоты.
Лабораторные методы
[ редактировать ]Небольшие количества хлористого водорода для лабораторного использования можно получить в генераторе HCl путем обезвоживания соляной кислоты серной кислотой или безводным хлоридом кальция . Альтернативно, HCl может быть получен реакцией серной кислоты с хлоридом натрия: [17]
- NaCl + H 2 SO 4 → NaHSO 4 + HCl
Эта реакция происходит при комнатной температуре. Если в генераторе остался NaCl и он нагрет выше 200 °С, реакция идет дальше:
- NaCl + NaHSO 4 → HCl + Na 2 SO 4
Для работы таких генераторов реагенты должны быть сухими.
Хлороводород также можно получить гидролизом некоторых реакционноспособных хлоридных соединений, таких как хлориды фосфора , тионилхлорид ( SOCl 2 ) и ацилхлориды . Например, холодную воду можно постепенно капать на пентахлорид фосфора ( PCl 5 ) с получением HCl:
- PCl 5 + H 2 O → POCl 3 + 2 HCl
Приложения
[ редактировать ]Большая часть хлористого водорода расходуется на производство соляной кислоты. Он также используется в производстве винилхлорида и многих алкилхлоридов . [13] Трихлорсилан , предшественник сверхчистого кремния, производится в результате реакции хлористого водорода и кремния при температуре около 300 °C. [18]
- Si + 3 HCl → HSiCl 3 + H 2
История
[ редактировать ]Около 900 г. авторы арабских сочинений, приписываемых Джабиру ибн Хайяну (лат. Гебер) и персидскому врачу и алхимику Абу Бакру ар-Рази (ок. 865–925, латынь: Разес) экспериментировали с нашатырным спиртом ( хлоридом аммония ). , который при перегонке вместе с купоросом (гидратными сульфатами различных металлов) давал хлороводород. [19] Возможно, что в одном из своих экспериментов ар-Рази наткнулся на примитивный метод получения соляной кислоты . [20] Однако оказывается, что в большинстве этих ранних экспериментов с хлоридными солями газообразные продукты отбрасывались, а хлористый водород мог производиться много раз, прежде чем было обнаружено, что его можно использовать в химических целях. [21]
Одним из первых таких применений был синтез хлорида ртути (II) (коррозионного сулема), получение которого путем нагрева ртути либо с квасцами и хлоридом аммония, либо с купоросом и хлоридом натрия, было впервые описано в . De aluminibus et salibus («De aluminibus et salibus» («De aluminibus et salibus») О квасцах и солях»), арабский текст одиннадцатого или двенадцатого века, ошибочно приписываемый Абу Бакру ар-Рази и переведенный на латынь Герардом Кремонским (1144–1187). [22]
Другим важным достижением стало открытие псевдо-Гебером (в книге De Invente Veritatis , «Об открытии истины», около 1300 г.), что при добавлении хлорида аммония к азотной кислоте образуется сильный растворитель, способный растворять золото (т. е. вода regia ) могут быть произведены. [23]
После открытия в конце шестнадцатого века способа несмешанной соляной кислоты , получения [24] Было признано, что эта новая кислота (тогда известная как соляной спирт или acidum salis ) выделяла парообразный хлористый водород, который назывался морским кислотным воздухом . В 17 веке Иоганн Рудольф Глаубер использовал соль ( хлорид натрия ) и серную кислоту для приготовления сульфата натрия , выделяя газообразный хлористый водород (см. производство выше). В 1772 году Карл Вильгельм Шееле также сообщил об этой реакции, и ему иногда приписывают ее открытие. Джозеф Пристли получил хлористый водород в 1772 году, а в 1810 году Хэмфри Дэви установил, что он состоит из водорода и хлора . [25]
Во время промышленной революции спрос на щелочные вещества, такие как кальцинированная сода, увеличился, и Николя Леблан разработал новый промышленный процесс производства кальцинированной соды. В процессе Леблана соль превращалась в кальцинированную соду с использованием серной кислоты, известняка и угля, в результате чего в качестве побочного продукта получался хлористый водород. Первоначально этот газ выбрасывался в воздух, но Закон о щелочах 1863 года запретил такой выброс, поэтому тогда производители кальцинированной соды поглощали отходящий газ HCl в воде, производя соляную кислоту в промышленных масштабах. Позже был разработан процесс Харгривса , который аналогичен процессу Леблана, за исключением того, что вместо серной кислоты используются диоксид серы , вода и воздух в реакции, которая в целом является экзотермической. В начале 20 века процесс Леблана был эффективно заменен процессом Сольве , который не давал HCl. Однако производство хлористого водорода продолжалось как этап производства соляной кислоты.
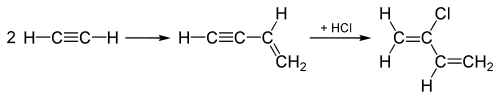
Историческое использование хлористого водорода в 20 веке включает гидрохлорирование алкинов при производстве хлорированных мономеров хлоропрена и винилхлорида , которые впоследствии полимеризуются с получением полихлоропрена ( неопрена ) и поливинилхлорида (ПВХ) соответственно. При производстве винилхлорида ацетилена ( C 2 H 2 ) гидрохлорируется добавлением HCl по тройной связи Молекула C 2 H 2 , превращающая тройную связь в двойную , дает винилхлорид.
«Ацетиленовый процесс», использовавшийся до 1960-х годов для производства хлоропрена , начинается с соединения двух молекул ацетилена , а затем к соединенному промежуточному соединению добавляется HCl по тройной связи , чтобы превратить его в хлоропрен, как показано здесь:
Этот «ацетиленовый процесс» был заменен процессом, который добавляет Вместо этого Cl 2 присоединяется к двойной связи этилена, а последующее отщепление дает вместо этого HCl, а также хлоропрен.
Безопасность
[ редактировать ]Хлороводород образует едкую соляную кислоту при контакте с водой, находящейся в тканях тела. Вдыхание паров может вызвать кашель , удушье , воспаление носа, горла и верхних дыхательных путей , а в тяжелых случаях — отек легких , недостаточность системы кровообращения и смерть. [26] Контакт с кожей может вызвать покраснение, боль и тяжелые химические ожоги . Хлорид водорода может вызвать серьезные ожоги глаз и необратимые повреждения глаз.
США Управление по безопасности и гигиене труда и Национальный институт безопасности и гигиены труда установили пределы профессионального воздействия хлористого водорода на уровне 5 частей на миллион (7 мг/м2). 3 ), [27] и собрал обширную информацию о проблемах безопасности на рабочем месте с использованием хлористого водорода. [28]
См. также
[ редактировать ]- Желудочная кислота , соляная кислота, выделяемая в желудок для облегчения переваривания белков .
- Хлориды , соли хлористого водорода
- Бромистый водород
- Гидрохлорид , органические соли соляной кислоты
- Гидрохлорирование , реакция присоединения с алкенами
Ссылки
[ редактировать ]- ^ «хлорид водорода (CHEBI:17883)» . Химические соединения биологического интереса (ХЭБИ) . Великобритания: Европейский институт биоинформатики.
- ^ Фавр, Анри А.; Пауэлл, Уоррен Х., ред. (2014). Номенклатура органической химии: Рекомендации ИЮПАК и предпочтительные названия 2013 . Кембридж: Королевское химическое общество . п. 131. ИСБН 9781849733069 .
- ^ Хейнс, Уильям М. (2010). Справочник по химии и физике (91 изд.). Бока-Ратон, Флорида, США: CRC Press . п. 4–67. ISBN 978-1-43982077-3 .
- ^ Хлороводород . Газовая энциклопедия. Эйр Ликид
- ^ Типпинг, Э. (2002) [1] . Издательство Кембриджского университета, 2004.
- ^ Труммал, А.; Липпинг, Л.; Кальюранд, И.; Коппель, Айова; Лейто, И. «Кислотность сильных кислот в воде и диметилсульфоксиде» J. Phys. хим. А. 2016 , 120 , 3663-3669. дои : 10.1021/acs.jpca.6b02253
- ^ Jump up to: а б с Карманный справочник NIOSH по химическим опасностям. «#0332» . Национальный институт охраны труда и здоровья (NIOSH).
- ^ Jump up to: а б «Хлороводород» . Непосредственно опасные для жизни и здоровья концентрации (IDLH) . Национальный институт охраны труда и здоровья (NIOSH).
- ^ Уэллетт, Роберт Дж.; Раун, Дж. Дэвид (2015). Основы органической химии . Эльзевир Наука. стр. 6–. ISBN 978-0-12-802634-2 .
- ^ Натта, Г. (1933). «Структура и полиморфизм галогеноводородов». Gazzetta Chimica Italiana (на итальянском языке). 63 : 425–439.
- ^ Шандор, Э.; Фэрроу, RFC (1967). «Кристаллическая структура твердого хлористого водорода и хлорида дейтерия». Природа . 213 (5072): 171–172. Бибкод : 1967Natur.213..171S . дои : 10.1038/213171a0 . S2CID 4161132 .
- ^ Соляная кислота - Краткое описание соединений . Пабчем
- ^ Jump up to: а б Остин, Северин; Гловацкий, Арндт (2000). Соляная кислота . дои : 10.1002/14356007.a13_283 . ISBN 3527306730 .
- ^ Пристли Дж. (1772 г.). «Наблюдения за различными видами воздуха [т. е. газов]» . Философские труды Лондонского королевского общества . 62 : 147–264 (234–244). дои : 10.1098/rstl.1772.0021 . S2CID 186210131 .
- ^ Дэви Х (1808 г.). «Электрохимические исследования по разложению земель; с наблюдениями за металлами, полученными из щелочноземельных металлов, и над амальгамой, полученной из аммиака» . Философские труды Лондонского королевского общества . 98 : 333–370. Бибкод : 1808RSPT...98..333D . дои : 10.1098/rstl.1808.0023 . S2CID 96364168 .
п. 343: Когда калий нагревали в газообразной соляной кислоте [т. е. в газообразном хлористом водороде], настолько сухом, насколько его можно было получить обычными химическими способами, происходило сильное химическое действие с воспламенением; и когда калий был в достаточном количестве, солянокислый газ полностью исчез, и от одной трети до одной четверти его объема водорода выделилось, и образовался соляной раствор поташа [т. е. хлорид калия]. (Реакция была: 2HCl + 2K → 2KCl + H 2 )
- ^ Крамер, Крис . Хловодородная пушка .
- ^ Франсиско Дж. Арнслиз (1995). «Удобный способ получения хлористого водорода в лаборатории первокурсников» . Дж. Хим. Образование. 72 (12): 1139. Бибкод : 1995JChEd..72.1139A . дои : 10.1021/ed072p1139 . Архивировано из оригинала 24 сентября 2009 года . Проверено 6 мая 2009 г.
- ^ Зиммлер, Уолтер (2000). «Соединения кремния неорганические». Энциклопедия промышленной химии Ульмана . дои : 10.1002/14356007.a24_001 . ISBN 978-3-527-30385-4 .
- ^ Краус, Пауль (1942–1943). Джабир ибн Хайян: Вклад в историю научных идей в исламе. I. Корпус джабирских сочинений. II. Джабир и греческая наука . Каир: Французский институт восточной археологии . ISBN 9783487091150 . OCLC 468740510 . том. II, стр. 41–42; Мультауф, Роберт П. (1966). Истоки химии . Лондон: Олдборн. стр. 141-142.
- ^ Стэплтон, Генри Э .; Азо, РФ; Хидаят Хусейн, М. (1927). «Химия в Ираке и Персии в десятом веке нашей эры» Мемуары Азиатского общества Бенгалии . VIII (6): 317–418. OCLC 706947607 . п. 333. Соответствующий рецепт гласит: «Возьмите равные части сладкой соли, горькой соли, табарзадской соли, андаранской соли, индийской соли, соли аль-Кили и соли мочи. После добавления равного веса хорошей кристаллизованной соли- нашатырный спирт, растворите влагой и перегоните (смесь) над крепкой водой, которая моментально расколет камень ( сахр ). (стр. 333) Глоссарий терминов, используемых в этом рецепте, см. на стр. 333. 322. Немецкий перевод того же отрывка в Руска, Юлий (1937). Книга Ар-Рази «Тайна тайн». С введением и пояснениями в немецком переводе . Источники и исследования по истории естествознания и медицины. Том VI. Берлин: Шпрингер. п. 182, §5. Английский перевод перевода Руски 1937 года можно найти в Тейлор, Гейл Марлоу (2015). Алхимия Ар-Рази: перевод «Книги Тайн» . Независимая издательская платформа CreateSpace. ISBN 9781507778791 . стр. 139–140.
- ^ Мультауф 1966 , с. 142, примечание 79.
- ^ Мультауф 1966 , стр. 160–163.
- ^ Карпенко Владимир; Норрис, Джон А. (2002). «Купорос в истории химии» . Химические листы . 96 (12): 997–1005. стр. 1002.
- ^ Мультауф 1966 , с. 208, примечание 29; ср. п. 142, примечание 79.
- ^ Хартли, Гарольд (1960). «Лекция Уилкинса. Сэр Хамфри Дэви, бакалавр, PRS 1778–1829». Труды Королевского общества А. 255 (1281): 153–180. Бибкод : 1960RSPSA.255..153H . дои : 10.1098/rspa.1960.0060 . S2CID 176370921 .
- ^ Загрязняющие вещества, Комитет Национального исследовательского совета (США) по рекомендуемым уровням аварийного и постоянного воздействия для отдельных подводных лодок (2009 г.), «Хлорид водорода» , Рекомендации по аварийным и постоянным воздействиям для выбранных подводных загрязнителей: Том 3 , National Academies Press (США) , извлечено 23 апреля 2024 г.
- ^ CDC - Карманный справочник NIOSH по химическим опасностям
- ^ «Хлороводород» . CDC-NIOSH Тема «Безопасность и здоровье на рабочем месте» . 5 марта 2012 года . Проверено 15 июля 2016 г.
Внешние ссылки
[ редактировать ]- Международная карта химической безопасности 0163
- Thames & Kosmos Chem C2000 Руководство по экспериментам