Бромистая кислота
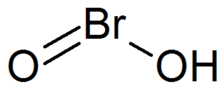 | |
 | |
 | |
| Имена | |
|---|---|
| ИЮПАК имена гидрокси-λ 3 -броманон гидроксидооксидобромин бромистая кислота | |
| Идентификаторы | |
3D model ( JSmol ) | |
| ЧЭБИ | |
| ХимическийПаук | |
ПабХим CID | |
Панель управления CompTox ( EPA ) | |
| Характеристики | |
| HBrO 2 | |
| Молярная масса | 112.911 g/mol |
| Сопряженная база | Бромит |
| Родственные соединения | |
Другие анионы | бромистоводородная кислота ; бромноватистой кислоты ; бромовая кислота ; бромная кислота |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Бромистая кислота – неорганическое соединение формулы HBrO 2 . Это нестабильное соединение, хотя были выделены соли его сопряженного основания – бромиты. В кислом растворе бромиты разлагаются до брома. [1]
Открытие
[ редактировать ]В 1905 году Ричардс А.Х. доказал существование бромистой кислоты посредством серии экспериментов с нитратом серебра (AgNO 3 ) и бромом. [2] Реакция избытка холодной воды с образованием бромноватистой кислоты (HBrO), бромида серебра (AgBr) и азотной кислоты (HNO 3 ):
- Br 2 + AgNO 3 + H 2 O → HBrO + AgBr + HNO 3
Ричардс обнаружил, что эффект добавления избытка жидкого брома в концентрированный нитрат серебра (AgNO 3 ) приводит к другому механизму реакции. По количеству эквивалентных частей кислого брома, образовавшегося в результате предыдущей реакции, было рассчитано соотношение между кислородом и бромом с точным значением O:Br (0,149975:0,3745), что позволяет предположить, что кислотное соединение содержит два атома кислорода на один атом брома. Таким образом, химическую структуру кислотного соединения вычислили как HBrO 2 . [2]
По Ричардсу, бромноватистой кислоты (HBrO) образуется в результате реакции брома и раствора нитрата серебра: [2]
- Br 2 + AgNO 3 + H 2 O → HBrO + AgBr + HNO 3
- 2 AgNO 3 + HBrO + Br 2 + H 2 O → HBrO 2 + 2 AgBr + 2 HNO 3
Изомерия
[ редактировать ]Молекула HBrO 2 имеет изогнутую структуру с углами ∠(H−O−Br) 106,1°. HOBrO также принимает неплоскую конформацию с одной изомерной структурой (2a) с двугранным углом ∠(H-O-Br-O) 74,2°. Более того, плоские структуры двух других изомеров (2b- цис и 2c- транс ) являются переходным состоянием для быстрой энантиомеризации. [3]
Другое исследование выявило три изомера: HOOBr, HOBrO и HBr(O)O. [4]
Синтез
[ редактировать ]Реакцию окисления между бромноватистой кислотой (HBrO) и хлорноватистой кислотой (HClO) можно использовать для получения бромистой кислоты (HBrO 2 ) и соляной кислоты (HCl). [ нужна ссылка ]
- HBrO + HClO → HBrO 2 + HCl
Окислительно-восстановительная реакция бромноватистой кислоты (HBrO) может образовывать бромистую кислоту (HBrO 2 ) в качестве продукта: [ нужна ссылка ]
- HBrO + H 2 O − 2e − → HBrO 2 + 2H +
Реакция диспропорционирования двух эквивалентов бромноватистой кислоты (HBrO) приводит к образованию как бромистой кислоты (HBrO 2 ), так и бромистоводородной кислоты (HBr): [ нужна ссылка ]
- 2 HBrO → HBrO 2 + HBr
Реакция перегруппировки, возникающая в результате синпропорции бромистой кислоты (HBrO 3 ) и бромистоводородной кислоты (HBr), дает бромистую кислоту (HBrO 2 ): [ нужна ссылка ]
- 2 HBrO 3 + HBr → 3 HBrO 2
Соли
[ редактировать ]Было предложено объединить этот раздел с разделом «Бромит натрия» . ( Обсудить ) Предлагается с февраля 2024 г. |

Соли NaBrO 2 ·3H 2 O и Ba(BrO 2 ) 2 ·H 2 O кристаллизованы. При обработке этих водных растворов солями Pb 2+ , ртуть 2+ , и Ag + соответствующие бромиты тяжелых металлов выпадают в осадок в виде твердых веществ. [1]
Реакция Белоусова-Жаботинского.
[ редактировать ]Бромистая кислота — продукт реакции Белоусова-Жаботинского, образующийся в результате соединения бромата калия, сульфата церия (IV), пропандиовой кислоты и лимонной кислоты в разбавленной серной кислоте. Бромистая кислота является промежуточной стадией реакции между бромат-ионом ( BrO −
3 ) и бром (Br − ): [5] [6]
- Братан −
3 +2 комн. − → HBrO 2 + HBrO
Другими важными реакциями в таких колебательных реакциях являются:
- HBrO 2 + BrO −
3 + Ч + → 2 БрО •
2 + Н 2 О - 2 HBrO 2 → BrO −
3 + НОБр + Н +
Бромиты восстанавливают перманганаты до манганатов (VI): [1]
- 2 МnО −
4 + БрО −
2 + ОН − → 2 МnО 2−
4 + БрО −
3 + Н 2 О
п К а измерение
[ редактировать ]Константа диссоциации бромистой кислоты, K a = [Ч + ][ Братан −
2 ] / [HBrO 2 ] определяли разными методами.
Величина p K a для бромистой кислоты была оценена в исследованиях по разложению бромитов. В ходе исследования была измерена скорость разложения бромита в зависимости от концентрации ионов водорода и бромита. Экспериментальные данные логарифма начальной скорости строили в зависимости от pH. Используя этот метод, расчетное значение p K a для бромистой кислоты составило 6,25. [7]
Другим методом измеряли рК а бромистой кислоты, исходя из начальной скорости реакции между бромитами натрия и йодом калия в диапазоне рН 2,9–8,0, при 25 °С и ионной силе 0,06 М. Зависимость первого порядка начальной скорости этой реакции диспропорционирования на [H + ] в диапазоне pH 4,5–8,0. Значение константы диссоциации кислоты, измеренное этим методом, составляет K a = (3,7 ± 0,9) × 10. −4 М и р К а = 3,43 ± 0,05 . [8]
Реактивность
[ редактировать ]По сравнению с другими кислородцентрированными окислителями (гипогалитами, анионами пероксидов) и в силу своей низкой основности бромит является довольно слабым нуклеофилом. [9] Константы скорости бромита по отношению к карбокатионам и акцепторно-замещенным олефинам на 1–3 порядка ниже, чем измеренные на гипобромите.
Ссылки
[ редактировать ]- ^ Jump up to: а б с Эгон Виберг, Арнольд Фредерик Холлеман (2001) Неорганическая химия , Elsevier ISBN 0-12-352651-5
- ^ Jump up to: а б с «Журнал Общества химической промышленности. т.25 1906 г.» . ХатиТраст . Проверено 28 апреля 2017 г.
- ^ Глейзер, Райнер; Йост, Мэри (16 августа 2012 г.). «Диспропорционирование бромистой кислоты HOBrO путем прямого переноса O и через ангидриды O(BrO) 2 и BrO-BrO 2 . Ab initio исследование механизма ключевой стадии колебательной реакции Белоусова-Жаботинского». Журнал физической химии А. 116 (32): 8352–8365. Бибкод : 2012JPCA..116.8352G . дои : 10.1021/jp301329g . ISSN 1520-5215 . ПМИД 22871057 .
- ^ Соуза, Габриэль LC де; Браун, Алекс (01 июля 2016 г.). «Основное и возбужденное состояния изомеров HBrO 2 [HOOBr, HOBrO и HBr(O)O] и HBrO 3 (HOOOBr и HOOBrO)». Теоретическая химия . 135 (7): 178. doi : 10.1007/s00214-016-1931-8 . ISSN 1432-881X . S2CID 99067360 .
- ^ Вассалини, Ирен; Алессандри, Ивано (2015). «Пространственное и временное управление хранением информации в целлюлозе посредством химически активируемых колебаний» . Прикладные материалы и интерфейсы ACS . 7 (51): 28708–28713. дои : 10.1021/acsami.5b11857 . ПМИД 26654462 .
- ^ Филд, Ричард Дж.; Корос, Эндре; Нойес, Ричард М. (1 декабря 1972 г.). «Колебания в химических системах. II. Тщательный анализ временных колебаний в системе бромат-церий-малоновая кислота». Журнал Американского химического общества . 94 (25): 8649–8664. дои : 10.1021/ja00780a001 . ISSN 0002-7863 .
- ^ Массагли, А. (1970). «Кинетическое исследование разложения бромита - ScienceDirect». Неорганика Химика Акта . 4 : 593–596. дои : 10.1016/S0020-1693(00)93357-7 .
- ^ Фариа, РБ; Эпштейн, Ирвинг Р.; Кастин, Кеннет (1 января 1994 г.). «Кинетика диспропорционирования и рКа бромистой кислоты». Журнал физической химии . 98 (4): 1363–1367. дои : 10.1021/j100055a051 . ISSN 0022-3654 .
- ^ Майер, Роберт Дж.; Офиал, Армин Р. (22 февраля 2018 г.). «Нуклеофильная реактивность отбеливающих реагентов». Органические письма . 20 (10): 2816–2820. doi : 10.1021/acs.orglett.8b00645 . ПМИД 29741385 .