Изоциановая кислота
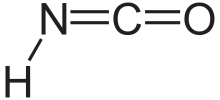 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК Изоциановая кислота | |
| Другие имена Карбимид [1] Углекислый имид | |
| Идентификаторы | |
3D model ( JSmol ) |
|
| ЧЭБИ | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.109.068 |
ПабХим CID | |
| НЕКОТОРЫЙ |
|
Панель управления CompTox ( EPA ) | |
| Характеристики | |
| ГНКО | |
| Молярная масса | 43.025 g·mol −1 |
| Появление | Бесцветная жидкость или газ (точка кипения близка к комнатной температуре) |
| Плотность | 1,14 г/см 3 (20 °С) |
| Температура плавления | -86 ° C (-123 ° F; 187 К) [4] |
| Точка кипения | 23,5 ° C (74,3 ° F; 296,6 К) |
| Растворяется | |
| Растворимость | Растворим в бензоле , толуоле , диэтиловом эфире. |
| Кислотность ( pKa ) | 3.7 [2] |
| Конъюгатная кислота | Оксометаниминиум [3] |
| Сопряженная база | Цианат |
| Опасности | |
| Безопасность и гигиена труда (OHS/OSH): | |
Основные опасности | Ядовитый |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Изоциановая кислота представляет собой химическое соединение со структурной формулой HNCO, которую часто записывают как H-N=C=O . Это бесцветное, летучее и ядовитое вещество с температурой кипения 23,5°С. Это преобладающий таутомер и изомер циановой кислоты (также известной как цианол) ( H−O−C≡N ).
Производный анион изоциановой кислоты такой же, как производный анион циановой кислоты, и этот анион [Н=С=О] − , который называется цианатом . Соответствующая функциональная группа −N=C=O представляет собой изоцианат ; он отличается от цианата ( −O−C≡N ), гремящий ( −O−N + ≡C − ) и оксид нитрила ( −C≡N + −О − ). [5]
Изоциановая кислота была открыта в 1830 году Юстусом фон Либихом и Фридрихом Вёлером . [6]
Изоциановая кислота — это простейшее стабильное химическое соединение , содержащее углерод , водород , азот и кислород — четыре наиболее часто встречающихся элемента в органической химии и биологии. Это единственный достаточно стабильный из четырех линейных изомеров с молекулярной формулой HOCN, остальные представляют собой циановую кислоту (цианол, синтезированных H−O−C≡N ) и неуловимую фульминовую кислоту ( H−C≡N + −О − ) [7] и изофульминовая кислота Х-О-Н + ≡C − . [5] [8]
Структура
[ редактировать ]Изоциановая кислота (HNCO)
[ редактировать ]Хотя электронную структуру согласно теории валентных связей можно записать как H−N=C=O, в колебательном спектре имеется полоса при 2268,8 см-1. −1 в газовой фазе, что, по мнению некоторых, указывает на тройную связь углерод-азот. [9] [10] Если да, то каноническая форма H-N + ≡C−O − является основной резонансной структурой .
Однако классический вибрационный анализ показал бы, что высота 2268,8 см −1 представляет собой асимметричное растяжение N=C=O, согласно Colthup et al., [11] а также веб-книгу NIST по химии, [12] который также сообщает, что соответствующее симметричное растяжение N=C=O (слабое в инфракрасном диапазоне, но сильное в комбинационном) составляет 1327 см. −1 . Основываясь на этих классических предположениях, нет необходимости ссылаться на полностью заряженное состояние атомов N и O для объяснения колебательных спектральных данных.
Циановая кислота (HOCN)
[ редактировать ]Таутомер , известный как циановая кислота, HOCN , в которой атом кислорода протонирован, существует в равновесии с изоциановой кислотой в пределах около 3%. [ нужна ссылка ] [ сомнительно – обсудить ] Колебательный спектр указывает на наличие тройной связи между атомами азота и углерода. [13]
Характеристики
[ редактировать ]В водном растворе это кислота , имеющая pKa слабая 3,7 : [2]
- ГНКО ⇌ Ч + + унтер-офицер −
Изоциановая кислота гидролизуется до углекислого газа и аммиака :
- HNCO + H 2 O → CO 2 + NH 3
Разбавленные растворы изоциановой кислоты устойчивы в инертных растворителях , например в эфире и хлорированных углеводородах . [14]
При высоких концентрациях изоциановая кислота олигомеризуется с образованием тримера циануровой кислоты и циамелида — полимера. Эти частицы обычно легко отделяются от продуктов реакции в жидкой или газовой фазе.
Изоциановая кислота реагирует с аминами с образованием мочевины (карбамидов):
- HNCO + RNH 2 → RNHC(O)NH 2
Эта реакция называется карбамилированием .
HNCO добавляет поперек богатые электронами двойные связи, такие как виниловые эфиры , с образованием соответствующих изоцианатов.
Изоциановая кислота, HNCO, представляет собой кислоту Льюиса которой , свободная энергия , энтальпия и энтропия изменяется при ее ассоциации 1:1 с рядом оснований в растворе четыреххлористого углерода при 25 ° C. [15] Акцепторные свойства HNCO сравниваются с другими кислотами Льюиса в модели ECW .
Низкотемпературный фотолиз твердых веществ, содержащих HNCO, приводит к образованию таутомера циановой кислоты. H−O−C≡N , также называемый цианатом водорода. [16] Чистая циановая кислота не выделена, а изоциановая кислота является преобладающей формой во всех растворителях. [14] Иногда информация, представленная в справочниках по циановой кислоте, на самом деле относится к изоциановой кислоте. [ нужна ссылка ]
Подготовка
[ редактировать ]Изоциановую кислоту можно получить протонированием цианат -аниона , например, из солей, таких как цианат калия , либо газообразным хлористым водородом , либо кислотами, такими как щавелевая кислота . [17]
HNCO также можно получить путем высокотемпературного термического разложения тримера циануровой кислоты :
В отличие от знаменитого синтеза мочевины Фридриха Вёлера ,
образуется изоциановая кислота, которая быстро тримеризуется до циануровой кислоты.
возникновение
[ редактировать ]Изоциановая кислота была обнаружена во многих межзвездных средах . [8]
Изоциановая кислота также присутствует в различных формах дыма , включая смог и сигаретный дым . Он был обнаружен с помощью масс-спектрометрии и легко растворяется в воде , создавая риск для здоровья легких. [18]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Цианамид также имеет это название, и для него оно более систематически правильно.
- ^ Перейти обратно: а б Петтит, Гвинет; Петтит, Лесли. «СК-База данных» (собственная база данных) . Тимбл, Йоркс: Академическое программное обеспечение — через собственный исполняемый файл.
- ^ «Оксометаминиум | CH2NO | ChemSpider» . www.chemspider.com . Проверено 27 января 2019 г.
- ^ Прадьот Патнаик. Справочник неорганических химикатов . МакГроу-Хилл, 2002 г., ISBN 0-07-049439-8
- ^ Перейти обратно: а б Уильям Р. Мартин и Дэвид В. Болл (2019): «Маленькие органические гремящие вещества как высокоэнергетические материалы. Гремящие вещества ацетилена, этилена и аллена». Журнал «Энергетические материалы» , том 31, выпуск 7, страницы 70-79. дои : 10.1080/07370652.2018.1531089
- ^ Либих, Дж.; Вёлер, Ф. (1830). «Исследования циановых кислот» . Энн. Физ . 20 (11): 394. Бибкод : 1830АнП....96..369Л . дои : 10.1002/andp.18300961102 .
- ^ Курцер, Фредерик (2000). «Фульминовая кислота в истории органической химии». Журнал химического образования . 77 (7): 851–857. Бибкод : 2000ЖЧЭд..77..851К . дои : 10.1021/ed077p851 .
- ^ Перейти обратно: а б Дунхуэй Цюань, Эрик Хербст, Ёсихиро Осамура и Эвелин Руефф (2010): «Моделирование газового зерна изоциановой кислоты (HNCO), циановой кислоты (HOCN), фульминовой кислоты (HCNO) и изофульминовой кислоты (HONC) в различных межзвездных средах. « Астрофизический журнал» , том 725, выпуск 2, стр. два : 10.1088/0004-637X/725/2/2101
- ^ Накамото, часть А, стр. 190.
- ^ Телес, Хоаким Энрике; Майер, Гюнтер; Андес Хесс, Б.; Шаад, Лоуренс Дж.; Винневиссер, Манфред; Винневиссер, Бренда П. (1989). «Изомеры CHNO». Химические отчеты . 122 (4): 753–766. дои : 10.1002/cber.19891220425 .
- ^ Колтуп, Норман Б.; Дейли, Лоуренс Х.; Виберли, Стивен Э. (1990). Введение в инфракрасную и рамановскую спектроскопию . Академическое издательство (Эльзевир). ISBN 978-0-12-182554-6 .
- ^ «Изоциановая кислота» . Национальный институт стандартов и технологий (Министерство торговли США) . Проверено 20 апреля 2023 г.
- ^ Телес, Хоаким Энрике; Майер, Гюнтер; Андес Хесс, Б.; Шаад, Лоуренс Дж.; Винневиссер, Манфред; Винневиссер, Бренда П. (1989). «Изомеры CHNO». хим. Бер . 122 (4): 1099–0682. дои : 10.1002/cber.19891220425 .
- ^ Перейти обратно: а б А.С. Нарула, К. Рамачандран «Изоциановая кислота» в Энциклопедии реагентов для органического синтеза, 2001, John Wiley & Sons, Нью-Йорк. doi : 10.1002/047084289X.ri072m Дата публикации статьи в Интернете: 15 апреля 2001 г.
- ^ Нельсон, Дж. (1970) Комплексы изоциановой кислоты с водородными связями: инфракрасные спектры и термодинамические измерения. Spectrochimica Acta Часть A: Молекулярная спектроскопия 26,109-120.
- ^ Джакокс, Мэн; Миллиган, Делавэр (1964). «Низкотемпературное инфракрасное исследование промежуточных продуктов фотолиза HNCO и DNCO». Журнал химической физики . 40 (9): 2457–2460. Бибкод : 1964JChPh..40.2457J . дои : 10.1063/1.1725546 .
- ^ Фишер, Г.; Гейт, Дж.; Клапотке, ТМ; Крумм Б. (2002). «Синтез, свойства и исследование димеризации изоциановой кислоты» (PDF) . З. Натурфорш . 57б (1): 19–25. дои : 10.1515/znb-2002-0103 . S2CID 37461221 .
- ^ Прейдт, Роберт. «Химические вещества в дыме могут представлять опасность для здоровья» . MyOptumHealth . AccuWeather . Проверено 14 сентября 2011 г.
Внешние ссылки
[ редактировать ]- Вальтер, Вольфганг (1997). Органическая химия: подробный учебный текст и справочник . Чичестер: Издательство Альбион. п. 364. ИСБН 978-1-898563-37-2 . Проверено 21 июня 2008 г.
- Циановая кислота из веб-книги NIST Chemistry (по состоянию на 9 сентября 2006 г.)



