Ион галония

Ион галония — это любой ониевый ион , содержащий атом галогена, несущий положительный заряд. Этот катион имеет общую структуру R− −R′, где X — любой галоген и нет ограничений на R, [1] эта структура может быть циклической или молекулярной структурой с открытой цепью. Ионы галония, образующиеся из фтора , хлора , брома и йода, называются фторонием , хлоронием , бромонием и йодонием соответственно. [1] Трехчленную циклическую разновидность, обычно предлагаемую в качестве промежуточных продуктов при электрофильном галогенировании, можно назвать ионами галирания, используя номенклатурную систему Ханча-Видмана .
Структура
[ редактировать ]Простейшие ионы галония имеют структуру H− −H (X = F, Cl, Br, I). Многие ионы галония имеют трехатомную циклическую структуру, аналогичную структуре эпоксида , возникающую в результате формального присоединения иона галогения. Х + C=C к двойной связи , как при присоединении галогена к алкену . [1] образование 5-членных ионов галония (например, ионов хлорлания, бромолания) за счет участия соседних групп . Хорошо изучено также [2]
Ионы диарилиодония ( [Ар 2 Я] + Х − ), как правило, представляют собой стабильные, изолируемые соли, которые имеют Т-образную геометрию с арильными группами, расположенными на расстоянии ~ 90 градусов друг от друга; [3] подробнее см. Гипервалентный йод .
Тенденция к образованию мостиковых ионов галония находится в порядке I > Br > Cl > F. В то время как йод и бром легко образуют мостиковые ионы йодония и бромония, ионы фторония только недавно были охарактеризованы в разработанных системах, которые вызывают близкое столкновение неподеленной пары фтора. и карбокатионный центр. На практике структурно существует континуум между галонием с симметричной мостиковой связью и несимметричным галонием с длинной слабой связью с одним из углеродных центров и настоящим β-галогенкарбокатионом без галониевого характера. Равновесная структура зависит от способности атомов углерода и галогена аккумулировать положительный заряд. Таким образом, ион бромония, соединяющий первичный и третичный углерод, часто будет иметь искаженную структуру со слабой связью с третичным центром (со значительным карбокатионным характером) и более прочной связью с первичным углеродом. Это связано с повышенной стабильностью третичных углеродов для стабилизации положительного заряда. В более крайнем случае, если третичный центр, например, дважды бензильный, тогда предпочтение может отдаваться открытой форме. Точно так же переход с брома на хлор также ослабляет мостиковый характер из-за более высокой электроотрицательности хлора и меньшей склонности к разделению электронной плотности по сравнению с бромом.
Реактивность
[ редактировать ]Эти ионы обычно являются лишь короткоживущими промежуточными продуктами реакции ; они очень реакционноспособны из-за высокой деформации трехчленного кольца и положительного заряда галогена; этот положительный заряд делает их великими электрофилами . Почти во всех случаях ион галония подвергается атаке нуклеофила за очень короткое время. Даже слабый нуклеофил, такой как вода , атакует ион галония; именно так галогидрины можно получить .
Иногда атом галония перегруппировывается в карбокатион . Обычно это происходит только тогда, когда этот карбокатион является аллильным или бензильным карбокатионом. [4]
История
[ редактировать ]Ионы галония были впервые постулированы в 1937 году Робертсом и Кимбаллом. [5] для объяснения наблюдаемой в антидиастереоселективности реакциях присоединения галогенов к алкенам . Они правильно утверждали, что если начальным промежуточным продуктом реакции бромирования является X–C–C с открытой цепью + Вращение вокруг одинарной связи C–C может привести к смеси равных количеств син- изомера и анти- изомера дигалогена , но это не так. Они также утверждали, что положительно заряженный атом галогена изоэлектронен кислороду и что углерод и бром имеют сравнимые потенциалы ионизации . Для некоторых арилзамещенных алкенов антистереоспецифичность снижается или теряется в результате ослабления или отсутствия галониевого характера в катионном промежуточном продукте.
В 1970 году Джорджу А. Оле удалось получить и выделить соли галония. [6] путем добавления метилгалогенида, такого как бромистый метил или метилхлорид, в диоксиде серы при -78 ° C к комплексу пентафторида сурьмы и тетрафторметана в диоксиде серы. После испарения сернистого газа в результате этой процедуры остались кристаллы [H 3 C– –CH 3 ][SbF 6 ] – , стабилен при комнатной температуре , но не к влаге. Недавно ион фторония был охарактеризован в фазе раствора (растворенного в диоксиде серы или фториде сульфурилхлорида ) при низкой температуре. [7]
Циклический и ациклический хлороний, [8] Ионы бромония и йодония были структурно охарактеризованы с помощью рентгеновской кристаллографии , например, катион бромония, полученный из би(адамантилидена), показанный ниже. [9]
 | 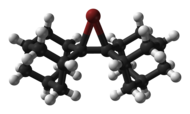 |
| скелетная формула | модель шарика и клюшки |
Соединений, содержащих ионы трехвалентного или четырехвалентного галония, не существует, но стабильность некоторых гипотетических соединений была проверена с помощью вычислений. [10]
Ссылки
[ редактировать ]- ^ Jump up to: а б с ИЮПАК , Сборник химической терминологии , 2-е изд. («Золотая книга») (1997). Интернет-исправленная версия: (2006–) « Ионы галония ». дои : 10.1351/goldbook.H02728
- ^ Петерсон, Пол Э. (1 декабря 1971 г.). «Циклические ионы галония с пятичленными кольцами» . Отчеты о химических исследованиях . 4 (12): 407–413. дои : 10.1021/ar50048a003 . ISSN 0001-4842 .
- ^ Садек, Омар; Перрин, Дэвид М.; Гра, Эммануэль (01.06.2019). «Несимметричные соли фенилтрифторбората диарилиодония: синтез, строение и фторирование» . Журнал химии фтора . 222–223: 68–74. doi : 10.1016/j.jfluchem.2019.04.004 . ISSN 0022-1139 . S2CID 132289845 .
- ^ Брюс, Паула Юрканис (2014). Органическая химия (7-е изд.). Пирсон Образование. ISBN 978-0-321-80322-1 .
- ^ Робертс, Ирвинг; Кимбалл, Джордж Э. (1937). «Галогенирование этиленов». Дж. Ам. хим. Соц. 59 (5): 947. doi : 10.1021/ja01284a507 .
- ^ Ола, Джордж А .; ДеМембер, Джон Р. (1970). «Химия Фриделя-Крафтса. V. Выделение, ядерный магнитный резонанс углерода-13 и лазерное рамановское спектроскопическое исследование фторантимонатов диметилгалония». Дж. Ам. хим. Соц. 92 (3): 718. doi : 10.1021/ja00706a058 .
- ^ Питтс, Коди Росс; Холл, Максвелл Гарджуло; Лектка, Томас (2018). «Спектроскопическая характеристика [C – F – C] + Ион фторония в растворе» . Angew. Chem. 130 (7). doi : 10.1002/ange.201712021 .
- ^ Мори, Т.; Ратор, Р. (1998). «Рентгеновская структура мостикового 2,2'-би(адамант-2-илиден) катиона хлорония и сравнение его реакционной способности с односвязным катионом хлороарения». ChemComm (8): 927–928. дои : 10.1039/a709063c .
- ^ Браун, РС; Нагорский, RW; Беннет, Эй Джей; МакКлунг, РЭД; Аартс, GHM; Клобуковски, М.; Макдональд, Р.; Сантарсьеро, BD (март 1994 г.). «Стабильные ионы бромония и йода затрудненных олефинов адамантилинеадамантан и бицикло[3.3.1]нонилиденбицикло[3.3.1]нонан. Рентгеновская структура, перенос положительных галогенов на акцепторные олефины и исследования ab initio». Дж. Ам. хим. Соц. 116 (6): 2448–2456. дои : 10.1021/ja00085a027 .
- ^ Шнайдер, Тобиас Ф.; Верц, Дэниел Б. (2010). «Поиски тетракоординированных ионов галония: теоретическое исследование». Орг. Летт . 12 (21): 4844–4847. дои : 10.1021/ol102059b . ПМИД 20923174 .
