Ацетилен
 | |
 | |
 | |
| Имена | |
|---|---|
| Предпочтительное название ИЮПАК Ацетилен [1] | |
| Систематическое название ИЮПАК Этин [2] | |
| Идентификаторы | |
3D model ( JSmol ) | |
| 906677 | |
| ЧЭБИ | |
| ЧЕМБЛ | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.000.743 |
| Номер ЕС |
|
| 210 | |
| КЕГГ | |
ПабХим CID | |
| номер РТЭКС |
|
| НЕКОТОРЫЙ | |
| Число | 1001 (распущен) 3138 (в смеси с этиленом и пропиленом ) |
Панель управления CompTox ( EPA ) | |
| Характеристики | |
| С 2 Ч 2 | |
| Молярная масса | 26.038 g·mol −1 |
| Появление | Бесцветный газ |
| Запах | Без запаха |
| Плотность | 1,1772 г/л = 1,1772 кг/м 3 (0 °С, 101,3 кПа) [3] |
| Температура плавления | -80,8 ° C (-113,4 ° F; 192,3 К) Тройная точка при 1,27 атм. |
| −84 °С; −119 ° F; 189 К (1 атм) | |
| слабо растворим | |
| Растворимость | мало растворим в спирте растворим в ацетоне , бензоле |
| Давление пара | 44,2 атм (20 °С) [4] |
| Кислотность ( pKa ) | 25 [5] |
| Конъюгатная кислота | Этиниум |
| −20.8 × 10 −6 см 3 /моль [6] | |
| Теплопроводность | 21,4 мВт·м −1 ·К −1 (300 К) [6] |
| Структура | |
| Линейный | |
| Термохимия [6] | |
Теплоемкость ( С ) | 44,036 Дж·моль −1 ·К −1 |
Стандартный моляр энтропия ( S ⦵ 298 ) | 200,927 Дж моль −1 ·К −1 |
Стандартная энтальпия образование (Δ f H ⦵ 298 ) | 227,400 кДж·моль −1 |
Свободная энергия Гиббса (Δ f G ⦵ ) | 209,879 кДж·моль −1 |
Стандартная энтальпия горение (Δ c H ⦵ 298 ) | 1300 кДж·моль −1 |
| Опасности | |
| СГС Маркировка : | |
  | |
| Опасность | |
| Х220 , Х336 | |
| P202 , P210 , P233 , P261 , P271 , P304 , P312 , P340 , P377 , P381 , P403 , P405 , P501 | |
| NFPA 704 (огненный алмаз) | |
| 300 ° С (572 ° F; 573 К) | |
| Взрывоопасные пределы | 2.5–100% |
| NIOSH (пределы воздействия на здоровье в США): | |
МЕХ (Допускается) | никто [4] |
РЕЛ (рекомендуется) | C 2500 частей на миллион (2662 мг/м 3 ) [4] |
IDLH (Непосредственная опасность) | без даты [4] |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Ацетилен ( систематическое название : этин ) — химическое соединение с формулой C 2 H 2 и строение H−C≡C−H . Это углеводород и простейший алкин . [7] Этот бесцветный газ широко используется в качестве топлива и химического строительного материала. В чистом виде он нестабилен, поэтому с ним обычно обращаются как с раствором. [8] Чистый ацетилен не имеет запаха, но коммерческие сорта обычно имеют выраженный запах из-за примесей, таких как дивинилсульфид и фосфин . [8] [9]
Как алкин, ацетилен ненасыщен , поскольку два его атома углерода связаны связью тройной . Тройная связь углерод-углерод помещает все четыре атома на одну прямую линию с валентным углом CCH 180 °. [10]
Открытие
[ редактировать ]Ацетилен был открыт в 1836 году Эдмундом Дэви , который определил его как «новый карбюратор водорода». [11] [12] Это было случайное открытие при попытке выделить металлический калий . Нагревая карбонат калия с углеродом при очень высоких температурах, он получил остаток того, что сейчас известно как карбид калия (K 2 C 2 ), который прореагировал с водой с выделением нового газа. Он был вновь открыт в 1860 году французским химиком Марселленом Бертло , который придумал название ацетилен . [13] Эмпирическая формула Бертло для ацетилена (C 4 H 2 ), а также альтернативное название « квадрикарбюр д'гидроген » (квадрикарбид водорода) были неверными, поскольку многие химики того времени использовали неправильную атомную массу углерода (6 вместо 12). . [14] Бертло смог получить этот газ, пропуская пары органических соединений (метанол, этанол и т. д.) через раскаленную трубку и собирая выходящие потоки . Он также обнаружил, что ацетилен образуется в результате искрообразования в смеси газов циана и водорода . Позднее Бертло получил ацетилен непосредственно путем пропускания водорода между полюсами угольной дуги . [15] [16]
Подготовка
[ редактировать ]За исключением Китая, в производстве ацетилена преобладает частичное сжигание природного газа. [17]
Частичное сжигание углеводородов
[ редактировать ]в основном производят путем частичного сжигания метана С 1950-х годов ацетилен . [18] [19] [20] побочный продукт производства этилена путем крекинга углеводородов . Это В 1983 году этим методом было произведено около 400 000 тонн. [18] Его присутствие в этилене обычно нежелательно из-за его взрывчатого характера и способности отравлять катализаторы Циглера-Натта . Его селективно гидрируют в этилен , обычно с использованием Pd - Ag . катализаторов [21]
3 СН 4 + 3 О 2 → С 2 Н 2 + СО + 5 Н 2 О.
При частичном сгорании метана также образуется ацетилен:
Дегидрирование алканов
[ редактировать ]Самые тяжелые алканы нефти и природного газа расщепляются на более легкие молекулы, которые дегидрируются при высокой температуре:
- С 2 Ч 6 → С 2 Ч 2 + 2 Ч 2
- 2 Ч 4 → С 2 Ч 2 + 3 Ч 2
Эта последняя реакция реализуется в процессе анаэробного разложения метана микроволновой плазмой. Преимуществом этой технологии является отсутствие выбросов CO2 и совместное производство водорода как побочного продукта. [22] Это делает производство низкоуглеродным и электрифицированным. На 32 т преобразованного метана получается 26 т ацетилена и 6 т водорода (по стехиометрии).
Карбохимический метод
[ редактировать ]Ацетилен традиционно получают гидролизом (реакцией с водой) карбида кальция :
- CaC 2 + 2 H 2 O → Ca(OH) 2 + C 2 H 2
1 кг карбида кальция соединяется с 562,5 г воды с выделением 350 литров ацетилена. Эту реакцию открыл Фридрих Вёлер в 1862 году. [23]
Использование этой технологии сократилось во всем мире, за заметным исключением Китая, где упор делается на химическую промышленность, основанную на угле. В противном случае нефть все больше вытесняет уголь как главный источник сокращения выбросов углерода. [24]
Производство карбида кальция требует высоких температур, ~ 2000 ° C, что требует использования электродуговой печи . В США этот процесс был важной частью химической революции конца XIX века, ставшей возможным благодаря масштабному проекту гидроэлектростанции на Ниагарском водопаде . [25]
Склеивание
[ редактировать ]С точки зрения теории валентных связей , в каждом атоме углерода 2s -орбиталь гибридизуется с одной 2p-орбиталью, образуя sp-гибрид. Две другие 2p-орбитали остаются негибридизованными. Два конца двух sp-гибридной орбитали перекрываются, образуя прочную валентную связь между атомами углерода, в то время как на каждом из двух других концов атомы водорода также присоединяются посредством σ-связей. Две неизмененные 2p-орбитали образуют пару более слабых π-связей . [26]
Поскольку ацетилен является линейной симметричной молекулой , он обладает D∞h точечной группой . [27]
Физические свойства
[ редактировать ]Изменения состояния
[ редактировать ]При атмосферном давлении ацетилен не может существовать в жидком виде и не имеет температуры плавления. Тройная точка на фазовой диаграмме соответствует температуре плавления (-80,8 ° C) при минимальном давлении, при котором может существовать жидкий ацетилен (1,27 атм). При температурах ниже тройной точки твердый ацетилен может превращаться непосредственно в пар (газ) путем сублимации . Точка сублимации при атмосферном давлении составляет -84,0 °C. [28]
Другой
[ редактировать ]При комнатной температуре растворимость ацетилена в ацетоне составляет 27,9 г на кг. Для того же количества диметилформамида (ДМФ) растворимость составляет 51 г. ВПри давлении 20,26 бар растворимость увеличивается до 689,0 и 628,0 г для ацетона и ДМФ соответственно. Эти растворители используются в газовых баллонах под давлением. [29]
Приложения
[ редактировать ]Сварка
[ редактировать ]Около 20% ацетилена поставляется промышленностью промышленных газов для газокислородной сварки и резки из -за высокой температуры пламени. Сгорание ацетилена с кислородом дает пламя с температурой более 3600 К (3330 ° C; 6020 ° F), выделяя 11,8 кДж / г. Кислород с ацетиленом — самая горячая горючая газовая смесь. [30] Ацетилен является третьим по температуре природным химическим пламенем после дицианоацетилена с температурой 5260 К (4990 °C; 9010 °F) и цианогена с температурой 4798 К (4525 °C; 8177 °F). Кислородно-ацетиленовая сварка была популярным процессом сварки в предыдущие десятилетия. Развитие и преимущества процессов дуговой сварки привели к тому, что кислородно-топливная сварка практически исчезла для многих применений. Использование ацетилена для сварки значительно сократилось. для ацетиленовой сварки С другой стороны, оборудование весьма универсально – не только потому, что горелка предпочтительна для некоторых видов сварки железа или стали (например, в некоторых художественных применениях), но и потому, что она легко поддается пайке, сварке твердым припоем. , нагрев металла (для отжига или отпуска, гибки или формовки), ослабление проржавевших гаек и болтов и другие применения. Специалисты по ремонту кабелей Bell Canada до сих пор используют портативные комплекты горелок, работающих на ацетилене, в качестве паяльного инструмента для герметизации соединений выводных гильз в люках и в некоторых воздушных точках. Газогенно-ацетиленовая сварка также может использоваться в местах, где электричество недоступно. Газокислородная резка применяется во многих цехах металлообработки. При использовании при сварке и резке рабочее давление должно контролироваться регулятором, поскольку давление выше 15 фунтов на квадратный дюйм (100 кПа) при воздействии ударной волны (вызванной, например, flashback ), ацетилен взрывоопасно разлагается на водород и углерод . [31]

Химикаты
[ редактировать ]Ацетилен полезен во многих процессах, но лишь немногие из них проводятся в промышленных масштабах. [32]
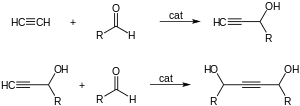
Одним из основных химических применений является этинилирование формальдегида. [8] Ацетилен присоединяется к альдегидам и кетонам с образованием α-этиниловых спиртов:
Реакция дает бутиндиол с пропаргиловым спиртом в качестве побочного продукта. ацетилид меди . В качестве катализатора используется [33] [34]
Помимо этинилирования, ацетилен реагирует с окисью углерода , ацетилен реагирует с образованием акриловой кислоты или акриловых эфиров. Требуются металлические катализаторы. Эти производные образуют такие продукты, как акриловые волокна , стекла , краски , смолы и полимеры . За исключением Китая, использование ацетилена в качестве химического сырья сократилось на 70% с 1965 по 2007 год из-за затрат и экологических соображений. [35] В Китае ацетилен является основным предшественником винилхлорида . [32]
Историческое использование
[ редактировать ]До широкого распространения нефтехимии ацетилен, полученный из угля, был строительным блоком для некоторых промышленных химикатов. Таким образом, ацетилен может гидратироваться с образованием ацетальдегида , который, в свою очередь, может окисляться до уксусной кислоты. Процессы получения акрилатов также были коммерциализированы. Почти все эти процессы устарели с появлением этилена и пропилена, получаемых из нефти. [36]
Нишевые приложения
[ редактировать ]В 1881 году русский химик Михаил Кучеров [37] описал гидратацию ацетилена в ацетальдегид с использованием таких катализаторов, как бромид ртути (II) . До появления процесса Вакера эта реакция проводилась в промышленных масштабах. [38]
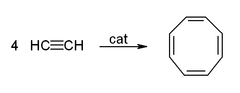
Полимеризация катализаторами ацетилена с Циглера-Натта приводит к образованию полиацетиленовых пленок. Полиацетилен — цепочка центров CH с чередующимися одинарными и двойными связями — был одним из первых открытых органических полупроводников . Его реакция с йодом приводит к образованию материала с высокой электропроводностью. Хотя такие материалы бесполезны, эти открытия привели к развитию органических полупроводников , что было признано Нобелевской премией по химии в 2000 году Алану Дж. Хигеру , Алану Дж. МакДиармиду и Хидеки Сиракаве . [8]
В 1920-х годах чистый ацетилен экспериментально использовался в качестве ингаляционного анестетика . [39]
Ацетилен иногда используется для цементации (то есть закалки) стали, когда объект слишком велик, чтобы поместиться в печи. [40]
Ацетилен используется для улетучивания углерода при радиоуглеродном датировании . Углеродистый материал археологического образца обрабатывается металлическим литием в небольшой специализированной исследовательской печи с образованием карбида лития (также известного как ацетилид лития). Затем карбид может быть подвергнут реакции с водой, как обычно, с образованием газообразного ацетилена, который подается в масс-спектрометр для измерения изотопного отношения углерода-14 к углероду-12. [41]
Сгорание ацетилена дает сильный и яркий свет, а повсеместное распространение карбидных ламп способствовало значительной коммерциализации ацетилена в начале 20 века. Общие области применения включали прибрежные маяки , [42] уличные фонари , [43] и автомобиль [44] и шахтные фары . [45] В большинстве этих применений прямое горение представляет опасность возгорания , поэтому ацетилен был заменен сначала лампами накаливания , а много лет спустя светодиодами малой мощности и высокой светоотдачи. Тем не менее, ацетиленовые лампы по-прежнему используются ограниченно в отдаленных или иным образом недоступных районах, а также в странах со слабой или ненадежной центральной электросетью . [45]
Естественное явление
[ редактировать ]Энергетическое богатство тройной связи C≡C и довольно высокая растворимость ацетилена в воде делают его подходящим субстратом для бактерий при наличии адекватного источника. [46] Идентифицирован ряд бактерий, живущих на ацетилене. Фермент ацетальдегида ацетиленгидратаза катализирует гидратацию ацетилена с образованием : [47]
- С 2 Н 2 + Н 2 О → СН 3 СНО
Ацетилен — умеренно распространенное химическое вещество во Вселенной, часто связанное с атмосферами газовых гигантов . [48] Одно любопытное открытие ацетилена произошло на Энцеладе , спутнике Сатурна . Считается, что природный ацетилен образуется в результате каталитического разложения длинноцепочечных углеводородов при температуре 1700 К (1430 ° C; 2600 ° F) и выше. Поскольку такие температуры крайне маловероятны на таком маленьком отдалённом теле, это открытие потенциально наводит на мысль о каталитических реакциях на этой луне, что делает её многообещающим местом для поиска пребиотической химии. [49] [50]
Реакции
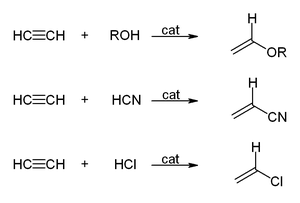
[ редактировать ]Реакции винилирования
[ редактировать ]В реакциях винилирования соединения H-X присоединяются по тройной связи. Спирты и фенолы присоединяются к ацетилену с образованием виниловых эфиров . Тиолы дают винилтиоэфиры. Аналогичным образом винилпирролидон и винилкарбазол производятся в промышленности путем винилирования 2-пирролидона и карбазола . [29] [8]
Гидратация ацетилена представляет собой реакцию винилирования, но образующийся виниловый спирт изомеризуется в ацетальдегид . Реакцию катализируют соли ртути. Эта реакция когда-то была доминирующей технологией производства ацетальдегида, но ее заменил процесс Вакера , который дает ацетальдегид путем окисления этилена , более дешевого сырья. Аналогичная ситуация применима к превращению ацетилена в ценный винилхлорид путем гидрохлорирования, а не оксихлорирования этилена.
Винилацетат используется вместо ацетилена для некоторых винилирований, которые более точно описываются как трансвинилирования . [51] Высшие эфиры винилацетата использовались в синтезе винилформиата .
Металлоорганическая химия
[ редактировать ]Ацетилен и его производные (2-бутин, дифенилацетилен и др.) образуют комплексы с переходными металлами . Его связь с металлом в чем-то аналогична связи этиленовых комплексов. Эти комплексы являются промежуточными продуктами во многих каталитических реакциях, таких как тримеризация алкинов в бензол, тетрамеризация в циклооктатетраен . [8] и карбонилирование до гидрохинона : [52]

- Fe(CO) 5 + 4 C 2 H 2 + 2 H 2 O → 2 C 6 H 4 (OH) 2 + FeCO 3 в основных условиях (50–80 °С , 20–25 атм ).
металлов Ацетилиды , виды формулы L n M−C 2 R также распространены. Ацетилид меди(I) и ацетилид серебра могут легко образовываться в водных растворах благодаря благоприятному равновесию растворимости . [53]
Кислотно-основные реакции
[ редактировать ]Ацетилен имеет p K a 25, ацетилен может быть депротонирован супероснованием образованием с ацетилида : [53]
Различные металлоорганические [54] и неорганический [55] реагенты эффективны.

гидрирование
[ редактировать ]Ацетилен можно полугидрировать до этилена , обеспечивая сырье для различных полиэтиленовых пластиков. Галогены присоединяются к тройной связи.
Безопасность и обращение
[ редактировать ]Ацетилен не особенно токсичен, но, будучи получен из карбида кальция , он может содержать токсичные примеси, такие как следы фосфина и арсина , которые придают ему отчетливый чесночный запах. Он также легко воспламеняется, как и большинство легких углеводородов, поэтому его используют при сварке. Его самая особенная опасность связана с его внутренней нестабильностью, особенно когда он находится под давлением: при определенных условиях ацетилен может вступать в экзотермическую реакцию присоединения с образованием ряда продуктов, обычно бензола и/или винилацетилена , возможно, в дополнение к углероду и водород . [ нужна ссылка ] Следовательно, ацетилен, если он инициируется сильным нагревом или ударной волной, может разложиться со взрывом, если абсолютное давление газа превышает примерно 200 килопаскалей (29 фунтов на квадратный дюйм). Большинство регуляторов и манометров на оборудовании показывают манометрическое давление , поэтому безопасный предел для ацетилена составляет 101 кПа ( манометрическое давление) или 15 фунтов на квадратный дюйм. [56] [57] Поэтому он поставляется и хранится растворенным в ацетоне или диметилформамиде (ДМФ). [57] [58] [59] содержится в газовом баллоне с пористым наполнением , что делает его безопасным при транспортировке и использовании при правильном обращении. Баллоны с ацетиленом следует использовать в вертикальном положении, чтобы избежать вытекания ацетона во время использования. [60]
Информация о безопасном хранении ацетилена в вертикальных баллонах предоставлена OSHA. [61] [62] Ассоциация сжатого газа, [57] Администрация США по безопасности и гигиене труда на шахтах (MSHA), [63] СОБСТВЕННЫЙ, [60] и другие агентства.
Медь катализирует разложение ацетилена, поэтому ацетилен не следует транспортировать в медных трубах. [64]
Баллоны следует хранить в помещении, изолированном от окислителей, чтобы избежать обострения реакции в случае возгорания/протечки. [57] [62] Баллоны с ацетиленом не следует хранить в замкнутых пространствах, закрытых транспортных средствах, гаражах и зданиях, чтобы избежать непреднамеренной утечки, приводящей к взрывоопасной атмосфере. [57] [62] В США Национальный электротехнический кодекс (NEC) требует учитывать опасные зоны, в том числе те, где ацетилен может выделяться во время аварий или утечек. [65] Рассмотрение может включать электрическую классификацию и использование электрических компонентов группы А в США. [65] Дополнительную информацию об определении областей, требующих особого внимания, можно найти в NFPA 497. [66] В Европе ATEX также требует учитывать опасные зоны, где во время аварий или утечек могут выделяться горючие газы. [60]
Ссылки
[ редактировать ]- ^ Номенклатура органической химии: Рекомендации ИЮПАК и предпочтительные названия 2013 (Синяя книга) . Кембридж: Королевское химическое общество . 2014. с. 375. дои : 10.1039/9781849733069-FP001 . ISBN 978-0-85404-182-4 .
Название ацетилен сохранено за соединением HC≡CH. Это предпочтительное имя IUPAC, но его замена любого рода не допускается; однако в общей номенклатуре допускается замещение, например, фторацетиленом [фторэтином (ПИН)], но не алкильными группами или какой-либо другой группой, удлиняющей углеродную цепь, а также характерными группами, выраженными суффиксами.
- ^ Ациклические углеводороды. Правило А-3. Ненасыщенные соединения и одновалентные радикалы. Архивировано 10 октября 2000 г. в Wayback Machine , Номенклатура органической химии ИЮПАК.
- ^ Запись ацетилена в базе данных веществ GESTIS Института охраны труда.
- ^ Jump up to: а б с д Карманный справочник NIOSH по химическим опасностям. «#0008» . Национальный институт охраны труда и здоровья (NIOSH).
- ^ «Ацетилен – Газовая энциклопедия Air Liquide» . Эйр Ликид . Архивировано из оригинала 4 мая 2022 года . Проверено 27 сентября 2018 г.
- ^ Jump up to: а б с CRC справочник по химии и физике: готовый справочник химических и физических данных . Уильям М. Хейнс, Дэвид Р. Лид, Томас Дж. Бруно (2016–2017, 97-е изд.). Бока-Ратон, Флорида. 2016. ISBN 978-1-4987-5428-6 . OCLC 930681942 . Архивировано из оригинала 4 мая 2022 года . Проверено 4 мая 2022 г.
{{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка ) CS1 maint: другие ( ссылка ) - ^ Р. Х. Петруччи; У. С. Харвуд; Ф.Г.Селедка (2002). Общая химия (8-е изд.). Прентис-Холл. п. 1072.
- ^ Jump up to: а б с д и ж Пасслер, Питер; Хефнер, Вернер; Бакл, Клаус; Мейнасс, Хельмут; Мейсвинкель, Андреас; Вернике, Ханс-Юрген; Эберсберг, Гюнтер; Мюллер, Рихард; Бесслер, Юрген; Берингер, Хартмут; Майер, Дитер (2008). «Химия ацетилена». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a01_097.pub3 . ISBN 978-3527306732 .
- ^ Ассоциация по сжатому газу (1995). Паспорт безопасности и технических данных - ацетилен. Архивировано 11 июля 2012 г. в Wayback Machine.
- ^ Уиттен К.В., Гейли К.Д. и Дэвис Р.Э. Общая химия (4-е изд., Saunders College Publishing, 1992), стр. 328–329, 1046. ISBN 0-03-072373-6 .
- ^ Эдмунд Дэви (август 1836 г.) «Уведомление о новом газообразном бикарбюраторе водорода». Архивировано 6 мая 2016 г. в Wayback Machine , отчет шестого собрания Британской ассоциации содействия развитию науки… , 5 : 62–63.
- ^ Миллер, С.А. (1965). Ацетилен: его свойства, производство и использование . Том. 1. Academic Press Inc. Архивировано из оригинала 15 апреля 2021 года . Проверено 16 июля 2021 г.
- ^ Бертоле (1860) « Заметка о новой серии органических соединений, тетрауглеродном гидриде и его производных ». Архивировано 13 июля 2015 года в Wayback Machine (Заметка о новой серии органических соединений, тетрауглеродном гидриде и его производных), Труды , серия 3, 50 : 805–808.
- ^ Иде, Аарон Дж. (1961). «Конгресс в Карлсруэ: столетняя ретроспектива» . Журнал химического образования . 38 (2): 83. Бибкод : 1961ЖЧЭд..38...83И . дои : 10.1021/ed038p83 . Архивировано из оригинала 30 декабря 2021 года . Проверено 29 декабря 2021 г.
Для углерода использовались атомные веса 6 и 12.
- ^ Бертло (1862) « Синтез ацетилена путем прямого соединения углерода с водородом ». Архивировано 14 августа 2020 г. в Wayback Machine (Синтез ацетилена путем прямого соединения углерода с водородом), Отчеты , серия 3, 54 : 640–644. .
- ↑ Ацетилен . Архивировано 28 января 2012 года в Wayback Machine .
- ^ Ганнон, Ричард Э. (2000). «Ацетилен из углеводородов». Энциклопедия химической технологии Кирка-Отмера . дои : 10.1002/0471238961.0103052007011414.a01 . ISBN 9780471484943 .
- ^ Jump up to: а б Пасслер, Питер; Хефнер, Вернер; Бакл, Клаус; Мейнасс, Хельмут; Мейсвинкель, Андреас; Вернике, Ханс-Юрген; Эберсберг, Гюнтер; Мюллер, Рихард; Бесслер, Юрген; Берингер, Хартмут; Майер, Дитер (2008). «Химия ацетилена». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a01_097.pub3 . ISBN 978-3527306732 .
- ^ Хабил, Фил; Сакс, Ганс (1954). «Производство ацетилена неполным сгоранием углеводородов кислородом (Производство ацетилена неполным сгоранием углеводородов кислородом)». Технология инженера-химика . 26 (5): 245–253. doi : 10.1002/cite.330260502 .
- ^ Хабил, Фил; Бартоломея, Э. (1954). «Проблемы крупнотоннажных установок по производству ацетилена кислородным способом». Технология инженера-химика . 26 (5): 253–258. doi : 10.1002/cite.330260503 .
- ^ Ацетилен: как производятся продукты. Архивировано 20 января 2007 г. в Wayback Machine.
- ^ «Как это работает» . Преобразование материалов . Проверено 21 июля 2023 г.
- ^ Велер (1862) « Образование ацетилена углеродом кальция ». Архивировано 12 мая 2016 года в Wayback Machine (Образование ацетилена карбидом кальция), Annals of Chemistry and Pharmacie , 124 : 220.
- ^ Хольцрихтер, Клаус; Нотт, Альфонс; Мерченк, Бернд; Зальцингер, Йозеф (2013). «Карбид кальция». Энциклопедия промышленной химии Ульмана . стр. 1–14. дои : 10.1002/14356007.a04_533.pub2 . ISBN 978-3-527-30673-2 .
- ^ Фриман, Гораций (1919). «Производство Цианамида» . «Химические новости» и «Журнал физической науки» . 117 : 232. Архивировано из оригинала 15 апреля 2021 года . Проверено 23 декабря 2013 г.
- ^ Органическая химия 7-е изд. Дж. Макмерри, Томсон, 2008 г.
- ^ Хаускрофт, CE; Шарп, AG (2008). Неорганическая химия (3-е изд.). Прентис Холл. стр. 94–95. ISBN 978-0-13-175553-6 .
- ^ Справочник по химии и физике (60-е изд., CRC Press 1979–80), стр. C-303 в таблице физических констант органических соединений (указанных как этин ).
- ^ Jump up to: а б Харреус, Альбрехт Людвиг; Бэкес, Р.; Эйхлер, Ж.-О.; Фейерхак, Р.; Якель, К.; Ман, У.; Пинкос, Р.; Фогельсанг»2-Пирролидон, Р. (2011). Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. doi : 10.1002/14356007.a22_457.pub2 . ISBN 978-3527306732 .
{{cite encyclopedia}}: CS1 maint: числовые имена: список авторов ( ссылка ) - ^ «Ацетилен» . Продукция и поставки > Топливные газы . Линде. Архивировано из оригинала 12 января 2018 года . Проверено 30 ноября 2013 г.
- ^ Справочник ESAB по ацетилен-кислородной сварке - Свойства ацетилена. Архивировано 10 мая 2020 г. в Wayback Machine .
- ^ Jump up to: а б Тротуш, Иоанн-Теодор; Циммерманн, Тобиас; Шют, Ферди (2014). «Каталитические реакции ацетилена: новый взгляд на сырье для химической промышленности» . Химические обзоры . 114 (3): 1761–1782. дои : 10.1021/cr400357r . ПМИД 24228942 .
- ^ Графье, Хайнц; Кёрниг, Вольфганг; Вайц, Ханс Мартин; Рейсс, Вольфганг; Стеффан, Гвидо; Диль, Герберт; Боше, Хорст; Шнайдер, Курт; Кецка, Хайнц (15 июня 2000 г.), «Бутандиолы, бутенедиол и бутинедиол» , в Wiley-VCH Verlag GmbH & Co. KGaA (редактор), Энциклопедия промышленной химии Ульмана , Вайнхайм, Германия: Wiley-VCH Verlag GmbH & Co. .KGaA, стр. a04_455, doi : 10.1002/14356007.a04_455 , ISBN. 978-3-527-30673-2 , S2CID 178601434 , заархивировано из оригинала 19 марта 2022 г. , получено 3 марта 2022 г.
- ^ Фальбе, Юрген; Бахрманн, Гельмут; Липпс, Вольфганг; Майер, Дитер (15 июня 2000 г.), «Алифатические спирты» , в Wiley-VCH Verlag GmbH & Co. KGaA (редактор), Энциклопедия промышленной химии Ульмана , Вайнхайм, Германия: Wiley-VCH Verlag GmbH & Co. KGaA, стр. a01_279, doi : 10.1002/14356007.a01_279 , ISBN 978-3-527-30673-2 , заархивировано из оригинала 9 марта 2022 года , получено 3 марта 2022 года.
- ^ Такаси Охара; Такахиса Сато; Нобору Симидзу; Гюнтер Прешер; Гельмут Швинд; Отто Вайберг; Клаус Мартен; Хельмут Грейм (2003). «Акриловая кислота и ее производные». Энциклопедия промышленной химии Ульмана : 7. doi : 10.1002/14356007.a01_161.pub2 . ISBN 3527306730 .
- ^ Шоберт, Гарольд (2014). «Производство ацетилена и химикатов на его основе из угля». Химические обзоры . 114 (3): 1743–1760. дои : 10.1021/cr400276u . ПМИД 24256089 .
- ^ Кучеров, М. (1881). «О новом методе прямого присоединения воды (гидратации) к углеводородам ацетиленового ряда» . Отчеты Немецкого химического общества . 14 : 1540–1542. дои : 10.1002/cber.188101401320 . Архивировано из оригинала 2 декабря 2020 года . Проверено 9 сентября 2019 г.
- ^ Дмитрий Анатольевич Пономарев; Сергей Михайлович Шевченко (2007). «Гидратация ацетилена: 125 лет» (PDF) . Дж. Хим. Образование. 84 (10): 1725. Бибкод : 2007ЖЧЭд..84.1725П . дои : 10.1021/ed084p1725 . Архивировано (PDF) из оригинала 11 июня 2011 года . Проверено 18 февраля 2009 г.
- ^ Уильям Стэнли Сайкс (1930). «Ацетилен в медицине». Британская энциклопедия . Том. 1 (14 изд.). п. 119.
- ^ «Ацетилен» . Продукты и услуги . БОК. Архивировано из оригинала 17 мая 2006 года.
- ^ Гейх, Мебус (1990). «Проблемы радиоуглеродного датирования с использованием ацетилена в качестве счетного газа» . Радиоуглерод . 32 (3): 321–324. дои : 10.2458/azu_js_rc.32.1278 . Архивировано из оригинала 26 декабря 2013 года . Проверено 26 декабря 2013 г.
- ^ «Лампы маяка сквозь время Томаса Тэга | Общество маяков США» . uslhs.org . Архивировано из оригинала 25 февраля 2017 года . Проверено 24 февраля 2017 г.
- ^ Майерс, Ричард Л. (2007). 100 важнейших химических соединений: Справочное руководство . АВС-КЛИО. ISBN 978-0-313-33758-1 . Архивировано из оригинала 17 июня 2016 года . Проверено 21 ноября 2015 г.
- ^ Грейнджер, Д., (2001). Ранний свет автомобилей: краткая история фар: фары 1900-х годов имели красные и зеленые линзы по левому и правому борту. Национальная почта. [Торонто издание] DT7.
- ^ Jump up to: а б Торп, Дэйв (2005). Карбидный фонарь: последнее пламя в американских шахтах . Издательство Бергамот. ISBN 978-0976090526 .
- ^ Акоб, Дениз (август 2018 г.). «Ацетиленотрофия: скрытый, но повсеместный микробный метаболизм?» . ФЭМС Микробиология Экология . 94 (8). дои : 10.1093/femsec/fiy103 . ПМК 7190893 . ПМИД 29933435 . Проверено 28 июля 2022 г.
- ^ тен Бринк, Феликс (2014). «Глава 2. Жизнь на ацетилене. Первозданный источник энергии». Питер М. Х. Кронек и Марта Э. Соса Торрес (ред.). Металлоориентированная биогеохимия газообразных соединений в окружающей среде . Ионы металлов в науках о жизни. Том. 14. Спрингер. стр. 15–35. дои : 10.1007/978-94-017-9269-1_2 . ISBN 978-94-017-9268-4 . ПМИД 25416389 .
- ^ «Предшественник белков и ДНК, обнаруженный в звездном диске» (пресс-релиз). Обсерватория В.М.Кека . 20 декабря 2005 г. Архивировано из оригинала 23 февраля 2007 г.
- ^ Эмили Лакдавалла (17 марта 2006 г.). «LPSC: среда, полдень: Кассини на Энцеладе» . Планетарное общество . Архивировано из оригинала 20 февраля 2012 года.
- ^ Джон Спенсер; Дэвид Гринспун (25 января 2007 г.). «Планетология: Внутри Энцелада» . Природа . 445 (7126): 376–377. Бибкод : 2007Natur.445..376S . дои : 10.1038/445376b . ПМИД 17251967 . S2CID 4427890 .
- ^ Манчанд, Перси С. (2001). «Винилацетат». Энциклопедия реагентов для органического синтеза . дои : 10.1002/047084289X.rv008 . ISBN 0471936235 .
- ^ Реппе, Уолтер; Кутепов, Н.; Магин, А (1969). «Циклизация ацетиленовых соединений». Angewandte Chemie International Edition на английском языке . 8 (10): 727–733. дои : 10.1002/anie.196907271 .
- ^ Jump up to: а б Вихе, Хайнц Гюнтер (1969). Химия ацетиленов (1-е изд.). Нью-Йорк: Марсель Деккер, Inc. стр. 170–179 и 225–241. ISBN 978-0824716752 .
- ^ Мидленд, ММ; Маклафлин, Дж.И.; Верли, Ральф Т. (младший) (1990). «Приготовление и использование ацетилида лития: 1-метил-2-этинилэндо - 3,3-диметил-2-норборнанол». Органические синтезы . 68 : 14. дои : 10.15227/orgsyn.068.0014 .
- ^ Коффман, Дональд Д. (1940). «Диметилэтинилкарбинол». Органические синтезы . 40:20 . дои : 10.15227/orgsyn.020.0040 .
- ^ «Спецификация ацетилена» . ООО КФК СтарТек. Архивировано из оригинала 11 марта 2014 года . Проверено 2 мая 2012 г.
- ^ Jump up to: а б с д и «law.resource.org CGA g-1 2009 (включено посредством ссылки)» (PDF) . Архивировано (PDF) из оригинала 10 октября 2016 г. Проверено 30 ноября 2016 г. .
- ^ Дауни, Северная Каролина (1997). Промышленные газы . Лондон; Нью-Йорк: Blackie Academic & Professional. ISBN 978-0-7514-0352-7 .
- ^ Корзун, Николай (1986). 1000 слов о взрывчатке и взрыве . Варшава: Издательство Министерства национальной обороны. ISBN 83-11-07044-Х . OCLC 69535236 .
- ^ Jump up to: а б с «Правила практики EIGA: ацетилен» (PDF) . Архивировано из оригинала (PDF) 1 декабря 2016 года . Проверено 30 ноября 2016 г. .
- ^ «OSHA 29 CFR 1910.102 Ацетилен» . Архивировано из оригинала 1 декабря 2016 года . Проверено 30 ноября 2016 г. .
- ^ Jump up to: а б с «OSHA 29 CFR 1926.350 Газовая сварка и резка» . Архивировано из оригинала 1 декабря 2016 года . Проверено 30 ноября 2016 г. .
- ^ Особая опасность ацетилена. Архивировано 24 марта 2016 г. в Wayback Machine ДЕПАРТАМЕНТА ТРУДА США, Управление по безопасности и гигиене труда в шахтах - MSHA.
- ^ Дэниел_Сарачик (16 октября 2003 г.). «ПРЕДУПРЕЖДЕНИЕ О БЕЗОПАСНОСТИ АЦЕТИЛЕНА» (PDF) . Управление по охране окружающей среды и безопасности (EHS). Архивировано (PDF) из оригинала 13 июля 2018 года . Проверено 27 сентября 2018 г.
- ^ Jump up to: а б «Бесплатный доступ NFPA к редакции NFPA 70 (NEC) 2017 года» . Архивировано из оригинала 1 декабря 2016 года . Проверено 30 ноября 2016 г. .
- ^ «Свободный доступ NFPA к NFPA 497 – Рекомендуемая практика классификации легковоспламеняющихся жидкостей, газов или паров и опасных (классифицированных) мест для электроустановок в зонах химических процессов» . Архивировано из оригинала 1 декабря 2016 года . Проверено 30 ноября 2016 г. .
Внешние ссылки
[ редактировать ]- Завод по производству ацетилена и подробный процесс. Архивировано 11 апреля 2015 г. в Wayback Machine.
- Ацетилен в химии оживает!
- Ацетилен, принципы его получения и использования в проекте «Гутенберг»
- Фильм, объясняющий образование ацетилена из карбида кальция и пределы взрывоопасности, создающие опасность пожара.
- Карбид кальция и ацетилен в периодической таблице видео (Ноттингемский университет)
- CDC - Карманный справочник NIOSH по химическим опасностям - ацетилен