Реакция Паусона-Ханда

Реакция Паусона -Кханда (ПК) — химическая реакция , описываемая как [2+2+1] циклоприсоединение . В нем алкин , алкен и окись углерода соединяются в α,β- циклопентенон в присутствии металл-карбонильного катализатора. [ 1 ] [ 2 ] Ихсан Улла Кханд (1935–1980) обнаружил эту реакцию примерно в 1970 году, когда работал научным сотрудником Питера Людвига Паусона (1925–2013) в Университете Стратклайда в Глазго. [ 3 ] [ 4 ] [ 5 ] Первоначальные открытия Паусона и Кханда носили межмолекулярный характер, но реакция имела плохую селективность. В некоторых современных приложениях вместо этого применяется реакция на внутримолекулярные концы. [ 6 ]
Традиционная реакция требует стехиометрического количества октакарбонила дикобальта , стабилизированного атмосферой углерода монооксида . [ 7 ] Каталитические количества металлов, повышенная реакционная способность и выход или стереоиндукция возможны при использовании правильных хиральных вспомогательных веществ , выбора переходного металла (Ti, Mo, W, Fe, Co, Ni, Ru, Rh, Ir и Pd) и добавок. [ 8 ] [ 9 ] [ 10 ] [ 11 ]
Механизм
[ редактировать ]Хотя этот механизм еще не полностью выяснен, объяснение Магнуса 1985 г. [ 12 ] широко распространен как для моно-, так и для биядерных катализаторов и подтверждено вычислительными исследованиями, опубликованными Накамурой и Яманакой в 2001 году. [ 13 ] Реакция начинается с комплекса дикобальта с гексакарбонилацетиленом . Связывание алкена дает металлциклопентеновый комплекс. Затем CO миграционно вставляется в связь MC. Восстановительное выведение доставляет циклопентенон . Обычно скорость диссоциации монооксида углерода из металлоорганического комплекса является лимитирующей. [ 8 ]

- 1:
- Алкиновая координация , вставка и диссоциация лиганда с образованием 18-электронного комплекса ;
- 2:
- Диссоциация лиганда с образованием 16-электронного комплекса;
- 3:
- Координация алкена с образованием 18-электронного комплекса;
- 4:
- Вставка алкена и ассоциация лиганда ( синперипланарная , все еще 18 электронов);
- 5:
- Миграционная вставка CO;
- 6, 7:
- Восстановительное удаление металла (потеря [Co 2 (CO) 6 ]);
- 8:
- Ассоциация CO для регенерации активного металлоорганического комплекса. [ 14 ]
Селективность
[ редактировать ]Реакция работает как с концевыми, так и с внутренними алкинами, хотя внутренние алкины имеют тенденцию давать более низкие выходы. Порядок реакционной способности алкена:
(напряженный циклический) > (концевой) > (двузамещенный) > (трехзамещенный).
Тетразамещенные алкены и алкены с сильно электроноакцепторными группами непригодны.
С несимметричными алкенами или алкинами реакция редко бывает региоселективной , хотя некоторые закономерности можно наблюдать.

Для монозамещенных алкенов алкиновые заместители обычно являются прямыми: более крупные группы предпочитают C 2 положение, а электроноакцепторные группы предпочитают C 3 позиция.

Но сам алкен с трудом различает C 4 и С 5 положение, если только C 2 положение стерически перегружено или алкен имеет хелатирующий гетероатом.
Плохая селективность реакции улучшается во внутримолекулярных реакциях . По этой причине внутримолекулярная реакция Паусона-Кханда распространена в общем синтезе, особенно при образовании 5,5- и 6,5-членных слитых велосипедов .
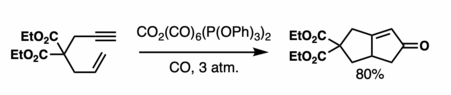
Обычно реакция является высокосинселективной по отношению к водороду мостика и заместителям циклопентана.

Соответствующие хиральные лиганды или вспомогательные вещества могут сделать реакцию энантиоселективной (см. § Амин-N-оксиды ). BINAP Обычно используется .
Добавки
[ редактировать ]
Типичными условиями Паусона-Ханда являются повышенные температуры и давления в ароматических углеводородных (бензол, толуол) или эфирных (тетрагидрофуран, 1,2-дихлорэтан) растворителях. Эти суровые условия можно смягчить добавлением различных добавок.

Впитывающие поверхности
[ редактировать ]Адсорбция металлического комплекса на кремнеземе или оксиде алюминия может повысить скорость обмена декарбонильных лигандов, как показано на изображении ниже. [ 15 ] [ 16 ] Это происходит потому, что донор располагается на твердой поверхности (т.е. кремнеземе). [ нужны разъяснения ] Кроме того, использование твердой опоры ограничивает конформационное движение ( эффект ротамера ). [ 17 ] [ 18 ] [ 19 ]
Базы Льюиса
[ редактировать ]Традиционные каталитические вспомогательные средства, такие как фосфиновые лиганды, делают кобальтовый комплекс слишком стабильным, но объемистые фосфитные лиганды работоспособны.
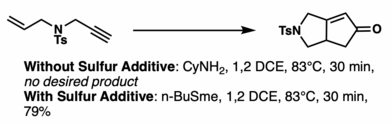
основные добавки Льюиса, такие как n -BuSMe Считается, что , ускоряют процесс обмена декарбонилирующих лигандов. Однако альтернативная точка зрения заключается в том, что добавки вместо этого делают необратимым внедрение олефинов. [ 20 ] Соединения серы обычно трудны в обращении и имеют неприятный запах, но н-додецилметилсульфид [ 21 ] и тетраметилтиомочевина [ 22 ] не страдают от этих проблем и могут улучшить реакцию.
Амин N -оксиды
[ редактировать ]Двумя наиболее распространенными амино- N -оксидами являются N -метилморфолина -оксид N (NMO) и -оксид триметиламина N (TMANO) . Считается, что эти добавки удаляют лиганды монооксида углерода посредством нуклеофильной атаки N -оксида на карбонил CO, окисляя CO до CO 2 и образуя ненасыщенный металлоорганический комплекс. [ 23 ] [ 24 ] Это делает первый этап механизма необратимым и позволяет создать более мягкие условия. гидраты вышеупомянутых амино- N -оксидов. Аналогичное действие оказывают [ 25 ] [ 26 ] [ 27 ]

Добавки N -оксида также могут улучшать энантио- и диастереоселективность, хотя механизм этого не ясен. [ 28 ] [ 29 ] [ 30 ]

Альтернативные катализаторы
[ редактировать ](Co) 4 (CO) 12 и Co 3 (CO) 9 (μ 3 -CH) также катализируют ПК-реакцию [ 31 ] [ 32 ] хотя Такаяма и др. подробно описывают реакцию, катализируемую октакарбонилом дикобальта . [ 33 ]

Одним из методов стабилизации является создание катализатора на месте . Чанг сообщает, что Co(acac) 2 может служить предкатализатором , активируемым боргидридом натрия . [ 35 ]
Другие металлы
[ редактировать ]Для катализатора требуется сокатализатор трифлат серебра для осуществления реакции Паусона-Ханда: [ 36 ]

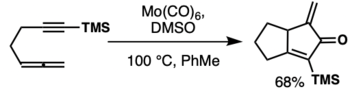
Гексакарбонил молибдена является донором монооксида углерода в реакциях ПК-типа между алленами и алкинами с диметилсульфоксидом в толуоле. [ 37 ] Титан, никель, [ 38 ] и цирконий [ 39 ] комплексы допускают реакцию. В этих превращениях можно использовать и другие металлы. [ 40 ] [ 9 ]
Толерантность к подложке
[ редактировать ]В целом аллены поддерживают реакцию Паусона-Ханда; региоселективность определяется выбором металлического катализатора. Исследования функционала плотности показывают, что изменения возникают из-за различной геометрии металлов в переходном состоянии. [ 41 ]
Гетероатомы также приемлемы: Мукаи и др. полный синтез физостигмина Применил реакцию Паусона-Ханда к карбодиимиду . [ 42 ]

Циклобутадиен также поддается циклоприсоединению [2+2+1], хотя этот реагент слишком активен, чтобы хранить его в больших количествах. Вместо этого циклобутадиен нитрата церия-аммония образуется in situ в результате декомплексообразования стабильного трикарбонила циклобутадиен-железа с (CAN).

Примером более новой версии является использование димера хлордикарбонилродия(I) [(CO) 2 RhCl] 2 в синтезе (+)-форбола Филом Бараном . Помимо использования родиевого катализатора, этот синтез характеризуется внутримолекулярной циклизацией, в результате которой образуется обычный 5-членный α,β- циклопентенон , а также 7-членное кольцо. [ 43 ]
Образование угарного газа на месте
[ редактировать ]Циклопентеноновый мотив можно получить из альдегидов, карбоновых кислот и формиатов. В этих примерах в качестве катализатора обычно используется родий, поскольку он обычно используется в декарбонилирования реакциях . Реакция декарбонилирования и ПК протекает в одном и том же реакционном сосуде. [ 44 ] [ 45 ]
См. также
[ редактировать ]Дальнейшее чтение
[ редактировать ]Взгляд Ханда и Паусона на реакцию:
- Кханд, Ихсан У.; Нокс, Грэм Р.; Паусон, Питер Л .; Уоттс, Уильям Э. (1973a). «Кобальторганические комплексы, Часть I: Ареновые комплексы, полученные из додекакарбонилтетракобальта». Журнал Химического общества, Perkin Transactions (1): 975–977. дои : 10.1039/p19730000975 . ISSN 0300-922X .
- Кханд, Ихсан У.; Нокс, Грэм Р.; Паусон, Питер Л .; Уоттс, Уильям Э.; Форман, Майкл И. (1973b). «Кобальторганические комплексы, Часть II: Реакция ацетиленгексакарбонилдикобальтовых комплексов, (R 1 С 2 Р 2 )Co 2 (CO) 6 с норборненом и его производными». Журнал Химического общества, Perkin Transactions (1): 977–981. doi : 10.1039/p19730000977 . ISSN 0300-922X .
- Паусон, PL ; Кханд, АйЮ (1977). «Использование комплексов кобальт-карбонилацетилен в органическом синтезе». Энн. Н-Й акад. наук. 295 (1): 2–14. Бибкод : 1977NYASA.295....2P . дои : 10.1111/j.1749-6632.1977.tb41819.x . S2CID 84203764 .
Для современной точки зрения:
- Хартвиг, Джон Ф. (2010). Химия органопереходных металлов: от связывания к катализу . Милл-Вэлли, Калифорния: Университетские научные книги. ISBN 978-1-891389-53-5 . OCLC 310401036 – через Knovel.
- Риос Торрес, Рамон (2012). Риос Торрес, Рамон (ред.). Реакция Паусона-Ханда: область применения, варианты и применение . Хобокен, Нью-Джерси: John Wiley & Sons. дои : 10.1002/9781119941934 . ISBN 978-1-118-30863-9 . OCLC 774982574 .
- Гибсон, Сьюзен Э.; Стивенацци, Андреа (2003). «Реакция Паусона-Ханда: эпоха катализа наступила!». Энджью. хим. Межд. Эд. 42 (16): 1800–1810. дои : 10.1002/anie.200200547 . ПМИД 12722067 .
- Бухвальд, Стивен Л.; Хикс, Фредерик А. (1999). «Реакции типа Паусона – Кханда». В Якобсене, Эрик Н.; Пфальц, Андреас; Ямамото Хисаси (ред.). Комплексный асимметричный катализ . Том. II. Берлин: Шпрингер. стр. 491–513.
Ссылки
[ редактировать ]- ^ Кханд, АйЮ; Нокс, Греция; Паусон, Польша; Уоттс, МЫ (1971). «Реакция расщепления, индуцированная кобальтом, и новая серия карбонильных комплексов аренкобальта». Журнал Химического общества D: Химические коммуникации : 36а. дои : 10.1039/C2971000036A .
- ^ Бланко-Ургоити, Хайме; Аньорбе, Лорето; Перес-Серрано, Летисия; Домингес, Хема; Перес-Кастельс, Хавьер (2004). «Реакция Паусона-Ханда, мощный синтетический инструмент для синтеза сложных молекул». хим. Соц. Преподобный. 33 (1): 32–42. дои : 10.1039/b300976a . ПМИД 14737507 .
- ^ Вернер, Хельмут (2014). «Некролог: Питер Людвиг Паусон (1925–2013)». Энджью. хим. Межд. Эд. 53 (13): 3309. doi : 10.1002/anie.201400432 .
- ^ Кханд и др. 1973а .
- ^ Кханд и др. 1973б .
- ^ Шор, штат Невада; Крудас, MC (1 декабря 1981 г.). «Получение бицикло[3.3.0]окт-1-ен-3-она и бицикло[4.3.0]нон-1(9)-ен-8-она путем внутримолекулярной циклизации альфа,омега-енинов. " . Журнал органической химии . 46 (26): 5436–5438. дои : 10.1021/jo00339a046 . ISSN 0022-3263 .
- ^ Бухвальд и Хикс 1999 .
- ^ Jump up to: а б Хартвиг 2010 .
- ^ Jump up to: а б Риос Торрес 2012 .
- ^ Шор, Нил Э. (1991). «Реакция циклоприсоединения Паусона-Ханда для синтеза циклопентенонов». Орг. Реагировать. 40 : 1–90. дои : 10.1002/0471264180.или040.01 . ISBN 0471264180 .
- ^ Гибсон и Стивенацци 2003 .
- ^ Магнус, Филип; Принсипи, Лоуренс М. (январь 1985 г.). «Природа 1,2- и 1,3-стереоселективности в циклизациях дикобальтоктакарбонилалкен-алкин для синтеза замещенных бицикло[3.3.0]октенонов» . Буквы тетраэдра . 26 (40): 4851–4854. дои : 10.1016/s0040-4039(00)94968-2 . ISSN 0040-4039 . , позже расширенный до Магнус, Филип; Эксон, Кристофер; Олбо-Робертсон, Памела (1 января 1985 г.). «Дикобальтоктакарбонил-алкиновые комплексы как полупродукты синтеза бицикло[3.3.0]октенонов для синтеза кориолина и гирсутиновой кислоты» . Тетраэдр . 41 (24): 5861–5869. дои : 10.1016/S0040-4020(01)91425-5 . ISSN 0040-4020 .
- ^ Яманака, Масахиро; Накамура, Эйичи (1 февраля 2001 г.). «Исследование функционала плотности реакции Паусона-Ханда» . Журнал Американского химического общества . 123 (8): 1703–1708. дои : 10.1021/ja005565+ . ISSN 0002-7863 . ПМИД 11456770 .
- ^ Курти Ласло; Чако Барбара (2005). Стратегическое применение названных реакций в органическом синтезе: предыстория и подробные механизмы . Амстердам: Elsevier Academic Press. ISBN 978-0-12-429785-2 . OCLC 60792519 .
- ^ Биллингтон, Дэвид С.; Уиллисон, Дебра (1984). «Простой кобальторганический синтез замещенных 3-оксабицикло[3.3.0]окт-6-ен-7-онов» . Буквы тетраэдра . 25 (36): 4041–4044. дои : 10.1016/0040-4039(84)80061-1 . ISSN 0040-4039 .
- ^ Моримото, Такаши; Хирано, Масао; Этигоя, Коки; Сато, Такафуми (1986). «Окисление β-метилстиролов ацетатом кобальта(III). Часть 10. Влияние кольцевых заместителей на распределение продуктов окисления β-метилстиролов ацетатом кобальта(III) в уксусной кислоте» . Дж. Хим. Soc., Перкин Транс. 2 (8): 1205–1209. дои : 10.1039/p29860001205 . ISSN 0300-9580 .
- ^ Браун, Скотт В.; Паусон, Питер Л. (1990). «Синтез азотистых гетероциклов внутримолекулярной реакцией Ханда: образование тетра- и гексагидроциклопента[c]пиррол-5(1H)-онов и гексагидро-6H-2-пириндин-6-онов» . Журнал Химического общества, Perkin Transactions 1 (4): 1205–1209. дои : 10.1039/p19900001205 . ISSN 0300-922X .
- ^ Шилов, Александр Е; Шульпин, Георгий Б (31 мая 1987 г.). «Активация и каталитические реакции алканов в растворах металлокомплексов» . Российское химическое обозрение . 56 (5): 442–464. Бибкод : 1987RuCRv..56..442S . дои : 10.1070/rc1987v056n05abeh003282 . ISSN 0036-021X . S2CID 250841849 .
- ^ Смит, Вашингтон; Киреев С.Л.; Нефедов О.М.; Тарасов, В.А. (1989-01-01). «Метиленциклопропан как алкеновый компонент в реакции Ханда-Паусона» . Буквы тетраэдра . 30 (30): 4021–4024. дои : 10.1016/S0040-4039(00)99313-4 . ISSN 0040-4039 .
- ^ Валле, Карлос Перес дель; Миле, Энн; Гимбер, Ив; Грин, Эндрю Э. (2005). «Промоутеры базы Льюиса в реакции Паусона-Ханда: другой сценарий» . Angewandte Chemie, международное издание . 44 (35): 5717–5719. дои : 10.1002/anie.200500955 . ISSN 1521-3773 . ПМИД 16078280 .
- ^ Кокрейн, Элисон Р.; Керр, Уильям Дж.; Патерсон, Лаура К.; Пирсон, Колин М.; Шоу, Пол (08 января 2021 г.). «Достижения в катализируемой кобальтом реакции Паусона-Ханда: разработка протокола с использованием микроволнового излучения, стимулируемого сульфидами» . Тетраэдр . 78 : 131805. doi : 10.1016/j.tet.2020.131805 . ISSN 0040-4020 . S2CID 229387356 .
- ^ Рейтер, Карин; Фёгтле, Фриц (март 2000 г.). «Ротаксаны с добавлением Майкла †» . Органические письма . 2 (5): 593–595. дои : 10.1021/ol990350u . ISSN 1523-7060 . ПМИД 10814386 .
- ^ Шамбаяни, Соруш; Кроу, Уильям Э.; Шрайбер, Стюарт Л. (1 января 1990 г.). «N-оксид способствует циклизации Паусон-Ханда при комнатной температуре» . Буквы тетраэдра . 31 (37): 5289–5292. дои : 10.1016/S0040-4039(00)98052-3 . ISSN 0040-4039 .
- ^ Альпер, Ховард; Эдвард, Джей Ти (3 февраля 2011 г.). «Реакции пентакарбонила железа с соединениями, содержащими связь N—O» . Канадский химический журнал . 48 (10): 1543–1549. дои : 10.1139/v70-251 .
- ^ Кроуфорд, Джеймс Дж.; Керр, Уильям Дж.; Маклафлин, Марк; Моррисон, Ангус Дж.; Паусон, Питер Л.; Терстон, Грэм Дж. (4 декабря 2006 г.). «Использование высокоэффективной внутримолекулярной циклизации Паусона-Кханда для формального полного синтеза (±)-α- и β-цедрена путем получения цедрона» . Тетраэдр . 62 (49): 11360–11370. дои : 10.1016/j.tet.2006.05.044 . ISSN 0040-4020 .
- ^ Крафт, Мари Э.; Ромеро, Ромуло Х.; Скотт, Ян Л. (1 сентября 1992 г.). «Реакция Паусона-Ханда с электронодефицитными алкинами» . Журнал органической химии . 57 (20): 5277–5278. дои : 10.1021/jo00046a001 . ISSN 0022-3263 .
- ^ Бернардес, Ваня; Канн, Нина; Риера, Энтони; Мояно, Альберт; Перикас, Майкл А.; Грин, Эндрю Э. (1 октября 1995 г.). «Асимметричная циклизация Паусона-Ханда: формальный полный синтез природного брефелдина А» . Журнал органической химии . 60 (21): 6670–6671. дои : 10.1021/jo00126a010 . ISSN 0022-3263 .
- ^ Jump up to: а б Джеймисон, Тимоти Ф.; Шамбаяти, Соруш; Кроу, Уильям Э.; Шрайбер, Стюарт Л. (1 мая 1997 г.). «Тандемное использование кобальт-опосредованных реакций для синтеза (+)-эпоксидидиктимена, дитерпена, содержащего трансконденсированную кольцевую систему 5-5» . Журнал Американского химического общества . 119 (19): 4353–4363. дои : 10.1021/ja970022u . ISSN 0002-7863 .
- ^ Карбери, Дэвид Р.; Керр, Уильям Дж.; Линдси, Дэвид М.; Скотт, Джеймс С.; Уотсон, Стивен П. (22 апреля 2000 г.). «Получение и реакция десимметризованных кобальталкиновых комплексов» . Буквы тетраэдра . 41 (17): 3235–3239. дои : 10.1016/S0040-4039(00)00356-7 . ISSN 0040-4039 .
- ^ Йоньчик, Анджей; Конарская, Анна (июль 1999 г.). «Получение и реакции илидов аммония в основных двухфазных системах: удобный синтез циклопропанов, оксиранов и алкенов, замещенных электроноакцепторными группами» . Синлетт . 1999 (7): 1085–1087. дои : 10.1055/s-1999-2757 . ISSN 0936-5214 . S2CID 196781210 .
- ^ Ким, Чон Ук; Чунг, Ён Гын (февраль 1998 г.). «Реакция Паусона-Ханда, катализируемая Co4(CO)12» . Синтез . 1998 (2): 142–144. дои : 10.1055/с-1998-2016 . ISSN 0039-7881 . S2CID 196736582 .
- ^ Сугихара, Такумичи; Ямагучи, Масахико (1 октября 1998 г.). «Реакция Паусона-Ханда, катализируемая нонакарбонильным кластером метилидинтрикобальта» . Журнал Американского химического общества . 120 (41): 10782–10783. дои : 10.1021/ja982635s . ISSN 0002-7863 .
- ^ Jump up to: а б с Красиво, Ацуши; Когуре, Норюки; Китачима, Марико; Такаяма, Хиромицу (2011). «Асимметричный полный синтез пентациклического алкалоида ликоподия: гиперзин-Q». Солнце. хим. Межд. Эд. 50 (35): 8025–8028. дои : 10.1002/anie.201103550 . ПМИД 21751323 . S2CID 10947595 .
- ^ Хо, Це-Лок (2016). «Дикобальт Октакарбонил» . Реагенты Физерса для органического синтеза . Том. 28. Джон Уайли и сыновья . стр. 251–252. ISBN 9781118942819 .
- ^ Ли, Нам Ён; Чунг, Ён Гын (апрель 1996 г.). «Синтез циклопентенонов: новая каталитическая реакция социклизации алкина, алкена и монооксида углерода с использованием каталитических Co(acac)2 и NaBH4» . Буквы тетраэдра . 37 (18): 3145–3148. дои : 10.1016/0040-4039(96)00513-8 . ISSN 0040-4039 .
- ^ Накчхоль Чжон, Бён Ки Сон, Джин Сон Ким, Сун Бон Пак, Сон Док Со, Джин Ён Шин, Кю Ёль Ин, Юн Кён Чхве Реакция типа Паусон-Кханд, опосредованная катализаторами Rh (I) Pure Appl. хим. , Том. 74, № 1, стр. 85–91, 2002 г. ( Интернет-статья )
- ^ Кент, Дж (1995). «Новое алленовое циклоприсоединение Паусона-Ханда для получения α-метиленциклопентенонов». Буквы тетраэдра . 36 (14): 2407–2410. дои : 10.1016/0040-4039(95)00315-4 .
- ^ Титан:
- Хикс, Фредерик А.; Бухвальд, Стивен Л. (1 января 1996 г.). «Высокоэнантиоселективное каталитическое образование бициклических циклопентенонов типа Паусона-Ханда» . Журнал Американского химического общества . 118 (46): 11688–11689. дои : 10.1021/ja9630452 . ISSN 0002-7863 .
- Хикс, Фредерик А.; Каблауи, Наташа М.; Бухвальд, Стивен Л. (январь 1996 г.). «Катализируемое титаноценом циклокарбонилирование энинов в циклопентеноны» . Журнал Американского химического общества . 118 (39): 9450–9451. дои : 10.1021/ja9621509 . ISSN 0002-7863 .
- Чжан, Минхуэй; Бухвальд, Стивен Л. (январь 1996 г.). «Катализируемый никелем (0) процесс превращения энинов в бициклические циклопентеноны» . Журнал органической химии . 61 (14): 4498–4499. дои : 10.1021/jo960410z . ISSN 0022-3263 . ПМИД 11667365 .
- ^
- Негиси, Эйичи; Холмс, Стивен Дж.; Тур, Джеймс М.; Миллер, Джозеф А. (1 апреля 1985 г.). «Металл способствует циклизации. 7. Цирконий способствует бициклизации енинов» . Журнал Американского химического общества . 107 (8): 2568–2569. дои : 10.1021/ja00294a071 . ISSN 0002-7863 .
- Негиси, Эйичи; Холмс, Стивен Дж.; Тур, Джеймс М.; Миллер, Джозеф А.; Седербаум, Фредерик Э.; Суонсон, Дуглас Р.; Такахаши, Тамоцу (апрель 1989 г.). «Циклизация, стимулируемая металлами. 19. Новая бициклизация енинов и диинов, стимулируемая производными цирконоцена, и превращение цирконабициклов в бициклические еноны посредством карбонилирования» . Журнал Американского химического общества . 111 (9): 3336–3346. дои : 10.1021/ja00191a035 . ISSN 0002-7863 .
- ^ Чон, Накчхоль; Хван, Сон Хи; Ли, Ёншин; Чунг, Ён Гын (апрель 1994 г.). «Каталитическая версия внутримолекулярной реакции Паусона-Ханда» . Журнал Американского химического общества . 116 (7): 3159–3160. дои : 10.1021/ja00086a070 . ISSN 0002-7863 .
- ^ Байден, Александр С.; Браммонд, Кей М .; Джордан, Кеннет Д. (01 октября 2006 г.). «Вычислительный взгляд на каталитические точки принятия решения в реакции циклокарбонилирования алленов, катализируемой переходным металлом [2 + 2 + 1]» . Металлоорганические соединения . 25 (22): 5204–5206. дои : 10.1021/om0607503 . ISSN 0276-7333 . ПМЦ 4441411 . ПМИД 26005240 .
- ^ Мукаи, Чисато; Ёсида, Тацунори; Соримачи, Мао; Одани, Акира (январь 2006 г.). «Co 2 (CO) 8 -Катализируемая внутримолекулярная гетеро-Паусон-Ханд-реакция алкинкарбодиимида: синтез (±)-физостигмина» . Органические буквы 8 (1): 83–86. дои : 10.1021/ol052562z . ISSN 1523-7060 . ПМИД 16381573 .
- ^ Кавамура, Сюхей; Чу, Ханг; Фелдинг, Якоб; Бэран, Фил С. (2016). «Девятнадцатиэтапный полный синтез (+)-форбола» . Природа . 532 (7597): 90–93. Бибкод : 2016Natur.532...90K . дои : 10.1038/nature17153 . ПМЦ 4833603 . ПМИД 27007853 .
- ^ Моримото, Цумору; Фудзи, Кодзи; Цуцуми, Кен; Какиучи, Киёми (2002). «Реакции карбонилирования с переносом CO. Каталитическая реакция типа Паусона-Ханда энинов с альдегидами как источник монооксида углерода». Журнал Американского химического общества . 124 (15): 3806–3807. дои : 10.1021/ja0126881 .
- ^ Сибата, Таканори; Тосида, Нацуко; Такаги, Кентаро (2002). «Каталитическая реакция типа Паусона-Ханда с использованием альдегидов в качестве источника CO». Органические письма . 4 (9): 1619–1621. дои : 10.1021/ol025836g .