Силоксан

В кремнийорганической химии силоксан — это органическое соединение , содержащее функциональную группу из двух атомов кремния, связанных с атомом кислорода : Си-О-Си . Исходные и включают олигомерные силоксаны полимерные гидриды формул H[OSiH 2 ] n OH и [OSiH 2 ] н . [1] К силоксанам также относятся разветвленные соединения , определяющей особенностью которых является то, что каждая пара кремниевых центров разделена одним атомом кислорода. Силоксановая функциональная группа образует основу силиконов . [-R 2 Si-O-SiR 2 -] n , главным примером которого является полидиметилсилоксан (ПДМС). [2] Функциональная группа R 3 SiO- (где три R могут быть разными) называется силокси . соединений Силоксаны являются искусственными и имеют множество коммерческих и промышленных применений из-за гидрофобности , низкой теплопроводности и высокой гибкости.
Структура
[ редактировать ]Силоксаны обычно принимают структуры, ожидаемые для связанных тетраэдров (« sp 3 -подобные") центры. Si-O Длина связи составляет 1,64 Å (по сравнению с расстоянием Si-C 1,92 Å), а угол Si-O-Si довольно открыт и составляет 142,5 °. [3] Напротив, расстояние C-O в типичном диалкиловом эфире намного короче и составляет 1,414 (2) Å с более острым углом C-O-C, равным 111 °. [4] Можно принять во внимание, что силоксаны будут иметь низкие барьеры для вращения вокруг связей Si-O вследствие низких стерических затруднений. Это геометрическое соображение лежит в основе полезных свойств некоторых силоксансодержащих материалов, таких как их низкие температуры стеклования .
Синтез силоксанов
[ редактировать ]
Основной путь получения силоксановой функциональной группы — гидролиз хлоридов кремния :
- 2 R 3 Si−Cl + H 2 O → R 3 Si−O−SiR 3 + 2 HCl
Реакция протекает через начальное образование силанолов (R 3 Si−OH):
- R 3 Si−Cl + H 2 O → R 3 Si−OH + HCl
Затем силоксановая связь может образовываться по пути силанол + силанол или по пути силанол + хлорсилан:
- 2 R 3 Si−OH → R 3 Si−O−SiR 3 + H 2 O
- R 3 Si-OH + R 3 Si-Cl → R 3 Si-O-SiR 3 + HCl
Гидролиз силилдихлорида может давать линейные или циклические продукты. Линейные продукты имеют концевые силанольные группы:
- n R 2 Si(OH) 2 → H(R 2 SiO) n OH + ( n − 1) H 2 O
Циклические продукты не имеют силанольных концов:
- n R 2 Si(OH) 2 → (R 2 SiO) n + n H 2 O
Линейные продукты — полидиметилсилоксан (ПДМС) — имеют большую коммерческую ценность. Для их производства необходимо производство диметилкремния дихлорида .
Начиная с трисиланолов, возможны клетки, такие как виды с формулой (RSi) n O 3 n /2 с кубической ( n = 8) и гексагонально-призматической ( n = 12) структурами. Кубические клетки представляют собой кластеры кубанского типа с кремниевыми центрами в углах куба, кислородными центрами, охватывающими каждый из двенадцати ребер. [6]
Реакции
[ редактировать ]Окисление кремнийорганических соединений, в том числе силоксанов, дает диоксид кремния . Это превращение иллюстрируется горением гексаметилциклотрисилоксана :
- ((CH 3 ) 2 SiO) 3 + 12 O 2 → 3 SiO 2 + 6 CO 2 + 9 H 2 O
Сильное основание разрушает силоксановую группу, часто образуя силоксидные соли :
- ((CH 3 ) 3 Si) 2 O + 2 NaOH → 2 (CH 3 ) 3 SiONa + H 2 O
Эта реакция протекает с образованием силанолов. Подобные реакции используются в промышленности для превращения циклических силоксанов в линейные полимеры. [2]
Использование
[ редактировать ]Полисилоксаны (силиконы) при горении в инертной атмосфере обычно подвергаются пиролизу с образованием оксикарбида кремния или карбида кремния (SiC). Используя эту реакцию, полисилоксаны стали использовать в качестве прекерамических полимеров в различных процессах, включая аддитивное производство. Поливинилсилоксан (винилполисилоксан) используется для изготовления зубных и промышленных оттисков. Использование предшественника полисилоксана в керамике на основе полимеров позволяет формировать керамические тела сложной формы, хотя необходимо учитывать значительную усадку при пиролизе. [ нужна ссылка ]
Трисилоксаны можно использовать в качестве жидкости для диффузионных насосов .
циклометиконы
[ редактировать ]Циклометиконы представляют собой группу метилсилоксанов, класс жидких силиконов (циклические полидиметилсилоксановые полимеры), которые обладают характеристиками низкой вязкости и высокой летучести , а также являются смягчающими средствами для кожи и в определенных обстоятельствах полезными чистящими растворителями. [7] В отличие от диметиконов , которые представляют собой линейные неиспаряющиеся силоксаны цикличны , циклометиконы : обе группы состоят из основной цепи [(CH 3 ) 2 SiO] n . Они используются во многих косметических продуктах, включая дезодоранты и антиперспиранты, которые должны покрывать кожу, но не оставаться впоследствии липкими. [8] Компания Dow является крупным производителем циклометиконов. [9]
Циклометиконы, как и все силоксаны, разлагаются путем гидролиза с образованием силанолов . [10] Эти силанолы производятся в таких низких количествах, что не мешают гидролитическим ферментам. [11] Хотя некоторые циклометиконы по структуре напоминают краун-эфиры , они слабо связывают ионы металлов. [12]
Номенклатура
[ редактировать ]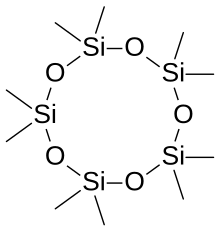
Слово силоксан происходит от кремний , кислород и алкан . слов В некоторых случаях силоксановые материалы состоят из нескольких различных типов силоксановых групп; они помечены в соответствии с количеством связей Si-O:
- М-единицы: (CH 3 ) 3 SiO 0,5 ,
- D-единицы: (CH 3 ) 2 SiO,
- Т-единицы: (CH 3 )SiO 1,5 .
| Циклические силоксаны (циклометиконы) | КАС | Линейные силоксаны | КАС |
|---|---|---|---|
| L 2 , ММ: гексаметилдисилоксан. | 107-46-0 | ||
| D3 . : гексаметилциклотрисилоксан | 541-05-9 | L 3 , МДМ: октаметилтрисилоксан. | 107-51-7 |
| D 4 : октаметилциклотетрасилоксан. | 556-67-2 | L 4 , MD 2 M: декаметилтетрасилоксан. | 141-62-8 |
| D5 . : декаметилциклопентасилоксан | 541-02-6 | L 5 , MD 3 M: додекаметилпентасилоксан. | 141-63-9 |
| D6 . : додекаметилциклогексасилоксан | 540-97-6 | L 6 , MD 4 M: тетрадекаметилгексасилоксан. | 107-52-8 |
Соображения безопасности и защиты окружающей среды
[ редактировать ]Поскольку силиконы широко используются в биомедицинских и косметических целях, их токсикология тщательно изучается. «Инертность силиконов по отношению к теплокровным животным была продемонстрирована в ряде испытаний». При LD 50 для крыс >50 г/кг они практически нетоксичны. [13] Однако остаются вопросы о хронической токсичности или последствиях биоаккумуляции, поскольку силоксаны могут быть долгоживущими.
Выводы о биоаккумуляции во многом основаны на лабораторных исследованиях. Полевые исследования биоаккумуляции не достигли консенсуса. «Даже если концентрации силоксанов, которые мы обнаружили в рыбе, высоки по сравнению с концентрациями классических загрязнителей, таких как ПХБ , несколько других исследований во фьорде Осло в Норвегии, озере Пепин в США и озере Эри в Канаде показали снижение концентрации силоксанов. на более высоких уровнях пищевой цепи. Это открытие поднимает вопрос о том, какие факторы влияют на потенциал биоаккумуляции силоксанов». [14]
Циклометиконы распространены повсеместно, поскольку они широко используются в биомедицинских и косметических целях. Их можно найти на высоких уровнях в американских городах. Они могут быть токсичными для водных животных в концентрациях, часто встречающихся в окружающей среде. [15] [16] циклометиконы D 4 и D 5 обладают способностью к биоаккумуляции в некоторых водных организмах. Согласно одному сообщению, [17]
В Европейском Союзе D 4 , D 5 и D 6 считаются опасными согласно регламенту REACH . Они были охарактеризованы как вещества, вызывающие очень большую озабоченность (SVHC) из-за их свойств PBT и vPvB . [18] Канада регулирует D 4 в соответствии с планом предотвращения загрязнения. [15] Научный обзор, проведенный в Канаде в 2011 году, пришел к выводу, что «Силоксан D5 не представляет опасности для окружающей среды». [19]
Литература
[ редактировать ]- Кристоф Рюкер, Клаус Кюммерер: Экологическая химия органосилоксанов. В: Химические обзоры . 115(1), 2015, с. 466–524, дои : 10.1021/cr500319v .
Ссылки
[ редактировать ]- ^ Силоксаны , Золотая книга ИЮПАК .
- ^ Перейти обратно: а б Рёше, Л.; Джон, П.; Рейтмайер, Р. «Органические кремниевые соединения» Энциклопедия промышленной химии Ульмана. Джон Уайли и сыновья: Сан-Франциско, 2003. два : 10.1002/14356007.a24_021 .
- ^ Х. Стейнфинк, Б. Пост и И. Фанкучен. «Кристаллическая структура октаметилциклотетрасилоксана». Акта Кристаллогр. 1955, вып. 8, 420–424. дои : 10.1107/S0365110X55001333 .
- ^ К. Войнович, У. Лоузхэнд, Н. В. Митцель. «Агрегация дихлорсилана и диметилового эфира: новый мотив в образовании аддукта галосилана». Далтон Транс., 2004, 2578–2581. два : 10.1039/B405684A .
- ^ Кремний: Кремнийорганическая химия. Онлайн-энциклопедия неорганической химии, 2-е изд.; Уайли: Нью-Джерси, 2005. два : 10.1002/0470862106.ia220 .
- ^ С.Д. Кинраде, Дж.Ч. Донован, А.С. Шах и КТГ Найт (2002), Два замещенных кубических октамерных силикатных каркаса в водном растворе . Дж. Хим. Soc., Далтон Транс. , 1250–1252. дои : 10.1039/b107758a .
- ^ Барбара Канегсберг; Эдвард Канегсберг (2011). Справочник по критической уборке: чистящие средства и системы . КПР. п. 19. ISBN 978-1-4398-2827-4 .
- ^ Амарджит Сахота (25 ноября 2013 г.). Устойчивое развитие: как косметическая промышленность становится экологичной . Уайли. п. 208. ИСБН 978-1-118-67650-9 .
- ^ Мейер Розен (23 сентября 2005 г.). Справочник по системам доставки средств личной гигиены и косметических продуктов: технологии, применение и составы . Уильям Эндрю. п. 693. ИСБН 978-0-8155-1682-8 .
- ^ С. Варапрат, К. Л. Сальерс, К. П. Плотцке и С. Нанавати «Идентификация метаболитов октаметилциклотетрасилоксана (D4) в крысиной моче» Drug Metab Dispos 1999, 27, 1267-1273.
- ^ Р. Питшниг, С. Спирк (2016). «Химия органосилантриолов». Коорд. хим. Преподобный . 323 : 87–106. дои : 10.1016/j.ccr.2016.03.010 .
- ^ Ф. Данкерт, К. фон Ханиш (2021). «Возврат к координации силоксана: характер связи Si-O, реакционная способность и великолепные молекулярные формы». Евро. Дж. Неорг. Хим . 2021 (29): 2907–2927. дои : 10.1002/ejic.202100275 . S2CID 239645449 .
- ^ Моретто, Ганс Генрих; Шульце, Манфред; Вагнер, Гебхард (2005). «Силиконы». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a24_057 . ISBN 3527306730 .
- ^ «Силоксаны: мягкие, блестящие — и опасные?» Кристин Солбаккен, Science Nordic, 28 августа 2015 г. Проверено 31 мая 2016 г.
- ^ Перейти обратно: а б Карпус, Дженнифер (20 июня 2014 г.). «Исполнительный директор: Силиконовая промышленность должна сосредоточиться на безопасности и окружающей среде» . Новости резины и пластмассы . Проверено 8 апреля 2015 г.
- ^ Бьенковски, Брайан (30 апреля 2013 г.). «Химические вещества из средств личной гигиены широко распространены в воздухе Чикаго» . Научный американец . Проверено 8 апреля 2015 г.
- ^ Ван, Де-Гао; Норвуд, Уоррен; Алаи, Мехран; Байер, Джонатан Д.; Бримбл, Саманта (октябрь 2013 г.). «Обзор последних достижений в исследованиях токсичности, обнаружения, возникновения и судьбы циклических летучих метилсилоксанов в окружающей среде». Хемосфера . 93 (5): 711–725. Бибкод : 2013Chmsp..93..711W . doi : 10.1016/j.chemSphere.2012.10.041 . ПМИД 23211328 .
- ^ «Список кандидатов на получение разрешения на вещества, вызывающие особую озабоченность» . ЭХА . Проверено 18 декабря 2019 г.
- ^ Отчет наблюдательного совета по декаметилциклопентасилоксану (силоксан D5)