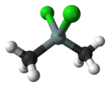
Диметилдихлорсилан
 | |||
| |||
| Имена | |||
|---|---|---|---|
| Предпочтительное название ИЮПАК Дихлорди(метил)силан | |||
| Другие имена Дихлордиметилсилан, дихлордиметилкремний, диметилкремния дихлорид, диметилсилан дихлорид, ДМДКС | |||
| Идентификаторы | |||
3D model ( JSmol ) | |||
| ХимическийПаук | |||
| Информационная карта ECHA | 100.000.820 | ||
| Номер ЕС |
| ||
ПабХим CID | |||
| номер РТЭКС |
| ||
| НЕКОТОРЫЙ | |||
| Число | 1162 | ||
Панель управления CompTox ( EPA ) | |||
| Характеристики | |||
| С 2 Н 6 Cl 2 Si | |||
| Молярная масса | 129.06 g·mol −1 | ||
| Появление | Бесцветная жидкость | ||
| Плотность | 1,07 г·см −3 ( л ) | ||
| Температура плавления | -76 ° C (-105 ° F; 197 К) | ||
| Точка кипения | 70 ° C (158 ° F; 343 К) | ||
| Разлагается | |||
| Опасности | |||
| СГС Маркировка : | |||
  | |||
| Опасность | |||
| Х225 , Х315 , Х319 , Х335 | |||
| P210 , P233 , P240 , P241 , P242 , P243 , P261 , P264 , P271 , P280 , P302+P352 , P303+P361+P353 , P304+P340 , P305+P351+P338 , P312 , П332 1 , +П313 , П337+ P313 , P362 , P370+P378 , P403+P233 , P403+P235 , P405 , P501 | |||
| точка возгорания | −9 ° C (16 ° F; 264 К) | ||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |||
Диметилдихлорсилан представляет собой тетраэдрическое кремнийорганическое соединение формулы Si(CH 3 ) 2 Cl 2 . При комнатной температуре это бесцветная жидкость, которая легко реагирует с водой с образованием как линейных, так и циклических цепочек Si-O. Диметилдихлорсилан производится в промышленных масштабах в качестве основного предшественника соединений диметилсиликона и полисилана .
История
[ редактировать ]О первых кремнийорганических соединениях сообщили в 1863 году Чарльз Фридель и Джеймс Крафтс , которые синтезировали тетраэтилсилан из диэтилцинка и тетрахлорида кремния . [1] Однако большого прогресса в кремнийорганической химии не произошло до тех пор, пока Фредерик Киппинг и его ученики не начали экспериментировать с диорганодихлорсиланами. R 2 SiCl 2 ), полученные взаимодействием тетрахлорида кремния с реактивами Гриньяра . К сожалению, этот метод страдал от многих экспериментальных проблем. [2]
В 1930-е годы спрос на силиконы возрос в связи с необходимостью создания более качественных изоляторов для электродвигателей и уплотнительных материалов для авиационных двигателей, а вместе с этим и необходимостью более эффективного синтеза диметилдихлорсилана. Чтобы решить эту проблему, General Electric , Corning Glass Works и Dow Chemical Company заключили партнерство, которое в конечном итоге стало компанией Dow Corning . В 1941–1942 годах Юджин Г. Рохов , химик из General Electric, и Ричард Мюллер , работавший независимо в Германии, нашли альтернативный синтез диметилдихлорсилана, который позволил производить его в промышленных масштабах. [1] Этот прямой синтез, или прямой процесс , который используется в современной промышленности, включает реакцию элементарного кремния с метилхлоридом в присутствии медного катализатора.
Подготовка
[ редактировать ]Синтез Рочоу включал пропускание метилхлорида через нагретую трубку, заполненную измельченным кремнием и хлоридом меди (I) . [2] Современный промышленный метод помещает мелкоизмельченный кремний в реактор с псевдоожиженным слоем при температуре около 300 °C. Катализатор применяется как Си 2 О. Затем метилхлорид пропускают через реактор с получением в основном диметилдихлорсилана.
Механизм прямого синтеза неизвестен. Однако медный катализатор необходим для протекания реакции.
Помимо диметилдихлорсилана, продуктами этой реакции являются СН 3 SiCl 3 , CH 3 SiHCl 2 и (CH 3 ) 3 SiCl , которые отделяют друг от друга фракционной перегонкой . Выходы и температуры кипения этих продуктов показаны в следующей таблице. [3]
| Продукт | Урожай (%) | Температура кипения (°C) |
|---|---|---|
| ( CH3 ) SiCl2SiCl2 | 80–90 | 70.0 |
| CH3SiClCH3SiCl3 | 5–15 | 65.7 |
| СН 3 SiHCl 2 | 3–5 | 40.7 |
| (СН 3 ) 3 SiCl | 3–5 | 57.3 |
Основные реакции
[ редактировать ]Диметилдихлорсилан гидролизуется с образованием линейных и циклических силиконов , соединений, содержащих основные цепи Si-O. Длина образующегося полимера зависит от концентрации концевых групп цепи, которые добавляются в реакционную смесь. Скорость реакции определяется переносом реагентов через границу водно-органической фазы; следовательно, реакция наиболее эффективна в турбулентных условиях. Реакционную среду можно дополнительно варьировать для максимизации выхода конкретного продукта.
Диметилдихлорсилан реагирует с метанолом с образованием диметоксидиметилсиланов.
Хотя гидролиз диметоксидиметилсиланов происходит медленнее, он выгоден, когда побочный продукт соляной кислоты нежелателен: [3]
Поскольку диметилдихлорсилан легко гидролизуется, с ним нельзя обращаться на воздухе. Одним из методов решения этой проблемы является преобразование его в менее реакционноспособный бис(диметиламино)силан.
Еще одним преимуществом замены диметилдихлорсилана на его аналог бис(диметиламино)силана является то, что он образует точно чередующийся полимер при сочетании с сомономером дисиланола. [4]
Сплав натрия и калия можно использовать для полимеризации диметилдихлорсилана с образованием полисилановых цепей с основной цепью Si-Si. Например, додекаметилциклогексасилан можно получить таким способом: [5] В результате реакции также образуются полидиметилсилан и декаметилпентасилан. Различные типы предшественников дихлорсилана, такие как Ph 2 SiCl 2 может быть добавлен для регулирования свойств полимера. [3]
В органическом синтезе (вместе со своим близким родственником дифенилдихлорсиланом ) используется в качестве защитной группы для гем -диолов . [ нужна ссылка ]
Приложения
[ редактировать ]
Основная цель диметилдихлорсилана — использование в синтезе силиконов — отрасли, стоимость которой в 2005 году оценивалась более чем в 10 миллиардов долларов в год. Он также используется в производстве полисиланов, которые, в свою очередь, являются предшественниками карбида кремния . [3] В практическом применении дихлордиметилсилан можно использовать в качестве покрытия на стекле, чтобы избежать адсорбции микрочастиц. [6]
Ссылки
[ редактировать ]- ^ Jump up to: а б Кремний: Кремнийорганическая химия. Онлайн-энциклопедия неорганической химии, 2-е изд.; Уайли: Нью-Джерси, 2005. два : 10.1002/0470862106.ia220
- ^ Jump up to: а б Рочоу, Юджин Г (1950). «Диметилдихлорсилан». Неорг. Синтез . 3 : 56–58. дои : 10.1002/9780470132340.ch14 .
- ^ Jump up to: а б с д Полисилоксаны и полисиланы. Онлайн-энциклопедия неорганической химии, 2-е изд.; Уайли: Нью-Джерси, 2005. два : 10.1002/0470862106.ia201
- ^ Ульрих Лаутер, † Саймон В. Кантор, Клаус Шмидт-Рор иУильям Дж. Макнайт, Винилзамещенные силфениленсилоксановые сополимеры: новые высокотемпературные эластомеры. Макромолекулы . 1999, 32 , стр. 3426-3431. дои : 10.1021/ma981292f
- ^ Уэст, Роберт; Бро, Лоуренс; Войновский, Веслав (2007). «Додекаметилциклогексасилан». Неорганические синтезы : 265–268. дои : 10.1002/9780470132500.ch62 . ISBN 9780470132500 .
- ^ Монджуширо, Х. и др. «Сортировка биологических микрочастиц по размеру с помощью устройства нанозазоров с кольцом Ньютона», Elsevier, 7 декабря 2005 г.


![{\displaystyle {\begin{alignedat}{4}n\ {\ce {(CH3)2SiCl2}} \ +&&n\ {\ce {H2O}} \ \longrightarrow && {\ ce {[Si(CH3)2O] }}_{n}\quad \,+&&2n\ {\ce {HCl}}\\m\ {\ce {(CH3)2SiCl2}}\ +&&\ (m\!+\!1)\ {\ ce {H2O}}\ \longrightarrow &&\ \ {\ce {HO[Si(CH3)2O]}}_{m}{\ce {H}}\ +&&\ 2m\ {\ce {HCl}}\ конец {alignedat}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d4e0baa511f1bb273ef33f3cc108686ee3a9680c)

![{\displaystyle n\ {\ce {(CH3)2Si(OCH3)2}}+n\ {\ce {H2O -> [(CH3)2SiO]}} _ {n}+2n \ {\ ce {CH3OH} }}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5d88531dd9ead52296278d348f944943e37d33ca)
![{\displaystyle {\ce {(CH3)2SiCl2 + 4 HN(CH3)2 -> (CH3)2Si[N(CH3)2]2 + 2H2N(CH3)2Cl}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/215f081fd822a68b45220e7934c004d6e8ebe400)
![{\displaystyle n\ {\ce {(CH3)2Si[N(CH3)2]2}}+n \ {\ce {HO(CH2)2SiRSi(CH2)2OH -> [(CH3)2SiO(CH2)2SiRSi (CH2)2O]}}_{n}+2n\{\ce {HN(CH3)2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/491f88d6d4c97bc39306334604bdfddbc7683986)
![{\displaystyle {\what {6 (CH3)2SiCl2 + 12 M -> [(CH3)2Si]6 + 12 MCl}} \ {\what {(M = Na, K)}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ed5ea6ce16092f39fc40b4bace119c4b6848953d)