реактив Гриньяра

Реагенты Гриньяра или соединения Гриньяра — это химические соединения общей формулы R-Mg-X , где X представляет собой галоген , а R представляет собой органическую группу , обычно алкил или арил . Двумя типичными примерами являются хлорид метилмагния. Cl-Mg-CH 3 и бромид фенилмагния (C 6 H 5 )-Mg-Br . Они представляют собой подкласс магнийорганических соединений .
Соединения Гриньяра — популярные реагенты в органическом синтезе для создания новых углерод-углеродных связей . Например, при реакции с другим галогенированным соединением R'-X' в присутствии подходящего катализатора обычно дают R−R' и галогенид магния MgXX' как побочный продукт; и последний нерастворим в обычно используемых растворителях. В этом отношении они аналогичны литийорганическим реагентам .
Реагенты Гриньяра редко выделяют в виде твердых веществ. Вместо этого с ними обычно обращаются в виде растворов в растворителях, таких как диэтиловый эфир или тетрагидрофуран, используя безвоздушные методы . Реагенты Гриньяра представляют собой комплексы с атомом магния, связанным с двумя эфирными лигандами, а также галогенидным и органильным лигандами.
Открытие реакции Гриньяра в 1900 году было отмечено Нобелевской премией, присужденной Виктору Гриньяру в 1912 году.
Синтез
[ редактировать ]Из металла Mg
[ редактировать ]Традиционно реактивы Гриньяра готовят путем обработки органического галогенида (обычно броморганического соединения) металлическим магнием. Эфиры необходимы для стабилизации магнийорганического соединения . вода и воздух, которые быстро разрушают реагент за счет протонолиза или окисления. Исключаются [1] Хотя реагенты по-прежнему должны быть сухими, ультразвук может позволить реагентам Гриньяра образовываться во влажных растворителях за счет активации магния, так что он поглощает воду. [2]
Как это обычно бывает с реакциями с участием твердых веществ и растворов, образование реактивов Гриньяра часто сопровождается индукционным периодом . На этом этапе пассивирующий оксид магния удаляется. После этого индукционного периода реакции могут быть сильно экзотермическими . Эту экзотермичность необходимо учитывать при масштабировании реакции от лаборатории до производственного предприятия. [3] Большинство галогенорганических соединений подойдут, но связи углерод-фтор обычно нереакционноспособны, за исключением специально активированного магния (через металлы Риеке ).
Магний
[ редактировать ]Обычно реакция образования реактивов Гриньяра включает использование магниевой ленты. Весь магний покрыт пассивирующим слоем оксида магния , который ингибирует реакции с органическим галогенидом. Было разработано множество методов для ослабления этого пассивирующего слоя, тем самым подвергая высокореактивный магний воздействию органического галогенида. Механические методы включают измельчение кусочков магния на месте, быстрое перемешивание и обработку ультразвуком . [4] Йод , йодистый метил и 1,2-дибромэтан являются обычными активирующими агентами. Использование 1,2-дибромэтана выгодно, поскольку его действие можно контролировать по наблюдению за пузырьками этилена . Кроме того, побочные продукты безобидны:
- Mg + BrC 2 H 4 Br → C 2 H 4 + MgBr 2
Количество Mg, потребляемое этими активаторами, обычно незначительно. Небольшое количество ртути амальгамирует хлорида поверхность металла, повышая его реакционную способность. В качестве инициатора часто используют добавление заранее приготовленного реактива Гриньяра.
Специально активированный магний, такой как магний Риеке , решает эту проблему. [5] Оксидный слой также можно разрушить с помощью ультразвука, используя стержень для перемешивания, чтобы соскоблить окисленный слой. [6] или добавив несколько капель йода или 1,2-дииодэтана . Другой вариант — использовать сублимированный магний или антрацен магния . [7]
получают восстановлением безводного : магния калием «Риеке магний » хлорида
- MgCl 2 + 2 К → Mg + 2 KCl
Механизм
[ редактировать ]По механизму реакция протекает путем одноэлектронного переноса : [8] [9] [10]
Реакция переноса Mg (обмен галоген-Mg)
[ редактировать ]Альтернативный способ приготовления реактивов Гриньяра включает перенос Mg из предварительно полученного реактива Гриньяра в органический галогенид. Используют и другие магнийорганические реагенты. [11] Преимущество этого метода заключается в том, что перенос Mg допускает многие функциональные группы. Иллюстративная реакция включает хлорид изопропилмагния и арилбромид или иодиды: [12]
- i -PrMgCl + ArCl → i -PrCl + ArMgCl
Из соединений алкилцинка (восстановительное трансметаллирование )
[ редактировать ]Другой метод синтеза реактивов Гриньяра включает реакцию Mg с цинкорганическим соединением . Этот метод использовался для получения реагентов Гриньяра на основе адамантана , которые из-за побочных реакций сочетания CC трудно получить обычным методом из алкилгалогенида и Mg. Восстановительная трансметаллизация обеспечивает: [13]
- AdZnBr + Mg → AdMgBr + Zn
Тестирование реактивов Гриньяра
[ редактировать ]Поскольку реактивы Гриньяра очень чувствительны к влаге и кислороду, было разработано множество методов проверки качества партии. Типичные тесты включают титрование взвешенными безводными протонными реагентами, например ментолом, в присутствии цветового индикатора. Взаимодействие реактива Гриньяра с фенантролином или 2,2'-бихинолином вызывает изменение цвета. [14]
Реакции реактивов Гриньяра
[ редактировать ]| Реакции реактива Гриньяра | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Назван в честь | Виктор Гриньяр | ||||||||||
| Тип реакции | Реакция сцепления | ||||||||||
| Реакция | |||||||||||
| |||||||||||
С карбонильными соединениями
[ редактировать ]Реактивы Гриньяра реагируют с различными карбонильными производными. [15]

Наиболее распространенным применением реактивов Гриньяра является алкилирование альдегидов и кетонов, т.е. реакция Гриньяра : [16]

Обратите внимание, что ацетальная функциональная группа (защищенный карбонил) не вступает в реакцию.
Такие реакции обычно включают водно-кислотную обработку, хотя этот этап редко показан на схемах реакций. В тех случаях, когда реактив Гриньяра добавляется к альдегиду или прохиральному кетону, модель Фелкина-Аня или правило Крама обычно позволяют предсказать, какой стереоизомер образуется. С легко депротонируемыми 1,3- дикетонами и родственными кислотными субстратами реактив Гриньяра RMgX действует просто как основание, давая енолят -анион и высвобождая алкан RH.
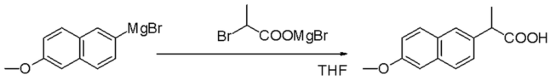
Реагенты Гриньяра представляют собой нуклеофилы в нуклеофильных алифатических замещениях , например, с алкилгалогенидами на ключевом этапе промышленного производства напроксена :
Реагенты Гриньяра также реагируют со многими «карбонилоподобными» соединениями и другими электрофилами:

Реакции как основа
[ редактировать ]Реактивы Гриньяра служат основой для непротонных субстратов (на этой схеме не указаны условия обработки, обычно включающие воду). Реактивы Гриньяра являются основными и реагируют со спиртами, фенолами и др. с образованием алкоксидов (ROMgBr). Производное феноксида подвержено формилированию параформальдегидом с образованием салицилового альдегида . [17]
Алкилирование металлов и металлоидов
[ редактировать ]Как и литийорганические соединения , реактивы Гриньяра полезны для образования связей углерод-гетероатом.
Реактивы Гриньяра реагируют со многими электрофилами на основе металлов. Например, они подвергаются переметаллированию хлоридом кадмия (CdCl 2 ) с образованием диалкилкадмия : [18]
- 2 RMgX + CdCl 2 → R 2 Cd + 2 Mg(X)Cl
Равновесие Шленка
[ редактировать ]Большинство реакций Гриньяра проводят в эфирных растворителях, особенно в диэтиловом эфире и ТГФ . Реактивы Гриньяра реагируют с 1,4-диоксаном с образованием магнийорганических соединений и нерастворимого координационного полимера. MgX 2 (диоксан) 2 и (R = органическая группа, X = галогенид):
- 2 RMgX + диоксан ⇌ R 2 Mg + MgX 2 (диоксан) 2
Эта реакция использует равновесие Шленка , сдвигая его вправо.
Прекурсоры магнезиатов
[ редактировать ]Реагенты Гриньяра реагируют с литийорганическими соединениями с образованием ататных комплексов (Bu = бутил): [19]
- BuMgBr + 3 BuLi → LiMgBu 3 + BuBr
Соединение с органическими галогенидами
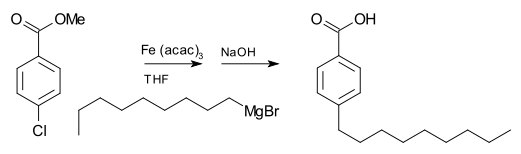
[ редактировать ]Реактивы Гриньяра обычно не реагируют с органическими галогенидами, в отличие от их высокой реакционной способности с галогенидами других основных групп. Однако в присутствии металлических катализаторов реагенты Гриньяра участвуют в реакциях сочетания CC . Например, нонилмагнийбромид реагирует с метил- п -хлорбензоатом с образованием п -нонилбензойной кислоты в присутствии трис(ацетилацетонато)железа(III) (Fe(acac) 3 ) после обработки NaOH для гидролиза сложного эфира , как показано ниже. . Без Fe(acac) 3 реактив Гриньяра будет атаковать сложноэфирную группу , а не арилгалогенид . [20]
для сочетания арилгалогенидов с арилреагентами Гриньяра также является хлорид никеля в тетрагидрофуране Хорошим катализатором (ТГФ). Кроме того, эффективным катализатором реакции сочетания алкилгалогенидов является катализатор Гилмана тетрахлоркупрат лития ( Li 2 CuCl 4 ), полученный смешением хлорида лития (LiCl) и хлорида меди(II) ( CuCl 2 ) в ТГФ. Соединение Кумада-Корриу дает доступ к [замещенным] стиролам .
Окисление
[ редактировать ]Обработка реактива Гриньяра кислородом дает органопероксид магния. Гидролиз этого материала дает гидроперекиси или спирт. В этих реакциях участвуют радикальные промежуточные соединения.
Простое окисление реактивов Гриньяра с образованием спиртов не имеет большого практического значения, поскольку выходы обычно низкие. Напротив, двухстадийная последовательность через боран ( см. выше ), который впоследствии окисляется до спирта перекисью водорода, имеет синтетическое применение.
Синтетическая полезность окисления Гриньяра может быть увеличена за счет реакции реагентов Гриньяра с кислородом в присутствии алкена с образованием этиленового расширенного спирта . [21] Для этой модификации требуются арильные или виниловые Гриньяры. Добавление только Гриньяра и алкена не приводит к реакции, демонстрирующей, что присутствие кислорода существенно. Единственным недостатком является требование наличия как минимум двух эквивалентов Гриньяра, хотя это можно частично обойти, используя двойную систему Гриньяра с дешевым восстановителем Гриньяра, таким как н-бутилмагнийбромид.

Устранение
[ редактировать ]В синтезе олефинов по Борду добавление магния к некоторым β-галогенэфирам приводит к реакции отщепления алкена. Эта реакция может ограничить полезность реакций Гриньяра.

Промышленное использование
[ редактировать ]Пример реакции Гриньяра — ключевой этап (нестереоселективного) промышленного производства тамоксифена. [22] (в настоящее время используется для лечения рецептором эстрогена с положительным рака молочной железы у женщин): [23]

См. также
[ редактировать ]Галерея
[ редактировать ]- Магниевые стружки помещают в колбу.
- Добавляют тетрагидрофуран и небольшой кусочек йода.
- При нагревании добавляют раствор алкилбромида.
- После завершения добавления смесь некоторое время нагревают.
- Формирование реактива Гриньяра завершено. Небольшое количество магния все еще остается в колбе.
- Приготовленный таким образом реактив Гриньяра охлаждают до 0°С перед добавлением карбонильного соединения. Раствор мутнеет, так как реактив Гриньяра выпадает в осадок.
- К реактиву Гриньяра добавляют раствор карбонильного соединения.
- Раствор подогревают до комнатной температуры. На этом этапе реакция завершена.
Ссылки
[ редактировать ]- ^ Гебель, Монтана; Марвел, CS (1933). «Окисление реактивов Гриньяра». Журнал Американского химического общества . 55 (4): 1693–1696. дои : 10.1021/ja01331a065 .
- ^ Смит, Дэвид Х. (1999). «Реакции Гриньяра во «мокром» эфире». Журнал химического образования . 76 (10): 1427. Бибкод : 1999JChEd..76.1427S . дои : 10.1021/ed076p1427 .
- ^ Филип Э. Ракита (1996). «5. Практика безопасного обращения с реактивами Гриньяра промышленного масштаба» ( отрывок из Google Books ) . У Гэри С. Сильвермана; Филип Э. Ракита (ред.). Справочник реактивов Гриньяра . ЦРК Пресс . стр. 79–88. ISBN 0-8247-9545-8 .
- ^ Смит, Дэвид Х. (1999). «Реакции Гриньяра во «мокром» эфире». Журнал химического образования . 76 (10): 1427. Бибкод : 1999JChEd..76.1427S . дои : 10.1021/ed076p1427 .
- ^ Рике, Р.Д. (1989). «Получение металлоорганических соединений из высокореактивных металлических порошков». Наука . 246 (4935): 1260–1264. Бибкод : 1989Sci...246.1260R . дои : 10.1126/science.246.4935.1260 . ПМИД 17832221 . S2CID 92794 .
- ^ Клейден, Джонатан; Гривз, Ник (2005). Органическая химия . Оксфорд: Оксфордский университет. Нажимать. стр. 212 . ISBN 978-0-19-850346-0 .
- ^ Уэйкфилд, Бэзил Дж. (1995). Магнийорганические методы в органической химии . Академическая пресса. стр. 21–25. ISBN 0080538177 .
- ^ Гарст, Дж. Ф.; Унгвари, Ф. «Механизм образования реактива Гриньяра». В реактивах Гриньяра ; Ричи, Р.С., ред.; Джон Уайли и сыновья: Нью-Йорк, 2000; стр. 185–275. ISBN 0-471-99908-3 .
- ^ Продвинутая органическая химия, часть B: Реакции и синтез Ф.А. Кэри, Р.Дж. Сундберг, 2-е изд. 1983. Страница 435.
- ^ Гарст, Дж. Ф.; Сориага, М.П. "Формирование реактива Гриньяра", Координат. хим. Ред. 2004 , 248, 623–652. doi:10.1016/j.ccr.2004.02.018.
- ^ Арредондо, Хуан Д.; Ли, Хунмэй; Балселлс, Жауме (2012). «Получение т-бутил-3-бром-5-формилбензоата посредством реакций селективного обмена металл-галоген» . Органические синтезы . 89 : 460. дои : 10.15227/orgsyn.089.0460 .
- ^ Кнохель, П.; Доул, В.; Гоммерманн, Н.; Кнайзель, ФФ; Копп, Ф.; Корн, Т.; Сапунцис, И.; Ву, В.А. (2003). «Высокофункциональные магнийорганические реагенты, полученные методом галоген-металлообмена». Angewandte Chemie, международное издание . 42 (36): 4302–4320. дои : 10.1002/anie.200300579 . ПМИД 14502700 .
- ^ Армстронг, Д.; Тауллай, Ф.; Сингх, К.; Мираби, Б.; Лох, Эй Джей; Фекл, У. (2017). «Адамантиловые металлические комплексы: новые пути к адамантил-анионам и новым трансметаллам». Транзакции Далтона . 46 (19): 6212–6217. дои : 10.1039/C7DT00428A . ПМИД 28443859 .
- ^ Красовский, Аркадий; Кнохель, Пол (2006). «Удобный метод титрования металлоорганических реагентов цинка, харшалади магния и лантаноидов». Синтез . 2006 (5): 890–891. дои : 10.1055/s-2006-926345 .
- ^ Генри Гилман и Р. Х. Кирби (1941). «Масляная кислота, α-метил-» . Органические синтезы ; Сборник томов , т. 1, с. 361 .
- ^ Хоган, Ярл Андре; Сонге, Пол; Рёмминг, Кристиан; Вставай, Фроде; Хартшорн, Майкл П.; Мерчан, Мануэла; Робинсон, Уорд Т.; Роос, Бьорн О.; Валланс, Клэр; Вуд, Брайан Р. (1997). «Полный синтез апокаротеноидов C31-метилкетона 2: первый полный синтез (3R)-триофаксантина» (PDF) . Acta Chemica Scandinavica . 51 : 1096–1103. doi : 10.3891/acta.chem.scand.51-1096 . Проверено 26 ноября 2009 г.
- ^ Питерс, Д.Г.; Джи, К. (2006). «Многоэтапный синтез для передовой студенческой лаборатории органической химии». Журнал химического образования . 83 (2): 290. Бибкод : 2006ЖЧЭд..83..290П . дои : 10.1021/ed083p290 .
- ^ «Блок 12 Альдегиды, кетоны и карбоновые кислоты» (PDF) . Химия Часть II Учебник для XII класса . Том. 2. Индия: Национальный совет образовательных исследований и обучения. 2010. с. 355. ИСБН 978-81-7450-716-7 . Архивировано из оригинала (PDF) 20 сентября 2018 года . Проверено 9 марта 2019 г.
- ^ Арредондо, Хуан Д.; Ли, Хунмэй; Балселлс, Жауме (2012). «Получение т-бутил-3-бром-5-формилбензоата посредством реакций селективного обмена металл-галоген» . Органические синтезы . 89 : 460. дои : 10.15227/orgsyn.089.0460 .
- ^ А. Фюрстнер, А. Лейтнер, Г. Зайдель (2004). «4-нонилбензойная кислота» . Органические синтезы . 81 : 33–42
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) . - ^ Юхэй Нобе; Кёхей Араяма; Хирокадзу Урабе (2005). «Добавление реагентов Гриньяра к олефинам с помощью воздуха. Простой протокол процесса трехкомпонентного сочетания с получением спиртов». Дж. Ам. хим. Соц. 127 (51): 18006–18007. дои : 10.1021/ja055732b . ПМИД 16366543 .
- ^ Ричи, Герман Гленн (2000). Реагенты Гриньяра: новые разработки . Уайли. ISBN 0471999083 .
- ^ Джордан ВК (1993). «Четырнадцатая лекция памяти Гаддума. Современный взгляд на тамоксифен для лечения и профилактики рака молочной железы» . Бр Джей Фармакол . 110 (2): 507–17. дои : 10.1111/j.1476-5381.1993.tb13840.x . ПМК 2175926 . ПМИД 8242225 .
Дальнейшее чтение
[ редактировать ]- Ракита, Филип Э.; Сильверман, Гэри С., ред. (1996). Справочник реактивов Гриньяра . Нью-Йорк, штат Нью-Йорк: Марсель Деккер. ISBN 0-8247-9545-8 .
- Мэри Макхейл, «Реакция Гриньяра», Connexions, http://cnx.org/content/m15245/1.2/ . 2007.
- Знания Гриньяра: Химия сочетания алкилов с недорогими переходными металлами Ларри Дж. Веструм, Fine Chemistry, ноябрь / декабрь 2002 г., стр. 10–13 [1]
Специализированная литература
[ редактировать ]- Роджерс, HR; Хилл, CL; Фудзивара, Ю.; Роджерс, Р.Дж.; Митчелл, Х.Л.; Уайтсайдс, генеральный менеджер (1980). «Механизм образования реактивов Гриньяра. Кинетика реакции алкилгалогенидов в диэтиловом эфире с магнием». Журнал Американского химического общества . 102 (1): 217. doi : 10.1021/ja00521a034 .
- Де Бур, HJR; Аккерман, ОС; Бикельхаупт, Ф. (1988). «Карбанионы как промежуточные продукты синтеза реактивов Гриньяра». Энджью. хим. Межд. Эд . 27 (5): 687–89. дои : 10.1002/anie.198806871 .
- Ван Клинк, GPM; де Бур, HJR; Шат, Г.; Аккерман, ОС; Бикельхаупт, Ф.; Спек, А. (2002). «Карбанионы как промежуточные соединения при образовании реактивов Гриньяра». Металлоорганические соединения . 21 (10): 2119–35. дои : 10.1021/om011083a . hdl : 1874/14334 . S2CID 94556915 .
- Шао, Ю.; Лю, З.; Хуанг, П.; Лю, Б. (2018). «Единая модель образования реактива Гриньяра». Физическая химия Химическая физика . 20 (16): 11100–08. Бибкод : 2018PCCP...2011100S . дои : 10.1039/c8cp01031e . ПМИД 29620768 .
![{\displaystyle {\begin{aligned}{\ce {RX{}+Mg}}&\longrightarrow {\ce {[RX^{\bullet }]^{-}{}+[Mg^{\bullet }] +}}\\{\ce {[RX^{\bullet }]-}}&\longrightarrow {\ce {R^{\bullet }{}+X-}}\\{\ce {R^{\ пуля }{}+[Mg^{\bullet }]+}}&\longrightarrow {\ce {R-Mg+}}\\{\ce {R-Mg+{}+X-}}&\longrightarrow {\ce {R-MgX}}\end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e5ad1a3f77639428eb795568fed4835951e25400)
![Реакции реактивов Гриньяра с неуглеродными электрофилами {\displaystyle {\begin{matrix}{\ce {R4B-}}\\{\color {White}\scriptstyle {\ce {Et2O.BF3\ or\ NaBF4}}}{\Bigg \uparrow }\scriptstyle { \ce {Et2O.BF3\ or\ NaBF4}}\\{\ce {Ph2PR<-[{\ce {Ph2PCl}}]RMgX->[{\ce {Bu3SnCl}}]Bu3SnR}}\\{\color {White}\scriptstyle {\ce {B(OMe)3}}}{\Bigg \downarrow }\scriptstyle {\ce {B(OMe)3}}\\{\ce {RB(OMe)2}}\ конец{матрица}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e437b60e37160b69a20e287dba0820ae949a6a4d)
![Пути окисления кислорода по Гриньяру {\displaystyle {\begin{array}{lcrll}{\ce {{R-MgX}+O2->}}\ {\color {Red}{\ce {{R^{\bullet }}+[O2^ {\bullet }]-}}}+{\ce {MgX+->}}&{\ce {ROO-MgX}}& {\color {Gray}+\ {\ce {H3O+}}}&{\ce {->{ROOH}}}&{\color {Gray}+\ {\ce {{HO-MgX}+H+}}}\\&{\Bigg \downarrow }{\ce {R-MgX}}\ \&{\ce {RO-MgX}}&{\color {Gray}+\ {\ce {H3O+}}}&{\ce {->{ROH}}}&{\color {Gray}+\ { \ce {{HO-MgX}+H+}}}\\\end{array}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/137122d243bd686bf1055500358b585b758a0c54)







