Аллильный комплекс переходного металла
Аллильные комплексы переходных металлов представляют собой координационные комплексы с аллилом и его производными в качестве лигандов . Аллил представляет собой радикал со связностью CH 2 CHCH 2 , хотя в качестве лиганда его обычно рассматривают как аллильный анион CH 2 =CH-CH 2 . − , которую обычно описывают как две эквивалентные резонансные структуры.
Примеры
[ редактировать ]Аллильный лиганд обычно встречается в металлоорганической химии . Чаще всего аллильные лиганды связываются с металлами через все три атома углерода, η 3 - режим привязки. η 3 -аллильная группа классифицируется как лиганд типа LX в схеме классификации лигандов Green LXZ и служит 3e – донор с использованием подсчета нейтральных электронов и 4e – донора с использованием ионного счета электронов. Более распространены комплексы с аллильными и другими лигандами. Примеры включают (η 3 -аллил)Mn(CO) 4 и CpPd(аллил) .
Гомолептические комплексы
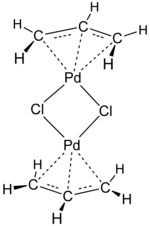
[ редактировать ]- бис(аллил)никель [1]
- бис(аллил)палладий [1]
- бис(аллил)платина [1]
- трис(аллил)хром [1]
- трис(аллил)родий [2]
- трис(аллил)иридий [2]
Хелатирующие бис(аллильные) комплексы
[ редактировать ]
1,3- Диены, такие как бутадиен и изопрен, димеризуются в координационных сферах некоторых металлов, образуя хелатирующие бис(аллильные) комплексы. Такие комплексы также возникают в результате раскрытия кольца дивинилциклобутана. Хелатирующие бис(аллильные) комплексы являются промежуточными продуктами катализируемой металлами димеризации бутадиена с образованием винилциклогексена и циклоокта-1,5-диена . [3]
Аллильные σ-лиганды
[ редактировать ]Комплексы с η 1 Также известны -аллильные лиганды (классифицируемые как лиганды Х-типа). Одним из примеров является CpFe(CO) 2 (η 1 -C 3 H 5 ), у которого к Fe-центру присоединена только метиленовая группа (т.е. она имеет связность [Fe]–CH 2 –CH=CH 2 ). Как и во многих других η 1 -аллильных комплексов моногаптичность аллильного лиганда в этом виде обеспечивается правилом 18 электронов , поскольку CpFe(CO) 2 (η 1 -C 3 H 5 ) уже представляет собой 18-электронный комплекс, а η 3 -аллильный лиганд приведет к количеству электронов 20 и нарушит правило 18 электронов . Такие комплексы могут превращаться в η 3 -аллильные производные диссоциацией нейтрального (двухэлектронного) лиганда L. Для CpFe(CO) 2 (η 1 -C 3 H 5 ), диссоциация L = CO происходит в фотохимических условиях: [4]
- CpFe(CO) 2 (η 1 -C 3 H 5 ) → CpFe(CO)(η 3 -С 3 Н 5 ) + СО
Синтетические методы
[ редактировать ]Аллильные комплексы часто образуются путем окислительного присоединения аллилгалогенидов к комплексам низковалентных металлов. Этот путь используется для получения (аллила) 2 Ni 2 Cl 2 : [5] [6]
- 2 Ni(CO) 4 + 2 ClCH 2 CH=CH 2 → Ni 2 (μ-Cl) 2 (η 3 -С 3 Н 5 ) 2 + 8 СО
Подобное окислительное присоединение включает реакцию аллилбромида с нонакарбонилом дижелеза . [7] Путь окислительного присоединения также использовался для аллильных комплексов Mo (II): [8]
- Mo(CO) 3 (пиридин) 3 + BrCH 2 CH=CH 2 → Mo(CO) 2 (Cl)(C 3 H 5 )(пиридин) 2
Другие методы синтеза включают присоединение нуклеофилов к η. 4 -диеновые комплексы и отделение гидридов от алкеновых комплексов. [2] Например, хлорид палладия (II) атакует алкены, образуя сначала алкеновый комплекс, но затем отрывает водород, образуя алкеновый комплекс дихлоргидридопалладия, а затем удаляет хлористый водород : [9]
- PdCl 2 + >C=CHCH< → Cl 2 Pd–(η 2 -(>CCHCH<)) → Cl 2 Pd(H)⚟(>CCHC<) → ClPd⚟(>CCHC<) + HCl
Один аллильный комплекс может передавать аллильный лиганд другому комплексу. [10] Анионный комплекс металла может замещать галогенид с образованием аллильного комплекса. Однако, если центр металла координирован с 6 или более другими лигандами, аллил может в конечном итоге оказаться «захваченным» в виде σ (η 1 -) лиганд. В таких обстоятельствах нагревание или облучение могут сместить другой лиганд, освободив место для связи алкен-металл. [11]
В принципе, реакции метатезиса соли могут присоединять аллильный лиганд из аллилмагнийбромида или родственного аллиллитиевого реагента. [2] Однако предшественники карбанионовых солей требуют тщательного синтеза, поскольку аллилгалогениды легко подвергаются сочетанию Вюрца . Аллилгалогениды ртути и олова, по-видимому, избегают этой побочной реакции. [12]
Бензильные комплексы
[ редактировать ]
Бензильные и аллильные лиганды часто проявляют схожие химические свойства. Бензильные лиганды обычно используют либо η 1 или η 3 режимы склеивания. Реакции взаимопревращения параллельны реакциям η 1 - или η 3 -аллильные лиганды:
- CpFe(CO) 2 (η 1 -CH 2 Ph) → CpFe(CO)(η 3 -СН 2 Ф) + СО
Во всех способах связи бензильный атом углерода прочнее связан с металлом, на что указывают расстояния связи MC, которые различаются примерно на 100%. 0,2 Å в η 3 -связанные комплексы. [14] Рентгеновская кристаллография показывает, что бензильные лиганды в тетрабензилцирконии очень гибкие. Один полиморф имеет четыре η 2 -бензильные лиганды, тогда как другой полиморф имеет два η 1 - и два η 2 -бензильные лиганды . [13]
Приложения
[ редактировать ]С точки зрения применения популярным аллильным комплексом является хлорид аллилпалладия . [15]
Реакционная способность аллильных лигандов зависит от всего комплекса, хотя влияние металлоцентра можно грубо резюмировать как [16]
- (более реакционноспособный) Fe ≫ Pd > Mo > W (менее реакционноспособный)
Такие комплексы обычно электрофильны (т.е. реагируют с нуклеофилами), а аллильные комплексы никеля обычно нуклеофильны (соответственно с электрофилами). [17] В первом случае присоединение может происходить в необычных местах и может быть полезно в органическом синтезе . [18]
Ссылки
[ редактировать ]- ^ Jump up to: а б с д О'Брайен, С.; Фишвик, М.; Макдермотт, Б.; Уоллбридж, Миннесота; Райт, Джорджия (1972). «Изолептические аллильные производные различных металлов». Неорганические синтезы . Том. 13. С. 73–79. дои : 10.1002/9780470132449.ch14 . ISBN 978-0-470-13244-9 .
- ^ Jump up to: а б с д Кевин Д. Джон; Джудит Л. Эглин; Кеннет В. Салазар; Р. Томас Бейкер; Альфред П. Саттельбергер (2014). «Трис(аллил)иридий и -родий». Неорганические синтезы: Том 36 . Том. 36. с. 165. дои : 10.1002/9781118744994.ch32 . ISBN 978-1-118-74499-4 .
- ^ Хирано, Масафуми; Сакате, Юмико; Муниципалитет Нобуюки; Комия, Санширо; Ван, Сянь-Ци; Беннетт, Мартин А. (2011). «Стехиометрические регио- и стереоселективные реакции окислительного сочетания сопряженных диенов с рутением (0). Механистический взгляд на происхождение селективности». Металлоорганические соединения . 30 (4): 768–777. дои : 10.1021/om100956f .
- ^ Фиш, RW; Гиринг, В.П.; Мартен, Д.; Розенблюм, М. (27 января 1976 г.). «Термические и фотохимические взаимные превращения изомерных монокарбонильных η5-циклопентадиенил(η3-аллил)комплексов железа» . Журнал металлоорганической химии . 105 (1): 101–118. дои : 10.1016/S0022-328X(00)91977-6 . ISSN 0022-328X .
- ^ Мартин Ф. Семмельхак и Пол М. Хелквист (1988). «Реакция арилгалогенидов с галогенидами π-аллилникеля: металлилбензол» . Органические синтезы ; Сборник томов , т. 6, с. 722 .
- ^ Крейг Р. Смит; Айбин Чжан; Дэниел Дж. Манс; ТВ Раджанбабу (2008). «(R)-3-метил-3-фенил-1-пентен посредством каталитического асимметричного гидровинилирования» . Орг. Синтез . 85 : 248–266. дои : 10.15227/orgsyn.085.0248 . ПМЦ 2723857 . ПМИД 19672483 .
- ^ Путник, Чарльз Ф.; Велтер, Джеймс Дж.; Стаки, Гален Д.; д'Аньелло, MJ; Сосинский, Б.А.; Кирнер, Дж. Ф.; Муэттертис, EL (1978). «Металлические кластеры в катализе. 15. Структурное и химическое исследование биядерного металлического комплекса гексакарбонилбис (эта 3-2-пропенил) дижелеза (Fe-Fe)». Журнал Американского химического общества . 100 (13): 4107–4116. дои : 10.1021/ja00481a020 .
- ^ Пирсон, Энтони Дж.; Шофферс, Эльке (1997). «Трикарбонилтрис (пиридин) молибден: удобный реагент для получения комплексов (π-аллил) молибдена». Металлоорганические соединения . 16 (24): 5365–5367. дои : 10.1021/om970473n .
- ^ Пирсон, AJ (1987). «Карбокатионы, стабилизированные переходными металлами, в органическом синтезе». В Хартли, Фрэнк Р. (ред.). Химия связи металл-углерод . Том. 4. Джон Уайли и сыновья. п. 911. дои : 10.1002/9780470771778 . ISBN 978-0-470-77177-8 .
- ^ Пауэлл 1982 , с. 328.
- ^ Пауэлл 1982 , с. 329.
- ^ Пауэлл, П. (1982). «Синтез η 3 -аллильные комплексы». В Хартли, Фрэнк Р.; Патаи, Сол (ред.). Химия связи металл-углерод . Том 1: Структура, получение, термохимия и характеристика металлоорганических соединений. Чичестер, Великобритания: Interscience . (опубликовано в апреле 1987 г., стр. 326–8 ) 0471100587 .
- ^ Jump up to: а б Ронг, Йи; Аль-Харби, Ахмед; Паркин, Джерард (2012). «Сильно переменные углы связи Zr–CH 2 –Ph в тетрабензилцирконии: анализ режимов координации бензильных лигандов». Металлоорганические соединения . 31 страница = 8208–8217 (23): 8208–8217. дои : 10.1021/om300820b .
- ^ Трост, Барри М.; Чабанюк, Лара К. (2014). «Структура и реакционная способность позднего переходного металла η». 3 -Бензильные комплексы». Angew. Chem. Int. Ed . 53 (11): 2826–2851. doi : 10.1002/anie.201305972 . PMID 24554487 .
- ^ Тацуно, Ю.; Оцука, С. "(η; 3 Комплексы -аллил)палладия(II) « Неорганические синтезы » , 1990, том 28, страницы 342-345. ISBN 0-471-52619-3
- ^ Пирсон 1987 , стр. 932–933.
- ^ Кьюзоли, GP; Салерно, Г.; Цудзи Дж .; Сато Ф. (1985). «Образование углерод-углеродной связи с помощью η 3 -аллильные комплексы». В Хартли, Фрэнк Р.; Патаи, Сол (ред.). Химия связи металл-углерод . Том 3: Образование связи углерод-углерод с использованием металлоорганических соединений. Чичестер, Великобритания: John Wiley & Sons. . стр. 143–205 . 0471905577 .
- ^ Хартвиг, Дж. Ф. Химия органопереходных металлов, от связывания к катализу; Университетские научные книги: Нью-Йорк, 2010. ISBN 189138953X