Тиолатный комплекс переходного металла
Тиолатные комплексы переходных металлов представляют собой комплексы металлов , содержащие тиолатные лиганды . Тиолаты представляют собой лиганды, которые можно классифицировать как мягкие основания Льюиса. Следовательно, тиолатные лиганды наиболее сильно координируются с металлами, которые ведут себя как мягкие кислоты Льюиса, в отличие от тех, которые ведут себя как жесткие кислоты Льюиса. Большинство комплексов помимо тиолатных лигандов содержат и другие лиганды, однако известно множество гомолептических комплексов, содержащих только тиолатные лиганды. Аминокислота ферментах цистеин имеет тиоловую функциональную группу, следовательно, многие кофакторы в белках и содержат кофакторы цистеинат-металл. [1]


Синтез
[ редактировать ]Тиолатные комплексы металлов обычно получают реакциями комплексов металлов с тиолами (RSH), тиолатами (RS − ) и дисульфиды (R 2 S 2 ). Путь реакции солевого обмена является распространенным. В этом методе тиолат щелочного металла обрабатывают галогенидом переходного металла с образованием галогенида щелочного металла и комплекса тиолата металла:
- LiSC 6 H 5 + CuI → Cu(SC 6 H 5 ) + LiI
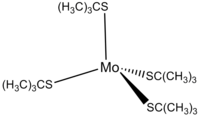
лития Трет-бутилтиолат реагирует с MoCl 4 с образованием тетратиолатного комплекса: [3]
- MoCl 4 + 4 t -BuSLi → Mo( t -BuS) 4 + 4 LiCl
Mo( t -BuS) 4 представляет собой темно-красный диамагнитный комплекс, чувствительный к воздуху и влаге. Центр молибдена имеет искаженную тетраэдрическую координацию четырех атомов серы с общей D 2 . симметрией [3]
Никелоцен и этантиол образуют димерный тиолат, основанием которого служит один циклопентадиенильный лиганд:
- 2 HSC 2 H 5 + 2 Ni(C 5 H 5 ) 2 → [Ni(SC 2 H 5 )(C 5 H 5 )] 2 + 2 C 5 H 6

Что касается механизма образования из тиолов, то тиолатные комплексы металлов могут образовываться путем депротонирования тиоловых комплексов. [4] [5]
Редокс-маршруты
[ редактировать ]Многие тиолатные комплексы получаются окислительно-восстановительными реакциями. Органические дисульфиды окисляют металлы низкой валентности, о чем свидетельствует окисление дикарбонила титаноцена :
- (C 5 H 5 ) 2 Ti(CO) 2 + (C 6 H 5 S) 2 → (C 5 H 5 ) 2 Ti(SC 6 H 5 ) 2 + 2 CO
Некоторые металлоцентры окисляются тиолами, побочным продуктом которых является газообразный водород:
- Fe 3 (CO) 12 + 2 C 2 H 5 SH → Fe 2 (SC 2 H 5 ) 2 (CO) 6 + Fe(CO) 5 + CO + H 2
Эти реакции могут протекать за счет окислительного присоединения тиола к Fe(0).
Тиолы и особенно тиолатные соли являются восстановителями . Следовательно, они вызывают окислительно-восстановительные реакции с некоторыми переходными металлами. Это явление иллюстрируется синтезом тиолатов меди из предшественников меди:
- 4 HSC 6 H 5 + 2 CuO → 2 Cu(SC 6 H 5 ) + (C 6 H 5 S) 2 + 2 H 2 O
Тиолатные кластеры типа [Fe 4 S 4 (SR) 4 ] 2− Встречаются в железосерных белках . Синтетические аналоги можно получить совместными реакциями окислительно-восстановительного и солевого обмена: [6]
- 4 FeCl 3 + 6 NaSR + 6 NaSH → Na 2 [Fe 4 S 4 (SR) 4 ] + 10 NaCl + 4 HCl + H 2 S + R 2 S 2
Структура
[ редактировать ]Двухвалентная сера имеет валентные углы, приближающиеся к 90 °. Такие острые углы наблюдаются и в углах МСК тиолатов металлов. Заполнив р-орбитали подходящей симметрии, тиолаты являются пи-донорными лигандами. Это свойство играет роль в стабилизации состояний Fe(IV) в ферменте цитохроме P450 .

Реакции
[ редактировать ]Тиолаты являются относительно основными лигандами, происходящими из сопряженных кислот с pK a от 6,5 ( тиофенол ) до 10,5 ( бутантиол ). Следовательно, тиолатный лиганд часто связывает пары металлов. Одним из примеров является Fe 2 (SCH 3 ) 2 (CO) 6 . Тиолатные лиганды, особенно немостиковые, подвержены воздействию электрофилов, включая кислоты, алкилирующие агенты и окислители.

Возникновение и применение
[ редактировать ]Функциональность тиолатов металлов широко распространена в металлоферментах . Белки железа и серы , белки синей меди и цинксодержащий фермент алкогольдегидрогеназа печени имеют тиолатные лиганды. Обычно тиолатный лиганд образуется из остатка цистеина . Все молибдопротеины содержат тиолаты в форме цистеинила и/или молибдоптерина . [8]

Ссылки
[ редактировать ]- ^ Коттон, Ф. Альберт ; Уилкинсон, Джеффри ; Мурильо, Карлос А.; Бохманн, Манфред (1999), Передовая неорганическая химия (6-е изд.), Нью-Йорк: Wiley-Interscience, ISBN 0-471-19957-5
- ^ Аксель Керн; Кристиан Нэтер; Феликс Штудт; Феликс Тучек (2004). «Применение универсального силового поля к смешанным кубиновым и гетерокубановым кластерам Fe/Mo-S/Se. 1. Замещение серы на селен в ряду [Fe4X4(YCH3)4]2-; X = S/Se и Y = S /Се». Неорг. Хим . 43 (16): 5003–5010. дои : 10.1021/ic030347d . ПМИД 15285677 .
- ^ Jump up to: а б Оцука, Сэй; Камата, Масато; Хироцу, Кен; Хигучи, Тайичи (1981). «Новое тиолатомолибденовое соединение, тетракис (трет-бутилтиолато) молибден (IV). Получение, кристаллическая и молекулярная структура». Журнал Американского химического общества . 103 (11): 3011–3014. дои : 10.1021/ja00401a017 .
- ^ Джессоп, Филип Г.; Моррис, Роберт Х. (1993). «Реакции обмена водорода и дейтерия в дитиоловом комплексе иридия». Неорганическая химия . 32 (11): 2236–2237. дои : 10.1021/ic00063a006 .
- ^ Хеллер, М.; Шелдрик, WS (2004). «Координационные полимеры меди (I) с алкандитиолом и -динитриловыми мостиковыми лигандами». Журнал неорганической и общей химии . 630 (12): 1869–1874. дои : 10.1002/zaac.200400165 .
- ^ Ли, Южная Каролина; Низкий.; Холм, Р.Х. (2014). «Развития биомиметической химии железо-серных кластеров кубинского типа и с более высокой ядерностью» . Химические обзоры . 114 (7): 3579–3600. дои : 10.1021/cr4004067 . ПМЦ 3982595 . ПМИД 24410527 .
- ^ Нгуен, Т.; Панда, А.; Олмстед, ММ; Ричардс, А.Ф.; Стендер, М.; Бринда, М.; Энергия, ПП (2005). «Синтез и характеристика квазидвухкоординированных дитиолатов переходных металлов M(SAr) 2 (M = Cr, Mn, Fe, Co, Ni, Zn; Ar = C 6 H 3 -2,6(C 6 H 2 -2) ,4,6-Пр я 3 ) 2 )". J. Am. Chem. Soc . 127 (23): 8545–8552. doi : 10.1021/ja042958q . PMID 15941290 .
- ^ С. Дж. Липпард, Дж. М. Берг «Принципы биоинорганической химии» Университетские научные книги: Милл-Вэлли, Калифорния; 1994. ISBN 0-935702-73-3 .