Эфирный комплекс переходного металла

В химии эфирный комплекс переходного металла представляет собой координационный комплекс, состоящий из переходного металла, связанного с одним или несколькими эфирными лигандами . Номенклатура комплексов обширна. [2] Обычными эфирными лигандами являются диэтиловый эфир и тетрагидрофуран . Обычные хелатирующие эфирные лиганды включают глимы , диметоксиэтан (dme) и диглим , а также краун-эфиры . Будучи липофильными, комплексы металла и эфира часто проявляют растворимость в органических растворителях, что представляет интерес для синтетической химии. Напротив, диэфир 1,4-диоксан обычно представляет собой мостиковый лиганд .
Связь, структура, реакции
[ редактировать ]
Эфиры являются лигандами L-типа . Они являются σ-донорами, оказывающими слабое поле лигандов . Они напоминают водные лиганды, наблюдаемые в аквакомплексах . Однако они с трудом участвуют в образовании водородных связей . Эфирный кислород в своих комплексах почти тригонально-планарен. [4]
Будучи слабоосновными, эфирные лиганды легко замещаются. В противном случае эфирные лиганды относительно нереакционноспособны. Циклические эфиры, такие как thf, могут раскрывать кольцо или даже дезоксигенировать при связывании с высокоэлектрофильными галогенидами металлов. Таким образом, обработка гексахлорида вольфрама одним эквивалентом его дает 1,4-дихлорбутан : [5]
- WCl 6 + OC 4 H 8 → WOCl 4 + ClCH 2 CH 2 CH 2 CH 2 Cl
При более высоких концентрациях thf политетрагидрофуран образуется .
Примеры
[ редактировать ]Гомолептические комплексы
[ редактировать ]Эфиры являются относительно объемистыми лигандами, поэтому гомолептические (т. е. все лиганды одинаковые) эфирные комплексы встречаются редко. В примерах часто присутствуют слабокоординирующие анионы, такие как BAr. Ф 4 − и Al(OR Ф ) 4 − .
- [V(thf) 6 ](BAr Ф 4 ) 2 [6]
- [Mn(thf) 6 ](Mn(CO) 5 ] 2 [7]
- [[Fe(thf) 6 ]][BAr Ф 24] 2 [8]
- [Ni(thf) 6 ][Al(OR Ф ) 4 ] 2 [9]
Металлогалогенные комплексы
[ редактировать ]
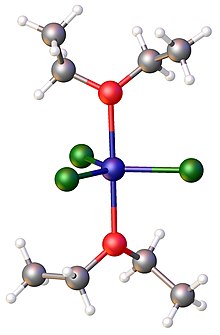
хлоридов металлов с тетрагидрофураном . Особенно изучены комплексы [12] Эти соединения часто являются реагентами, поскольку они растворимы в органических растворителях, а также являются безводными.
| Формула комплексы металл-хлорид-эфир | Координация сфера | цвет |
|---|---|---|
| TiCl 4 (тыс) 2 | ТиО 2 Cl 4 | желтый [13] |
| TiCl 3 (thf) 3 | TiO3ClTiO3Cl3 | синий [12] |
| [TiCl 3 (thf) 2 ] 2 | ТиО 2 Cl 4 | зеленый [14] |
| ZrCl 4 (thf) 2 | ZrO 2 Cl 4 | белый [12] |
| HfCl 4 (thf) 2 | HfO 2 Cl 4 | белый [12] |
| VCl 3 (thf) 3 | VO3ClVO3Cl3 | розовый [12] |
| VCl 3 (thf) 2 ] 2 | ВО 2 Кл 4 | красный [14] |
| NbCl 4 (тф) 2 | NbO 2 Cl 4 | желтый [15] |
| Та 3 Cl 9 (тф) 4 | TaO 2 Cl 4 и TaOCl 5 [15] | |
| CrCl 3 (thf) 3 | CrO3ClCrO3Cl3 | розовый [12] [16] |
| MoCl 4 (тыс) 2 | МоО 2 Cl 4 | розовый [17] |
| MoCl 4 (Et 2 O) 2 | МоО 2 Cl 4 | бежевый [18] |
| MoCl 3 (тыс) 3 | MoO3ClMoO3Cl3 | красный [17] |
| WCl 4 (Et 2 O) 2 | WO 2 Cl 4 | желтый [19] |
| MnCl 3 (тф) 3 | MnO3ClMnO3Cl3 | коричнево-фиолетовый [20] |
| TcCl 4 (тф) 2 | ТсО 2 Cl 4 | желтый [13] |
| ReCl 4 (тыс) 2 | РеО 2 Cl 4 | зеленый [21] |
| Fe 4 Cl 8 (тф) 6 | FeO 2 Cl 3 , FeO 2 Cl 4 | коричневый [22] |
| FeCl 3 (тыс) 2 | FeO2ClFeO2Cl3 [23] | родственный комплекс диэтилового эфира имеет коричневый цвет. |
| FeCl 3 (OEt 2 ) 2 | FeO2ClFeO2Cl3 | коричневый [11] |
| Co 4 Cl 8 (thf) 6 | СоО 2 Cl 3 , СоО 2 Cl 4 | синий [24] |
| [CoCl 2 (дМЕ)] 2 | CoO2ClCoO2Cl3 [25] | |
| NiCl 2 (диметоксиэтан) 2 | NiCl 2 O 4 | желтый [26] |
| [Cu 2 Cl 4 (thf) 3 ] n | CuO 2 Cl 4 , CuOCl 4 | апельсин [27] |
| ZnCl 2 (тф) 2 | ZnO 2 Cl 2 | белый [16] |
Карбонильные комплексы металлов
[ редактировать ]- M(CO) 5 (thf) (M = Cr, Mo, W) [4]
- Mo(CO) 3 (диглим)
Ссылки
[ редактировать ]- ^ Дурадж, ЮАР; Города; Бейкер; Шупп, Дж. (1990). «Структура цис -тетрахлоробис(тетрагидрофурана)гафния(IV)». Акта Кристаллографика . C46 (5): 890–2. дои : 10.1107/S010827018901382X .
- ^ Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . ISBN 978-0-08-037941-8 .
- ^ Дуань, Чжимин; Чжан, Ян; Чжан, Бинь; Чжу, Даобэнь (2009). «Преобразование кристалл-к-кристаллу антиферромагнитных цепей в ферромагнитный алмазоидный каркас». Журнал Американского химического общества . 131 (20): 6934–6935. дои : 10.1021/ja902101x . ПМИД 19402661 .
- ^ Перейти обратно: а б Шуберт, У.; Фридрих П.; Орама, О. (1978). «Кристаллическая и молекулярная структура пентакарбонилтетрагидрофурана хрома (0)». Журнал металлоорганической химии . 144 (2): 175–179. дои : 10.1016/S0022-328X(00)84160-1 .
- ^ Бьянки, Сабрина; Бортолуцци, Марко; Кастельветро, Вальтер; Маркетти, Фабио; Пампалони, Гвидо; Пинцино, Калоджеро; Заккини, Стефано (2016). «Реакционная способность гексахлорида вольфрама с тетрагидрофураном и 2-метоксиэтанолом». Многогранник . 117 : 769–776. дои : 10.1016/j.poly.2016.07.024 . hdl : 11568/803763 .
- ^ Шукроун, Роберт; Мумбоко, Пьер; Найт, Сандрин; Этьен, Мишель; Доннадье, Бруно (1998). «Катионные гомолептические комплексы ванадия (II), (IV) и (V), образующиеся в результате протонолиза [V (NEt2) 4]». Angewandte Chemie, международное издание . 37 (22): 3169–3172. doi : 10.1002/(SICI)1521-3773(19981204)37:22<3169::AID-ANIE3169>3.0.CO;2-0 . ПМИД 29711321 .
- ^ Конг, Гапгунг; Харакас, Джордж Н.; Уиттлси, Брюс Р. (1995). «Необычный кластер переходного металла, содержащий семь плоскостей атомов металла. Синтез и кристаллические структуры [Mn] [Mn7 (THF) 6 (CO) 12] 2, Mn3 (THF) 2 (CO) 10 и [Mn (THF)» 6][Mn(CO)5]2». Журнал Американского химического общества . 117 (12): 3502–3509. дои : 10.1021/ja00117a019 .
- ^ Лихтенберг, Криспин; Адельхардт, Марио; Верле, Михаэль; Бюттнер, Торстен; Мейер, Карстен; Грюцмахер, Хансйорг (2015). «Моно- и биядерные нейтральные и катионные соединения железа (II), поддерживаемые амидинатодиолефиновым лигандом: характеристика и каталитическое применение». Металлоорганические соединения . 34 (12): 3079–3089. doi : 10.1021/acs.organomet.5b00395 .
- ^ Шваб, Мириам М.; Небеса, Дэниел; Качпржак, Сильвия; Радтке, Валентин; Скретч, Дэниел; Ясин, Зейнаб; Вайс, Филипп; Вебер, Стефан; Кроссинг, Инго (2018). «Реакционная способность [Ni(cod)2][Al(ORF)4] по отношению к малым молекулам и элементам». Журнал неорганической и общей химии . 644 : 50-57. дои : 10.1002/zaac.201700367 .
- ^ Крючком, Орельен; Фромм, Катарина М. (2010). «Полиэфирные аддукты соединений металлов с d-блоком как исходные материалы для новых кластерных соединений» (PDF) . Журнал неорганической и общей химии . 636 (8): 1484–1496. дои : 10.1002/zaac.201000022 .
- ^ Перейти обратно: а б Шпандл, Иоганн; Куссеров, М.; Брюдгам, И. (2003). «Алкоксосоединения трехвалентного железа: Синтез и характеристика [Fe2(Ot Bu )6], [Fe2Cl2(Ot Bu )4], [Fe2Cl4(Ot Bu )2] и [N(n Bu )4]2[Fe6OCl6 ( ОМе)12]" . Журнал неорганической и общей химии . 629 (6): 968–974. дои : 10.1002/zaac.200300008 .
- ^ Перейти обратно: а б с д и ж Манзер, Л.Е. (1982). Тетрагидрофурановые комплексы некоторых ранних переходных металлов . Неорганические синтезы. Том. 21. С. 135–140. дои : 10.1002/9780470132524.ch31 .
- ^ Перейти обратно: а б Хагенбах, Адельхайд; Йеген, Эда; Абрам, Ульрих (2006). «Тетрахлорид технеция как предшественник малых комплексов технеция (IV)». Неорганическая химия . 45 (18): 7331–7338. дои : 10.1021/ic060896u . ПМИД 16933935 .
- ^ Перейти обратно: а б Собота, Петр; Эйфлер, Иоланта; Шаферт, Славомир; Щегот, Кшиштоф; Савка-Добровольская, Ванда (1993). «Новые промежуточные соединения для синтеза катализаторов полимеризации олефинов: комплексы [M 2 (μ-Cl) 2 Cl 4 (THF) 4 ] (M = Ti или V, THF = тетрагидрофуран); Кристаллические структуры и свойства». Журнал Химического общества, Dalton Transactions (15): 2353–2357. дои : 10.1039/dt9930002353 .
- ^ Перейти обратно: а б Бабаян-Кибала, Элизабет; Коттон, Ф. Альберт; Шан, Маоюй (1990). «Новые синтетические пути получения треугольных кластерных соединений ниобия (III) и тантала (III)». Неорганическая химия . 29 (26): 5148–5156. дои : 10.1021/ic00351a005 .
- ^ Перейти обратно: а б Буджук, Филип; Итак, Чон Хо (1992). «Сольватированные и несольватированные безводные хлориды металлов из гидратов хлоридов металлов». Неорганические синтезы . Неорганические синтезы. Том. 29. С. 108–111. дои : 10.1002/9780470132609.ch26 . ISBN 9780470132609 .
- ^ Перейти обратно: а б Дилворт, Джонатан Р.; Ричардс, Раймонд Л. (1990). «Синтез азотистых комплексов молибдена и вольфрама». Неорганические синтезы . Неорганические синтезы. Том. 28. С. 33–43. дои : 10.1002/9780470132593.ch7 . ISBN 9780470132593 .
- ^ Мария, Себастьян; Поли, Ринальдо (2014). «Эфирные комплексы хлоридов молибдена (III) и молибдена (IV)». Неорганические синтезы: Том 36 (PDF) . Неорганические синтезы. стр. 15–18. дои : 10.1002/9781118744994.ch03 . ISBN 9781118744994 .
- ^ Шефер, Андре (2021). «Разгадана многолетняя загадка хлорида бис (диэтилового эфира) вольфрама (IV)» . Acta Crystallographica Раздел C Структурная химия . 77 (4): 167–168. дои : 10.1107/S2053229621002461 . ПМК 8020884 . ПМИД 33818437 .
- ^ Найтингейл, Олаф; Патаки, Астрид; Мольски, Матиас; Ленц, Дитер; Шпандл, Иоганн (2015). «Возвращение к сольватам трихлорида марганца - синтез, выделение и кристаллическая структура MnCl3 ( THF) 3 ». Журнал неорганической и общей химии . 641 (6): 1164–1168. дои : 10.1002/zaac.201500106 .
- ^ Свидерский, Х.-В.; Пеблер, Дж.; Денике, К.; Фенске, Д. (1990). «Тетрахлорид технеция как предшественник малых комплексов технеция (IV)». Неорганическая химия . 45 (18): 7331–8. дои : 10.1021/ic060896u . ПМИД 16933935 .
- ^ Коттон, Ф. Альберт; Удачи, Руди Л.; Сон, Кён Э (1991). «Новые полиядерные соединения хлорида железа(II) с лигандами-донорами кислорода. Часть I. Fe4Cl8(THF)6: Синтез и определение рентгеноструктурного анализа монокристалла». Неорганика Химика Акта . 179 : 11–15. дои : 10.1016/S0020-1693(00)85366-9 .
- ^ L. V. Ivakina, N. R. Strel'tsova, V. K. Bel'skii, P. A. Storozhenko, B. M. Bulychev, A. B. Tarasov (1987). Zh.Obshch.Khim. (Russ.J.Gen.Chem.) . 57 : 1600.
{{cite journal}}: Отсутствует или пусто|title=( помощь ) CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Собота, Петр; Олейник, Зофья; Утко, Джозеф; Лисс, Тадеуш (1993). «Синтез, магнитные свойства и структура комплекса [Co4 ( μ3 Cl ) 2 (μ2 - ) 4Cl2 Cl - (THF) 6 ]». Многогранник 12 (6): 613–616. дои : 10.1016/S0277-5387(00) 84976-1
- ^ Петричек, Саша (2011). «Октаэдрические и тетраэдрические центры кобальта (II) в комплексах хлорида кобальта с полиэфирами» . Croatica Chemica Acta : 515–520. дои : 10.5562/cca1747 .
- ^ Уорд, Лэрд Г.Л. (1972). «Безводные галогениды никеля (II) и их тетракис (этанол) и 1,2-диметоксиэтановые комплексы». Неорганические синтезы . Неорганические синтезы. Том. 13. С. 154–164. дои : 10.1002/9780470132449.ch30 . ISBN 9780470132449 .
- ^ Беккер, Сабина; Дюрр, Максимилиан; Миска, Андреас; Беккер, Джонатан; Гавлиг, Кристофер; Беренс, Ульрих; Иванович-Бурмазович, Ивана; Шиндлер, Зигфрид (2016). «Катализ хлоридом меди: играют ли кластеры меди ц4-оксидо меди значительную роль?». Неорганическая химия . 55 (8): 3759–3766. doi : 10.1021/acs.inorgchem.5b02576 . ПМИД 27045752 .