Алкильные комплексы переходных металлов

Алкильные комплексы переходных металлов представляют собой координационные комплексы , содержащие связь между переходным металлом и алкильным лигандом . Подобные комплексы не только широко распространены, но и представляют практический и теоретический интерес. [1] [2]
Объем
[ редактировать ]Большинство металлалкильных комплексов содержат другие, неалкильные лиганды. Большой интерес, главным образом теоретический, вызвали гомолептические комплексы. Действительно, первый зарегистрированный пример комплекса, содержащего металл-sp 3 углеродная связь представляла собой гомолептический комплекс диэтилцинк . Другие примеры включают гексаметилвольфрам , тетраметилтитан и тетранорборнилкобальт. [3]

Строение диэтилцинка. Связи Zn-C имеют длину 194,8(5) пм, а угол C-Zn-C слегка изогнут и составляет 176,2(4)°. [4]
Смешаннолигандные или гетеролептические комплексы, содержащие алкилы, многочисленны. В природе витамин B12 и многие его производные содержат реакционноспособные со-алкильные связи.

Гексаметилвольфрам является примером «гомолептического» (все лиганды одинаковы) металлалкильного комплекса. [3]
| пример | комментарий |
|---|---|
| Ти(СН 3 ) 4 | наблюдается только в виде моноэфирата, d 0 [5] |
| [Ти(СН 3 ) 5 ] − | тригонально-бипирамидальный, d 0 [5] |
| [Ти 2 (СН 3 ) 9 ] − | один мостиковый метиловый лиганд, d 0 ,д 0 [5] |
| [Zr(CH 3 ) 6 ] − | тригонально-призматический, d 0 [6] [5] |
| [Hf(CH 3 ) 6 ] − | тригонально-призматический, d 0 [6] |
| [Nb(CH 3 ) 6 ] − | д 0 [3] [6] |
| [Та(СН 3 ) 6 ] − | д 0 [3] |
| Мо( СН3 ) 5 | д 1 [7] |
| W(СН 3 ) 6 | тригонально-призматический, d 0 [3] |
| [Mn(CH 3 ) 4 ]2- | д 5 [8] |
| [Mn(CH 3 ) 6 ]2- | д 3 [9] |
| [Re(CH 3 ) 6 ] | д 1 [3] |
| [Fe(CH 3 ) 4 ] − | низкоспиновый, d 5 , плоский квадрат [10] |
| [Со( СН3 ) 4 ] − | плоский квадрат, d 6 [11] |
| [Rh(CH 3 ) 6 ] 3- | д 6 [12] |
| [Ир(СН 3 ) 6 ] 3- | д 6 [12] |
| [Ни( СН3 ) 4 ] 2- | д 8 [13] |
| [Пт( СН3 ) 4 ] 2- [12] | д 8 [14] |
| [Аи(СН 3 ) 2 ] − | д 10 [15] |
| [Аи(СН 3 ) 4 ] − | д 8 [15] |
| Zn(CH 3 ) 2 | д 10 |
| Cd(CH 3 ) 2 | д 10 |
| Ртуть( CH3 ) 2 | д 10 |
Подготовка
[ редактировать ]Металлалкилкомплексы обычно получают двумя путями: с использованием алкилнуклеофилов и с использованием алкилэлектрофилов. Нуклеофильные источники алкильных лигандов включают реактивы Гриньяра и литийорганические соединения . Поскольку многие сильные нуклеофилы также являются сильными восстановителями, иногда используются слабонуклеофильные алкилирующие агенты, чтобы избежать окислительно-восстановительных реакций. К таким более мягким реагентам относятся цинкорганические соединения и алюминийорганические соединения .
Электрофильное алкилирование обычно начинается с комплексов металлов с низкой валентностью. Типичными электрофильными реагентами являются алкилгалогениды . Показательным является получение метильного производного циклопентадиенилирондикарбонильного аниона железа : [16]
- CpFe(CO) 2 Na + CH 3 I → CpFe(CO) 2 CH 3 + NaI
Многие алкилы металлов получают путем окислительного присоединения : [2]
Примером может служить реакция комплекса Васьки с метилйодидом .

Агостические взаимодействия и отщепление бета-гидрида
[ редактировать ]Некоторые алкилы металлов характеризуются агостическими взаимодействиями между связью CH алкильной группы и металлом. Такие взаимодействия особенно характерны для комплексов ранних переходных металлов в высших степенях окисления. [18]
Одним из факторов, определяющих кинетическую стабильность металл-алкильных комплексов, является наличие водорода в бета-положении металла. Если такие водороды присутствуют и металлоцентр координационно ненасыщен , то комплекс может подвергаться отщеплению бета-гидрида с образованием комплекса металл-алкен:
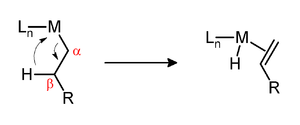
Предполагается, что эти преобразования происходят посредством агостических взаимодействий.
Катализ
[ редактировать ]Многие гомогенные катализаторы действуют через посредничество алкилов металлов. Эти реакции включают гидрирование , гидроформилирование , изомеризацию алкенов и полимеризацию олефинов . Предполагается, что в соответствующих гетерогенных реакциях участвуют и связи металл-алкил. [19]
Ссылки
[ редактировать ]- ^ Оливейра, Хосе; Эльшенбройх, Кристоф (2006). Металлоорганические соединения (3-е, полностью переработанное и расширенное изд.). Вайнхайм: Wiley-VCH-Verl. ISBN 978-3-527-29390-2 .
- ^ Jump up to: а б Хартвиг, Дж. Ф. (2010). Химия органопереходных металлов: от связывания к катализу . Нью-Йорк: Университетские научные книги. ISBN 978-1-891389-53-5 .
- ^ Jump up to: а б с д и ж Кляйнхенц, С.; Пфенниг, В.; Зеппельт, К. (1998). «Получение и структура [W(CH 3 ) 6 ], [Re(CH 3 ) 6 ], [Nb(CH 3 ) 6 ] − , и [Та(СН 3 ) 6 ] − ". Химия – Европейский журнал . 4 (9): 1687–1691. doi : 10.1002/(SICI)1521-3765(19980904)4:9<1687::AID-CHEM1687>3.0.CO;2-R .
- ^ Джон Бакса; Феликс Ханке; Сара Хиндли; Раджеш Одедра; Джордж Р. Дарлинг; Энтони С. Джонс; Александр Штайнер (2011). «Твердотельные структуры диметилцинка и диэтилцинка» . Angewandte Chemie, международное издание . 50 (49): 11685–11687. дои : 10.1002/anie.201105099 . ПМЦ 3326375 . ПМИД 21919175 .
- ^ Jump up to: а б с д Кляйнхенц, Свен; Зеппельт, Конрад (1999). «Получение и строение соединений метилтитана». Химия - Европейский журнал . 5 (12): 3573–3580. doi : 10.1002/(SICI)1521-3765(19991203)5:12<3573::AID-CHEM3573>3.3.CO;2-F .
- ^ Jump up to: а б с Морс, Пейдж М.; Джиролами, Грегори С. (1989). «Всегда ли комплексы d0 ML6 октаэдрические? Рентгеновская структура тригонально-призматического [Li(tmed)]2[ZrMe6]». Журнал Американского химического общества . 111 (11): 4114–4116. дои : 10.1021/ja00193a061 .
- ^ Беатрис Росслер; Свен Кляйнхенца; Конрад Зеппельт (2000). «Пентаметилмолибден». Химические коммуникации (12): 1039–1040. дои : 10.1039/b000987n .
- ^ Моррис, Роберт Дж.; Джиролами, Грегори С. (1988). «Перметилманганаты. Синтез и характеристика двухвалентных [MnMe42-], трехвалентных [MnMe52-] и четырехвалентных [MnMe62-]». Журнал Американского химического общества . 110 (18): 6245–6246. дои : 10.1021/ja00226a049 . ПМИД 22148809 .
- ^ Моррис, Роберт Дж.; Джиролами, Грегори С. (1991). «Химия высоковалентного марганца. 1. Синтез и характеристика алкилов марганца(III) и -(IV)». Металлоорганические соединения . 10 (3): 792–799. дои : 10.1021/om00049a047 .
- ^ Аль-Афьюни, Малик Х.; Филлман, Кэтлин Л.; Бреннессел, Уильям В.; Нейдиг, Майкл Л. (2014). «Выделение и характеристика феррата тетраметилжелеза (III): промежуточного продукта на пути восстановления солей железа с помощью MeMg Br » . Журнал Американского химического общества . 136 (44): 15457–15460. дои : 10.1021/ja5080757 . ПМЦ 4227835 . ПМИД 25333789 .
- ^ Карпентер, Стефани Х.; Бреннессел, Уильям В.; Нейдиг, Майкл Л. (2019). «Выделение и характеристика гомолептического искаженного квадратно-планарного комплекса тетраметилкобальта (III)» . Металлоорганические соединения . 38 (19): 3486–3489. doi : 10.1021/acs.organomet.9b00387 . S2CID 203144530 .
- ^ Jump up to: а б с Хэй-Мазервелл, Робин С.; Уилкинсон, Джеффри; Хусейн, Билкис; Херстхаус, Майкл Б. (1989). «Гомолептические метиловые соединения родия и иридия (III). Рентгеноструктурные кристаллические структуры тетраметилэтилендиамина лития, гексаметилродата (III) и -иридата (III)». Журнал Химического общества, Chemical Communications (19): 1436. doi : 10.1039/C39890001436 .
- ^ Вальтер, Дирк; Столленц, Майкл; Гёрлс, Хельмар (2001). «Биядерные комплексы [RNi(oxam)NiR] (Oxam = N1,N2-бис(2-пиридилметил)-N3,N4-бис(2,4,6-триметилфенил)оксаламидинат; R = Me, Ph, C⋮CH, C⋮CPH): Реакции метилового комплекса и образования [Li(THF)]2Li2Ni2Me8 и [Li(THF)]4Ni2Me8». Металлоорганические соединения . 20 (20): 4221–4229. дои : 10.1021/om000960u .
- ^ Вырва, Р.; Гёрлс, Х. (1999). «Необычные молекулярные структуры комплексов ата платины (II)». Журнал неорганической и общей химии . 625 (11): 1904–1907. doi : 10.1002/(SICI)1521-3749(199911)625:11<1904::AID-ZAAC1904>3.0.CO;2-2 .
- ^ Jump up to: а б Чжу, Данмин; Линдеман, Сергей В.; Кочи, Джей К. (1999). «Рентгеновские кристаллические структуры и легкое окислительное (Au-C) расщепление гомологов диметилаурата (I) и тетраметилурата (III)» . Металлоорганические соединения . 18 (11): 2241–2248. дои : 10.1021/om990043s .
- ^ Кинг, Б. (1970). «Применение карбонильных анионов металлов в синтезе необычных металлоорганических соединений». Акк. хим. Рез . 3 (12): 417–427. дои : 10.1021/ar50036a004 .
- ^ З. Давуди; МЛХ Зеленый; ВСБ Мтетва; К. Праут; Эй Джей Шульц; Дж. М. Уильямс; Т. Ф. Кетцле (1986). «Доказательства взаимодействия углерода, водорода и титана: синтез и кристаллические структуры агостичных алкилов [TiCl 3 (Me 2 PCH 2 CH 2 PMe 2 )R] (R = Et или Me)» . Дж. Хим. Soc., Далтон Транс. (8): 1629. дои : 10.1039/dt9860001629 .
- ^ Шерер, В.; МакГрэйди, GS (2004). «Агостические взаимодействия в d 0 Металлалкильные комплексы». Angew. Chem. Int. Ed . 43 (14): 1782–1806. doi : 10.1002/anie.200200548 . PMID 15054779 .
- ^ Форбс, Джеффри Г.; Геллман, Эндрю Дж. (1 июля 1993 г.). «Механизм удаления бета-гидрида в адсорбированных алкильных группах». Журнал Американского химического общества . 115 (14): 6277–6283. дои : 10.1021/ja00067a048 . ISSN 0002-7863 .


