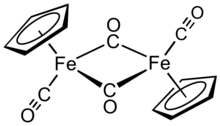
Димер дикарбонила циклопентадиенилирона
 | |
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК Ди-μ-карбонилдикарбонилбис(η 5 -циклопента-2,4-диен-1-ил)дижелезо | |
| Другие имена Бис(циклопентадиенил)тетракарбонилдижелезо, Ди(циклопентадиенил)тетракарбонилдижелезо, Бис(дикарбонилциклопентадиенилирон) | |
| Идентификаторы | |
3D model ( JSmol ) | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.032.057 |
| Номер ЕС |
|
ПабХим CID | |
| Характеристики | |
| С 14 Н 10 Fe 2 О 4 | |
| Молярная масса | 353.925 g/mol |
| Появление | Темно-фиолетовые кристаллы |
| Плотность | 1,77 г/см 3 , твердый |
| Температура плавления | 194 ° С (381 ° F; 467 К) |
| Точка кипения | разложение |
| нерастворимый | |
| Растворимость в других растворителях | бензол, ТГФ, хлоруглероды |
| Структура | |
| искаженный октаэдрический | |
| 3,1 Д (раствор бензола) | |
| Опасности | |
| Безопасность и гигиена труда (OHS/OSH): | |
Основные опасности | источник CO |
| СГС Маркировка : | |
   | |
| Опасность | |
| Х228 , Х302 , Х330 , Х331 | |
| Родственные соединения | |
Родственные соединения | Fe(C 5 H 5 ) 2 Fe(CO) 5 |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Димер дикарбонила циклопентадиенилирона представляет собой металлоорганическое соединение формулы [( η 5 -C 5 H 5 )Fe(CO) 2 ] 2 , часто сокращенно Cp 2 Fe 2 (CO) 4 , [CpFe(CO) 2 ] 2 или даже Fp 2 , с разговорным названием «фип-димер». Это темно-красновато-фиолетовое кристаллическое твердое вещество, которое легко растворяется в умеренно полярных органических растворителях, таких как хлороформ и пиридин , но менее растворимо в четыреххлористом углероде и сероуглероде . Cp 2 Fe 2 (CO) 4 нерастворим в воде, но стабилен по отношению к воде. Cp 2 Fe 2 (CO) 4 достаточно стабилен при хранении на воздухе и служит удобным исходным материалом для получения других производных Fp (CpFe(CO) 2 ) (описанных ниже). [1]
Структура
[ редактировать ]В растворе Cp 2 Fe 2 (CO) 4 можно рассматривать как димерный полусэндвич- комплекс. Он существует в трех изомерных формах: цис , транс и немостиковая открытая форма. Эти изомерные формы отличаются положением лигандов. Цис- ( и транс- изомеры различаются взаимным расположением лигандов C 5 H 5 Cp). Цис- изомеры и транс- имеют формулировку [( η 5 -C 5 H 5 )Fe(CO)( μ -CO)] 2 , то есть два лиганда CO являются концевыми, тогда как два других лиганда CO образуют мостик между атомами железа. Цис- . и транс -изомеры взаимопревращаются через открытый изомер, который не имеет мостиковых лигандов между атомами железа Вместо этого он формулируется как ( η 5 -C 5 H 5 )(OC) 2 Fe−Fe(CO) 2 ( η 5 -C 5 H 5 ) — металлы скрепляются связью железо–железо. В равновесии цис- и транс- преобладают изомеры.
Кроме того, известно, что концевые и мостиковые карбонилы подвергаются обмену: транс -изомер может подвергаться мостиково-концевому обмену CO-лигандом через открытый изомер или посредством скручивающего движения, не проходя через открытую форму. Напротив, мостиковые и концевые лиганды CO цис- изомера могут обмениваться только через открытый изомер. [2]
В растворе цис- , транс- и открытые изомеры быстро взаимопревращаются при комнатной температуре, что делает молекулярную структуру текучей . Флюсационный процесс для димера циклопентадиенилирондикарбонила железа происходит быстрее, чем временная шкала ЯМР, так что в 1 Спектр ЯМР 1H при 25 °C. Аналогично, 13 Спектр ЯМР 1С демонстрирует один резкий сигнал CO при температуре выше -10 °C, а сигнал Cp обостряется до одного пика при температуре выше 60 °C. Исследования ЯМР показывают, что при комнатной температуре цис- изомера немного больше, чем транс- изомера, а количество открытой формы невелико. [2] Флюксионный процесс недостаточно быстр, чтобы произвести усреднение в ИК-спектре . Таким образом, для каждого изомера наблюдаются три поглощения. Мостиковые лиганды CO появляются около 1780 см-1. −1 тогда как концевые лиганды CO наблюдаются около 1980 см. −1 . [3] Усредненная структура этих изомеров Cp 2 Fe 2 (CO) 4 приводит к дипольному моменту 3,1 Д в бензоле . [4]
Молекулярная структура твердого тела как цис-, так и транс -изомеров была проанализирована методами рентгеновской и нейтронной дифракции . Разделение Fe-Fe и длины связей Fe-C одинаковы в ромбоидах Fe 2 C 2 , точно плоское Fe 2 C 2 четырехчленное кольцо в транс- изомере против свернутого ромбоида в цис с углом 164°. и значительные искажения в Cp-кольце транс- изомера, отражающие различные популяции Cp-орбиталей. [5] Хотя в старых учебниках показано, что два атома железа связаны друг с другом, теоретический анализ указывает на отсутствие прямой связи Fe-Fe. Эта точка зрения согласуется с расчетами и рентгенокристаллографическими данными, которые указывают на отсутствие значительной электронной плотности между атомами железа. [6] Однако Лабинджер предлагает иную точку зрения, основанную в первую очередь на химической реакционной способности и спектроскопических данных, утверждая, что электронная плотность не обязательно является лучшим показателем наличия химической связи. Более того, без связи Fe-Fe мостиковые карбонилы должны формально рассматриваться как лиганд μ-X 2 и лиганд μ-L, чтобы центры железа удовлетворяли правилу 18 электронов . Утверждается, что этот формализм дает вводящие в заблуждение выводы относительно химического и спектроскопического поведения карбонильных групп. [7]
Синтез
[ редактировать ]Cp 2 Fe 2 (CO) 4 был впервые получен в 1955 году в Гарварде Джеффри Уилкинсоном с использованием того же метода, который используется сегодня: реакция пентакарбонила железа и дициклопентадиена . [7] [8]
- 2 Fe(CO) 5 + C 10 H 12 → ( η 5 -C 5 H 5 ) 2 Fe 2 (CO) 4 + 6 CO + H 2
При этом препарате дициклопентадиен расщепляется с образованием циклопентадиена, который реагирует с Fe(CO) 5 с потерей CO . После этого пути фотохимического и термического путей слегка различаются, но оба влекут за собой образование промежуточного гидрида . [5] Метод используется в учебной лаборатории. [3]
Реакции
[ редактировать ]не имеет большой коммерческой ценности, он Хотя Fp 2 является рабочей лошадкой в металлоорганической химии , поскольку он недорог, а производные FpX прочны (X = галогенид, органил).
"Фп − (ФпНа и ФпК)
[ редактировать ]Восстановительное расщепление [CpFe(CO) 2 ] 2 (формально комплекс железа(I)) приводит к образованию производных щелочных металлов, формально полученных из дикарбонильного аниона циклопентадиенилирона, [CpFe(CO) 2 ] − или называется Fp − (формально железо(0)), которые, как предполагается, существуют как плотная ионная пара . Типичным восстановителем является металлический натрий или амальгама натрия ; [9] сплав NaK , графит калия (KC 8 Использовались ) и триалкилборгидриды щелочных металлов. [CpFe(CO) 2 ]Na является широко изученным реагентом, поскольку он легко алкилируется, ацилируется или металлируется при обработке соответствующим электрофилом . [10] Это превосходный нуклеофил S N 2 , на один-два порядка более нуклеофильный, чем тиофенолят PhS. – при реакции с первичными и вторичными алкилбромидами. [11]
- [CpFe(CO) 2 ] 2 + 2 Na → 2 CpFe(CO) 2 Na
- [CpFe(CO) 2 ] 2 + 2 KBH(C 2 H 5 ) 3 → 2 CpFe(CO) 2 K + H 2 + 2 B(C 2 H 5 ) 3
Обработка NaFp алкилгалогенидом ( RX, X = Br, I) дает FeR( η 5 -C 5 H 5 )(CO) 2
- CpFe(CO) 2 K + CH 3 I → CpFe(CO) 2 CH 3 + KI
Fp 2 также может расщепляться щелочными металлами. [12] и электрохимическим восстановлением . [13] [14]
FpX (X = Cl, Br, I)
[ редактировать ]Галогены окислительно расщепляют [CpFe(CO) 2 ] 2 с образованием частиц Fe(II) FpX (X = Cl, Br, I):
- [CpFe(CO) ] 2 + X 2 → 2 CpFe(CO) 2 2
Одним из примеров является циклопентадиенилирондикарбонилиодид железа .
Fp( η 2 -алкен) + , Fp( η 2 -алкин) + и другие "Фп + "
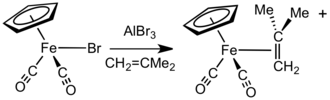
[ редактировать ]В присутствии акцепторов галогенидных анионов, таких как бромид алюминия или тетрафторборат серебра , соединения FpX (X = галогенид) реагируют с алкенами , алкинами или нейтральными лабильными лигандами (такими как простые эфиры и нитрилы ) с образованием Fp. + комплексы. [15] В другом подходе соли [Fp(изобутен)] + легко получаются реакцией NaFp с металлилхлоридом с последующим протонолизом. Этот комплекс является удобным и универсальным предшественником других катионных комплексов Fp-алкен и Fp-алкин. [16] Процесс обмена облегчается за счет потери газообразного и объемистого изобутена . [17] Обычно менее замещенные алкены связываются сильнее и могут вытеснять более затрудненные алкеновые лиганды. Алкеновые и алкиновые комплексы также можно получить нагреванием катионного эфира или аквакомплекса, например [Fp( thf )] +
лучший друг −
4 , с алкеном или алкином. [18] [Фпл] +
лучший друг −
Комплексы 4 также можно получить обработкой FpMe HBF 4 · Et 2 O в CH 2 Cl 2 при -78 °C с последующим добавлением L. [19]
Комплексы алкен -Fp также можно получить из аниона Fp косвенным путем. Таким образом, при отщеплении гидрида от Fp-алкильных соединений с помощью трифенилметилгексафторфосфата образуется [Fp(α-алкен)] + комплексы.
- FpNa + RCH 2 CH 2 I → FpCH 2 CH 2 R + NaI
- FpCH 2 CH 2 R + Ph 3 CPF 6 → [Fp(CH
2 = ХР) +
]ПФ −
6 + Ф 3 СН
Реакция NaFp с эпоксидом с последующей кислотной дегидратацией также приводит к образованию алкеновых комплексов. Фп (алкен) + устойчивы по отношению к бромированию , гидрированию и ацетоксимеркурации , но алкен легко высвобождается йодидом натрия в ацетоне или при нагревании с ацетонитрилом . [20]
Алкеновый лиганд в этих катионах активируется для атаки нуклеофилов , открывая путь для ряда реакций образования углерод-углеродных связей . Нуклеофильное присоединение обычно происходит по более замещенному углероду. Такая региохимия объясняется большей плотностью положительного заряда в этом положении. Региоконтроль часто бывает скромным. Добавление нуклеофила является полностью стереоселективным и происходит анти по отношению к группе Fp. Аналог Фп(алкин) + Сообщается также, что комплексы подвергаются реакциям нуклеофильного присоединения с участием различных нуклеофилов углерода, азота и кислорода. [21]
Фп (алкен) + и Fp (алкин) + π-комплексы также являются весьма кислыми в аллильном и пропаргильном положениях соответственно и могут быть количественно депротонированы аминными основаниями, такими как Et 3 N, с образованием нейтральных σ-комплексов Fp-аллил и Fp-алленил (уравнение 1). [16]
- (1) Fp(H
2 С=СНСН
2 СН
3 ) +
лучший друг −
4 + Et 3 N → FpCH 2 CH=CHCH 3 + Et
33НХ +
лучший друг −
4 - (2) ФпСН 2 СН=СНСН 3 + Е +
лучший друг −
4 → Fp(H
2 С=СНСН( Е )СН
3 ) +
лучший друг −
4
Fp-аллил и Fp-алленил реагируют с катионными электрофилами E (такими как Me 3 O + , карбокатионы , ионы оксокарбения ) с образованием продуктов аллильной и пропаргильной функционализации соответственно (уравнение 2). [16] Родственный комплекс [Cp*Fe(CO) 2 (thf)] + [БФ 4 ] − Было показано, что он катализирует пропаргильную и аллильную функционализацию CH путем объединения процессов депротонирования и электрофильной функционализации, описанных выше. [22]
или 2 -Алленильные комплексы Fp + и замещенные катионы дикарбонила циклопентадиенилирона также были охарактеризованы, причем рентгеноструктурный анализ показал существенный изгиб у центрального алленового углерода (угол связи <150 °). [23] [24]
Реагенты циклопропанирования на основе Fp
[ редактировать ]разработаны реагенты на основе Fp Для циклопропанаций . [25] Ключевой реагент приготовлен из FpNa с тиоэфиром и метилйодидом и имеет хороший срок хранения, в отличие от типичных промежуточных продуктов Симмонса-Смита и диазоалканов .
- FpNa + ClCH 2 SCH 3 → FpCH 2 SCH 3 + NaCl
- FpCH 2 SCH 3 + CH 3 I + NaBF 4 → FpCH 2 S(CH 3 ) 2 ]BF 4 + NaI
Использование [FpCH 2 S(CH 3 ) 2 ]BF 4 не требует специальных условий.
- Fp(CH
2 С +
(CH
3 )
2 )БФ −
4 + (Ph) 2 C=CH 2 → 1,1-дифенилциклопропан + …
Хлорид железа (III) добавляется для уничтожения побочных продуктов.
Предшественники Fp=CH +
2 , как и FpCH 2 OMe, который при протонировании превращается в карбен железа , также использовался в качестве реагентов циклопропанирования. [26]
Фотохимическая реакция
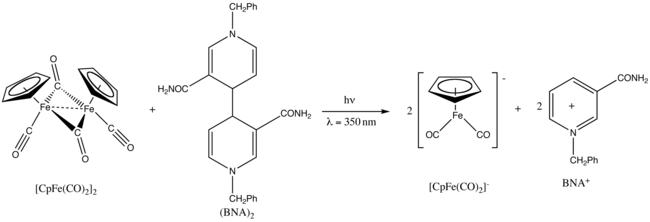
[ редактировать ]Fp 2 демонстрирует фотохимию . [27] Например, при УФ- облучении с длиной волны 350 нм он восстанавливается с помощью димера бензилникотинамид|1-бензил-1,4-дигидроникотинамид, также известного как (BNA) 2 . [28]
Ссылки
[ редактировать ]- ^ Келли, Уильям Дж. (2001). «Бис(дикарбонилциклопентадиенилирон)». Энциклопедия реагентов для органического синтеза . дои : 10.1002/047084289X.rb139 . ISBN 0471936235 .
- ^ Jump up to: а б Харрис, Дэниел С.; Розенберг, Эдвард; Робертс, Джон Д. (1974). «Спектры ядерного магнитного резонанса углерода-13 и механизм мостик-концевого карбонильного обмена в ди- ц -карбонил-бис[карбонил( η -циклопентадиенил)железо](Fe-Fe) [{( η -C 5 H 5 )Fe( CO) 2 } 2 ] cd -ди- µ -карбонил- f -карбонилаэ - ди( η -циклопентадиенил)- b -(триэтилфосфит)дижелезо(Fe–Fe) [( η -C 5 H) ; 5 ) 2 Fe 2 (CO) 3 P(OEt) 3 ] и некоторые родственные комплексы» (PDF) . Журнал Химического общества: Dalton Transactions (22): 2398–2403. дои : 10.1039/DT9740002398 . ISSN 0300-9246 .
- ^ Jump up to: а б Джиролами, Г .; Раухфусс, Т.; Анжеличи, Р. (1999). Синтез и техника в неорганической химии (3-е изд.). Саусалито, Калифорния: Университетские научные книги. стр. 171–180. ISBN 978-0-935702-48-4 .
- ^ Коттон, Ф. Альберт ; Ягупский Г. (январь 1967 г.). «Таутомерные изменения в карбонилах металлов. I.pi.-Циклопентадиенилирондикарбонильный димер железа и .pi.-циклопентадиенилрутендикарбонильный димер» . Неорганическая химия . 6 (1): 15–20. дои : 10.1021/ic50047a005 . ISSN 0020-1669 .
- ^ Jump up to: а б Уилкинсон, Г. , изд. (1982). Комплексная металлоорганическая химия . Том. 4. Нью-Йорк: Пергамон Пресс. стр. 513–613. ISBN 978-0-08-025269-8 .
- ^ Грин, Дженнифер С.; Грин, Малкольм Л.Х.; Паркин, Джерард (2012). «Возникновение и представление трехцентровых двухэлектронных связей в ковалентных неорганических соединениях». Химические коммуникации . 2012 (94): 11481–11503. дои : 10.1039/c2cc35304k . ПМИД 23047247 .
- ^ Jump up to: а б Лабингер, Джей А. (2015). «Имеет ли димер дикарбонила циклопентадиенильного железа связь металл-металл? Кто спрашивает?». Неорганика Химика Акта . Металл-металлические связные соединения и металлические кластеры. 424 : 14–19. дои : 10.1016/j.ica.2014.04.022 . ISSN 0020-1693 .
- ^ Пайпер, Т.С.; Коттон, ФА; Уилкинсон, Г. (1955). «Циклопентадиенил-моноксид углерода и родственные соединения некоторых переходных металлов». Журнал неорганической и ядерной химии . 1 (3): 165–174. дои : 10.1016/0022-1902(55)80053-X .
- ^ Чанг, TCT; Розенблюм, М.; Симмс, Н. (1988). «Винилирование енолятов эквивалентом винилового катиона: транс -3-метил-2-винилциклогексанон» . Органические синтезы . 66:95 ; Сборник томов , т. 8, с. 479 .
- ^ Кинг, Б. (1970). «Применение карбонильных анионов металлов в синтезе необычных металлоорганических соединений». Отчеты о химических исследованиях . 3 (12): 417–427. дои : 10.1021/ar50036a004 .
- ^ Десси, Раймонд Э.; Пол, Рудольф Л.; Кинг, Р. Брюс (1 ноября 1966 г.). «Металлоорганическая электрохимия. VII.1 Нуклеофильность металлических и металлоидных анионов, полученных из металлов групп IV, V, VI, VII и VIII» . Журнал Американского химического общества . 88 (22): 5121–5124. дои : 10.1021/ja00974a015 . ISSN 0002-7863 .
- ^ Эллис, Дж. Э.; Флом, Э.А. (1975). «Химия карбонильных анионов металлов: III. Натрий-калиевый сплав: эффективный реагент для производства карбонильных анионов металлов». Журнал металлоорганической химии . 99 (2): 263–268. дои : 10.1016/S0022-328X(00)88455-7 .
- ^ Десси, Р.Э.; Кинг, РБ; Уолдроп, М. (1966). «Металлоорганическая электрохимия. V. Переходный ряд». Журнал Американского химического общества . 88 (22): 5112–5117. дои : 10.1021/ja00974a013 .
- ^ Десси, Р.Э.; Вайсман, премьер-министр; Поль, Р.Л. (1966). «Металлоорганическая электрохимия. VI. Электрохимический разрыв связей металл-металл». Журнал Американского химического общества . 88 (22): 5117–5121. дои : 10.1021/ja00974a014 .
- ^ Сильвер, Дж. (1993). Химия железа . Дордрехт: Springer Нидерланды. ISBN 9789401121408 . OCLC 840309324 .
- ^ Jump up to: а б с Катлер, А.; Энхольт, Д.; Леннон, П.; Николас, К.; Мартен, Дэвид Ф.; Мадхаварао, М.; Рагху, С.; Розан, А.; Розенблюм, М. (1975). «Химия комплексов дикарбонил-эта-5-циклопентадиенилирона. Общий синтез монозамещенных η. 2 -олефиновых комплексов и 1-замещенных η 1 -аллильные комплексы. Конформационные эффекты на ход депротонирования ( η 2 -олефиновые) катионы». Журнал Американского химического общества . 97 (11): 3149–3157. doi : 10.1021/ja00844a038 . ISSN 0002-7863 .
- ^ Тернбулл, Марк М. (2001). «Дикарбонил(циклопентадиенил)(изобутен)тетрафторборат железа». Энциклопедия реагентов для органического синтеза . эЭРОС . дои : 10.1002/047084289X.rd080 . ISBN 0471936235 .
- ^ Шривер, Д.Ф.; Брюс, Мичиган; Уилкинсон, Г. (1995). Железо, Рутений и Осмий . Кидлингтон: Elsevier Science. ISBN 978-0-08-096396-9 . OCLC 953660855 .
- ^ Редлих, Марк Д.; Майер, Майкл Ф.; Хоссейн, М. Махмун (2003). "Железная кислота Льюиса [( η 5 -C 5 H 5 )Fe(CO) 2 (ТГФ)] + Катализируемые органические реакции». Aldrichimica Acta . 36 : 3–13.
- ^ Пирсон, Эй Джей (1994). Соединения железа в органическом синтезе . Сан-Диего, Калифорния: Academic Press. стр. 22–35. ISBN 978-0-12-548270-7 .
- ^ Акита, Мунетака, Сатоши; Терада, Масако, Масако, Ёсихико (2001) ; 2 -алкиновый лиганд в [CpFe(CO) 2 ( η 2 -R-C⋮C-R)] + . Зависимость стереохимии алкенильных продуктов от основности нуклеофила». Металлоорганика . 20 (13): 2736–2750. doi : 10.1021/om010095t . ISSN 0276-7333 .
- ^ Ван, Идун; Чжу, Цзинь; Дарем, Остин К.; Линдберг, Хейли; Ван, И-Мин (2019). «Функционализация α-C – H π-связей с использованием комплексов железа: каталитическое гидроксиалкилирование алкинов и алкенов». Журнал Американского химического общества . 141 (50): 19594–19599. дои : 10.1021/jacs.9b11716 . ISSN 0002-7863 . ПМИД 31791121 . S2CID 208611984 .
- ^ Фоксман, Брюс М. (1 января 1975 г.). «Рентгеновская молекулярная структура дикарбонил-η5-циклопентадиенил-(η2-тетраметилалленил)тетрафторбората железа. Простерически переполненный алленовый комплекс» . Журнал Химического общества, Химические коммуникации (6): 221–222. дои : 10.1039/C39750000221 . ISSN 0022-4936 .
- ^ Ван, Идун; Скривенер, Сара Г.; Цзо, Сяо-Дун; Ван, Жуйхан; Палермо, Филип Н.; Мерфи, Итан; Дарем, Остин К.; Ван, И-Мин (22 сентября 2021 г.). «Катализируемая железом контрастная функционализация алленовых связей C(sp 2 ) –H: синтез α-аминоалкил-1,1-дизамещенных алленов» . Журнал Американского химического общества . 143 (37): 14998–15004. дои : 10.1021/jacs.1c07512 . ISSN 0002-7863 . ПМЦ 8458257 . ПМИД 34491051 .
- ^ Мэттсон, Миннесота; О'Коннор, Э.Дж.; Хелквист, П. (1992). «Циклоппанирование с использованием железосодержащего реагента для переноса метилена: 1,1-дифенилциклопропана» . Органические синтезы . 70 :177 ; Сборник томов , т. 9, с. 372 .
- ^ Джонсон, доктор медицинских наук (1982), «Моноядерные соединения железа с η 1 -Углеводородные лиганды» , Комплексная металлоорганическая химия , Elsevier, стр. 331–376, doi : 10.1016/b978-008046518-0.00049-0 , ISBN. 978-0-08-046518-0 , получено 11 декабря 2019 г.
- ^ Райтон, М. (1974). «Фотохимия карбонилов металлов». Химические обзоры . 74 (4): 401–430. дои : 10.1021/cr60290a001 .
- ^ Фукузуми, С.; Окубо, К.; Фудзицука, М.; Ито, О.; Тейхманн, MC; Мезонот, Э.; Аматоре, К. (2001). «Фотохимическая генерация дикарбонильного аниона циклопентадиенилирона с помощью аналога димера никотинамид-аденин-динуклеотида». Неорганическая химия . 40 (6): 1213–1219. дои : 10.1021/ic0009627 . ПМИД 11300821 .


![Присоединение карбаниона к [Fp(алкен)]+.](http://upload.wikimedia.org/wikipedia/commons/thumb/7/7e/FpMalonateRxn.png/330px-FpMalonateRxn.png)