Железоорганическая химия
Железоорганическая химия — это химия соединений железа, содержащих углерод - железо химическую связь . [1] [2] Железоорганические соединения актуальны в органическом синтезе в качестве реагентов, таких как пентакарбонил железа , нонакарбонил дижелеза и тетракарбонилферрат динатрия . Хотя железо, как правило, менее активно во многих каталитических приложениях, оно менее дорогое и « зеленее », чем другие металлы. [3] Железоорганические соединения содержат широкий спектр лигандов , поддерживающих связь Fe-C; как и в случае с другими металлоорганическими соединениями, эти поддерживающие лиганды в основном включают фосфины , монооксид углерода и циклопентадиенил , но жесткие лиганды, также используются и такие как амины.
Железо(–II) и Железо(0)
[ редактировать ]
Карбонильные комплексы
[ редактировать ]Важными карбонилами железа являются три нейтральных бинарных карбонила: пентакарбонил железа , нонакарбонил дижелеза и додекакарбонил трижелеза . Один или несколько карбонильных лигандов в этих соединениях могут быть заменены множеством других лигандов, включая алкены и фосфины. Комплекс железа(–II), тетракарбонилферрат динатрия (Na 2 [Fe(CO) 4 ]), также известный как «реагент Коллмана», получают восстановлением пентакарбонила железа металлическим натрием. Высоконуклеофильный анионный реагент может быть алкилирован и карбонилирован с образованием ацильных производных, которые подвергаются протонолизу с образованием альдегидов: [4]
- LiFe(CO) 4 (C(O)R) + H + → РЧО (+железосодержащие продукты)
Подобные ацилы железа можно получить, обработав пентакарбонил железа литийорганическими соединениями:
- ArLi + Fe(CO) 5 → LiFe(CO) 4 C(O)Ar
В этом случае карбанион атакует лиганд CO. В дополнительной реакции реагент Коллмана можно использовать для превращения ацилхлоридов в альдегиды. Аналогичные реакции могут быть достигнуты с [HFe(CO) 4 ] − соли. [5]
Производные алкена-Fe(0)-CO
[ редактировать ]
Моноалкены
[ редактировать ]Пентакарбонил железа фотохимически реагирует с алкенами с образованием Fe(CO) 4 (алкен). [6]
Производные диена-Fe(0)-CO
[ редактировать ]Диеновые комплексы железа обычно получают из Fe(CO) 5 или Fe 2 (CO) 9 . Известны производные обычных диенов, таких как циклогексадиен , [7] норборнадиен и циклооктадиен , но даже циклобутадиен можно стабилизировать. В комплексе с бутадиеном диен принимает цис-конформацию . Карбонилы железа являются потенциальными защитными группами для диенов, защищая их от гидрирования и реакций Дильса-Альдера . Трикарбонил циклобутадиен- железа получают из 3,4-дихлорциклобутена и Fe 2 (CO) 9 .
Циклогексадиены, многие из которых образуются в результате Берчем восстановления ароматических соединений , образуют производные (диена)Fe(CO) 3 . Сродство звена Fe(CO) 3 к сопряженным диенам проявляется в способности карбонилов железа катализировать изомеризацию 1,5 в -циклооктадиена 1,3 -циклооктадиен . Комплексы циклогексадиена подвергаются отщеплению гидрида с образованием циклогексадиенильных катионов, которые присоединяют нуклеофилы. Отщепление гидрида от циклогексадиеновых комплексов железа (0) дает производные железа. [8] [9]
Еноновый комплекс (бензилиденацетон)трикарбонил железа служит источником субъединицы Fe(CO) 3 и используется для получения других производных. Его используют аналогично Fe 2 (CO) 9 .
Производные алкин-Fe(0)-CO
[ редактировать ]Алкины реагируют с карбонилами железа, образуя большое количество производных. К производным относятся ферролы (Fe 2 (C 4 R 4 )(CO) 6 ), (п- хинон ) Fe(CO) 3 , (циклобутадиен) Fe(CO) 3 и многие другие. [10]
Три- и полиеновые комплексы Fe(0)
[ редактировать ]Стабильные железосодержащие комплексы с лигандами CO и без них известны для широкого спектра полиненасыщенных углеводородов, например циклогептатриена , азулена и булвалена . В случае циклооктатетраена (COT) производные включают Fe(COT) 2 , [11] Fe 3 (COT) 3 , [12] и несколько смешанных COT-карбонилов (например, Fe(COT)(CO) 3 и Fe 2 (COT)(CO) 6 ).

Железо(I) и железо(II)
[ редактировать ]Поскольку Fe(II) является обычной степенью окисления Fe, известны многие железоорганические соединения(II). Соединения Fe(I) часто содержат связи Fe-Fe, но встречаются исключения, например [Fe(антрацен) 2 ] − . [13]
Ферроцен и его производные
[ редактировать ]Быстрый рост металлоорганической химии в 20 веке можно отнести к открытию ферроцена , очень стабильного соединения, которое предшествовало синтезу многих родственных сэндвич-соединений . Ферроцен образуется в результате реакции циклопентадиенида натрия с хлоридом железа (II) :
- 2 NaC 5 H 5 + FeCl 2 → Fe(C 5 H 5 ) 2 + 2 NaCl
Ферроцен проявляет разнообразную реакционную способность, локализованную на циклопентадиенильных лигандах, включая реакции Фриделя-Крафтса и литирование. Однако некоторые реакции электрофильной функционализации протекают через первоначальную атаку на центр Fe с образованием изгиба [Cp 2 Fe–Z] + виды (формально Fe(IV)). Например, HF:PF 5 и Hg(OTFA) 2 образуют изолируемые или наблюдаемые спектроскопически комплексы [Cp 2 Fe–H] + ПФ 6 – и Cp 2 Fe + –Hg – (OTFA) 2 соответственно. [14] [15] [16]
Ферроцен также является структурно необычным каркасом, о чем свидетельствует популярность таких лигандов, как 1,1'-бис(дифенилфосфино)ферроцен , которые полезны в катализе. [17] Обработка ферроцена трихлоридом алюминия и бензолом дает катион [CpFe(C 6 H 6 )] + . Окисление ферроцена дает синий вид ферроцения 17e . Производные фуллерена также могут выступать в роли сильнозамещенного циклопентадиенильного лиганда.
Фп 2 , Фп − и Фп + и производные
[ редактировать ]Fe(CO) 5 реагирует с циклопентадиеном с образованием двухъядерного димера дикарбонила циклопентадиенилирона Fe(I) ([FeCp(CO) 2 ] 2 ), часто обозначаемого сокращенно Fp 2 . Пиролиз Fp 2 дает кубический кластер [FeCp(CO)] 4 .
Сильно затрудненные замещенные циклопентадиенильные лиганды могут давать изолируемые мономерные формы Fe (I). Например, КП я-Пр5 Fe(CO) 2 (Cp я-Пр5 = i-Pr 5 C 5 ) охарактеризован кристаллографически. [18]
Восстановление Fp 2 натрием дает «NaFp», содержащий мощный нуклеофил и предшественник многих производных типа CpFe(CO) 2 R. [19] Производное [FpCH 2 S(CH 3 ) 2 ] + использовался в циклопропанациях . [20] Фп + фрагмент является кислотным по Льюису и легко образует комплексы с простыми эфирами, аминами, пиридином и др., а также с алкенами и алкинами в η 2 координационный режим. Комплекс Фп + (или 2 - виниловый эфир )] + представляет собой замаскированный виниловый катион . [21] Недавно появился метановый комплекс [Fp(CH 4 )] + [Al(OC(CF 3 ) 3 ) 4 ] – , был получен и охарактеризован спектроскопически с использованием перфторалкоксиалюмината в качестве некоординирующего противоиона и 1,1,1,3,3,3-гексафторпропана в качестве некоординирующего растворителя. [22]
Соединения Fp-R являются прохиральными , и в исследованиях использовались хиральные производные CpFe(PPh 3 )(CO) ацил. [23]
Алкильные, аллильные и арильные соединения
[ редактировать ]Простых пералкильных и перарильных комплексов железа меньше, чем производных Cp и CO. Одним из примеров является тетрамезитилдижелезо .

Соединения типа [(η 3 -аллил)Fe(CO) 4 ] + Х − являются аллильных катионов синтонами при аллильном замещении . [6] Напротив, соединения типа [(η 5 -C 5 H 5 )Fe(CO) 2 (CH 2 CH=CHR)], обладающий η 1 -аллильные группы аналогичны формам аллилметаллов основной группы (M = B, Si, Sn и т. д.) и реагируют с углеродными электрофилами с образованием продуктов аллилирования с S E 2'-селективностью. [24] Аналогично, алленил(циклопентадиенилирон)дикарбонильные комплексы проявляют реакционную способность, аналогичную соединениям алленилметаллов основной группы, и служат нуклеофильными пропаргилсинтонами. [25]
Производные серы и фосфора
[ редактировать ]Комплексы типа Fe 2 (SR) 2 (CO) 6 и Fe 2 (PR 2 ) 2 (CO) 6 образуются обычно при реакции тиолов и вторичных фосфинов с карбонилами железа. [26] Тиолаты также можно получить из тетраэдрана Fe 2 S 2 (CO) 6 .
Железо(III)
[ редактировать ]Алкилирование FeCl 3 метилмагнийбромидом 4 дает [Fe( 3 ) CH ] – , который термически лабилен. [27] Такие соединения могут иметь отношение к механизму реакций кросс-сочетания, катализируемых Fe . [28]
Некоторые железоорганические соединения (III) получают окислением железоорганических соединений (II). Давно известный пример — ферроцений [(C 5 H 5 ) 2 Fe] + . Также многочисленны железо(III)-порфириновые комплексы, включая алкильные и арильные производные. [29] [30]
Железо(IV)
[ редактировать ]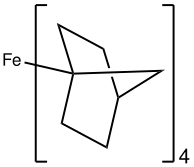
В Fe(норборниле) 4 Fe(IV) стабилизирован алкильным лигандом, который препятствует удалению бета-гидрида . [32] Удивительно, но FeCy 4 , который подвержен элиминированию бета-гидрида, также был выделен и кристаллографически охарактеризован и стабилен при –20 °C. Неожиданная стабильность была объяснена стабилизирующими дисперсионными силами, а также конформационными эффектами, которые препятствуют удалению бета-гидрида. [33]
Двухэлектронное окисление декаметилферроцена дает дикатион [Fe(C 5 Me 5 ) 2 ] 2+ , который образует карбонильный комплекс, [Fe(C 5 Me 5 ) 2 (CO)](SbF 6 ) 2 . [34] Также известно, что ферроцен подвергается протонированию в железном центре с помощью HF/AlCl 3 или HF/PF 5 с образованием формально гидридного комплекса Fe(IV) [Cp 2 FeH] + [ПФ 6 ] – . [35] [36]
Iron(V, VI, VII)
[ редактировать ]В 2020 году Джереми М. Смит и его коллеги сообщили о кристаллографической характеристике бисимидных комплексов Fe (V) и Fe (VI) на основе бидентатного бис (карбен) боратного лиганда. [37] В силу строения опорных лигандов эти виды образуют металлоорганические комплексы Fe(V) и Fe(VI).
В 2024 году Карстен Мейер и его коллеги сообщили о кристаллографически охарактеризованном нитридном комплексе Fe (VI) [(TIMMN Мы )Фе МЫ (≡N)(F)](PF 6 ) 2 ·CH 2 Cl 2 , который несет трис(N-гетероциклический карбеновый) лиганд (трис[(3-мезитилимидазол-2-илиден)метил]амин). Родственные комплексы Fe(V) были кристаллографически охарактеризованы в том же исследовании, а разновидность Fe(VII), разлагающаяся при температуре выше –50 °C, была охарактеризована с помощью мессбауэровской спектроскопии . [38]
Железоорганические соединения в органическом синтезе и гомогенном катализе.
[ редактировать ]используются редко В промышленном катализе комплексы железа в отличие от кобальта и никеля . Из-за дешевизны и малой токсичности солей железо привлекательно в качестве стехиометрического реагента. Некоторые области расследования включают в себя:
- Гидрирование и восстановление , например, катализатор Кнёлькер комплекс .
- Реакции кросс-сочетания . Соединения железа, такие как Fe( acac ) 3, катализируют широкий спектр реакций кросс-сочетания, при этом одним субстратом является арил или алкил Гриньяра , а другим субстратом является арил, алкенил (винил) или ацилорганический галогенид . В родственном соединении Кумады катализаторы основаны на палладии и никеле .
- Комплексы оснований Шиффа являются активными катализаторами полимеризации олефинов. [39]
Биохимия
[ редактировать ]В области металлоорганической химии железоорганические соединения обнаруживаются в активных центрах трех ферментов гидрогеназы, а также дегидрогеназы угарного газа.
Дальнейшее чтение
[ редактировать ]- Э. А. Кернер фон Густорф; Ф.-В. Гревелс; И. Фишлер, ред. (1978). Органическая химия железа . Академическая пресса. дои : 10.1016/B978-0-12-417101-5.X5001-X . ISBN 978-0-12-417101-5 .
Ссылки
[ редактировать ]- ^ Синтез металлоорганических соединений: Практическое руководство Санширо Комия Ред. С. Комия, М. Хурано 1997 г.
- ^ Болм, Карстен (2004). «Катализируемые железом реакции в органическом синтезе». Химические обзоры . 104 (12): 6217–6254. дои : 10.1021/cr040664h . PMID 15584700 .
- ^ Энталер, С.; Юнге, К.; Беллер, М. (2008). «Устойчивый катализ металлов железом: от ржавчины к восходящей звезде?». Энджью. хим. Межд. Эд . 47 (18): 3317–3321. дои : 10.1002/anie.200800012 . ПМИД 18412184 .
- ^ Финке, Ричард Г.; Соррелл, Томас Н. (1979). «Нуклеофильное ацилирование тетракарбонилферратом динатрия: метил-7-оксогептаноат и метил-7-оксооктаноат». Органические синтезы . 59 : 102. дои : 10.15227/orgsyn.059.0102 .
- ^ Брюне Джей-Джей (1990). «Тетракарбонилгидридоферраты, MHFe(CO) 4 : универсальные инструменты в органическом синтезе и катализе». хим. Преподобный . 90 (1041–1059): 1041. doi : 10.1021/cr00104a006 .
- ^ Перейти обратно: а б Д. Эндерс; Б. Янделейт; С. фон Берг (2002). «(+)-(1R,2S,3R)-Тетракарбонил[(1-3η)-1-(Фенилсульфонил)-Бут-2-ен-1-ил]тетрафторборат железа(1+)». Орг. Синтез . 78 : 189. дои : 10.15227/orgsyn.078.0189 .
- ^ Пирсон, Энтони Дж.; Сунь, Хуйкай (2008). «Циклогексадиен-трикарбонил железа». Энциклопедия реагентов для органического синтеза E-EROS . дои : 10.1002/047084289X.rn00791 . ISBN 978-0471936237 .
- ^ Берч, Эй Джей; Чемберлен, КБ (1977). «Трикарбонил[(2,3,4,5-η)-2,4-циклогексадиен-1-он]железо и трикарбонил[(1,2,3,4,5-η)-2-метокси-2,4 -циклогексадиен-1-ил]железо(1+) Гексафторфосфат(1-) из анизола». Органические синтезы . 57 : 107. дои : 10.15227/orgsyn.057.0107 .
- ^ Берч, Эй Джей; Чемберлен, КБ (1977). «Алкилирование димедона комплексом трикарбонил(диен)железа: трикарбонил[2-[(2,3,4,5-η)-4-метокси-2,4-циклогексадиен-1-ил]-5,5-диметил -1,3-циклогександион]железо». Орг. Синтез . 57 : 16. дои : 10.15227/orgsyn.057.0016 .
- ^ К. Хоогзанд; В. Хьюбель (1968). «Циклическая полимеризация ацетиленов карбонильными соединениями металлов». В Вендере, И.; Пино, П. (ред.). Органический синтез с помощью карбонилов металлов. Том 1 . Уайли. ISBN 0-471-93367-8 .
- ^ Д.Х. Герлах, Р.А. Шунн, Inorg. Синтез. том 15, 2 ( 1974 ) два : 10.1002/9780470132463.ch1
- ^ Лавалло Винсент, Граббс Роберт Х (2009). «Карбены как катализаторы превращений железоорганических комплексов» . Наука . 326 (5952): 559–562. Бибкод : 2009Sci...326..559L . дои : 10.1126/science.1178919 . ПМЦ 2841742 . ПМИД 19900894 .
- ^ Эллис, Дж. Э. (2019). «Реакция Чатта: традиционные пути получения гомолептических аренметаллатов элементов d-блока». Транзакции Далтона . 48 (26): 9538–9563. дои : 10.1039/C8DT05029E . ПМИД 30724934 . S2CID 73436073 .
- ^ Астрюк, Дидье (2017). «Почему ферроцен такой исключительный?». Европейский журнал неорганической химии . 2017 (1): 6–29. дои : 10.1002/ejic.201600983 . ISSN 1099-0682 .
- ^ Малишевский, Мориц; Зеппельт, Конрад; Саттер, Йорг; Хайнеманн, Франк В.; Диттрих, Биргер; Мейер, Карстен (2017). «Протонирование ферроцена: низкотемпературное рентгеновское дифракционное исследование [Cp2FeH] (PF6) выявило связанный с железом гидридо-лиганд». Международное издание «Прикладная химия» . 56 (43): 13372–13376. дои : 10.1002/anie.201704854 . ISSN 1521-3773 . ПМИД 28834022 .
- ^ Каннингем, Аллан Ф. (1 марта 1997 г.). «Механизм меркурации ферроцена: общий подход к электрофильному замещению производных ферроцена». Металлоорганические соединения . 16 (6): 1114–1122. дои : 10.1021/om960815+ . ISSN 0276-7333 .
- ^ Петр Степницка «Ферроцены: лиганды, материалы и биомолекулы» Дж. Вили, Хобокен, 2008. ISBN 0-470-03585-4
- ^ Зицманн, Гельмут; Декабрь, Томас; Каим, Вольфганг; Бауманн, Франк; Сталке, Дитмар; Керхер, Йорг; Дорманн, Эльмар; Зима, Юбер; Вахтер, Кристоф; Келемен, Марк (1996). «Синтез и характеристика стабильного дикарбонильного (циклопентадиенил) радикала железа [(C5R5)Fe(CO)2] (R CHMe2)» . Международное издание «Прикладная химия» на английском языке . 35 (23–24): 2872–2875. дои : 10.1002/anie.199628721 . ISSN 1521-3773 .
- ^ Кейт Х. Паннелл; Хемант К. Шарма (2010). «(Циклопентадиенил)дикарбонилметилжелезо ((η 5 -C 5 H 5 )Fe(CO) 2 CH 3 , FpMe), семенной алкильный комплекс переходного металла: подвижность метильной группы». Металлоорганические соединения . 29 (21): 4741–4745. doi : 10.1021/om1004594 .
- ^ Мэтью Н. Мэттсон; Эдвард Дж. О'Коннор; Пол Хелквист (1998). «Циклопропанирование с использованием железосодержащего реагента для переноса метилена: 1,1-дифенилциклопропана» . Органические синтезы ; Сборник томов , т. 9, с. 372 .
- ^ Тони CT Чанг; Майрон Розенблюм; Нэнси Симмс (1988). «Винилирование енолятов эквивалентом винилового катиона: транс-3-метил-2-винилциклогексанон». Орг. Синтез . 66 : 95. дои : 10.15227/orgsyn.066.0095 .
- ^ Уотсон, Джеймс Д.; Филд, Лесли Д.; Болл, Грэм Э. (28 сентября 2022 г.). «[Fp(CH 4 )] + , [η 5 -CpRu(CO) 2 (CH 4 )] + и [η 5 -CpOs(CO) 2 (CH 4 )] +: полный набор металлов 8-й группы. –Метановые комплексы» . Журнал Американского химического общества . 144 (38): 17622–17629. дои : 10.1021/jacs.2c07124 . ISSN 0002-7863 .
- ^ Карола Рюк-Браун «Ацильные комплексы железа» в переходных металлах для органического синтеза. Том 1. 2-е изд., М. Беллер, К. Болм, ред. Wiley-VCH, 2004, Вайнхайм. ISBN 3-527-30613-7 .
- ^ Катлер, А.; Энхольт, Д.; Леннон, П.; Николас, К.; Мартен, Дэвид Ф.; Мадхаварао, М.; Рагху, С.; Розан, А.; Розенблюм, М. (1 мая 1975 г.). «Химия дикарбонил-эта.5-циклопентадиенилироновых комплексов железа. Общие синтезы монозамещенных .эта.2-олефиновых комплексов и 1-замещенных .эта.1-аллильных комплексов. Конформационные эффекты на ход депротонирования (.2-) олефиновые) катионы». Журнал Американского химического общества . 97 (11): 3149–3157. дои : 10.1021/ja00844a038 . ISSN 0002-7863 .
- ^ Ван, Идун; Чжу, Цзинь; Дарем, Остин К.; Линдберг, Хейли; Ван, И-Мин (18 декабря 2019 г.). «Функционализация α-C – H π-связей с использованием комплексов железа: каталитическое гидроксиалкилирование алкинов и алкенов». Журнал Американского химического общества . 141 (50): 19594–19599. дои : 10.1021/jacs.9b11716 . ISSN 0002-7863 . ПМИД 31791121 . S2CID 208611984 .
- ^ Кинг, Р.Б., «Сераорганические производные карбонилов металлов. I. Выделение двух изомерных продуктов в реакции додекакарбонила трижелеза с диметилдисульфидом», J. Am. хим. Сок., 1962, 84, 2460.
- ^ Сирс, Джеффри Д.; Муньос, Сальвадор Б.; Куэнка, Мария Камила Агилера; Бреннессел, Уильям В.; Нейдиг, Майкл Л. (2019). «Синтез и характеристика стерически обремененного гомолептического комплекса феррата тетраалкилжелеза (III)» . Многогранник . 158 : 91–96. дои : 10.1016/j.poly.2018.10.041 . ПМК 6481957 . ПМИД 31031511 . и ссылки в нем.
- ^ Мако, ТЛ; Байерс, Дж. А. (2016). «Последние достижения в реакциях перекрестного сочетания, катализируемых железом, и их механистическая основа». Границы неорганической химии . 3 (6): 766–790. дои : 10.1039/C5QI00295H .
- ^ Огоши, Хисанобу; Сугимото, Хироши; Ёсида, Дзен-Ичи; Кобаяши, Ханако; Сакаи, Хироши; Маэда, Ютака (1982). «Синтез и магнитные свойства комплексов арилирона(III) октаэтилпорфиринов» . Журнал металлоорганической химии . 234 (2): 185–195. дои : 10.1016/s0022-328x(00)85854-4 . ISSN 0022-328X .
- ^ Лекса, Дорис; Миспельтер, Джоэл; Саван, Жан Мишель (1981). «Электровосстановительное алкилирование железа в порфириновых комплексах. Электрохимические и спектральные характеристики сигма-алкилжелезопорфиринов» . Журнал Американского химического общества . 103 (23): 6806–6812. дои : 10.1021/ja00413a004 . ISSN 0002-7863 .
- ^ Паскаль Доппельт (1984). «Молекулярная стереохимия низкоспинового пятикоординационного фенил(мезо-тетрафенилпорфиринато)железа(III)». Неорг. Хим . 23 (24): 4009–4011. дои : 10.1021/ic00192a033 .
- ^ Б. К. Бауэр и Х. Г. Теннент (1972). «Бицикло[2.2.1]гепт-1-илы переходных металлов». Дж. Ам. хим. Соц. 94 (7): 2512–2514. дои : 10.1021/ja00762a056 .
- ^ Каситас, Алисия; Рис, Джулиан А.; Годдард, Ричард; Билл, Экхард; ДеБир, Серена; Фюрстнер, Алоис (14 августа 2017 г.). «Два исключительных гомолептических тетраалкильных комплекса железа (IV)» . Angewandte Chemie, международное издание . 56 (34): 10108–10113. дои : 10.1002/anie.201612299 . ПМИД 28251752 .
- ^ Малишевский, Мориц; Зеппельт, Конрад; Саттер, Йорг; Мунц, Доминик; Мейер, Карстен (2018). «Дикатионный карбонильный комплекс железа (IV) на основе ферроцена». Международное издание «Прикладная химия» . 57 (44): 14597–14601. дои : 10.1002/anie.201809464 . ISSN 1521-3773 . ПМИД 30176109 . S2CID 52145802 .
- ^ Розенблюм, Мирон; Сантер, Дж. О. (1959). «ПРОТОНИРОВАНИЕ ФЕРРоценА СИЛЬНЫМИ КИСЛОТАМИ 1» . Журнал Американского химического общества . 81 (20): 5517–5518. дои : 10.1021/ja01529a075 . ISSN 0002-7863 .
- ^ Малишевский, Мориц; Зеппельт, Конрад; Саттер, Йорг; Хайнеманн, Франк В.; Диттрих, Биргер; Мейер, Карстен (16 октября 2017 г.). «Протонирование ферроцена: низкотемпературное рентгеновское дифракционное исследование [Cp 2 FeH] (PF 6 ) выявило связанный с железом гидридо-лиганд» . Международное издание «Прикладная химия» . 56 (43): 13372–13376. дои : 10.1002/anie.201704854 . ISSN 1433-7851 .
- ^ Мартинес, Хорхе Л.; Лутц, Шон А.; Ян, Хао; Се, Цзязе; Тельсер, Джошуа; Хоффман, Брайан М.; Карта, Вероника; Пинк, Марен; Лосовый, Ярослав; Смит, Джереми М. (16 октября 2020 г.). «Структурная и спектроскопическая характеристика бис(имидо) комплекса Fe (VI)» . Наука . 370 (6514): 356–359. дои : 10.1126/science.abd3054 . ISSN 0036-8075 .
- ^ Кейлверт, Мартин; Мао, Вэйцин; Малишевский, Мориц; Яннуцци, Серджио А.В.; Брейтвизер, Кевин; Хайнеманн, Франк В.; Шерер, Андреас; ДеБир, Серена; Мунц, Доминик; Билл, Экхард; Мейер, Карстен (30 января 2024 г.). «Синтез и характеристика нитридо комплекса железа (VII)» . Химия природы : 1–7. дои : 10.1038/s41557-023-01418-4 . ISSN 1755-4349 . ПМЦ 10997499 .
- ^ Аллан, ЛЕН; Шейвер, член парламента; Уайт, AJP и Гибсон, VC, «Корреляция спинового состояния металла в катализаторах альфа-дииминового железа с механизмом полимеризации», Inorg. хим., 2007, 46, 8963-8970.
