Химическая связь
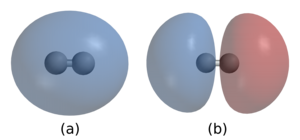
2 . В (а) два ядра окружены облаком из двух электронов на связующей орбитали, которая удерживает молекулу вместе. водорода (б) показывает разрыхляющую орбиталь , которая имеет более высокую энергию и обычно не занята электронами.
— Химическая связь это объединение атомов или ионов с образованием молекул , кристаллов и других структур. Связь может возникнуть в результате электростатической силы между противоположно заряженными ионами, как в ионных связях , или в результате совместного использования электронов, как в ковалентных связях , или в результате некоторой комбинации этих эффектов. Химические связи описываются как имеющие разную силу: существуют «сильные связи» или «первичные связи», такие как ковалентные , ионные и металлические связи, и «слабые связи» или «вторичные связи», такие как диполь-дипольные взаимодействия , дисперсионная сила Лондона. и водородная связь .
Поскольку противоположные электрические заряды притягиваются, отрицательно заряженные электроны, окружающие ядро, и положительно заряженные протоны внутри ядра притягивают друг друга. Электроны, общие для двух ядер, будут притягиваться к ним обоим. «Конструктивная квантовомеханическая волновых функций интерференция » [1] стабилизирует парные ядра (см. Теории химической связи ). Связанные ядра поддерживают оптимальное расстояние (расстояние связи), уравновешивая эффекты притяжения и отталкивания, количественно объясненные квантовой теорией . [2] [3]
Атомы в молекулах , кристаллах , металлах и других формах материи удерживаются вместе химическими связями, которые определяют структуру и свойства материи.
Все связи могут быть описаны квантовой теорией , но на практике упрощенные правила и другие теории позволяют химикам предсказывать силу, направленность и полярность связей. [4] Примерами являются правило октетов и теория VSEPR . Более сложные теории — это теория валентных связей , которая включает орбитальную гибридизацию. [5] и резонанс , [6] и теория молекулярных орбиталей [7] которая включает линейную комбинацию атомных орбиталей и теорию поля лигандов . Электростатика используется для описания полярности связей и их воздействия на химические вещества.
Обзор основных типов химических связей
Химическая связь – это притяжение между атомами. Это притяжение можно рассматривать как результат различного поведения внешних или валентных электронов атомов. Эти модели поведения плавно переходят друг в друга в различных обстоятельствах, поэтому между ними невозможно провести четкую границу. Однако остается полезным и общепринятым различать разные типы связи, которые приводят к различным свойствам конденсированного вещества .
В простейшем виде ковалентной связи один или несколько электронов (часто пара электронов) втягиваются в пространство между двумя атомными ядрами. Энергия высвобождается при образовании связи. [8] Это происходит не в результате уменьшения потенциальной энергии, поскольку притяжение двух электронов к двум протонам компенсируется электрон-электронным и протон-протонным отталкиванием. Вместо этого высвобождение энергии (и, следовательно, стабильность связи) возникает из-за уменьшения кинетической энергии из-за того, что электроны находятся на более пространственно распределенной (т.е. с более длинной длиной волны де Бройля ) орбитали по сравнению с тем, что каждый электрон удерживается ближе к соответствующему ядру. . [9] Эти связи существуют между двумя конкретными идентифицируемыми атомами и имеют направление в пространстве, что позволяет отображать их в виде отдельных соединительных линий между атомами на рисунках или моделировать в виде палочек между сферами в моделях.
В полярной ковалентной связи один или несколько электронов неравномерно распределены между двумя ядрами. Ковалентные связи часто приводят к образованию небольших групп атомов с лучшими связями, называемых молекулами , которые в твердых телах и жидкостях связаны с другими молекулами силами, которые часто намного слабее, чем ковалентные связи, которые удерживают молекулы вместе внутри. Такие слабые межмолекулярные связи придают органическим молекулярным веществам, таким как воски и масла, мягкую объемность и низкую температуру плавления (в жидкостях молекулы должны прекратить наиболее структурированный или ориентированный контакт друг с другом). Однако когда ковалентные связи соединяют длинные цепочки атомов в больших молекулах (как в полимерах, таких как нейлон ) или когда ковалентные связи распространяются в сетях через твердые тела, которые не состоят из дискретных молекул (таких как алмаз или кварц или силикатные минералы во многих типы горных пород), то получаемые в результате структуры могут быть как прочными, так и жесткими, по крайней мере, в правильно ориентированном направлении с сетью ковалентных связей. [10] Кроме того, значительно повышаются температуры плавления таких ковалентных полимеров и сеток.
В упрощенном представлении об ионной связи связывающий электрон вообще не разделяется, а переносится. В связи этого типа внешняя атомная орбиталь одного атома имеет вакансию, которая позволяет присоединить один или несколько электронов. Эти вновь добавленные электроны потенциально занимают более низкое энергетическое состояние (фактически ближе к большему заряду ядра), чем в другом атоме. Таким образом, одно ядро обеспечивает более прочную связь с электроном, чем другое ядро, в результате чего один атом может передать электрон другому. В результате этого переноса один атом принимает чистый положительный заряд, а другой — чистый отрицательный заряд. возникает В этом случае связь в результате электростатического притяжения между положительно и отрицательно заряженными ионами . Ионные связи можно рассматривать как крайние примеры поляризации ковалентных связей. Часто такие связи не имеют определенной ориентации в пространстве, поскольку возникают в результате одинакового электростатического притяжения каждого иона ко всем ионам вокруг него. Ионные связи прочны (и, следовательно, для плавления ионных веществ требуются высокие температуры), но также хрупкие, поскольку силы между ионами кратковременны и с трудом перекрывают трещины и разрушения. Этот тип связи обуславливает физические характеристики кристаллов классических минеральных солей, например поваренной соли.
Менее часто упоминаемый тип соединения — металлическое соединение . При этом типе связи каждый атом металла отдает один или несколько электронов «морю» электронов, которое находится между многими атомами металла. В этом море каждый электрон может (в силу своей волновой природы ) быть связан с большим количеством атомов одновременно. Связь возникает потому, что атомы металла становятся несколько положительно заряженными из-за потери своих электронов, в то время как электроны продолжают притягиваться ко многим атомам, не являясь частью какого-либо данного атома. Металлическую связь можно рассматривать как крайний пример делокализации электронов в большой системе ковалентных связей, в которой участвует каждый атом. Этот тип связи часто бывает очень прочным (что приводит к прочности металлов на разрыв). Однако металлические связи по своей природе более коллективны, чем другие типы, и поэтому они позволяют металлическим кристаллам легче деформироваться, поскольку они состоят из атомов, притягивающихся друг к другу, но не каким-либо особенно ориентированным образом. Это приводит к ковкости металлов. Облако электронов в металлической связи обуславливает характерную для металлов хорошую электро- и теплопроводность, а также их блестящий блеск. блеск , отражающий большинство частот белого света.
История

Ранние предположения о природе химической связи , возникшие еще в XII веке, предполагали, что определенные типы химических соединений связаны определенным типом химического сродства . В 1704 году сэр Исаак Ньютон в «Запросе 31» своей «Оптики » изложил свою теорию атомных связей , согласно которой атомы прикрепляются друг к другу с помощью некоторой « силы ». В частности, после признания различных популярных в то время теорий о том, как считалось, что атомы прикрепляются друг к другу, т.е. на основании их сцепления он предпочел бы сделать вывод, что «частицы притягивают друг друга какой-то силой , которая при непосредственном контакте чрезвычайно сильна, на малых расстояниях совершает химические операции и распространяется недалеко от частиц с каким-либо ощутимым эффектом».
В 1819 году, вслед за изобретением гальванической батареи , Йёнс Якоб Берцелиус разработал теорию химического соединения, подчеркивая электроотрицательный и электроположительный характер объединяющихся атомов. К середине 19 века Эдвард Франкланд , Ф. А. Кекуле , А. С. Купер, Александр Бутлеров и Герман Кольбе , опираясь на теорию радикалов , разработали теорию валентности , первоначально названную «объединяющей силой», в которой соединения соединялись благодаря притяжение положительных и отрицательных полюсов. В 1904 году Ричард Абегг предложил свое правило , согласно которому разница между максимальной и минимальной валентностью элемента часто равна восьми. На тот момент валентность все еще оставалась эмпирическим числом, основанным только на химических свойствах.
Однако природа атома стала яснее после Эрнестом Резерфордом открытия в 1911 году атомного ядра , окруженного электронами, в котором он цитировал Нагаоку, отверг модель Томсона на том основании, что противоположные заряды непроницаемы. В 1904 году Нагаока предложил альтернативную планетарную модель атома , в которой положительно заряженный центр окружен множеством вращающихся электронов, подобно Сатурну и его кольцам. [11]
Модель Нагаоки сделала два прогноза:
- очень массивный атомный центр (по аналогии с очень массивной планетой)
- электроны, вращающиеся вокруг ядра, связанные электростатическими силами (по аналогии с кольцами, вращающимися вокруг Сатурна, связанными силами гравитации).
Резерфорд упоминает модель Нагаоки в своей статье 1911 года, в которой атомное ядро . предлагается [12]
На Сольвеевской конференции 1911 года при обсуждении того, что может регулировать разницу в энергии между атомами, Макс Планк заявил: «Посредниками могут быть электроны». [13] Эти ядерные модели предполагали, что электроны определяют химическое поведение.
Следующей появилась Нильсом Бором в модель ядерного атома с электронными орбитами, разработанная 1913 году. В 1916 году химик Гилберт Н. Льюис разработал концепцию электронно-парных связей , в которой два атома могут разделять от одного до шести электронов, образуя таким образом одноэлектронную связь , одинарную связь , двойную связь или тройную связь ; По словам самого Льюиса: «Электрон может образовывать часть оболочки двух разных атомов, и нельзя сказать, что он принадлежит исключительно одному из них». [14]
Также в 1916 году Вальтер Коссель выдвинул теорию, аналогичную теории Льюиса, только его модель предполагала полный перенос электронов между атомами и, таким образом, была моделью ионной связи . И Льюис, и Коссель построили свои модели связей на основе правила Абегга (1904).
Нильс Бор также предложил модель химической связи в 1913 году. Согласно его модели двухатомной молекулы , электроны атомов молекулы образуют вращающееся кольцо, плоскость которого перпендикулярна оси молекулы и равноудалена от атомных ядер. . Динамическое равновесие молекулярной системы достигается за счет баланса сил между силами притяжения ядер к плоскости кольца электронов и силами взаимного отталкивания ядер. Модель химической связи Бора учитывала кулоновское отталкивание – электроны в кольце находятся на максимальном расстоянии друг от друга. [15] [16]
В 1927 году было получено первое математически полное квантовое описание простой химической связи, т.е. той, которая образуется одним электроном в молекулярном ионе водорода H 2 . + , была выведена датским физиком Ойвиндом Буррау . [17] Эта работа показала, что квантовый подход к химическим связям может быть фундаментально и количественно правильным, но используемые математические методы не могут быть распространены на молекулы, содержащие более одного электрона. Более практичный, хотя и менее количественный подход был предложен в том же году Уолтером Хайтлером и Фрицем Лондоном . Метод Гейтлера-Лондона лежит в основе того, что сейчас называется теорией валентных связей . [18] В 1929 году приближение метода молекулярных орбиталей линейной комбинации атомных орбиталей (LCAO) было введено сэром Джоном Леннардом-Джонсом , который также предложил методы вывода электронных структур молекул молекул F 2 ( фтора ) и O 2 ( кислорода ), из основные квантовые принципы. Эта теория молекулярных орбиталей представляла ковалентную связь как орбиталь, образованную путем объединения квантовомеханических атомных орбиталей Шредингера , которые были выдвинуты гипотезой для электронов в отдельных атомах. Уравнения связи электронов в многоэлектронных атомах не могли быть решены с математическим совершенством (т. е. аналитически ), но аппроксимации для них все же давали много хороших качественных предсказаний и результатов. Большинство количественных расчетов в современной квантовой химии используют в качестве отправной точки либо теорию валентных связей, либо теорию молекулярных орбиталей, хотя третий подход, теория функционала плотности , становится все более популярным в последние годы.
В 1933 году Х. Х. Джеймс и А. С. Кулидж провели расчет молекулы диводорода, в котором, в отличие от всех предыдущих расчетов, в которых использовались только функции расстояния электрона от атомного ядра, использовались функции, которые также явно добавляли расстояние между двумя электронами. [19] Используя до 13 регулируемых параметров, они получили результат, очень близкий к экспериментальному результату для энергии диссоциации. Более поздние расширения использовали до 54 параметров и дали превосходное согласие с экспериментами. Этот расчет убедил научное сообщество в том, что квантовая теория может согласоваться с экспериментом. Однако этот подход не имеет никакой физической картины теорий валентной связи и молекулярных орбиталей, и его трудно распространить на более крупные молекулы.
Связи в химических формулах
Поскольку атомы и молекулы трехмерны, трудно использовать единый метод для обозначения орбиталей и связей. В молекулярных формулах химические связи (связывающие орбитали) между атомами обозначаются по-разному в зависимости от предмета обсуждения. Иногда некоторые детали упускаются из виду. Например, в органической химии иногда речь идет только о функциональной группе молекулы. Таким образом, молекулярная формула этанола может быть записана в конформационной форме, трехмерной форме, полной двумерной форме (с указанием каждой связи без трехмерных направлений), сжатой двумерной форме (СН 3 –СН 2 –ОН). , путем отделения функциональной группы от другой части молекулы (C 2 H 5 OH) или ее атомных составляющих (C 2 H 6 O), в соответствии с тем, что обсуждается. Иногда отмечаются даже несвязывающие электроны валентной оболочки (с двумерными приблизительными направлениями), например, для элементарного углерода . ' С ' . Некоторые химики могут также отмечать соответствующие орбитали, например гипотетический этилен. −4 анион ( \ / С=С / \ −4 ), что указывает на возможность образования облигаций.
Прочные химические связи
| Типичная длина связи в мкм и энергии связи в кДж/моль. [20] Длины связей можно конвертировать в Å. делением на 100 (1 Å = 100 пм). | ||
| Связь | Длина (вечера) | Энергия (кДж/моль) |
|---|---|---|
| Н — Водород | ||
| Ч – Ч | 74 | 436 |
| Н – О | 96 | 467 |
| В – П | 92 | 568 |
| H–Cl | 127 | 432 |
| С — Углерод | ||
| С – Ч | 109 | 413 |
| С – С | 154 | 347 |
| С – С= | 151 | |
| =C – C≡ | 147 | |
| =С–С= | 148 | |
| С=С | 134 | 614 |
| C≡C | 120 | 839 |
| C – N | 147 | 308 |
| С – О | 143 | 358 |
| С=О | 745 | |
| C≡O | 1,072 | |
| C – F | 134 | 488 |
| C–Cl | 177 | 330 |
| Н — Азот | ||
| Н – Н | 101 | 391 |
| Н – Н | 145 | 170 |
| N≡N | 110 | 945 |
| О — Кислород | ||
| О-О | 148 | 146 |
| О=О | 121 | 495 |
| F, Cl, Br, I — Галогены | ||
| Ф–Ф | 142 | 158 |
| Cl–Cl | 199 | 243 |
| Бр–Ч | 141 | 366 |
| Бр–Бр | 228 | 193 |
| Я – Ч | 161 | 298 |
| Я-я | 267 | 151 |
Сильные химические связи — это внутримолекулярные силы, которые удерживают атомы вместе в молекулах . Прочная химическая связь образуется в результате переноса или совместного использования электронов между атомными центрами и основана на электростатическом притяжении между протонами в ядрах и электронами на орбиталях.
Типы прочной связи различаются из-за разницы в электроотрицательности составляющих элементов. Электроотрицательность — это тенденция атома данного химического элемента притягивать общие электроны при образовании химической связи, при этом чем выше связанная электроотрицательность, тем больше он притягивает электроны. Электроотрицательность служит простым способом количественной оценки энергии связи , которая характеризует связь по непрерывной шкале от ковалентной до ионной связи . Большая разница в электроотрицательности приводит к более полярному (ионному) характеру связи.
Ионная связь
Ионная связь — это тип электростатического взаимодействия между атомами, имеющими большую разницу электроотрицательностей. Не существует точного значения, которое отличало бы ионную связь от ковалентной, но разница в электроотрицательности более 1,7, вероятно, будет ионной, а разница менее 1,7, вероятно, будет ковалентной. [21] Ионная связь приводит к разделению положительных и отрицательных ионов . Заряды ионов обычно составляют от -3 e до +3 e . Ионная связь обычно возникает в солях металлов, таких как хлорид натрия (поваренная соль). Типичной особенностью ионных связей является то, что они образуют ионные кристаллы, в которых ни один ион не образует специальную пару с каким-либо другим ионом в определенной направленной связи. Скорее, каждый вид ионов окружен ионами противоположного заряда, и расстояние между ним и каждым из противоположно заряженных ионов рядом с ним одинаково для всех окружающих атомов одного и того же типа. Таким образом, больше невозможно связать ион с каким-либо конкретным другим одиночным ионизованным атомом рядом с ним. Эта ситуация отличается от ситуации в ковалентных кристаллах, где ковалентные связи между конкретными атомами все еще различимы на более коротких расстояниях между ними, измеренных с помощью таких методов, как дифракция рентгеновских лучей .
Ионные кристаллы могут содержать смесь ковалентных и ионных частиц, как, например, соли комплексных кислот, таких как цианид натрия , NaCN. Рентгеновская дифракция показывает, что в NaCN, например, связи между катионами натрия (Na + ) и цианид- анионы (CN − ) являются ионными , без ионов натрия , связанных с каким-либо конкретным цианидом . Однако связи между атомами углерода (C) и азота (N) в цианиде имеют ковалентный тип, так что каждый углерод прочно связан только с одним азотом, к которому он физически гораздо ближе, чем к другим атомам углерода или азот в кристалле цианида натрия.
Когда такие кристаллы плавятся в жидкости, в первую очередь разрушаются ионные связи, поскольку они ненаправлены и позволяют заряженным частицам свободно перемещаться. Аналогичным образом, когда такие соли растворяются в воде, ионные связи обычно разрушаются при взаимодействии с водой, но ковалентные связи продолжают сохраняться. Например, в растворе ионы цианида, все еще связанные вместе в виде отдельных CN − ионы движутся через раствор независимо, как и ионы натрия, например Na + . В воде заряженные ионы расходятся, потому что каждый из них сильнее притягивается к ряду молекул воды, чем друг к другу. Притяжение между ионами и молекулами воды в таких растворах обусловлено типом слабой химической связи диполь-дипольного типа. В расплавленных ионных соединениях ионы продолжают притягиваться друг к другу, но не каким-либо упорядоченным или кристаллическим образом.
Ковалентная связь

Ковалентная связь — это распространенный тип связи, при котором два или более атома делят валентные электроны более или менее одинаково . Самый простой и распространенный тип — это одинарная связь , в которой два атома имеют два общих электрона. Другие типы включают двойную связь , тройную связь , одно- и трехэлектронные связи , трехцентровую двухэлектронную связь и трехцентровую четырехэлектронную связь .
В неполярных ковалентных связях разница электроотрицательности между связанными атомами невелика, обычно от 0 до 0,3. Связи внутри большинства органических соединений описываются как ковалентные. На рисунке показан метан (СН 4 ), в котором каждый водород образует ковалентную связь с углеродом. См. сигма-связи и пи-связи для описания таких связей LCAO. [22]
Молекулы, которые образуются в основном из неполярных ковалентных связей, часто не смешиваются с водой или другими полярными растворителями , но гораздо лучше растворимы в неполярных растворителях, таких как гексан .
Полярная ковалентная связь — это ковалентная связь со значительным ионным характером . Это означает, что два общих электрона находятся ближе к одному из атомов, чем к другому, что создает дисбаланс заряда. Такие связи возникают между двумя атомами с умеренно различной электроотрицательностью и приводят к диполь-дипольным взаимодействиям . Разница электроотрицательности между двумя атомами в этих связях составляет от 0,3 до 1,7.
Одиночные и множественные облигации
Одинарная связь между двумя атомами соответствует совместному использованию одной пары электронов. Атом водорода (H) имеет один валентный электрон. Два атома водорода могут тогда образовать молекулу, удерживаемую вместе общей парой электронов. Каждый атом H теперь имеет электронную конфигурацию гелия (He) благородного газа. Пара общих электронов образует одинарную ковалентную связь. Электронная плотность этих двух связывающих электронов в области между двумя атомами увеличивается по сравнению с плотностью двух невзаимодействующих атомов H.

Двойная связь имеет две общие пары электронов: одну в сигма-связи и одну в пи-связи, причем электронная плотность сосредоточена на двух противоположных сторонах межъядерной оси. Тройная связь состоит из трех общих электронных пар, образующих одну сигма- и две пи-связи. Примером является азот. Четверные и более высокие связи очень редки и возникают только между определенными атомами переходных металлов .
Координатная ковалентная связь (диполярная связь)

Координатная ковалентная связь — это ковалентная связь, в которой два общих связывающих электрона принадлежат одному и тому же атому, участвующему в связи. Например, трифторид бора (BF 3 ) и аммиак (NH 3 ) образуют аддукт или координационный комплекс F 3 B ←NH 3 со связью B–N, в которой неподеленная пара электронов на N является общей с пустой атомной орбиталью на B. BF 3 с пустой орбиталью описывается как акцептор электронной пары или кислота Льюиса , тогда как NH 3 с неподеленной парой, которая может быть общей, описывается как донор электронной пары или основание Льюиса . Электроны распределяются между атомами примерно поровну, в отличие от ионной связи. Такая связь показана стрелкой, указывающей на кислоту Льюиса. (На рисунке сплошные линии — связи в плоскости диаграммы, клиновые связи направлены к наблюдателю, пунктирные — в сторону от наблюдателя.)
Комплексы переходных металлов обычно связаны координационными ковалентными связями. Например, ион Ag + реагирует как кислота Льюиса с двумя молекулами основания Льюиса NH 3 с образованием комплексного иона Ag(NH 3 ) 2 + , который имеет две координатные ковалентные связи Ag ←N.
Металлическое соединение
При металлической связи связывающие электроны делокализованы в решетке атомов. Напротив, в ионных соединениях расположение связывающих электронов и их зарядов статичны. Свободное движение или делокализация связывающих электронов приводит к классическим свойствам металла, таким как блеск поверхности (отражательная способность ), электрическая и теплопроводность , пластичность и высокая прочность на разрыв .
Межмолекулярная связь
Существует несколько типов слабых связей, которые могут образовываться между двумя или более молекулами, не связанными ковалентно. Межмолекулярные силы заставляют молекулы притягивать или отталкивать друг друга. Часто эти силы влияют на физические характеристики (например, температуру плавления ) вещества.
Силы Ван-дер-Ваальса — это взаимодействие между молекулами с замкнутой оболочкой . К ним относятся как кулоновские взаимодействия между парциальными зарядами в полярных молекулах, так и отталкивания Паули между замкнутыми электронными оболочками. [23] : 696
Силы Кисома — это силы между постоянными диполями двух полярных молекул. [23] : 701 Дисперсионные силы Лондона — это силы между индуцированными диполями разных молекул. [23] : 703 Также может иметь место взаимодействие между постоянным диполем в одной молекуле и индуцированным диполем в другой молекуле. [23] : 702
Водородные связи формы A--H••B возникают, когда A и B представляют собой два сильно электроотрицательных атома (обычно N, O или F), так что A образует высокополярную ковалентную связь с H, так что H имеет частичный положительный заряд. , а B имеет неподеленную пару электронов, которая притягивается к этому частичному положительному заряду и образует водородную связь. [23] : 702 Водородные связи ответственны за высокие температуры кипения воды и аммиака по сравнению с их более тяжелыми аналогами. В некоторых случаях подобную галогенную связь может образовывать атом галогена, расположенный между двумя электроотрицательными атомами разных молекул.
На малых расстояниях также становятся важными силы отталкивания между атомами. [23] : 705-6
Теории химической связи
В (нереалистичном) пределе «чистой» ионной связи электроны идеально локализованы на одном из двух атомов связи. Такие связи можно понять с помощью классической физики . Сила между атомами зависит от электростатических потенциалов изотропного континуума. Величина силы находится в простой пропорции к произведению двух ионных зарядов согласно закону Кулона . [ нужна ссылка ]
Ковалентные связи лучше понимаются с помощью теории валентных связей (VB) или теории молекулярных орбиталей (МО) . Свойства задействованных атомов можно понять, используя такие понятия, как степень окисления , формальный заряд и электроотрицательность . Электронная плотность внутри связи не приписывается отдельным атомам, а делокализована между атомами. В теории валентной связи связь понимается как образованная парами электронов, которые локализованы и разделены двумя атомами за счет перекрытия атомных орбиталей. Концепции орбитальной гибридизации и резонанса дополняют это основное представление о связи электронной пары. В теории молекулярных орбиталей связь рассматривается как делокализованная и распределенная по орбиталям, которые распространяются по всей молекуле и адаптируются к ее свойствам симметрии, обычно путем рассмотрения линейных комбинаций атомных орбиталей (ЛКАО). Теория валентных связей более интуитивно понятна с химической точки зрения, поскольку она пространственно локализована и позволяет сосредоточить внимание на частях молекулы, претерпевающих химические изменения. Напротив, молекулярные орбитали более «естественны» с квантово-механической точки зрения, поскольку орбитальные энергии физически значимы и напрямую связаны с экспериментальными энергиями ионизации от фотоэлектронная спектроскопия . Следовательно, теория валентных связей и теория молекулярных орбиталей часто рассматриваются как конкурирующие, но дополняющие друг друга концепции, которые предлагают разные взгляды на химические системы. В качестве подходов к теории электронной структуры методы МО и ВБ могут давать приближения с любым желаемым уровнем точности, по крайней мере, в принципе. Однако на более низких уровнях приближения различаются, и один подход может лучше подходить для вычислений, включающих конкретную систему или свойство, чем другой. [ нужна ссылка ]
В отличие от сферически-симметричных кулоновских сил в чистых ионных связях, ковалентные связи обычно направлены и анизотропны . Их часто классифицируют на основе их симметрии относительно молекулярной плоскости как сигма-связи и пи-связи . В общем случае атомы образуют связи, промежуточные между ионными и ковалентными, в зависимости от относительной электроотрицательности участвующих атомов. Связи этого типа известны как полярные ковалентные связи . [24]
Ссылки
- ^ Левин, Дэниел С.; Хед-Гордон, Мартин (29 сентября 2020 г.). «Выяснение квантовомеханического происхождения ковалентной химической связи» . Природные коммуникации . 11 (1). Springer Science and Business Media LLC: 4893. doi : 10.1038/s41467-020-18670-8 . ISSN 2041-1723 . ПМЦ 7524788 . ПМИД 32994392 . S2CID 222157102 .
- ^ Полинг, Л. (1931), «Природа химической связи. Применение результатов, полученных из квантовой механики и теории парамагнитной восприимчивости к структуре молекул», Журнал Американского химического общества , 53 (4): 1367–1400, номер документа : 10.1021/ja01355a027.
- ^ Дог, Ф. (1928). «К интерпретации молекулярных спектров. IV» . Журнал физики (на немецком языке). 51 (11–12): 759–795. дои : 10.1007/BF01400239 . ISSN 1434-6001 . S2CID 121366097 .
- ^ Фрекинг, Гернот; Крапп, Андреас (15 января 2007 г.). «Единороги в мире моделей химической связи» . Журнал вычислительной химии . 28 (1): 15–24. дои : 10.1002/jcc.20543 . ПМИД 17109434 . S2CID 7504671 . Архивировано из оригинала 8 апреля 2023 г.
- ^ Дженсен, Фрэнк (1999). Введение в вычислительную химию . Джон Уайли и сыновья. ISBN 978-0-471-98425-2 .
- ^ Полинг, Лайнус (1960). «Понятие резонанса» . Природа химической связи - Введение в современную структурную химию (3-е изд.). Издательство Корнельского университета. стр. 10–13. ISBN 978-0801403330 .
- ^ Гиллеспи, Р.Дж. (2004), «Преподавание молекулярной геометрии с помощью модели VSEPR», Журнал химического образования , 81 (3): 298–304, Бибкод : 2004JChEd..81..298G , doi : 10.1021/ed081p298
- ^ Хаускрофт, Кэтрин Э.; Шарп, Алан Г. (2005). Неорганическая химия (2-е изд.). Пирсон Прентис-Хэл. п. 100. ИСБН 0130-39913-2 .
- ^ Риу, Ф. (2001). «Ковалентная связь в H 2 ». Химический педагог . 6 (5): 288–290. дои : 10.1007/s00897010509a . S2CID 97871973 .
- ^ Хаускрофт, Кэтрин Э.; Шарп, Алан Г. (2005). Неорганическая химия (2-е изд.). Пирсон Прентис-Хэл. п. 100. ИСБН 0130-39913-2 .
- ^ Б. Брайсон (2003). Краткая история почти всего . Бродвейские книги . ISBN 0-7679-0817-1 .
- ^ Происхождение атома Бора, Джон Л. Хейлброн и Томас С. Кун, Исторические исследования в области физических наук, Том. 1 (1969), стр. VI, 211–290 (81 страница), University of California Press.
- ^ Оригинальные материалы Сольвеевской конференции 1911 года, опубликованные в 1912 году. ТЕОРИЯ ИЗЛУЧЕНИЯ И КВАНТОВ. ОТЧЕТЫ И ДИСКУССИИ Совещания, проходившего в Брюсселе с 30 октября по 3 ноября 1911 г. под эгидой М. Е. Сольве. Опубликовано ММ. П. ЛАНЖЕВЕН и г-н де БРОЛЬИ. Перевод с французского, с. 127.
- ^ Льюис, Гилберт Н. (1916). «Атом и молекула» . Журнал Американского химического общества . 38 (4): 772. doi : 10.1021/ja02261a002 . S2CID 95865413 . копия. Архивировано 18 апреля 2021 г. в Wayback Machine.
- ^ Паис, Авраам (1986). Внутренняя граница: о материи и силах в физическом мире . Нью-Йорк: Издательство Оксфордского университета. стр. 228–230 . ISBN 978-0-19-851971-3 .
- ^ Свидзинский Анатолий Александрович; Марлан О. Скалли; Дадли Р. Хершбах (2005). «Возвращение к молекулярной модели Бора 1913 года» (PDF) . Труды Национальной академии наук . 102 (34): 11985–11988. arXiv : физика/0508161 . Бибкод : 2005PNAS..10211985S . дои : 10.1073/pnas.0505778102 . ПМК 1186029 . ПМИД 16103360 . Архивировано (PDF) из оригинала 18 июля 2018 г.
- ^ Лейдлер, К.Дж. (1993). Мир физической химии . Издательство Оксфордского университета. п. 346 . ISBN 978-0-19-855919-1 .
- ^ Хайтлер, В.; Лондон, Ф. (1927). «Взаимодействие нейтральных атомов и гомеополярных связей по квантовой механике» [Взаимодействие нейтральных атомов и гомеополярных связей по квантовой механике]. Журнал физики . 44 (6–7): 455–472. Бибкод : 1927ZPhy...44..455H . дои : 10.1007/bf01397394 . S2CID 119739102 . английский перевод в Хеттема, Х. (2000). Квантовая химия: классические научные статьи . Всемирная научная. п. 140. ИСБН 978-981-02-2771-5 . Проверено 5 февраля 2012 г.
- ^ Джеймс, Х.Х.; Кулидж, А.С. (1933). «Основное состояние молекулы водорода». Журнал химической физики . 1 (12): 825–835. Бибкод : 1933ЖЧФ...1..825Ж . дои : 10.1063/1.1749252 .
- ^ «Энергия облигаций» . Свободные тексты по химии. 2 октября 2013 года . Проверено 25 февраля 2019 г.
- ^ Аткинс, Питер ; Лоретта Джонс (1997). Химия: молекулы, материя и изменения . Нью-Йорк: WH Freeman & Co., стр. 294–295. ISBN 978-0-7167-3107-8 .
- ^ Стрейтвизер, Эндрю; Хиткок, Клейтон Х.; Косауэр, Эдвард М. (1992). Введение в органическую химию . Хиткок, Клейтон Х., Косауэр, Эдвард М. (4-е изд.). Нью-Йорк: Макмиллан. стр. 250 . ISBN 978-0024181701 . ОСЛК 24501305 .
- ^ Jump up to: Перейти обратно: а б с д и ж Аткинс, Питер; де Паула, Хулио (2002). Физическая химия (7-е изд.). У. Фриман. стр. 696–706. ISBN 0-7167-3539-3 .
- ^ Уэллетт, Роберт Дж.; Раун, Дж. Дэвид (2015). «Полярная ковалентная связь» . Наука Директ . Проверено 14 сентября 2023 г.
Полярная ковалентная связь существует, когда атомы с разной электроотрицательностью имеют общие электроны в ковалентной связи.
Внешние ссылки
- В. Локк (1997). Введение в теорию молекулярных орбиталей . Проверено 18 мая 2005 г.
- Карл Р. Нейв (2005). Гиперфизика . Проверено 18 мая 2005 г.
- Лайнус Полинг и природа химической связи: документальная история . Проверено 29 февраля 2008 г.


