Растворитель
Растворитель — (от латинского solvō «ослаблять, развязывать, растворять») — вещество, которое растворяет растворенное вещество, в результате чего образуется раствор . Растворитель обычно представляет собой жидкость, но также может быть твердым веществом, газом или сверхкритической жидкостью . Вода является растворителем полярных молекул и наиболее распространенным растворителем, используемым живыми существами; все ионы и белки в клетке растворены в воде внутри клетки.
Растворители в основном используются в красках, средствах для удаления краски, чернилах и химической чистке. [2] конкретно используются Органические растворители в химической чистке (например, тетрахлорэтилен ); как разбавители красок ( толуол , скипидар ); в качестве жидкости для снятия лака и растворителей клея ( ацетон , метилацетат , этилацетат ); в пятновыводителях ( гексан , петролейный эфир); в моющих средствах ( цитрусовые терпены ); и в парфюмерии ( этанол ). Растворители находят различное применение в химической, фармацевтической , нефтегазовой промышленности, в том числе в химического синтеза процессах и очистки.
Решения и сольватация
[ редактировать ]Когда одно вещество растворяется в другом, раствор . образуется [3] Это противоположно ситуации, когда соединения нерастворимы, как песок в воде. В растворе все ингредиенты равномерно распределяются на молекулярном уровне и не остается остатков. Смесь растворителя и растворенного вещества состоит из одной фазы , в которой все молекулы растворенного вещества встречаются в виде сольватов ( комплексов растворитель-растворенное вещество ), в отличие от отдельных непрерывных фаз, как в суспензиях, эмульсиях и других типах нерастворенных смесей. Способность одного соединения растворяться в другом называется растворимостью; если это происходит во всех пропорциях, его называют смешивающимся .
Помимо смешивания, вещества в растворе взаимодействуют друг с другом на молекулярном уровне. Когда что-то растворяется, молекулы растворителя располагаются вокруг молекул растворенного вещества. теплообмен Участвует и увеличивается энтропия , что делает раствор более термодинамически стабильным, чем растворенное вещество и растворитель по отдельности. Такое расположение обусловлено соответствующими химическими свойствами растворителя и растворенного вещества, такими как водородная связь , дипольный момент и поляризуемость . [4] Сольватация не вызывает химической реакции или изменения химической конфигурации растворенного вещества. Однако сольватация напоминает реакцию образования координационного комплекса , часто со значительной энергетикой (теплотой сольватации и энтропией сольватации) и поэтому далека от нейтрального процесса.
Когда одно вещество растворяется в другом, образуется раствор. Раствор – это гомогенная смесь, состоящая из растворенного вещества, растворенного в растворителе. Растворенное вещество – это вещество, которое растворяется, а растворитель – это растворяющая среда. Растворы могут быть приготовлены с использованием множества различных типов и форм растворенных веществ и растворителей.
Классификации растворителей
[ редактировать ]Растворители можно разделить на две категории: полярные и неполярные . Особый случай — элементарная ртуть , растворы которой известны как амальгамы ; других кроме того, существуют растворы металлов , которые являются жидкими при комнатной температуре.
Обычно диэлектрическая проницаемость растворителя является грубой мерой полярности растворителя. На сильную полярность воды указывает ее высокая диэлектрическая проницаемость 88 (при 0 °C). [5] Растворители с диэлектрической проницаемостью менее 15 обычно считаются неполярными. [6]
Диэлектрическая проницаемость измеряет тенденцию растворителя частично компенсировать напряженность электрического поля заряженной частицы , погруженной в него. Это уменьшение затем сравнивается с напряженностью поля заряженной частицы в вакууме. [6] С эвристической точки зрения диэлектрическую проницаемость растворителя можно рассматривать как его способность уменьшать эффективный внутренний заряд растворенного вещества . Как правило, диэлектрическая проницаемость растворителя является приемлемым показателем способности растворителя растворять распространенные ионные соединения , такие как соли.
Другие шкалы полярности
[ редактировать ]Диэлектрическая проницаемость — не единственная мера полярности. Поскольку растворители используются химиками для проведения химических реакций или наблюдения химических и биологических явлений, необходимы более конкретные меры полярности. Большинство этих мер чувствительны к химической структуре.
Грюнвальда -Винштейна m Y Шкала измеряет полярность с точки зрения влияния растворителя на накопление положительного заряда растворенного вещества во время химической реакции.
Косауэра - Z шкала измеряет полярность с точки зрения влияния растворителя на максимумы УФ -поглощения соли, обычно пиридиния йодида пиридиния или цвиттер-иона . [7]
Число доноров и шкала доноров-акцепторов измеряют полярность с точки зрения того, как растворитель взаимодействует с конкретными веществами, такими как сильная кислота Льюиса или сильное основание Льюиса. [8]
Параметр Хильдебранда представляет собой квадратный корень из плотности энергии сцепления . Его можно использовать с неполярными соединениями, но нельзя использовать сложную химию.
Краситель Райхардта, сольватохромный , меняющий цвет в зависимости от полярности, дает шкалу значений ET краситель (30). ET — энергия перехода между основным состоянием и низшим возбужденным состоянием в ккал/моль, а (30) идентифицирует краситель. Другая, примерно коррелирующая шкала ( ( ET 33)) может быть определена с нильским красным .
Полярность, дипольный момент, поляризуемость и водородные связи растворителя определяют, какой тип соединений он способен растворять и с какими другими растворителями или жидкими соединениями он смешивается . Как правило, полярные растворители лучше всего растворяют полярные соединения, а неполярные растворители лучше всего растворяют неполярные соединения; следовательно, « подобное растворяется в подобном ». Сильно полярные соединения, такие как сахара (например, сахароза ) или ионные соединения, такие как неорганические соли (например, поваренная соль ), растворяются только в очень полярных растворителях, таких как вода, тогда как сильно неполярные соединения, такие как масла или воски, растворяются только в очень неполярных органических растворителях, таких как гексан . Точно так же вода и гексан (или уксус и растительное масло) не смешиваются друг с другом и быстро разделяются на два слоя даже после хорошего встряхивания.
Полярность можно разделить на разные вклады. Например, параметрами Камлета-Тафта являются диполярность/поляризуемость ( π* ), кислотность водородных связей ( α ) и основность водородных связей ( β ). Их можно рассчитать по сдвигу длины волны 3–6 различных сольватохромных красителей в растворителе, обычно включая краситель Райхардта , нитроанилин и диэтилнитроанилин . Другой вариант, параметры растворимости Хансена , разделяет плотность энергии когезии на вклады дисперсии, полярности и водородных связей.
Полярный протон и полярный апротон
[ редактировать ]Растворители с диэлектрической проницаемостью (точнее, относительной статической диэлектрической проницаемостью ) более 15 (т.е. полярные или поляризуемые) можно дополнительно разделить на протонные и апротонные. Протонные растворители, такие как вода , сольватируют анионы (отрицательно заряженные растворенные вещества) сильно за счет водородных связей . Полярные апротонные растворители , такие как ацетон или дихлорметан , имеют тенденцию иметь большие дипольные моменты (разделение частичных положительных и частичных отрицательных зарядов внутри одной и той же молекулы) и сольватировать положительно заряженные частицы через их отрицательный диполь. [9] В химических реакциях использование полярных протонных растворителей благоприятствует S N 1 механизму реакции , тогда как полярные апротонные растворители благоприятствуют механизму реакции S N 2 . Эти полярные растворители способны образовывать водородные связи с водой и растворяться в воде, тогда как неполярные растворители не способны образовывать прочные водородные связи.
Физические свойства
[ редактировать ]Таблица свойств распространенных растворителей
[ редактировать ]Растворители сгруппированы в неполярные , полярные апротонные и полярные протонные растворители, причем каждая группа упорядочена по возрастанию полярности. Жирным шрифтом выделены свойства растворителей , превосходящие свойства воды.
| Растворитель | Химическая формула | Точка кипения [10] (°С) | Диэлектрическая проницаемость [11] | Плотность (г/мл) | Дипольный момент ( Д ) |
|---|---|---|---|---|---|
Неполярные углеводородные растворители[ редактировать ] | |||||
| Пентан | 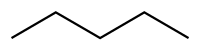 СН 3 СН 2 СН 2 СН 2 СН 3 | 36.1 | 1.84 | 0.626 | 0.00 |
| Гексан | 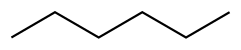 СН 3 СН 2 СН 2 СН 2 СН 2 СН 3 | 69 | 1.88 | 0.655 | 0.00 |
| Бензол | 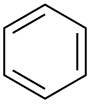 C6HC6H6 | 80.1 | 2.3 | 0.879 | 0.00 |
| Гептан |  Н 3 С(СН 2 ) 5 СН 3 | 98.38 | 1.92 | 0.680 | 0.0 |
| Толуол |  С 6 Н 5 -СН 3 | 111 | 2.38 | 0.867 | 0.36 |
Неполярные эфирные растворители[ редактировать ] | |||||
| 1,4-Диоксан |  С 4 Н 8 О 2 | 101.1 | 2.3 | 1.033 | 0.45 |
| Диэтиловый эфир |  СН 3 СН 2 -О-СН 2 СН 3 | 34.6 | 4.3 | 0.713 | 1.15 |
| Тетрагидрофуран (ТГФ) | 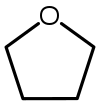 С 4 Н 8 О | 66 | 7.5 | 0.886 | 1.75 |
Неполярные хлоруглеродные растворители[ редактировать ] | |||||
| Хлороформ |  CHClCHCl3 | 61.2 | 4.81 | 1.498 | 1.04 |
| Полярные апротонные растворители | |||||
| Дихлорметан (ДХМ) |  СН 2 Cl 2 | 39.6 | 9.1 | 1.3266 | 1.60 |
| Этилацетат |  СН 3 -С(=О)-О-СН 2 -СН 3 | 77.1 | 6.02 | 0.894 | 1.78 |
| Ацетон |  СН 3 -С(=О)-СН 3 | 56.1 | 21 | 0.786 | 2.88 |
| Диметилформамид (ДМФ) | 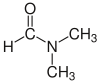 HC(=O)N(CH 3 ) 2 | 153 | 38 | 0.944 | 3.82 |
| Ацетонитрил (MeCN) | CH3 C≡N – | 82 | 37.5 | 0.786 | 3.92 |
| Диметилсульфоксид (ДМСО) |  СН 3 -S(=O)-СН 3 | 189 | 46.7 | 1.092 | 3.96 |
| Нитрометан | 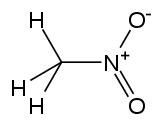 СН 3 -НО 2 | 100–103 | 35.87 | 1.1371 | 3.56 |
| Пропиленкарбонат |  C4H6OC4H6O3 | 240 | 64.0 | 1.205 | 4.9 |
Полярные протонные растворители[ редактировать ] | |||||
| Аммиак | 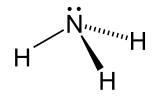 NHNH3 | -33.3 | 17 | 0.674 (при -33,3 °С) | 1.42 |
| Муравьиная кислота |  HC(=O)OH | 100.8 | 58 | 1.21 | 1.41 |
| н -бутанол | CH3CH2CH2CHCH3CH2CH2CH2OH OH | 117.7 | 18 | 0.810 | 1.63 |
| Изопропиловый спирт (IPA) | 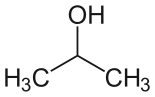 СН3 -СН (-ОН) -СН3 | 82.6 | 18 | 0.785 | 1.66 |
| н -Пропанол |  СН 3 СН 2 СН 2 ОН | 97 | 20 | 0.803 | 1.68 |
| Этанол | СН 3 СН 2 ОН | 78.2 | 24.55 | 0.789 | 1.69 |
| Метанол | 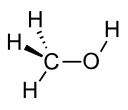 СН 3 ОН | 64.7 | 33 | 0.791 | 1.70 |
| Уксусная кислота |  СН3 -С (=О)ОН | 118 | 6.2 | 1.049 | 1.74 |
| Вода |  ХОХ | 100 | 80 | 1.000 | 1.85 |
Институт зеленой химии ACS поддерживает инструмент для выбора растворителей на основе методом главных компонентов . анализа свойств растворителей [12]
Значения параметров растворимости Хансена
[ редактировать ]Значения параметра растворимости Хансена (HSP) [13] [14] в основе лежат дисперсионные связи (δD), полярные связи (δP) и водородные связи (δH). Они содержат информацию о межмолекулярных взаимодействиях с другими растворителями, а также с полимерами, пигментами, наночастицами и т. д. Это позволяет разрабатывать рациональные составы, зная, например, что существует хорошее соответствие HSP между растворителем и полимером. Рациональные замены также могут быть сделаны для «хороших» растворителей (эффективных при растворении растворенного вещества) на «плохие» (дорогие или опасные для здоровья или окружающей среды). В следующей таблице показано, что интуитивное понимание «неполярных», «полярных апротонных» и «полярных протонных» выражается численно: «полярные» молекулы имеют более высокие уровни δP, а протонные растворители имеют более высокие уровни δH. Поскольку используются числовые значения, сравнения можно проводить рационально, сравнивая числа. Например, ацетонитрил гораздо более полярен, чем ацетон, но имеет немного меньше водородных связей.
| Растворитель | Химическая формула | δD Дисперсия | δP Полярный | δH Водородная связь |
|---|---|---|---|---|
Неполярные растворители[ редактировать ] | ||||
| н-гексан | СН 3 СН 2 СН 2 СН 2 СН 2 СН 3 | 14.9 | 0.0 | 0.0 |
| Бензол | C6HC6H6 | 18.4 | 0.0 | 2.0 |
| Толуол | С 6 Н 5 -СН 3 | 18.0 | 1.4 | 2.0 |
| Диэтиловый эфир | СН 3 СН 2 -О-СН 2 СН 3 | 14.5 | 2.9 | 4.6 |
| Хлороформ | CHClCHCl3 | 17.8 | 3.1 | 5.7 |
| 1,4-Диоксан | /-СН 2 -СН 2 -О-СН 2 -СН 2 -О-\ | 17.5 | 1.8 | 9.0 |
Полярные апротонные растворители[ редактировать ] | ||||
| Этилацетат | СН 3 -С(=О)-О-СН 2 -СН 3 | 15.8 | 5.3 | 7.2 |
| Тетрагидрофуран (ТГФ) | /-СН 2 -СН 2 -О-СН 2 -СН 2 -\ | 16.8 | 5.7 | 8.0 |
| дихлорметан | СН 2 Cl 2 | 17.0 | 7.3 | 7.1 |
| Ацетон | СН 3 -С(=О)-СН 3 | 15.5 | 10.4 | 7.0 |
| Ацетонитрил (MeCN) | CH3 C≡N – | 15.3 | 18.0 | 6.1 |
| Диметилформамид (ДМФ) | HC(=O)N(CH 3 ) 2 | 17.4 | 13.7 | 11.3 |
| Диметилсульфоксид (ДМСО) | СН 3 -S(=O)-СН 3 | 18.4 | 16.4 | 10.2 |
Полярные протонные растворители[ редактировать ] | ||||
| Уксусная кислота | СН3 -С (=О)ОН | 14.5 | 8.0 | 13.5 |
| н -бутанол | CH3CH2CH2CHCH3CH2CH2CH2OH OH | 16.0 | 5.7 | 15.8 |
| Изопропанол | СН3 -СН (-ОН) -СН3 | 15.8 | 6.1 | 16.4 |
| н -Пропанол | СН 3 СН 2 СН 2 ОН | 16.0 | 6.8 | 17.4 |
| Этанол | СН 3 СН 2 ОН | 15.8 | 8.8 | 19.4 |
| Метанол | СН 3 ОН | 14.7 | 12.3 | 22.3 |
| Муравьиная кислота | HC(=O)OH | 14.6 | 10.0 | 14.0 |
| Вода | ХОХ | 15.5 | 16.0 | 42.3 |
Если по экологическим или другим причинам требуется заменить растворитель или смесь растворителей другим растворителем с эквивалентной растворяющей способностью, замена может быть произведена на основе параметров растворимости Хансена каждого из них. Значения для смесей принимаются как средневзвешенные значения для чистых растворителей. Это можно рассчитать методом проб и ошибок , с помощью электронной таблицы значений или программного обеспечения HSP. [13] [14] Смесь толуола и 1,4-диоксана в соотношении 1:1 имеет значения δD, δP и δH 17,8, 1,6 и 5,5, что сопоставимо со значениями хлороформа : 17,8, 3,1 и 5,7 соответственно. Из-за опасности для здоровья, связанной с самим толуолом, другие смеси растворителей можно найти, используя полный набор данных HSP.
Точка кипения
[ редактировать ]| Растворитель | Точка кипения (°С) [10] |
|---|---|
| дихлорид этилена | 83.48 |
| пиридин | 115.25 |
| метилизобутилкетон | 116.5 |
| метиленхлорид | 39.75 |
| изооктан | 99.24 |
| сероуглерод | 46.3 |
| четыреххлористый углерод | 76.75 |
| о -ксилол | 144.42 |
Температура кипения является важным свойством, поскольку она определяет скорость испарения. Небольшие количества растворителей с низкой температурой кипения, таких как диэтиловый эфир , дихлорметан или ацетон, испаряются за секунды при комнатной температуре, тогда как растворители с высокой температурой кипения, такие как вода или диметилсульфоксид, требуют более высоких температур, потока воздуха или применения вакуума. для быстрого испарения.
- Низкокипящие: температура кипения ниже 100 °C (точка кипения воды).
- Средние котлы: от 100 °C до 150 °C.
- Высококипящие: выше 150 °C.
Плотность
[ редактировать ]Большинство органических растворителей имеют меньшую плотность, чем вода, а это значит, что они легче воды и образуют слой поверх воды. Важным исключением является то, что большинство галогенированных растворителей, таких как дихлорметан или хлороформ, опускаются на дно контейнера, оставляя воду в качестве верхнего слоя. Это очень важно помнить при распределении соединений между растворителями и водой в делительной воронке во время химического синтеза.
Часто удельный вес вместо плотности указывается . Удельный вес определяется как плотность растворителя, деленная на плотность воды при той же температуре. Таким образом, удельный вес является безразмерной величиной. Он легко определяет, будет ли нерастворимый в воде растворитель плавать (SG < 1,0) или тонуть (SG > 1,0) при смешивании с водой.
| Растворитель | Удельный вес [15] |
|---|
Многокомпонентные растворители
[ редактировать ]Этот раздел нуждается в дополнительных цитатах для проверки . ( январь 2022 г. ) |
Многокомпонентные растворители появились после Второй мировой войны в СССР и продолжают использоваться и производиться в государствах постсоветского пространства. Эти растворители могут иметь одно или несколько применений, но они не являются универсальными препаратами.
Растворители
[ редактировать ]| Имя | Состав |
|---|---|
| Растворитель 645 | толуол 50%, бутилацетат 18%, этилацетат 12%, бутанол 10%, этанол 10%. |
| Растворитель 646 | толуол 50%, этанол 15%, бутанол 10%, бутил- или амилацетат 10%, этилцеллозольв 8%, ацетон 7% [16] |
| Растворитель 647 | бутил- или амилацетат 29,8%, этилацетат 21,2%, бутанол 7,7%, толуол или пиробензол 41,3% [17] |
| Растворитель 648 | бутилацетат 50%, этанол 10%, бутанол 20%, толуол 20% [18] |
| Растворитель 649 | этилцеллозольв 30%, бутанол 20%, ксилол 50% |
| Растворитель 650 | этилцеллозольв 20%, бутанол 30%, ксилол 50% [19] |
| Растворитель 651 | уайт-спирит 90%, бутанол 10% |
| Растворитель КР-36 | бутилацетат 20%, бутанол 80% |
| Растворитель Р-4 | толуол 62%, ацетон 26%, бутилацетат 12%. |
| Растворитель Р-10 | ксилол 85%, ацетон 15%. |
| Растворитель Р-12 | толуол 60%, бутилацетат 30%, ксилол 10%. |
| Растворитель Р-14 | циклогексанон 50%, толуол 50%. |
| Растворитель Р-24 | растворитель 50%, ксилол 35%, ацетон 15%. |
| Растворитель Р-40 | толуол 50%, этилцеллозольв 30%, ацетон 20%. |
| Растворитель Р-219 | толуол 34%, циклогексанон 33%, ацетон 33%. |
| Растворитель Р-3160 | бутанол 60%, этанол 40%. |
| Растворитель РСС | ксилол 90%, бутилацетат 10%. |
| Растворитель РМЛ | этанол 64%, этилцеллозольв 16%, толуол 10%, бутанол 10%. |
| Растворитель ПМЛ-315 | толуол 25%, ксилол 25%, бутилацетат 18%, этилцеллозольв 17%, бутанол 15%. |
| Растворитель ПК-1 | толуол 60%, бутилацетат 30%, ксилол 10%. |
| Растворитель ПК-2 | уайт-спирит 70%, ксилол 30%. |
| Растворитель РФГ | этанол 75%, бутанол 25%. |
| Растворитель РЭ-1 | ксилол 50%, ацетон 20%, бутанол 15%, этанол 15%. |
| Растворитель РЭ-2 | нефтяной спирт 70%, этанол 20%, ацетон 10%. |
| Растворитель РЭ-3 | нефтяной спирт 50%, этанол 20%, ацетон 20%, этилцеллозольв 10%. |
| Растворитель РЭ-4 | нефтяной спирт 50%, ацетон 30%, этанол 20%. |
| Растворитель ФК-1 (?) | спирт абсолютный (99,8%) 95%, этилацетат 5% |
Разбавители
[ редактировать ]| Имя | Состав |
|---|---|
| Разбавитель РКБ-1 | бутанол 50%, ксилол 50% |
| Разбавитель РКБ-2 | бутанол 95%, ксилол 5% |
| Разбавитель РКБ-3 | ксилол 90%, бутанол 10% |
| Тоньше М | этанол 65%, бутилацетат 30%, этилацетат 5%. |
| Тоньше П-7 | циклогексанон 50%, этанол 50%. |
| Разбавитель Р-197 | ксилол 60%, бутилацетат 20%, этилцеллозольв 20%. |
| Разбавитель WFD | толуол 50%, бутилацетат (или амилацетат) 18%, бутанол 10%, этанол 10%, этилацетат 9%, ацетон 3%. |
Безопасность
[ редактировать ]Огонь
[ редактировать ]Большинство органических растворителей легковоспламеняющиеся или легковоспламеняющиеся, в зависимости от их летучести . Исключением являются некоторые хлорированные растворители, такие как дихлорметан и хлороформ . Смеси паров растворителя и воздуха могут взорваться . Пары растворителя тяжелее воздуха; они осядут на дно и смогут преодолевать большие расстояния практически в неразбавленном виде. Пары растворителя также можно обнаружить в предположительно пустых бочках и канистрах, что создает опасность внезапного возгорания ; следовательно, пустые контейнеры из-под летучих растворителей следует хранить открытыми и перевернутыми.
И диэтиловый эфир , и сероуглерод имеют исключительно низкие температуры самовоспламенения , что значительно увеличивает риск возгорания, связанный с этими растворителями. Температура самовоспламенения сероуглерода ниже 100 °C (212 °F), поэтому такие объекты, как паровые трубы, электрические лампочки , электрические плиты и недавно погасшие бунзеновские горелки , могут воспламенить его пары.
Кроме того, некоторые растворители, такие как метанол, могут гореть очень горячим пламенем, которое может быть почти невидимым при некоторых условиях освещения. [20] [21] Это может задержать или помешать своевременному распознаванию опасного пожара до тех пор, пока пламя не распространится на другие материалы.
Взрывоопасное образование перекиси
[ редактировать ]Эфиры , такие как диэтиловый эфир и тетрагидрофуран (ТГФ), могут образовывать взрывоопасные органические пероксиды под воздействием кислорода и света. ТГФ обычно с большей вероятностью образует такие пероксиды, чем диэтиловый эфир. Одним из наиболее чувствительных растворителей является диизопропиловый эфир , но все эфиры считаются потенциальными источниками пероксидов.
Гетероатом ( кислород ) стабилизирует образование свободного радикала , который образуется в результате отрыва атома водорода другим свободным радикалом. [ нужны разъяснения ] Образовавшийся таким образом углеродцентрированный свободный радикал способен вступать в реакцию с молекулой кислорода с образованием перекисного соединения. Процесс образования перекиси значительно ускоряется при воздействии даже низкого уровня света, но может протекать медленно даже в темноте.
Если не используется осушитель , который может разрушить пероксиды, они будут концентрироваться во время дистилляции из-за более высокой температуры кипения . Когда образуется достаточное количество пероксидов, они могут образовывать кристаллический , чувствительный к ударам твердый осадок в горлышке контейнера или бутылки. Незначительные механические воздействия, такие как соскабливание внутренней части сосуда или вымывание отложений, простое закручивание крышки может обеспечить достаточную энергию для взрыва или детонации перекиси . Образование пероксида не является серьезной проблемой, когда свежие растворители быстро израсходованы; они представляют собой большую проблему в лабораториях, которым могут потребоваться годы, чтобы закончить одну бутылку. Пользователи с небольшими объемами должны приобретать только небольшие количества растворителей, склонных к перекиси, и регулярно выбрасывать старые растворители.
Чтобы избежать взрывного образования перекиси, эфиры следует хранить в герметичном контейнере, вдали от света, поскольку и свет, и воздух могут способствовать образованию перекиси. [22]
Для обнаружения присутствия пероксида в эфире можно использовать ряд тестов; один из них - использовать комбинацию сульфата железа (II) и роданида калия . Перекись способна окислять Fe. 2+ ион в Fe 3+ ион, который затем образует темно-красный координационный комплекс с тиоцианатом .
Пероксиды можно удалить промыванием кислым сульфатом железа(II), фильтрованием через алюминия или перегонкой оксид натрия / бензофенона . Глинозем разлагает пероксиды, но некоторые из них могут остаться в нем неповрежденными, поэтому его необходимо утилизировать должным образом. [23] Преимущество использования натрия/бензофенона заключается в том, что влага и кислород. также удаляются [24]
Влияние на здоровье
[ редактировать ]Общие опасности для здоровья, связанные с воздействием растворителей, включают токсичность для нервной системы, повреждение репродуктивной системы, повреждение печени и почек, нарушение дыхания, рак, потерю слуха, [25] [26] и дерматит . [27]
Острое воздействие
[ редактировать ]Многие растворители [ который? ] может привести к внезапной потере сознания при вдыхании в больших количествах. [ нужна ссылка ] Растворители, такие как диэтиловый эфир и хлороформ, использовались в медицине в качестве анестетиков , седативных и снотворных средств . долгое время [ когда? ] Многими растворителями (например, бензином или клеями на основе растворителей) злоупотребляют в рекреационных целях, нюхая клей , что часто приводит к вредным долгосрочным последствиям для здоровья, таким как нейротоксичность или рак . Мошенническая замена 1,5-пентандиола психоактивным 1,4-бутандиолом субподрядчиком привела к отзыву продукции Bindeez . [28]
Этанол (зерновой спирт) — широко используемый психоактивный наркотик , которым злоупотребляют . При попадании в организм так называемые «токсичные спирты» (кроме этанола), такие как метанол , 1-пропанол и этиленгликоль , метаболизируются в токсичные альдегиды и кислоты, которые вызывают потенциально смертельный метаболический ацидоз . [29] Широко доступный спиртовой растворитель метанол при проглатывании может вызвать необратимую слепоту или смерть. Растворитель 2-бутоксиэтанол , используемый в жидкостях для гидроразрыва , может вызывать гипотонию и метаболический ацидоз. [30]
Хроническое воздействие
[ редактировать ]Хроническое воздействие растворителей часто возникает в результате вдыхания паров растворителей или проглатывания разбавленных растворителей, повторяющихся в течение длительного периода времени.
Некоторые растворители могут повредить внутренние органы, такие как печень , почки , нервная система или мозг . Совокупное воздействие на мозг длительного или многократного воздействия некоторых растворителей называется хронической энцефалопатией, вызванной растворителями (CSE). [31]
Хроническое воздействие органических растворителей на рабочем месте может вызвать ряд неблагоприятных нейропсихиатрических эффектов. Например, профессиональное воздействие органических растворителей связано с увеличением числа художников, страдающих алкоголизмом . [32] Этанол оказывает синергетический эффект при сочетании со многими растворителями; например, комбинация толуола / бензола и этанола вызывает более сильную тошноту / рвоту , чем любое вещество по отдельности.
Известно или предполагается, что некоторые органические растворители обладают катарактогенным действием. Было обнаружено, что смесь ароматических углеводородов , алифатических углеводородов , спиртов , сложных эфиров , кетонов и терпенов значительно увеличивает риск развития катаракты хрусталика глаза. [33]
Загрязнение окружающей среды
[ редактировать ]Основной путь индуцированных последствий для здоровья возникает в результате разливов или утечек растворителей, особенно хлорированных растворителей , которые достигают подстилающей почвы. Поскольку растворители легко мигрируют на значительные расстояния, широкомасштабное загрязнение почвы не является чем-то необычным; это особенно опасно для здоровья, если водоносные горизонты . затронуты [34] Проникновение паров может происходить с участков с обширным подземным загрязнением растворителями. [35]
См. также
[ редактировать ]- АСТДР
- Строительство | Ремонт | Ремонт
- Свободная энергия сольватации
- МАИР
- часто кипятят с обратным холодильником с соответствующим влагопоглотителем Растворители перед дистилляцией для удаления воды. Это можно выполнить перед химическим синтезом, где вода может помешать намеченной реакции.
- Список смешивающихся с водой растворителей
- Лиолюминесценция
- Гигиена труда
- Коэффициент распределения (log P ) является мерой дифференциальной растворимости соединения в двух растворителях.
- Загрязнение
- сольватация
- Системы растворителей существуют за пределами обычных органических растворителей: сверхкритические жидкости , ионные жидкости и глубокие эвтектические растворители.
- Суперфонд
- Летучее органическое соединение
- Водная модель
- Загрязнение воды
Ссылки
[ редактировать ]- ^ «В чем разница между ацетоном и жидкостью для снятия лака без ацетона?» . 3 ноября 2009 г.
- ^ Стой, Дитер (2000). «Растворители». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a24_437 . ISBN 3527306730 .
- ^ Тиноко I, Зауэр К., Ван Дж. К. (2002). Физическая химия . Прентис Холл. п. 134 . ISBN 978-0-13-026607-1 .
- ^ Лоури и Ричардсон, стр. 181–183.
- ^ Мальмберг К.Г., Мэриотт А.А. (январь 1956 г.). «Диэлектрическая проницаемость воды от 0° до 100°С» . Журнал исследований Национального бюро стандартов . 56 (1): 1. doi : 10.6028/jres.056.001 .
- ^ Jump up to: а б Лоури и Ричардсон, с. 177.
- ^ Косовер, Э.М. (1969) «Введение в физико-органическую химию» Wiley: Нью-Йорк, стр. 293
- ^ Гутманн В. (1976). «Влияние растворителей на реакционную способность металлоорганических соединений». Коорд. хим. Преподобный . 18 (2): 225. doi : 10.1016/S0010-8545(00)82045-7 .
- ^ Лоури и Ричардсон, с. 183.
- ^ Jump up to: а б Свойства растворителя – Точка кипения. Архивировано 14 июня 2011 г. в Wayback Machine . Xydatasource.com. Проверено 26 января 2013 г.
- ^ Диэлектрическая постоянная. Архивировано 4 июля 2010 года в Wayback Machine . Macro.lsu.edu. Проверено 26 января 2013 г.
- ^ Диорацио, Луи Дж.; Хоуз, Дэвид Р.Дж.; Адлингтон, Нил К. (2016). «На пути к более целостной схеме выбора растворителя» . Исследования и разработки органических процессов . 20 (4): 760–773. дои : 10.1021/acs.oprd.6b00015 .
- ^ Jump up to: а б Эбботт С., Хансен CM (2008). Параметры растворимости Хансена на практике . Хансен-Растворимость. ISBN 978-0-9551220-2-6 .
- ^ Jump up to: а б Хансен CM (январь 2002 г.). Параметры растворимости Хансена: справочник пользователя . ЦРК Пресс. ISBN 978-0-8493-7248-3 .
- ^ Отдельные свойства растворителя – Удельный вес. Архивировано 14 июня 2011 г. в Wayback Machine . Xydatasource.com. Проверено 26 января 2013 г.
- ^ «dcpt.ru Характеристика растворителя 646 (ru)» .
- ^ «dcpt.ru Характеристика растворителя 647 (ru)» .
- ^ «dcpt.ru Характеристики растворителя 648 (ru)» . Архивировано из оригинала 17 мая 2017 года . Проверено 18 января 2018 г.
- ^ «dcpt.ru Растворитель 650 Характеристики (ru)» .
- ^ Фаник Э.Р., Смит Л.Р., Бейнс Т.М. (1 октября 1984 г.). «Присадки, обеспечивающие безопасность для метанолового топлива» . Серия технических документов SAE . Том. 1. Уоррендейл, Пенсильвания: SAE. дои : 10.4271/841378 . Архивировано из оригинала 12 августа 2017 года.
- ^ Андерсон Дж. Э., Мадьярл М.В., Сигл В.О. (1 июля 1985 г.). «О светимости диффузионного пламени метанола и углеводородов». Наука и технология горения . 43 (3–4): 115–125. дои : 10.1080/00102208508947000 . ISSN 0010-2202 .
- ^ «Пероксиды и эфиры | Экологическая безопасность, безопасность и управление рисками» . www.uaf.edu . Проверено 25 января 2018 г.
- ^ «Обращение с химическими веществами, образующими перекись» . Проверено 24 сентября 2021 г.
- ^ Иноуэ, Ре; Ямагучи, Мана; Мураками, Ёсиаки; Окано, Кентаро; Мори, Ацунори (31 октября 2018 г.). «Возврат к бензофенон-кетиловому дистилляту: использование дисперсии натрия для приготовления безводных растворителей» . АСУ Омега . 3 (10): 12703–12706. дои : 10.1021/acsomega.8b01707 . ISSN 2470-1343 . ПМК 6210062 . ПМИД 30411016 .
- ^ https://www.cdc.gov/niosh/docs/2018-124/pdfs/2018-124.pdf .
- ^ Фуэнте, А.; Макферсон, Б. (2006). «Органические растворители и потеря слуха: вызов аудиологии» . Международный журнал аудиологии . 45 (7): 367–381. дои : 10.1080/14992020600753205 . ПМИД 16938795 .
- ^ «Растворители» . Управление по охране труда . Министерство труда США. Архивировано из оригинала 15 марта 2016 года.
- ^ Руд, Дэвид (7 ноября 2007 г.). «Национальный: заказан отзыв игрушки, которая превращается в наркотик» . www.theage.com.au .
- ^ Краут Дж.А., Маллинз М.Е. (январь 2018 г.). «Токсичные спирты». Медицинский журнал Новой Англии . 378 (3): 270–280. дои : 10.1056/NEJMra1615295 . ПМИД 29342392 . S2CID 36652482 .
- ^ Хунг Т., Девитт Ч.Р., Марц В., Шрайбер В., Холмс Д.Т. (июль 2010 г.). «Фомепизол не может предотвратить прогрессирование ацидоза при одновременном приеме 2-бутоксиэтанола и этанола». Клиническая токсикология . 48 (6): 569–71. дои : 10.3109/15563650.2010.492350 . ПМИД 20560787 . S2CID 23257894 .
- ^ ван дер Лаан, Герт; Сайнио, Маркку (1 августа 2012 г.). «Хроническая энцефалопатия, вызванная растворителями: шаг вперед» . Нейротоксикология . Нейротоксичность и нейродегенерация: местный эффект и глобальное воздействие. 33 (4): 897–901. Бибкод : 2012NeuTx..33..897V . дои : 10.1016/j.neuro.2012.04.012 . ISSN 0161-813X . ПМИД 22560998 .
- ^ Лундберг И., Густавссон А., Хёгберг М., Найз Г. (июнь 1992 г.). «Диагностика злоупотребления алкоголем и других нервно-психических расстройств среди маляров по сравнению с плотниками» . Британский журнал промышленной медицины . 49 (6): 409–15. дои : 10.1136/oem.49.6.409 . ПМЦ 1012122 . ПМИД 1606027 .
- ^ Раитта С., Хусман К., Тоссавайнен А. (август 1976 г.). «Смена линз у маляров автомобилей, подвергшихся воздействию смеси органических растворителей». Архив Альбрехта фон Грефе клинической и экспериментальной офтальмологии. Архив клинической и экспериментальной офтальмологии Альбрехта фон Грефе . 200 (2): 149–56. дои : 10.1007/bf00414364 . ПМИД 1086605 . S2CID 31344706 .
- ^ Маттеуччи, Федерика; Эрколе, Клаудия; дель Галло, Маддалена (2015). «Исследование загрязнения хлорированными растворителями водоносных горизонтов промышленной зоны в центральной Италии: возможность биоремедиации» . Границы микробиологии . 6 : 924. дои : 10.3389/fmicb.2015.00924 . ISSN 1664-302X . ПМЦ 4556989 . ПМИД 26388862 .
- ^ Форанд С.П., Льюис-Михл Э.Л., Гомес М.И. (апрель 2012 г.). «Неблагоприятные исходы родов и воздействие трихлорэтилена и тетрахлорэтилена на мать в результате проникновения паров почвы в штате Нью-Йорк» . Перспективы гигиены окружающей среды . 120 (4): 616–21. дои : 10.1289/ehp.1103884 . ПМЦ 3339451 . ПМИД 22142966 .
Библиография
[ редактировать ]- Лоури Т.Х., Ричардсон К.С. (1987). Механизм и теория в органической химии (3-е изд.). Издательство Харпер Коллинз . ISBN 978-0-06-364044-3 .
Внешние ссылки
[ редактировать ]- Инструмент выбора растворителя Институт зеленой химии ACS
- «Европейская группа по производству растворителей - ESIG - Европейская группа по производству растворителей ESIG» Растворители в Европе.
- Таблица и текст лекции по O-Chem
- Таблицы Свойства и токсичность органических растворителей
- CDC – Органические растворители – Тема NIOSH по безопасности и гигиене труда
- EPA – Салфетки, загрязненные растворителями