Очевидные молярные свойства
В термодинамике кажущееся молярное свойство компонента раствора в смеси или растворе — это величина, определяемая с целью выделения вклада каждого компонента в неидеальность смеси . Он показывает изменение соответствующего свойства раствора (например, объема ) на моль добавленного компонента, когда весь этот компонент добавляется в раствор. Оно описывается как очевидное, поскольку оно отражает молярные свойства этого компонента в растворе при условии, что предполагается, что свойства других компонентов раствора остаются постоянными во время добавления. Однако это предположение зачастую не оправдано, поскольку значения кажущихся молярных свойств компонента могут существенно отличаться от его молярных свойств в чистом состоянии.
Например, объем раствора, содержащего два компонента, идентифицированный [а] выражением растворитель и растворенное вещество определяется
где — объем чистого растворителя до добавления растворенного вещества, а его молярный объем (при той же температуре и давлении, что и раствор), — количество молей растворителя, — кажущийся молярный объём растворённого вещества , — количество молей растворенного вещества в растворе. Разделив это соотношение на молярное количество одного компонента, можно получить соотношение между кажущимися молярными свойствами компонента и соотношением компонентов в смеси.
Это уравнение служит определением . Первый член равен объему того же количества растворителя без растворенного вещества, а второй член представляет собой изменение объема при добавлении растворенного вещества. Тогда можно рассматривать как молярный объем растворенного вещества, если предположить , что молярный объем растворителя не изменяется при добавлении растворенного вещества. Однако это предположение часто следует считать нереалистичным, как показано в примерах ниже, так что описывается только как кажущаяся величина.
Кажущееся молярное количество можно определить аналогичным образом для компонента, идентифицированного как растворитель . Некоторые авторы сообщают об кажущихся молярных объемах обоих (жидких) компонентов одного и того же раствора. [1] [2] Эту процедуру можно распространить на тройные и многокомпонентные смеси.
Кажущаяся величина также может быть выражена с использованием массы вместо количества молей. Это выражение дает кажущиеся конкретные величины, такие как кажущийся удельный объем.
где конкретные количества обозначены маленькими буквами.
Кажущиеся (молярные) свойства не являются константами (даже при данной температуре), а являются функциями состава. При бесконечном разбавлении кажущееся молярное свойство и соответствующее частичное молярное свойство становятся равными.
Некоторыми кажущимися молярными свойствами, которые обычно используются, являются кажущаяся молярная энтальпия , кажущаяся молярная теплоемкость и кажущийся молярный объем.
Отношение к моляльности
[ редактировать ]Кажущийся (моляльный) объем растворенного вещества может быть выражен как функция моляльности b этого растворенного вещества (а также плотности раствора и растворителя). Объем раствора на моль растворенного вещества равен
Вычитание объема чистого растворителя на моль растворенного вещества дает кажущийся молярный объем:
Для большего количества растворенных веществ приведенное выше равенство модифицируется с учетом средней молярной массы растворенных веществ, как если бы они были одним растворенным веществом с моляльностью b T :
- ,
Сумма моляльностей продуктов – кажущихся молярных объемов растворенных веществ в их бинарных растворах равна произведению суммы молялей растворенных веществ и кажущегося молярного объема в тройном многокомпонентном растворе, упомянутом выше.
- ,
Связь с соотношением смешивания
[ редактировать ]Зависимость между кажущейся молярностью компонента смеси и молярным соотношением смешивания можно получить путем деления определяющего соотношения
количеству молей одного компонента. Это дает следующее соотношение:
Отношение к парциальным (молярным) количествам
[ редактировать ]Обратите внимание на контрастные определения между парциальным молярным количеством и кажущимся молярным количеством: в случае частичных молярных объемов , определяемый частными производными
- ,
можно написать , и так всегда держит. Напротив, при определении кажущегося молярного объема молярный объем чистого растворителя вместо этого используется , который можно записать как
- ,
для сравнения. Другими словами, мы предполагаем, что объем растворителя не меняется, и используем частичный молярный объем, при котором количество молей растворенного вещества равно нулю («молярный объем»). Таким образом, в определяющем выражении для кажущегося молярного объема ,
- ,
термин относят к чистому растворителю, а «остаточный» избыточный объем, , считается происходящим из растворенного вещества. При высоком разведении с , у нас есть , и поэтому кажущийся молярный объем и частичный молярный объем растворенного вещества также сходятся: .
Количественно связь между частичными молярными свойствами и кажущимися свойствами можно вывести из определения кажущихся величин и моляльности. Для объема,
Связь с коэффициентом активности электролита и номером его сольватной оболочки
[ редактировать ]Отношение r a между кажущимся молярным объемом растворенного электролита в концентрированном растворе и молярным объемом растворителя (воды) можно связать со статистической составляющей коэффициента активности электролита и его сольватной оболочки номер h : [3]
- ,
где ν — количество ионов, образующихся в результате диссоциации электролита, а b — моляльность, как указано выше.
Примеры
[ редактировать ]
Электролиты
[ редактировать ]Кажущийся молярный объем соли обычно меньше молярного объема твердой соли. Например, твердый NaCl имеет объем 27 см3. 3 на моль, но кажущийся молярный объем при низких концентрациях составляет всего 16,6 куб.см/моль. Фактически, некоторые водные электролиты имеют отрицательные кажущиеся молярные объемы: NaOH -6,7, LiOH -6,0 и Na 2 CO 3 -6,7 см. 3 /крот. [4] Это означает, что их растворы в данном количестве воды имеют меньший объем, чем такое же количество чистой воды. (Однако эффект невелик.) Физическая причина заключается в том, что близлежащие молекулы воды сильно притягиваются к ионам, поэтому они занимают меньше места.
Алкоголь
[ редактировать ]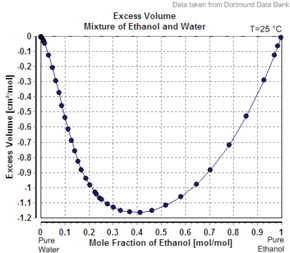
Другим примером того, что кажущийся молярный объем второго компонента меньше его молярного объема в чистом виде, является случай этанола в воде. Например, при 20 массовых процентах этанола объем раствора составляет 1,0326 л/кг при 20 °C, а объем чистой воды – 1,0018 л/кг (1,0018 куб.см/г). [5] Кажущийся объем добавленного этанола составляет 1,0326 л – 0,8 кг х 1,0018 л/кг = 0,2317 л. Количество молей этанола составляет 0,2 кг / (0,04607 кг/моль) = 4,341 моль, так что кажущийся молярный объем равен 0,2317. л/4,341 моль = 0,0532 л/моль = 53,2 куб.см/моль (1,16 куб.см/г). Однако чистый этанол имеет молярный объем при этой температуре 58,4 куб.см/моль (1,27 куб.см/г).
Если бы раствор был идеальным , его объем был бы суммой несмешанных компонентов. Объем 0,2 кг чистого этанола равен 0,2 кг х 1,27 л/кг = 0,254 л, а объем 0,8 кг чистой воды равен 0,8 кг х 1,0018 л/кг = 0,80144 л, поэтому идеальный объем раствора будет равен 0,254 л + 0,80144 л. L = 1,055 л. О неидеальности раствора свидетельствует незначительное уменьшение (примерно на 2,2%, 1,0326, а не 1,055 л/кг) объема объединенной системы при смешивании. Когда процентное содержание этанола приближается к 100%, кажущийся молярный объем возрастает до молярного объема чистого этанола.
Электролит – безэлектролитные системы
[ редактировать ]Видимые величины могут подчеркивать взаимодействия в системах электролит-неэлектролит, которые демонстрируют такие взаимодействия, как всаливание и высаливание , но также дают представление об ион-ионных взаимодействиях, особенно из-за их зависимости от температуры.
Многокомпонентные смеси или растворы
[ редактировать ]Для многокомпонентных растворов кажущиеся молярные свойства можно определить несколькими способами. Например, для объема тройного (3-компонентного) раствора с одним растворителем и двумя растворенными веществами все равно будет только одно уравнение , чего недостаточно для определения двух кажущихся объемов. (Это отличие от частичных молярных свойств , которые представляют собой четко определенные интенсивные свойства материалов и, следовательно, однозначно определены в многокомпонентных системах. Например, частичный молярный объем определяется для каждого компонента i как .)
В одном описании тройных водных растворов учитывается только средневзвешенный кажущийся молярный объем растворенных веществ. [6] определяется как
- ,
где - объем раствора и объем чистой воды.Этот метод можно распространить на смеси, содержащие более трех компонентов. [7]
- ,
Сумма моляльностей продуктов – кажущихся молярных объемов растворенных веществ в их бинарных растворах равна произведению суммы молялей растворенных веществ и кажущегося молярного объема в тройном многокомпонентном растворе, упомянутом выше.
- ,
Другой метод состоит в том, чтобы рассматривать тройную систему как псевдобинарную и определять кажущийся молярный объем каждого растворенного вещества относительно бинарной системы, содержащей оба других компонента: воду и другое растворенное вещество. [8] Тогда кажущиеся молярные объемы каждого из двух растворенных веществ будут
- и
Кажущийся молярный объем растворителя равен:
Однако это неудовлетворительное описание объемных свойств. [9]
Кажущийся молярный объем двух компонентов или растворенных веществ, рассматриваемых как один псевдокомпонент. или не следует путать с объемами частичных бинарных смесей с одним общим компонентом , Vij Vjk , которые , смешавшись в определенном соотношении компонентов, определенную тройную смесь V или Vijk образуют . [ нужны разъяснения ]
Конечно, дополнительный объем компонента по отношению к другим компонентам смеси можно определить как разницу между объемом смеси и объемом бинарной субсмеси данного состава, например:
Бывают ситуации, когда не существует строгого способа определить, что является растворителем, а что растворенным веществом, как в случае с жидкими смесями (скажем, водой и этанолом), которые могут растворять или нет твердые вещества, такие как сахар или соль. В этих случаях всем компонентам смеси можно и нужно приписывать явные молярные свойства.
См. также
[ редактировать ]- Объемная доля
- Идеальное решение
- Обычное решение
- Изменение энтальпии раствора
- Энтальпия смешения
- Блочный дизайн
- Теплота разбавления
- Энергия гидратации
- Ионно-транспортное число
- Сольватная оболочка
- Частичное молярное свойство
- Избыточное молярное количество
- Засолка
- Тройной сюжет
- Термодинамическая активность
Примечания
[ редактировать ]- ^ Эта маркировка произвольна. Для смесей двух жидкостей любую из них можно назвать растворителем. Для смесей жидкости и твердого вещества жидкость обычно идентифицируется как растворитель, а твердое вещество — как растворенное вещество, но теория по-прежнему справедлива, если метки поменять местами.
Ссылки
[ редактировать ]- ^ Рок, Питер А., Химическая термодинамика, MacMillan 1969, стр. 227-230 для водно-этанольных смесей.
- ^ Х.Х. Газоян и Ш. А. Маркарян (2014) ПЛОТНОСТИ, ИЗБЫТОЧНЫЕ МОЛЯРНЫЕ И ПАРЦИАЛЬНЫЕ МОЛЯРНЫЕ ОБЪЕМЫ ДЛЯ ДИЭТИЛСУЛЬФОКСИДА С МЕТАНОЛОМ ИЛИ ЭТАНОЛОМ БИНАРНЫХ СИСТЕМ В ДИАПАЗОНЕ ТЕМПЕРАТУР 298,15 – 323,15 К Известия ЕРЕВАНСКОГО ГОСУДАРСТВЕННОГО УНИВЕРСИТЕТА № 2, с.17-25. См. Таблицу 4.
- ^ Глюкауф, Э. (1955). «Влияние ионной гидратации на коэффициенты активности концентрированных растворов электролитов». Труды Фарадеевского общества . 51 : 1235–1244. дои : 10.1039/TF9555101235 .
- ^ Герберт Харнед и Бентон Оуэн , Физическая химия электролитических растворов , 1950, с. 253.
- ^ Рассчитано на основе данных Справочника CRC по химии и физике, 49-е издание.
- ^ Лимонная кислота Апельблат, Александр (Springer 2014) стр.50 ISBN 978-3-319-11233-6
- ^ Харнед, Оуэн,оп. цит. третье издание 1958 г., с. 398-399
- ^ Лимонная кислота Апельблат стр.320
- ^ Апельблат стр.320
Внешние ссылки
[ редактировать ]- Очевидные молярные свойства: решения: предпосылки
- Свойства (p,ρ,T) и кажущиеся молярные объемы этанольных растворов LiI или ZnCl2. Архивировано 4 марта 2016 г. на Wayback Machine.
- Кажущиеся мольные объемы и кажущаяся молярная теплоемкость Pr(NO3)3(вод), Gd(NO3)3(вод), Ho(NO3)3(вод) и Y(NO3)3(вод) при Т = (288,15) , 298,15, 313,15 и 328,15) К и р = 0,1 МПа
- Изотопные эффекты для видимых свойств электролитов






































