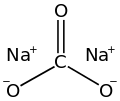
Карбонат натрия
 | |
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК Карбонат натрия | |
| Другие имена Кальцинированная сода, стиральная сода, кристаллы соды, триоксокарбонат натрия. | |
| Идентификаторы | |
3D model ( JSmol ) | |
| ЧЭБИ | |
| ЧЕМБЛ | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.007.127 |
| Номер ЕС |
|
| номер Е | E500(i) (регуляторы кислотности, ...) |
ПабХим CID | |
| номер РТЭКС |
|
| НЕКОТОРЫЙ |
|
Панель управления CompTox ( EPA ) | |
| Характеристики | |
| Na2CONa2CO3 | |
| Молярная масса | 105,9888 г/моль (безводный) 286,1416 г/моль (декагидрат) |
| Появление | Белое твердое вещество, гигроскопично. |
| Запах | Без запаха |
| Плотность | |
| Температура плавления | 851 ° C (1564 ° F; 1124 К) (безводный) 100 ° С (212 ° F; 373 К) разлагается (моногидрат) 33,5 ° C (92,3 ° F; 306,6 К) разлагается (гептагидрат) 34 ° С (93 ° F; 307 К) (декагидрат) [2] [6] |
Безводный, г/100 мл:
| |
| Растворимость | Растворим в водн. щелочи , [3] глицерин Мало растворим в водн. алкоголь Нерастворим в CS 2 , ацетоне , алкилацетатах , спирте, бензонитриле , жидком аммиаке. [4] |
| Растворимость в глицерине | 98.3 g/100 g (155 °C) [4] |
| Растворимость в этандиоле | 3,46 г/100 г (20 °С) [5] |
| Растворимость в диметилформамиде | 0,5 г/кг [5] |
| Кислотность ( pKa ) | 10.33 |
| −4.1·10 −5 см 3 /моль [2] | |
Показатель преломления ( n D ) | 1,485 (безводный) 1,420 (моногидрат) [6] 1,405 (декагидрат) |
| Вязкость | 3,4 сП (887 ° С) [5] |
| Структура | |
| Моноклинная (γ-форма, β-форма, δ-форма, безводная) [7] Орторомбический (моногидрат, гептагидрат) [1] [8] | |
| С2/м, № 12 (γ-форма, безводная, 170 К) С2/м, № 12 (β-форма, безводная, 628 К) P2 1 /n, № 14 (δ-форма, безводный, 110 К) [7] Pca2 1 , №29 (моногидрат) [1] Пбка, нет. 61 (гептагидрат) [8] | |
| 2/м (γ-форма, β-форма, δ-форма, безводный) [7] мм2 (моногидрат) [1] 2/м 2/м 2/м (гептагидрат) [8] | |
a = 8,920(7) Å, b = 5,245(5) Å, c = 6,050(5) Å (γ-форма, безводная, 295 К) [7] α = 90°, β = 101,35(8)°, γ = 90° | |
| Октаэдрический (Na + , безводный) | |
| Термохимия | |
Теплоемкость ( С ) | 112,3 Дж/моль К [2] |
Стандартный моляр энтропия ( S ⦵ 298 ) | 135 Дж/моль·К [2] |
Стандартная энтальпия образование (Δ f H ⦵ 298 ) | −1130,7 кДж/моль [2] [5] |
Свободная энергия Гиббса (Δ f G ⦵ ) | −1044,4 кДж/моль [2] |
| Опасности | |
| Безопасность и гигиена труда (OHS/OSH): | |
Основные опасности | Раздражающий |
| СГС Маркировка : | |
 [9] [9] | |
| Предупреждение | |
| H319 [9] | |
| П305+П351+П338 [9] | |
| NFPA 704 (огненный алмаз) | |
| Летальная доза или концентрация (LD, LC): | |
ЛД 50 ( средняя доза ) | 4090 мг/кг (крыса, перорально) [10] |
| Паспорт безопасности (SDS) | Паспорт безопасности |
| Родственные соединения | |
Другие анионы | Бикарбонат натрия |
Другие катионы | Карбонат лития Карбонат калия Карбонат рубидия Карбонат цезия |
Родственные соединения | Сесквикарбонат натрия Перкарбонат натрия |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Карбонат натрия (также известный как стиральная сода , кальцинированная сода и кристаллы соды ) представляет собой неорганическое соединение с формулой Na 2 CO 3 и его различные гидраты . Все формы представляют собой белые водорастворимые соли без запаха, образующие в воде щелочные растворы. Исторически его добывали из золы растений, выращенных на богатых натрием почвах, а поскольку зола этих богатых натрием растений заметно отличалась от золы древесины (некогда использовавшейся для производства поташа ), карбонат натрия стал известен как «кальцинированная сода». ". [12] Его производят в больших количествах из хлорида натрия и известняка по методу Сольве , а также путем карбонизации гидроксида натрия, который производится с использованием хлор-щелочного процесса.
Гидраты
[ редактировать ]Карбонат натрия получают в виде трех гидратов и безводной соли:
- декагидрат карбоната натрия ( натрон ), Na 2 CO 3 ·10H 2 O, который легко выцветает с образованием моногидрата.
- гептагидрат карбоната натрия (в минеральной форме неизвестен), Na 2 CO 3 ·7H 2 O.
- моногидрат карбоната натрия ( термонатрит ), Na 2 CO 3 ·H 2 O. Также известен как кристаллический карбонат .
- безводный карбонат натрия (натрит), также известный как кальцинированная сода, образуется при нагревании гидратов. Он также образуется при нагревании (прокаливании) гидрокарбоната натрия, например, на последней стадии процесса Сольве .
Декагидрат образуется из водных растворов, кристаллизующихся в диапазоне температур от -2,1 до +32,0 °С, гептагидрат - в узком диапазоне от 32,0 до 35,4 °С, а выше этой температуры образуется моногидрат. [13] В сухом воздухе декагидрат и гептагидрат теряют воду с образованием моногидрата. Сообщалось о других гидратах, например, с 2,5 единицами воды на единицу карбоната натрия («пента-полугидрат»). [14]
Стиральная сода
[ редактировать ]Декагидрат карбоната натрия (Na 2 CO 3 ·10H 2 O), также известный как стиральная сода, представляет собой наиболее распространенный гидрат карбоната натрия, содержащий 10 молекул кристаллизационной воды . Кальцинированную соду растворяют в воде и кристаллизуют, получая стиральную соду.
Это один из немногих карбонатов металлов , растворимых в воде.
Приложения
[ редактировать ]Некоторые распространенные применения карбоната натрия включают:
- В качестве чистящего средства для бытовых целей, например, для стирки одежды. Карбонат натрия входит в состав многих сухих мыльных порошков. Он обладает моющими свойствами благодаря процессу омыления , в ходе которого жиры и жиры преобразуются в водорастворимые соли (в частности, мыло). [15]
- Используется для снижения жесткости воды. [16] (см. § Умягчение воды ).
- Его используют при производстве стекла , [17] мыло , [17] и бумага (см. § Производство стекла ).
- Он используется в производстве соединений натрия, таких как бура .
Производство стекла
[ редактировать ]Карбонат натрия служит флюсом для кремнезема ( SiO 2 , температура плавления 1713 °C), снижая температуру плавления смеси до уровня, достижимого без специальных материалов. Это «натриевое стекло» слабо растворяется в воде, поэтому в расплавленную смесь добавляют немного карбоната кальция, чтобы сделать стекло нерастворимым. Бутылочное и оконное стекло (« натриево-известковое стекло » с температурой перехода ~570 °С) изготавливают путем плавления таких смесей карбоната натрия, карбоната кальция и кварцевого песка ( диоксида кремния (SiO 2 )). Когда эти материалы нагреваются, карбонаты выделяют углекислый газ. Таким образом, карбонат натрия является источником оксида натрия. Натриево-известковое стекло на протяжении веков было наиболее распространенной формой стекла. Это также ключевой ресурс для производства посуды из стекла. [15]
Умягчение воды
[ редактировать ]Жесткая вода обычно содержит ионы кальция или магния. Карбонат натрия используется для удаления этих ионов и замены их ионами натрия. [16]
Карбонат натрия является водорастворимым источником карбоната. Ионы кальция и магния при обработке ионами карбоната образуют нерастворимые твердые осадки :
Вода смягчается, поскольку в ней больше не содержатся растворенные ионы кальция и ионы магния. [16]
Пищевая добавка и кулинария
[ редактировать ]Карбонат натрия имеет несколько применений в кухне, главным образом потому, что он является более сильным основанием, чем пищевая сода ( бикарбонат натрия ), но более слабым, чем щелок (который может относиться к гидроксиду натрия или, реже, гидроксиду калия ). Щелочность влияет на выработку клейковины в замешанном тесте, а также улучшает подрумянивание за счет снижения температуры, при которой происходит реакция Майяра . Чтобы воспользоваться первым эффектом, карбонат натрия является одним из компонентов кансуи ( かん水 ) , раствора щелочных солей, используемого для придания японской лапше рамэн характерного вкуса и жевательной текстуры; аналогичный раствор используется в китайской кухне для приготовления ламяна по тем же причинам. Кантонские пекари также используют карбонат натрия вместо щелочной воды, чтобы придать лунным пирогам характерную текстуру и улучшить подрумянивание. В немецкой кухне (и в центральноевропейской кухне в более широком смысле) хлеб, такой как крендели и булочки с солью, традиционно обрабатываемый щелочью для улучшения подрумянивания, вместо этого можно обрабатывать карбонатом натрия; Карбонат натрия не дает такого сильного потемнения, как щелочь, но с ним гораздо безопаснее и легче работать. [18]
Карбонат натрия используется при производстве порошка шербета . Ощущение охлаждения и шипения возникает в результате эндотермической реакции между карбонатом натрия и слабой кислотой, обычно лимонной кислотой , с выделением углекислого газа, которая возникает, когда шербет смачивается слюной.
Карбонат натрия также находит применение в пищевой промышленности в качестве пищевой добавки (Е500), регулятора кислотности, антислеживателя , разрыхлителя и стабилизатора. Он также используется при производстве снюса для стабилизации pH конечного продукта.
Хотя он менее склонен вызывать химические ожоги, чем щелочь, все же следует соблюдать осторожность при работе с карбонатом натрия на кухне, поскольку он вызывает коррозию алюминиевой посуды, столовых приборов и фольги. [19]
Другие приложения
[ редактировать ]Карбонат натрия также используется как относительно сильное основание в различных областях. Как обычная щелочь, ее предпочитают во многих химических процессах, поскольку она дешевле гидроксида натрия и с ней гораздо безопаснее обращаться. Его мягкость особенно рекомендует его использование в домашних условиях.
Например, он используется в качестве регулятора pH для поддержания стабильной щелочной среды, необходимой для действия большинства проявителей фотопленки . Это также распространенная добавка в плавательные бассейны и аквариумную воду для поддержания желаемого уровня pH и карбонатной жесткости (KH). При окрашивании красителями, реагирующими с волокнами, карбонат натрия (часто под таким названием, как фиксатор кальцинированной соды или активатор кальцинированной соды) используется для обеспечения надлежащего химического связывания красителя с целлюлозными (растительными) волокнами, обычно перед крашением (для красителей для галстуков). , смешанный с красителем (для окраски красителем), или после окрашивания (для иммерсионного крашения). Он также используется в процессе пенной флотации для поддержания благоприятного pH в качестве кондиционера для флотации помимо CaO и других слабоосновных соединений.
Прекурсор других соединений
[ редактировать ]натрия Бикарбонат (NaHCO 3 ) или пищевая сода, также являющаяся компонентом огнетушителей, часто образуется из карбоната натрия. Хотя NaHCO 3 сам по себе является промежуточным продуктом процесса Сольве, нагревание, необходимое для удаления загрязняющего его аммиака, разлагает некоторое количество NaHCO 3 , что делает более экономичным взаимодействие готового Na 2 CO 3 с CO 2 :
В аналогичной реакции карбонат натрия используется для получения бисульфита натрия (NaHSO 3 ), который используется в «сульфитном» методе отделения лигнина от целлюлозы. Эту реакцию используют для удаления диоксида серы из дымовых газов на электростанциях:
Это применение стало более распространенным, особенно там, где станции должны соблюдать строгие меры контроля выбросов.
Карбонат натрия используется в хлопковой промышленности для нейтрализации серной кислоты, необходимой для кислотной очистки ворсистых семян хлопчатника.
Он также используется для образования карбонатов других металлов путем ионного обмена, часто с сульфатами других металлов.
Разнообразный
[ редактировать ]Карбонат натрия используется в кирпичной промышленности в качестве смачивающего агента для уменьшения количества воды, необходимой для экструдирования глины. При литье его называют «связующим агентом» и используют для прилипания влажного альгината к гелеобразному альгинату. Карбонат натрия используется в зубных пастах, где он действует как пенообразователь и абразив, а также для временного повышения pH во рту.
Карбонат натрия также используется при обработке и дублении шкур животных. [20]
Физические свойства
[ редактировать ]Интегральная энтальпия раствора карбоната натрия составляет -28,1 кДж/моль для 10% водного раствора. [21] Твердость по шкале Мооса составляет 1,3. моногидрата карбоната натрия [6]
Встречается как природный минерал
[ редактировать ]
Карбонат натрия растворим в воде и может встречаться в природе в засушливых регионах, особенно в минеральных отложениях ( эвапоритах ), образующихся при испарении сезонных озер. Месторождения минерала натрона добывались на дне высохших озер в Египте с древних времен, когда натрон использовался при изготовлении мумий и в раннем производстве стекла.
Безводная минеральная форма карбоната натрия встречается довольно редко и называется нитритом. Карбонат натрия также извергается из Ол Дойньо Ленгаи , уникального вулкана Танзании, и предполагается, что в прошлом он извергался из других вулканов, но из-за нестабильности этих минералов на поверхности Земли, вероятно, подвергнется эрозии. Все три минералогические формы карбоната натрия, а также трона , дигидрат гидрогендикарбоната натрия, также известны из ультращелочных пегматитовых пород , встречающихся, например, на Кольском полуострове в России.
За пределами Земли известный карбонат натрия встречается редко. Отложения были идентифицированы как источник ярких пятен на Церере , внутреннем материале, который был вынесен на поверхность. [22] есть Хотя на Марсе карбонаты , и ожидается, что среди них будет карбонат натрия. [23] месторождения еще не подтверждены, это отсутствие некоторые объясняют глобальным преобладанием низкого pH в ранее водной марсианской почве . [24]
Производство
[ редактировать ]Первоначальное крупномасштабное химическое производство было создано в Англии в 1823 году для производства кальцинированной соды. [17]
Горное дело
[ редактировать ]Трона , также известная как дигидрат гидрогендикарбоната тринатрия (Na 3 HCO 3 CO 3 ·2H 2 O), добывается в нескольких районах США и обеспечивает почти все потребление карбоната натрия в США. Крупные природные месторождения, обнаруженные в 1938 году, такие как месторождение возле Грин-Ривер, штат Вайоминг , сделали добычу полезных ископаемых более экономичной, чем промышленное производство в Северной Америке. В Турции имеются важные запасы троны; [25] Из запасов под Анкарой добыто два миллиона тонн кальцинированной соды.
Барилла и ламинария
[ редактировать ]Некоторые « галофитные » (солеустойчивые) виды растений и виды морских водорослей могут быть переработаны для получения нечистой формы карбоната натрия, и эти источники преобладали в Европе и других странах до начала 19 века. Наземные растения (обычно солянки или солянки ) или морские водоросли (обычно виды Fucus ) собирали, сушили и сжигали. Затем золу « выщелачивали » (промывали водой) с образованием раствора щелочи. Этот раствор кипятили досуха, чтобы получить конечный продукт, получивший название «кальцинированная сода»; это очень старое название происходит от арабского слова «сода» , которое, в свою очередь, применяется к соде Salsola , одному из многих видов прибрежных растений, собираемых для производства. «Барилла» — это коммерческий термин, применяемый к нечистой форме поташа , полученной из прибрежных растений или водорослей . [26]
Концентрация карбоната натрия в кальцинированной соде варьировалась в очень широких пределах: от 2–3 процентов для формы, полученной из морских водорослей (« ламинария »), до 30 процентов для лучшей бариллы, произведенной из солянки растений в Испании. К концу 18-го века источники кальцинированной соды, а также связанного с ней щелочного « калия » из растений и морских водорослей становились все более неадекватными, и поиск коммерчески жизнеспособных путей синтеза кальцинированной соды из соли и других химикатов активизировался. [27]
Процесс Леблана
[ редактировать ]В 1792 году французский химик Николя Леблан запатентовал процесс получения карбоната натрия из соли, серной кислоты , известняка и угля. На первом этапе хлорид натрия обрабатывают серной кислотой по Мангеймскому процессу . В результате этой реакции образуется сульфат натрия ( соляной осадок ) и хлористый водород :
Соляной пирог и измельченный известняк ( карбонат кальция ) восстанавливали нагреванием углем . [15] Это преобразование состоит из двух частей. Во-первых, это карботермическая реакция при которой уголь, источник углерода , восстанавливает сульфат , до сульфида :
Вторая стадия — это реакция с образованием карбоната натрия и сульфида кальция :
Эту смесь называют черной золой . Кальцинированную соду экстрагируют из черной золы водой. Выпаривание этого экстракта дает твердый карбонат натрия. Этот процесс экстракции был назван выщелачиванием .
Соляная кислота, полученная в процессе Леблана, была основным источником загрязнения воздуха, а побочный продукт сульфид кальция также представлял проблемы с утилизацией отходов. Однако он оставался основным методом производства карбоната натрия до конца 1880-х годов. [27] [28]
Сольвеевский процесс
[ редактировать ]В 1861 году бельгийский промышленный химик Эрнест Сольвей разработал метод получения карбоната натрия путем первой реакции хлорида натрия , аммиака , воды и углекислого газа с образованием бикарбоната натрия и хлорида аммония : [15]
Полученный бикарбонат натрия затем превращали в карбонат натрия путем его нагревания с выделением воды и углекислого газа:
Тем временем аммиак был регенерирован из побочного продукта хлорида аммония путем обработки его известью ( оксидом кальция ), оставшейся от образования углекислого газа:
Процесс Solvay перерабатывает аммиак. Он потребляет только рассол и известняк, а хлорид кальция единственным отходом его производства является . Этот процесс существенно более экономичен, чем процесс Леблана, при котором образуются два побочных продукта: сульфид кальция и хлористый водород . Процесс Сольвея быстро стал доминировать в производстве карбоната натрия во всем мире. К 1900 году 90% карбоната натрия производилось по процессу Сольве, а последний завод по процессу Леблана закрылся в начале 1920-х годов. [15]
Второй этап процесса Сольве — нагревание бикарбоната натрия — используется в небольших масштабах домашними поварами и ресторанами для приготовления карбоната натрия для кулинарных целей (включая крендели и щелочную лапшу ). Этот метод привлекателен для таких пользователей, поскольку бикарбонат натрия широко продается в виде пищевой соды, а температура, необходимая (от 250 ° F (121 ° C) до 300 ° F (149 ° C)) для преобразования пищевой соды в карбонат натрия, легко достигается. в обычных кухонных духовках . [18]
процесс Хоу
[ редактировать ]Этот процесс был разработан китайским химиком Хоу Дебаном в 1930-х годах. Более ранний побочный продукт парового риформинга, диоксид углерода, прокачивали через насыщенный раствор хлорида натрия и аммиака для получения бикарбоната натрия по следующим реакциям:
Бикарбонат натрия собирали в виде осадка из-за его низкой растворимости, а затем нагревали примерно до 80 ° C (176 ° F) или 95 ° C (203 ° F), чтобы получить чистый карбонат натрия, аналогично последней стадии процесса Сольвея. К оставшемуся раствору хлоридов аммония и натрия добавляют еще хлорида натрия; кроме того, в этот раствор закачивают больше аммиака при температуре 30–40 °C. Затем температуру раствора понижают до уровня ниже 10°C. Растворимость хлорида аммония выше, чем у хлорида натрия при 30°С и ниже при 10°С. Из-за разницы растворимости, зависящей от температуры, и эффекта общего иона хлорид аммония осаждается в растворе хлорида натрия.
Китайское название процесса Хоу, lianhe zhijian fa ( 联合制碱法 ), означает «метод совместного производства щелочи»: процесс Хоу связан с процессом Габера и обеспечивает лучшую экономию атомов за счет исключения производства хлорида кальция, поскольку аммиак больше не нуждается в быть возрожденным. Побочный продукт, хлорид аммония, можно продавать как удобрение.
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Перейти обратно: а б с д Харпер, JP (1936). Антипов, Евгений; Бисмайер, Ульрих; Хуппертц, Хьюберт; Петричек, Вацлав; Петтген, Райнер; Шмаль, Вольфганг; Тикинк, ERT; Цзоу, Сяодун (ред.). моногидрата карбоната Na2CO3.H2O » натрия « Кристаллическая структура . Журнал кристаллографии - Кристаллические материалы . 95 (1): 266–273. дои : 10.1524/zkri.1936.95.1.266 . ISSN 2196-7105 . Проверено 25 июля 2014 г.
- ^ Перейти обратно: а б с д и ж г Лиде, Дэвид Р., изд. (2009). Справочник CRC по химии и физике (90-е изд.). Бока-Ратон, Флорида : CRC Press . ISBN 978-1-4200-9084-0 .
- ^ Перейти обратно: а б Зейделл, Атертон; Линке, Уильям Ф. (1919). Растворимость неорганических и органических соединений (2-е изд.). Нью-Йорк : Компания Д. Ван Ностранда. п. 633 .
- ^ Перейти обратно: а б Коми, Артур Мессингер; Хан, Дороти А. (февраль 1921 г.). Словарь химической растворимости: неорганические вещества (2-е изд.). Нью-Йорк: Компания MacMillan. стр. 208–209.
- ^ Перейти обратно: а б с д Анатольевич, Кипер Руслан. «карбонат натрия» . chemister.ru . Проверено 25 июля 2014 г.
- ^ Перейти обратно: а б с Прадьот, Патнаик (2003). Справочник неорганических химикатов . МакГроу-Хилл. п. 861. ИСБН 978-0-07-049439-8 .
- ^ Перейти обратно: а б с д Душек, Михал; Шапюи, Жерве; Мейер, Матиас; Петричек, Вацлав (2003). «Возврат к карбонату натрия» (PDF) . Acta Crystallographica Раздел B. 59 (3): 337–352. Бибкод : 2003AcCrB..59..337D . дои : 10.1107/S0108768103009017 . ISSN 0108-7681 . ПМИД 12761404 . Проверено 25 июля 2014 г.
- ^ Перейти обратно: а б с Бетцель, К.; Сенгер, В.; Лоевус, Д. (1982). «Гептагидрат карбоната натрия». Acta Crystallographica Раздел B. 38 (11): 2802–2804. Бибкод : 1982AcCrB..38.2802B . дои : 10.1107/S0567740882009996 .
- ^ Перейти обратно: а б с Sigma-Aldrich Co. , Карбонат натрия . Проверено 6 мая 2014 г.
- ^ Чемберс, Майкл. «ChemIDplus - 497-19-8 - CDBYLPFSWZWCQE-UHFFFAOYSA-L - Карбонат натрия [NF] - Поиск подобных структур, синонимы, формулы, ссылки на ресурсы и другая химическая информация» .
- ^ «Паспорт безопасности материала – карбонат натрия безводный» (PDF) . Conservationsupportsystems.com . Системы поддержки охраны природы . Проверено 25 июля 2014 г.
- ^ «Статистика и информация по кальцинированной соде» . Географическая служба США . Проверено 03 марта 2024 г.
- ^ Т.Ричардс и А.Х. Фиске (1914). «О температурах перехода гидратов карбоната натрия как фиксированных точках в термометрии» . Журнал Американского химического общества . 36 (3): 485–490. дои : 10.1021/ja02180a003 .
- ^ А. Пабст. «О гидратах карбоната натрия» (PDF) .
- ^ Перейти обратно: а б с д и Кристиан Тиме (2000). «Карбонаты натрия». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a24_299 . ISBN 978-3527306732 .
- ^ Перейти обратно: а б с «Измерение жесткости воды» (PDF) . Корнеллский центр исследования материалов .
- ^ Перейти обратно: а б с Химмельблау, Дэвид М.; Риггс, Джеймс Б. (2022). Основные принципы и расчеты в химической технологии . Международная серия по физико-химическим инженерным наукам (Девятое изд.). Бостон: Пирсон. ISBN 978-0-13-732717-1 .
- ^ Перейти обратно: а б МакГи, Гарольд (24 сентября 2010 г.). «Чтобы придать старомодный вкус, приготовьте пищевую соду» . Нью-Йорк Таймс . Проверено 25 апреля 2019 г.
- ^ «Карбонат натрия» . коррозипедия . Джаналта Интерактив . Проверено 9 ноября 2020 г.
- ^ «Домашнее дубление шкур и меха» (PDF) . Проверено 16 апреля 2024 г.
- ^ «Tatachemicals.com/north-america/product/images/fig_2_1.jpg» .
- ^ Де Санктис, MC; и др. (29 июня 2016 г.). «Яркие карбонатные отложения как свидетельство водных изменений на (1) Церере». Природа . 536 (7614): 54–57. Бибкод : 2016Natur.536...54D . дои : 10.1038/nature18290 . ПМИД 27362221 . S2CID 4465999 .
- ^ Джеффри С. Каргел (23 июля 2004 г.). Марс – более теплая и влажная планета . Springer Science & Business Media. стр. 399–. ISBN 978-1-85233-568-7 .
- ^ Гротцингер, Дж. и Р. Милликен (ред.) 2012. Осадочная геология Марса. СЕРМ
- ^ «Синер рассматривает возможность продажи доли в предприятии по производству соды стоимостью 5 миллиардов долларов» . Bloomberg.com . 09.08.2021 . Проверено 4 декабря 2023 г.
- ^ Хупер, Роберт (1802). Лексикон Медикум (изд. 1848 г.). Лондон: Лонгман. стр. 1198–9. ОСЛК 27671024 .
- ^ Перейти обратно: а б Клоу, Арчибальд и Клоу, Нэн Л. (июнь 1952 г.). Химическая революция . Айер. стр. 65–90. ISBN 0-8369-1909-2 .
- ^ Кифер, Дэвид М. (январь 2002 г.). «Все дело в щелочи» . Сегодняшний химик за работой . 11 (1): 45–6.
Дальнейшее чтение
[ редактировать ]- Эггеман, Т. (2011). «Карбонат натрия». Энциклопедия химической технологии Кирка-Отмера . стр. 1–11. дои : 10.1002/0471238961.1915040918012108.a01.pub3 . ISBN 978-0471238966 .
- Тиме, К. (2000). «Карбонаты натрия». Энциклопедия промышленной химии Ульмана . дои : 10.1002/14356007.a24_299 . ISBN 978-3527306732 .
Внешние ссылки
[ редактировать ]- Американская компания по производству натуральной соды
- Международная карта химической безопасности 1135
- Корпорация FMC Вайоминг
- Использование карбоната натрия при крашении.
- Производство карбоната натрия синтетическими процессами

