Декаванадат натрия
| |

| |
| Идентификаторы | |
|---|---|
| |
3D model ( JSmol )
|
|
| ХимическийПаук |
|
| Номер ЕС |
|
ПабХим CID
|
|
| Характеристики | |
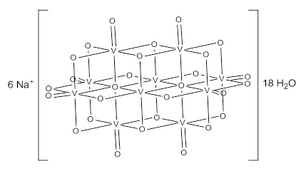
| Na 6 [В 10 О 28 ] | |
| Молярная масса | 1419.6 g/mol |
| Появление | оранжевый сплошной |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |
Декаванадат натрия описывает любого члена семейства неорганических соединений с формулой Na 6 [V 10 O 28 ](H 2 O) n . Это натриевые оранжевого цвета соли декаванадат- аниона [V 10 O 28 ] 6− . [ 1 ] Множество других солей декаванадата были выделены и изучены с 1956 года, когда он был впервые охарактеризован. [ 2 ]
Подготовка
[ редактировать ]Получение декаванадата достигается подкислением водного раствора ортованадата : [ 1 ]
- 10 Na 3 [VO 4 ] + 24 HOAc → Na 6 [V 10 O 28 ] + 12 H 2 O + 24 NaOAc
Образование декаванадата оптимизируется за счет поддержания диапазона pH 4–7. Типичные побочные продукты включают метаванадат, [VO 3 ] − и гексаванадат, [V 6 O 16 ] 2− , ионы. [ 1 ]
Структура
[ редактировать ]Декаванадат-ион состоит из 10 сросшихся октаэдров VO 6 и имеет симметрию D 2h . [ 3 ] [ 4 ] [ 5 ] Строение Na 6 [V 10 O 28 ]·18H 2 O подтверждено методом рентгеновской кристаллографии . [ 6 ]

Декаванадат-анионы содержат три набора эквивалентных атомов V (см. рис. 1). [ 3 ] VO 6 К ним относятся два центральных октаэдра (V c ) и по четыре периферийных тетрагонально-пирамидальных VO 5 группы (V a и V b ). Существует семь уникальных групп атомов кислорода (обозначенных от A до G). Два из них (A) соединяют шесть V-центров, четыре (B) соединяют три V-центра, четырнадцать из них (C, D и E) охватывают ребра между парами V-центров, а восемь (F и G) являются периферийными.
Степень окисления ванадия в декаванадате +5.
Кислотно-основные свойства
[ редактировать ]Водные соединения ванадата (V) подвергаются различным реакциям самоконденсации. [ 7 ] В зависимости от pH к основным ванадат-анионам в растворе относятся VO 2 (H 2 O) 4 2+ , ВО 4 3− , В 2 О 7 3− , В 3 О 9 3− , Вт 4 О 12 4− , и В 10 О 28 6− . Анионы часто обратимо протонируют . [ 5 ] Декаванадат образуется в соответствии с этим равновесием: [ 2 ] [ 7 ]
- Ч 3 В 10 О 28 3− ⇌ Ч 2 В 10 О 28 4− + Ч +
- Х 2 В 10 О 28 4− ⇌ ХВ 10 О 28 5− + Ч +
- ХВ 10 О 28 5− (вод) ⇌ V 10 O 28 6− + Ч +
Структура различных протонированных состояний декаванадат-иона была исследована 51 V ЯМР спектроскопия . [ 5 ] [ 7 ] Каждый вид дает три сигнала; со слегка меняющимися химическими сдвигами около -425, -506 и -523 частей на миллион относительно окситрихлорида ванадия ; предполагая, что происходит быстрый обмен протонами, приводящий к образованию одинаково симметричных видов. [ 8 ] Было показано, что три протонирования декаванадата происходят в мостиковых кислородных центрах, обозначенных как B и C на рисунке 1. [ 8 ]
Декаванадат наиболее стабилен в области pH 4–7. [ 1 ] [ 4 ] [ 7 ] Растворы ванадата становятся ярко-оранжевыми при pH 6,5, что указывает на присутствие декаванадата. Другие ванадаты бесцветны. При pH ниже 2,0 коричневый V 2 O 5 выпадает в осадок в виде гидрата. [ 3 ] [ 7 ]
- В 10 О 28 6− +6Ч + + 12Н 2 ⇌ 5В 2 О 5
Возможное использование
[ редактировать ]Было обнаружено, что декаванадат ингибирует фосфоглицератмутазу , фермент , который катализирует стадию 8 гликолиза . Кроме того, было обнаружено, что декавандат оказывает умеренное ингибирование жизнеспособности Leishmania tarentolae , что позволяет предположить, что декавандат может потенциально использоваться в качестве местного ингибитора простейших паразитов. [ 9 ]
Родственные декаванадаты
[ редактировать ]Охарактеризованы многие соли декаванадата. НХ 4 + , Как 2+ , Нет 2+ , сэр 2+ , и соли декаванадата группы I получают кислотно-основной реакцией между V 2 O 5 и оксидом, гидроксидом, карбонатом или гидрокарбонатом желаемого положительного иона. [ 1 ]
- 6 NH 3 + 5 V 2 O 5 + 3 H 2 O ⇌ (NH 4 ) 6 [V 10 O 28 ]
Другие декаванадаты:
- (NH 4 ) 6 [V 10 O 28 ]·6H 2 O [ 2 ]
- К 6 [В 10 О 28 ]·9Н 2 О [ 2 ]
- К 6 [В 10 О 28 ]·10Н 2 О [ 1 ] [ 2 ] [ 3 ]
- Са 3 [V 10 O 28 ]·16H 2 O [ 2 ] [ 3 ]
- К 2 Mg 2 [V 10 O 28 ]·16H 2 O [ 2 ] [ 3 ]
- К 2 Zn 2 [V 10 O 28 ]·16H 2 O [ 1 ] [ 2 ] [ 3 ]
- Cs 2 Mg 2 [V 10 O 28 ]·16H 2 O [ 3 ]
- Cs 4 Na 2 [V 10 O 28 ]·10H 2 O [ 10 ]
- К 4 Na 2 [V 10 O 28 ]·16H 2 O [ 11 ]
- Sr 3 [V 10 O 28 ]·22H 2 O [ 10 ]
- Ba 3 [V 10 O 28 ]·19H 2 O [ 10 ]
- [(C 6 H 5 ) 4 P]H 3 V 10 O 28 ·4CH 3 CN [ 8 ]
- Ag 6 [V 10 O 28 ]·4H 2 O [ 12 ] [ 13 ]
Встречающиеся в природе декаванадаты включают:
- Ca 3 V 10 O 28 ·17 H 2 O ( паскоит )
- Ca 2 Mg(V 10 O 28 )·16H 2 O ( Магнезиопаскоит )
- Na 4 Mg(V 10 O 28 )·24H 2 O ( Гюемулит )
Ссылки
[ редактировать ]- ^ Jump up to: а б с д и ж г Джонсон, Г.; Мурманн, РК (1979). «Декаянадаты натрия и аммония (V)». Неорганические синтезы . Том. 19. С. 140–145. дои : 10.1002/9780470132500.ch32 . ISBN 978-0-471-04542-7 .
- ^ Jump up to: а б с д и ж г час Россотти, Ф.Дж.; Россотти, Х. (1956). «Равновесные исследования полианионов» . Acta Chemica Scandinavica . 10 : 957–984. doi : 10.3891/acta.chem.scand.10-0957 .
- ^ Jump up to: а б с д и ж г час Эванс, Х.Т. младший (1966). «Молекулярная структура изополикомплексного иона декаванадата». Неорг. Хим . 5 : 967–977. дои : 10.1021/ic50040a004 .
- ^ Jump up to: а б Кустин, К.; Пессоа, JC; Кран, округ Колумбия (2007). Ванадий: универсальный металл . Вашингтон, округ Колумбия: Американское химическое общество. ISBN 978-0-8412-7446-4 .
- ^ Jump up to: а б с Редер, Д. (2008). Бионеорганическая химия ванадия . Уайли и сыновья. стр. 13–51. ISBN 978-0-470-06509-9 .
- ^ Дуриф, Пенсильвания; Авербух-Пушо, Монтана (1980). «Структура гидратированного декаванадата гексанатрия». Акта Кристаллогр. Б. 36 (3): 680–682. Бибкод : 1980AcCrB..36..680D . дои : 10.1107/S0567740880004116 .
- ^ Jump up to: а б с д и Трейси, А.С.; Кран, округ Колумбия (1998). Соединения ванадия . Вашингтон, округ Колумбия: Американское химическое общество. ISBN 0-8412-3589-9 .
- ^ Jump up to: а б с Дэй, Фольксваген; Клемперер, В.Г .; Мальтби, диджей (1987). «Где протоны в H 3 V 10 O 28 3− ?". Журнал Американского химического общества . 109 (10): 2991–3002. doi : 10.1021/ja00244a022 .
- ^ Тернер, Тимоти; Нгуен, Виктория; Маклауклан, Крейг; Даймон, Занета; Дорси, Бенджамин; Хукер, Жаклин; Джонс, Марджори (март 2012 г.). «Ингибирующее действие декаванадата на некоторые ферменты и Leishmania tarentolae In Vitro» . Журнал неорганической биохимии . 108 : 96–104. дои : 10.1016/j.jinorgbio.2011.09.009 . ПМИД 22005446 . Проверено 23 января 2021 г.
- ^ Jump up to: а б с Даметто, AC; де Араую, AS; де Соуза Корреа, Р.; Гильерме, ЛР; Массабни, AC (2010). «Синтез, инфракрасная спектроскопия и определение кристаллической структуры нового декаванадата». J Chem Crystallogr . 40 (11): 897–901. дои : 10.1007/s10870-010-9759-x . S2CID 97736357 .
- ^ Матиас, премьер-министр; Пессоа, JC; Дуарте, Монтана; Мадерия, К. (2000). «Декагидрат динатрия декаванадата (V) тетракалия». Акта Кристаллогр. С. 57 (3): е75–е76. Бибкод : 2000AcCrC..56E..75M . дои : 10.1107/S0108270100001530 . ПМИД 15263200 .
- ^ Эскобар, Мэн; Бэран, Э.Дж. (1981). «Колебательные спектры некоторых кристаллических декаванадатов» . Ежемесячные журналы по химии . 112 : 43-49. дои : 10.1007/BF00906241 . S2CID 101366009 .
- ^ Аурелиано, Мануэль; Кранс, Дебби С. (2009). «Декаванадат ( В.
10 О 6−
28 ) и оксованадаты: оксометаллаты со многими биологическими активностями» . Журнал неорганической биохимии . 103 (4): 536–546. doi : 10.1016/j.jinorgbio.2008.11.010 . ISSN 0162-0134 . PMID 19110314 .