Лейшмания
| Лейшмания | |
|---|---|
 | |
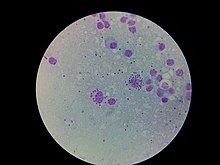
| L. donovani в клетках костного мозга | |
| Научная классификация | |
| Домен: | Эукариоты |
| Тип: | эвгленозоа |
| Сорт: | Кинетопластея |
| Заказ: | Трипаносоматида |
| Род: | Лейшмания Росс , 1903 год. |
| Разновидность | |
Л. эфиопика | |
Лейшмания / l iː ʃ ˈ m eɪ n i ə , - ˈ m æ n -/ [1] — паразитическое простейшее , одноклеточный организм рода Leishmania , ответственный за заболевание лейшманиоз . [2] [3] [4] Распространяются москитами рода Phlebotomus в Старом Свете и рода Lutzomyia в Новом Свете . По меньшей мере 93 вида москитов являются доказанными или вероятными переносчиками во всем мире. [5] Их первичные хозяева — позвоночные ; Лейшмания обычно поражает даманов , псовых , грызунов и людей .
История
[ редактировать ]Представители древнего рода , лейшманиям паразитов, подобных Paleoleishmania , были обнаружены у окаменевших москитов, относящихся к раннему меловому периоду. [6] Первое письменное упоминание о ярких симптомах кожного лейшманиоза появилось в Палеотропах в восточных текстах, датируемых VII веком до нашей эры (предположительно переписанных из источников на несколько сотен лет старше, между 1500 и 2000 годами до нашей эры). [7] ). Из-за своей широкой и устойчивой распространенности на протяжении всей античности как загадочной болезни с разнообразными симптоматическими исходами, лейшманиозу давали различные названия - от «белой проказы» до « черной лихорадки ». Некоторые из этих названий предполагают связь с негативными культурными верованиями или мифологией, которые до сих пор способствуют социальной стигматизации лейшманиоза. [8]
В Индии как кожный, так и висцеральный лейшманиоз вызывается Leishmania donovani . [9] [10] Первые сообщения о кожном лейшманиозе в Индии были сделаны британскими медиками в начале 19 века. К тому времени эта болезнь была известна как «восточная язва» или «Делийский фурункул»; [11] в то время как висцеральную форму по-разному называли «лихорадкой Бурдвана [в честь города Бурдвана ]», « кала азар» (черная лихорадка) или «лихорадкой Думдума [ города в Западной Бенгалии]». [12]
Возбудитель заболевания был идентифицирован в 1901 году Уильямом Бугом Лейшманом и Чарльзом Донованом . Они независимо друг от друга визуализировали микроскопических одноклеточных паразитов (позже названных тельцами Лейшмана-Донована), живущих в клетках инфицированных органов человека. Род паразитов позже будет классифицирован как трипаносоматидные простейшие под филогенетическим обозначением Leishmania donovani . Несколько видов с тех пор были классифицированы и сгруппированы в два основных подрода, а именно Leishmania Viannia (обычно расположенные в Неотропах ) или Leishmania Leishmania (обычно расположенные в Палеотропах , за основным исключением подгруппы L. mexicana ). [13]
Эпидемиология
[ редактировать ]В настоящее время лейшманией страдают 6 миллионов человек в 98 странах. Ежегодно происходит около 0,9–1,6 миллиона новых случаев, и известно, что 21 вид вызывает заболевание у человека: это считается зоонозом .
Структура
[ редактировать ]Leishmania Виды представляют собой одноклеточные эукариоты, имеющие четко выраженное ядро и другие клеточные органеллы, включая кинетопласты и жгутики . В зависимости от стадии жизненного цикла они существуют в двух структурных вариантах: [14] [15]
- Амастигота . встречается в мононуклеарных фагоцитах и кровеносной системе человека Это внутриклеточная и неподвижная форма, лишенная наружных жгутиков. Короткий жгутик прикреплен к переднему концу и не выступает наружу. Он имеет овальную форму, длину 3–6 мкм и ширину 1–3 мкм. Кинетопласт и базальное тело лежат к переднему концу.
- Форма промастиготы встречается в пищеварительном тракте москитов. Это внеклеточная и подвижная форма. Он значительно крупнее и сильно удлинен, имеет длину 15-30 мкм и ширину 5 мкм. Он имеет веретенообразную форму, сужающийся с обоих концов. Длинный жгутик (около длины тела) на переднем конце выступает наружу. В центре лежит ядро, а перед ним — кинетопласт и базальное тельце.
Эволюция
[ редактировать ]Детали эволюции этого рода обсуждаются, но Leishmania, по-видимому, произошла от предковой линии трипаносом. Самая старая линия — Bodonidae , за ней следует Trypanosoma brucei , последняя обитает на африканском континенте. Группы Trypanosoma cruzi с трипаносомами летучих мышей, южноамериканских млекопитающих и кенгуру предполагают происхождение из Южного полушария. Эти клады имеют лишь отдаленное родство.
Остальные клады этого дерева — Blastocrithidia , Herpetomonas и Phytomonas . Четыре рода Leptomonas , Crithidia , Leishmania и Endotrypanum образуют конечные ветви, что позволяет предположить относительно недавнее происхождение. Некоторые из этих родов могут быть полифилетическими и нуждаться в дальнейшем разделении. [16]
Происхождение самого рода Leishmania неясно. [17] [18] Одна теория предполагает африканское происхождение с миграцией в Америку. Другой предполагает миграцию из Америки в Старый Свет через сухопутный мост через Берингов пролив около 15 миллионов лет назад. Третья теория предполагает палеарктическое происхождение. [19] Такие миграции повлекут за собой последующую миграцию переносчика и резервуара или последовательные адаптации на этом пути. Более поздней миграцией является миграция L. infantum из стран Средиземноморья в Латинскую Америку (известная как L. chagasi ), после европейской колонизации Нового Света , где паразиты подхватили своих нынешних переносчиков Нового Света в своих соответствующих экосистемах. [20] Это и есть причина нынешних эпидемий. Одна из недавних эпидемий Нового Света касается гончих в США. [21]
Хотя предполагалось, что лейшмания могла возникнуть в Неотропах , [22] вероятно, это справедливо для видов, принадлежащих к подродам Viannia и Endotrypanum . Однако есть данные, что первичная эволюция подродов Leishmania и Sauroleishmania происходит в Старом Свете. В то время как виды Mundinia кажутся более универсальными в своей эволюции. Одна из теорий состоит в том, что разные линии были географически изолированы в разные периоды, и именно это привело к эволюционному мозаицизму. Но нет сомнения, что Leishmaniinae — монофилетическая группа.
Большой анализ данных показывает, что лейшмания возникла 90–100 миллионов лет назад в Гондване . [23] Виды, заражающие рептилий, произошли от клад млекопитающих.
Виды Sauroleishmania первоначально были определены на основании того, что они заражают рептилий ( ящериц ), а не млекопитающих . На основании молекулярных данных они были переведены в статус подрода в составе Leishmania . Этот подрод, вероятно, произошел от группы, первоначально заразившей млекопитающих. [24]
Таксономия
[ редактировать ]В этом роде признано 53 вида. Статус некоторых из них оспаривается, поэтому окончательное число может отличаться. По меньшей мере 20 видов заражают человека. Чтобы еще больше усложнить ситуацию, можно использовать гибриды , как сообщалось в Бразилии о гибриде Leishmania (V.) Guyanensis и Leishmania (V.) shawi shawi . [25]
Род в настоящее время разделен на 4 подрода: Leishmania , Sauroleishmania , Mundinia и Viannia . Разделение на два подрода ( Leishmania и Viannia ) было сделано Лэйнсоном и Шоу в 1987 году на основании их расположения в кишечнике насекомых. Виды подрода Viannia развиваются в задней кишке: L. (V.) braziliensis был предложен в качестве типового вида для этого подрода. Это разделение было подтверждено всеми последующими исследованиями. Шоу, Камарго и Тейшейра создали подрод Mundinia при пересмотре Leishmaniinae в 2016 году. [26]
Endotrypanum тесно связан с Leishmania . Некоторые виды Endotypanum уникальны тем, что заражают эритроциты своих хозяев (ленивцев). Все виды приурочены к Центральной и Южной Америке. [27] Инфекция E. colombiensis обнаружена у человека.
Первоначально Sauroleishmania была описана Ранкеном в 1973 году как отдельный род, но молекулярные исследования показывают, что на самом деле это подрод, а не отдельный род.
Предложенное в 2000 году разделение Leishmania на группы Euleishmania и Paraleishmania подчеркнуло глубокую филогенетическую дистанцию между паразитами, некоторые из которых были названы видами Leishmania . [28] вошли В состав Euleishmania виды, которые в настоящее время отнесены к подродам Leishmania , Sauroleishmania , Mundinia и Viannia . В состав предложенных Paraleishmania вошли виды Endotypanum, Leishmamnia — L. colomubensis , L.herreri , L.hertigi и L. deanei и L. equatorensis . В недавнем пересмотре этим видам был присвоен другой родовой статус.
четыре подрода Leishmania В настоящее время признаны — Leishmania , Sauroleishmania , Viannia и Mundinia ( комплекс L. enriettii ). Род Endotrypanum и Porcisia относятся к Paraleishmania .
четыре Mundinia вида — L. (Mundinia) enriettii , L. (Mundinia) martiniquensis , L. (Mundinia) macropodum и L. (Mundinia) orientalis. В Таиланде встречаются [29]
Особый статус L. Archibaldi не установлен, но он тесно связан с L. donovani .
L. herreri принадлежит скорее к роду Endotypanum, чем к Leishmania .
L. donovani и L. infantum тесно связаны.
Примечания
[ редактировать ]Селенофермент Seltryp , по-видимому, уникален для этого отряда. [30] Он был исключен из подрода Viannia .
L. deanei и L. hertigi , которые заражают дикобразов, были перенесены в род Porcisia.
Классификация
[ редактировать ]Подрод Leishmania Ross, 1903 по Сафьянова, 1982.
- Leishmania aethiopica Bray, Эшфорд и Брей, 1973 г.
- Leishmania amazonensis Lainson & Shaw, 1972 (включая garnhami Scorza et al., 1979 )
- Leishmania arabica Peters, Elbihari & Evans, 1986 г.
- Leishmania aristidesi Lainson & Shaw, 1979 г.
- Leishmania donovani (Лаверан и Мениль, 1903 г.)
- Leishmania forattinii Yoshida, Куба, Пачеко, Куполильо, Таварес, Мачадо, Хомен и Гримальди, 1993 г.
- Leishmania gerbilli Wang, Qu & Guan, 1964 г.
- Leishmania infantum Nicolle, 1908 (подвид chagasi Cunha & Chagas, 1937 )
- Leishmania killicki Rioux, Lamotte & Pratlong, 1986 г.
- Лейшмания майор Якимов и Шохор, 1914 г.
- Лейшмания мексиканская Бьяджи, 1953 г.
- Leishmania pifanoi Медина и Ромеро, 1959 г.
- Leishmania tropica (Райт, 1903 г.)
- Leishmania turanica Strelkova, Шурхал, Келлина, Елисеев, Эванс, Питерс, Чепмен, Ле Бланк и ван Эйс, 1990 г.
- Leishmania venezeulensis Бонфанте-Гарридо, 1980 г.
- Leishmania waltoni Shaw, Pratlong & Dedet 2015 г.
Подрод Mundinia Shaw, Camargo и Teixeira 2016 г.
- Leishmania enriettii Muniz & Medina, 1948 г.
- Leishmania macropodum Барратт, Кауфер, Питерс, Крейг, Лоуренс, Робертс, Ли, Маколифф, Старк, Эллис, 2017 г.
- Leishmania martiniquensis Desbois, Pratlong, Quist и Dedet, 2014 г. [31]
- Leishmania orientalis Jariyapan, Daroontum, Jaiwong, Chanmol,.Интахан, Сор-Суван, Сириясатиен, Сомбун, Бейтс, Бейтс, 2018
Подрод Sauroleishmania Ranque, 1973 по Сафьяновой, 1982.
- Лейшмания адлери Хейш, 1958 г.
- Лейшмания агама Давид, 1929 г.
- Leishmania ceramodactyli Адлер и Теодор, 1929 г.
- Leishmania gulikae Ovezmukhammedov & Saf'janova, 1987
- Leishmania Gymnodactyli † Ходукин и Софиев, 1940 г.
- Leishmania helioscopi † Чодукин и Софиев, 1940 г.
- Leishmania hemidactyli Mackie, Gupta & Swaminath, 1923 г.
- Leishmania hoogstrali McMillan, 1965 г.
- Leishmania nicollei Ходукин и Софиев, 1940 г.
- Leishmania platycephala Телфорд, 2009 г.
- Leishmania phrynocephali Чодукин и Софиев, 1940 г.
- Leishmania senegalensis Ranque, 1973 г.
- Leishmania sofieffi ↑ Markov, Lukina & Markova, 1964
- Leishmania tarentolae Wenyon, 1921 г.
- Leishmania zmeevi ↑ Андручко и Марков 1955
- Leishmania zuckermani Paperna, Boulard, Hering-Hagenbeck & Landau, 2001 г.
↑ Вид, описанный как Sauroleishmania . Их развитие отличается от других представителей подрода, поэтому их таксономическое положение сомнительно.
Подрод Viannia Lainson & Shaw, 1987 г.
- Leishmania braziliensis Вианна, 1911 г.
- Leishmania Guyanensis Floch, 1954 г.
- Leishmania lainsoni Silveira, Шоу, Брага и Исикава, 1987 г.
- Leishmania lindenbergi Silveira, Ishikawa, De Souza & Lainson, 2002 г.
- Leishmania naiffi Lainson & Shaw, 1989 г.
- Leishmania panamensis Lainson & Shaw, 1972 г.
- Лейшмания перуанская Велес, 1913 г.
- Лейшмания шави Лэйнсон, Брага и де Соуза, 1989 г.
- Leishmania utingensis Braga, Lainson, Ishikawa & Shaw, 2003 г.
Родственные роды
[ редактировать ]Отношения между Leishmania и другими родами, такими как Endotrypanum , Novymonas , Porcisia и Zelonia, в настоящее время неясны, поскольку они тесно связаны. [32] [13] Endotrypanum colombiensis , часто известный как Leishmania colombiensis, связан как с кожным, так и с висцеральным лейшманиозом в Венесуэле. [33]
Род Эндотрипанум.
- Endotrypanum colombiensis Kreutzer, Corredor, Grimaldi, Grogl, Rowton, Young, Morales, McMahon-Pratt, Guzman & Tesh, 1991
- Endotrypanum equatorensis Гримальди, Крейцер, Хашигути, Гомет, Мимори и Теш, 1992 г.
- Endotrypanum Herreri Zeledon, Ponce & Murillo, 1979.
- Endotrypanum monterogeii Шоу, 1969 г.
- Endotrypanum Schaudinni Mesnil и Brimont, 1908 г.
Genus Novymonas Костыгов и Юрченко 2016
- Novymonas esmeraldas Votýpka, Kostygov, Maslov and Lukeš, 2016
Род Porcisia Shaw, Камарго и Тейшейра, 2016 г.
- Porcisia deanei Lainson & Shaw, 1977 г.
- Porcisia Hertigi Herrer, 1971 г.
Род Зелония Шоу, Камарго и Тейшейра, 2016 г.
- Zelonia australiensis Барратт, Кауфер, Питерс, Крейг, Лоуренс, Робертс, Ли, Маколифф, Старк, Эллис, 2017 г.
- Zelonia costaricensis Yurchenko, Lukes, Jirku, Zeledon, Maslov, 2006
Биохимия и клеточная биология
[ редактировать ]Биохимия и клеточная биология Leishmania аналогичны таковым у других кинетопластид . У них общие основные морфологические особенности: один жгутик с впячиванием - жгутиковым карманом - в основании; кинетопласт , который находится в одной митохондрии ; и субпеликулярный массив микротрубочек, которые составляют основную часть цитоскелета .
Липофосфогликановая оболочка
[ редактировать ]Leishmania имеет липофосфогликановую оболочку на внешней стороне клетки. Липофосфогликан является триггером toll-подобного рецептора 2 , сигнального рецептора, участвующего в запуске врожденного иммунного ответа у млекопитающих.
Точная структура липофосфогликана варьируется в зависимости от вида и стадии жизненного цикла паразита. Гликановый компонент особенно изменчив, и различные варианты липофосфогликанов можно использовать в качестве молекулярного маркера на разных стадиях жизненного цикла. Лектины , группа белков , которые связывают различные гликаны, часто используются для обнаружения этих вариантов липофосфогликанов. Например, агглютинин арахиса связывает особый липофосфогликан, обнаруженный на поверхности инфекционной формы L. major .
Липофосфогликан используется паразитом для обеспечения его выживания в хозяине, а механизмы, с помощью которых паразит делает это, сосредоточены вокруг модуляции иммунного ответа хозяина. Это жизненно важно, поскольку паразиты Leishmania живут внутри макрофагов и необходимо не допускать их уничтожения макрофагами. Липофосфогликан играет роль в сопротивлении системе комплемента , ингибировании реакции окислительного взрыва , индукции воспалительной реакции и предотвращении распознавания Т-клетками естественных киллеров , что макрофаги заражены паразитом Leishmania .
| Тип | Патоген | Расположение |
|---|---|---|
| Инфекции кожного лейшманиоза (локализованные и диффузные) проявляются как явные кожные реакции. | Наиболее распространенной является восточная язва (вызывается видами Старого Света L. major , L. tropica и L. aethiopica ). В Новом Свете наиболее частым виновником является L. mexicana . | Кожные инфекции наиболее распространены в Афганистане , Бразилии , Иране , Перу , Саудовской Аравии и Сирии . |
| Заражение слизисто-кожным лейшманиозом начинается как реакция на укус, может метастазировать в слизистую оболочку и привести к летальному исходу. | Л. бразильский | Слизисто-кожные инфекции наиболее распространены в Боливии , Бразилии и Перу . Слизисто-кожные инфекции также обнаружены в Карамае , Китай, Синьцзян-Уйгурский автономный район. |
| Заражение висцеральным лейшманиозом часто распознается по лихорадке, отеку печени и селезенки и анемии . Они известны под многими местными названиями, из которых наиболее распространенным, вероятно, является Кала Азар . [34] [35] | Вызывается исключительно видами комплекса L. donovani ( L. donovani , L. infantum syn. L. chagasi ). [2] | Висцеральные инфекции встречаются в тропических и субтропических районах всех континентов, кроме Австралии . Наиболее распространены висцеральные инфекции в Бангладеш , Бразилии , Индии , Непале и Судане . [2] Висцеральный лейшманиоз также встречается в некоторых частях Китая, таких как провинции Сычуань, провинция Ганьсу и Синьцзян-Уйгурский автономный район. |
Внутриклеточный механизм заражения
[ редактировать ]Чтобы избежать разрушения иммунной системой и процветать, лейшмания «прячется» внутри клеток хозяина. Такое расположение позволяет ему избежать действия гуморального иммунного ответа (поскольку возбудитель безопасно находится внутри клетки и вне открытого кровотока), и, кроме того, оно может препятствовать разрушению иммунной системой хозяина посредством неопасных поверхностных сигналов, которые препятствуют апоптозу . Первичными типами клеток инфильтратов Leishmania являются фагоцитирующие клетки, такие как нейтрофилы и макрофаги . [36]
Обычно фагоцитирующая иммунная клетка, такая как макрофаг, поглощает патоген внутри закрытой эндосомы , а затем наполняет эту эндосому ферментами, которые переваривают патоген. Однако в случае с Leishmania эти ферменты не оказывают никакого действия, позволяя паразиту быстро размножаться. Этот неограниченный рост паразитов в конечном итоге подавляет макрофаги хозяина или другие иммунные клетки, вызывая их гибель. [37]
Передаваемые москитами , простейшие паразиты L. могут major переключать стратегию первой иммунной защиты с поедания/воспаления/убийства на поедание/отсутствие воспаления/отсутствие уничтожения фагоцита хозяина и повреждать его ради собственной выгоды. [ нужна ссылка ] Они тщательно используют охотно фагоцитирующие полиморфноядерные нейтрофильные гранулоциты (ПМН) в качестве хитрого укрытия, где они размножаются, не распознаваемые иммунной системой, и проникают в долгоживущие макрофаги , чтобы установить «скрытую» инфекцию . [ нужна ссылка ]
Поглощение и выживание
[ редактировать ]
При микробном заражении ПМЯ выходят из кровотока через эндотелиальный слой сосудов к месту инфицированной ткани (кожной ткани после укуса мухи). Они немедленно инициируют первый иммунный ответ и фагоцитируют захватчика, распознавая чужеродные и активирующие поверхности паразита. Активированные ПМН секретируют хемокины , в частности IL-8 , для привлечения дополнительных гранулоцитов и стимуляции фагоцитоза. Кроме того, L. major увеличивает секрецию IL-8 ПМН. Этот механизм наблюдается при заражении другими облигатными внутриклеточными паразитами и . Для подобных микробов существует множество внутриклеточных механизмов выживания. Удивительно, но совместная инъекция апоптотических и жизнеспособных патогенов вызывает гораздо более молниеносное течение заболевания, чем инъекция только жизнеспособных паразитов. Когда противовоспалительный сигнал фосфатидилсерин, обычно обнаруживаемый на апоптотических клетках, оказывается на поверхности мертвых паразитов, L. major выключает окислительный взрыв , тем самым предотвращая уничтожение и деградацию жизнеспособного патогена.
В случае Leishmania потомство не генерируется в ПМЯ, но таким образом оно может выжить и персистировать незапутанным в первичном очаге инфекции. Формы промастигот также высвобождают хемотаксический фактор Leishmania (LCF) для активного рекрутирования нейтрофилов, но не других лейкоцитов , например моноцитов или NK-клеток . выработка индуцируемого интерфероном гамма блокируется В дополнение к этому, при лейшмании (IFNγ) белка 10 (IP10) PMN , что включает в себя прекращение воспалительного и защитного иммунного ответа за счет рекрутирования NK и Th1 клеток . Патогены остаются жизнеспособными во время фагоцитоза, поскольку их первичные хозяева, PMN, обнаруживают молекулярный паттерн, ассоциированный с апоптотическими клетками (ACAMP), сигнализирующий об отсутствии патогена.
Настойчивость и привлекательность
[ редактировать ]Продолжительность жизни нейтрофильных гранулоцитов довольно коротка. Они циркулируют в кровотоке в течение примерно 6-10 часов после выхода из костного мозга , после чего подвергаются спонтанному апоптозу . Сообщалось, что микробные патогены влияют на клеточный апоптоз различными способами. Очевидно, что за счет ингибирования активации каспазы 3 L. major может вызывать задержку апоптоза нейтрофилов и продлевать их продолжительность жизни как минимум на 2–3 дня. Факт увеличения продолжительности жизни очень благоприятен для развития инфекции, поскольку конечными клетками-хозяевами этих паразитов являются макрофаги, которые обычно мигрируют к местам заражения в течение двух-трех дней. Возбудители не являются дряблыми; вместо этого они берут на себя командование в первичном очаге заражения. Они индуцируют выработку PMN хемокинов MIP-1α и MIP-1β ( воспалительный белок макрофагов ) для рекрутирования макрофагов. [38]
Важным фактором продления инфекции является угнетение адаптивной иммунной системы . Это происходит особенно во время межклеточных фаз, когда амастиготы ищут новые макрофаги для заражения и более восприимчивы к иммунным ответам. Целевыми объектами являются почти все типы фагоцитов . [39] Например, было показано, что минкл является целью L. major . Взаимодействие минкла с белком, выделяемым паразитом, приводит к ослаблению иммунного ответа в дендритных клетках . [40]
Теория тихого фагоцитоза
[ редактировать ]Чтобы сохранить целостность окружающей ткани от токсичных клеточных компонентов и протеолитических ферментов, содержащихся в нейтрофилах, апоптотические ПМН незаметно очищаются макрофагами. Умирающие ПМЯ обнажают сигнал фосфатидилсерин «съешь меня» , который переносится на внешний листок плазматической мембраны во время апоптоза. Благодаря отсроченному апоптозу паразиты, персистирующие в ПМЯ, поглощаются макрофагами, используя абсолютно физиологический и невоспалительный процесс. Стратегия такого «тихого фагоцитоза» имеет для паразита следующие преимущества:
- Поглощение апоптотических клеток подавляет активность уничтожения макрофагов, что приводит к выживанию патогенов.
- Патогены внутри ПМЯ не имеют прямого контакта с поверхностными рецепторами макрофагов , поскольку они не могут видеть паразита внутри апоптотической клетки. Итак, активации фагоцита для иммунной активации не происходит.
Однако исследования показали, что это маловероятно, поскольку видно, что патогены покидают апотопные клетки, и нет никаких доказательств захвата макрофагов этим методом.
Молекулярная биология
[ редактировать ]Важным аспектом простейших Leishmania является гликоконъюгатный слой липофосфогликана (LPG). Он удерживается вместе с помощью фосфоинозитидного мембранного якоря и имеет трехчастную структуру, состоящую из липидного домена, нейтрального гексасахарида и фосфорилированной галактозо-маннозы с окончанием в нейтральном конце. Эти паразиты не только развивают постфлеботомное пищеварение, но также считается, что оно необходимо для окислительных всплесков, обеспечивая тем самым проход инфекции. Характеристики внутриклеточного пищеварения включают слияние эндосомы с лизосомой , высвобождение кислых гидролаз , которые разрушают ДНК , РНК , белки и углеводы .
Геномика
[ редактировать ]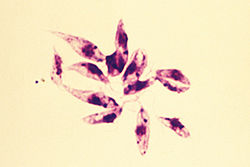
Геномы четырех видов Leishmania ( L. major , L. infantum , L. donovani и L. braziliensis ) были секвенированы, в результате чего было выявлено более 8300 кодирующих белок и 900 генов РНК . Почти 40% генов, кодирующих белки, относятся к 662 семействам, содержащим от двух до 500 членов. Большинство меньших семейств генов представляют собой тандемные массивы из одного-трех генов, в то время как более крупные семейства генов часто рассредоточены в тандемных массивах в разных локусах по всему геному . Каждая из 35 или 36 хромосом организована в небольшое количество кластеров генов, состоящих из десятков или сотен генов на одной и той же цепи ДНК. Эти кластеры могут быть организованы по принципу «голова к голове» (дивергентная) или «хвост к хвосту» (конвергентная), причем последние часто разделены генами тРНК , рРНК и/или мяРНК . Транскрипция генов, кодирующих белок, начинается двунаправленно в расходящихся областях переключения цепи между кластерами генов и распространяется полицистронно через каждый кластер генов, а затем заканчивается в области переключения цепи, разделяющей конвергентные кластеры. Leishmania Теломеры обычно относительно небольшие и состоят из нескольких типов повторяющихся последовательностей. Можно найти доказательства рекомбинации между несколькими различными группами теломер. Геномы L. major и L. infantum содержат только около 50 копий неактивных дегенерированных Ingi /L1Tc-родственных элементов (DIRE), тогда как L. braziliensis также содержит несколько связанных с теломерами мобильных элементов и сплайсированных ретроэлементов, связанных с лидером. Геномы Leishmania имеют общий консервативный основной протеом, состоящий примерно из 6200 генов, с родственными трипаносоматидами Trypanosoma brucei и Trypanosoma cruzi около 1000 специфичных для Leishmania , но известно существует относительно мало (около 200) видоспецифичных различий в содержании генов генов, которые в основном распределены по геному случайным образом. Между тремя секвенированными геномами Leishmania , но около 8% генов, по-видимому, развиваются с разной скоростью между тремя видами, что указывает на различное селективное давление, которое может быть связано с патология заболевания. Около 65% генов, кодирующих белки, в настоящее время не имеют функционального назначения. [3]
Виды Leishmania производят несколько различных белков теплового шока . К ним относятся Hsp83, гомолог Hsp90 . Регуляторный элемент в 3'-UTR Hsp83 контролирует трансляцию Hsp83 термочувствительным образом. Эта область образует стабильную структуру РНК , которая плавится при более высоких температурах. [41]
Геномная нестабильность
[ редактировать ]У Leishmania отсутствует промотор-зависимая регуляция, поэтому ее геномная регуляция осуществляется на посттранскрипционном уровне посредством вариаций числа копий (CNV) транскриптов - механизма, способного контролировать количество этих транскриптов в зависимости от ситуации, в которой оказывается организм. Эти процессы вызывают большую восприимчивость паразита к геномной нестабильности. Это включает в себя эпистатические взаимодействия между генами, которые приводят к этим изменениям в экспрессии генов, что приводит к компенсаторным механизмам в геноме Leishmania , которые приводят к адаптивной эволюции паразита.В ходе исследования, проведенного Джованни Буссотти и его сотрудниками в Институте Пастера при Парижском университете, полногеномное исследование ассоциаций ( GWAS ) Leishmania donovani выявило CNV в 14% кодирующих областей и в 4% некодирующих областей. -кодирование регионов. Кроме того, было проведено экспериментальное эволюционное исследование (EE Approach) на амастиготах L. donovani, полученных из клинических случаев хомяков. Извлекая эти амастиготы из инфицированных организмов и культивируя их in vitro в течение 36 недель (3800 поколений), было продемонстрировано, как нестабильность генома этого паразита способна адаптироваться к сложным ситуациям, таким как культура in vitro.Делеция размером 11 КБ была обнаружена в гене, кодирующем Ld1S_360735700, NIMA-родственная киназа с ключевыми функциями в правильном развитии митоза. С развитием поколений культуры in vitro потеря киназы становится все более известной, что снижает скорость роста паразита, но геномная нестабильность Leishmania позволяет посредством компенсаторных механизмов ослабить это снижение роста, так что культура in vitro сохраняется. . Во-первых, в качестве адаптации культуры к потере этой киназы было обнаружено увеличение экспрессии другой ортологичной киназы (Ld1S_360735800), кодирующая область которой примыкает к кодирующей области потерянной киназы. снижение экспрессии 23 транскриптов, связанных с биогенезом жгутиков Во-вторых, наблюдалось . Так адаптация у Leishmania приводит к тому, что паразит устраняет движение жгутика из своих нужд, поскольку в культуре in vitro оно не является необходимым, сохраняя затраченную на это движение энергию для увеличения скорости роста и компенсации потери киназы.Наконец, коамплификация кластеров рибосомальных белков, рибосомальная РНК (рРНК), транспортная РНК (тРНК) и малая ядрышковая РНК наблюдались (мяРНК). Повышенная экспрессия этих кластеров приводит к усилению рибосомального биогенеза и биосинтеза белка. Наиболее очевидно это в случае малых ядрышковых РНК (мякРНК), для которых на хромосоме 33 наблюдалась амплификация большого кластера из 15 мякРНК. Функция этих нуклеиновых кислот — метилирование и включение псевдоуридина в рибосомы. При этом усиление этих модификаций наблюдалось в крупных субъединицах рибосом индивидуумов в культуре, в частности в ПТК ( пептидилтрансферазном центре) и в туннеле входа мРНК в рибосому для синтеза белка. Эти изменения приводят к усилению биогенеза рибосом, что приводит к увеличению синтеза белка и скорости роста.В заключение, потеря киназы компенсируется геномной нестабильностью Leishmania donovani за счет увеличения экспрессии другой ортологичной киназы, снижения жгутикового биогенеза и увеличения рибосомального биогенеза. Эти компенсации приводят к тому, что первоначальная потеря киназы в минимальной степени влияет на скорость роста культуры, и паразит прекрасно адаптируется к культуре in vitro, которая не является его естественной средой обитания. [42]
Половое размножение
[ редактировать ]Репродуктивная система микробного возбудителя является одним из основных биологических процессов, обуславливающих экологию микроорганизма и распространение болезней. [43] В 2009 г. Акопьянц и др. [44] продемонстрировали, что у L. major имеется половой цикл, включающий мейотический процесс. Формируется гибридное потомство, имеющее полный геномный набор от обоих родителей. Спаривание происходит только у переносчиков москитов , а гибриды могут передаваться хозяину-млекопитающему через укус москитов. У L. braziliensis спаривания в природе происходят преимущественно между родственными особями, что приводит к крайнему инбридингу. [45] Скорость ауткроссинга между различными штаммами Leishmania среди переносчиков москитов зависит от частоты коинфекции. Такие случаи ауткроссинга, по-видимому, редки для L. major. [44] и Л. Доновани . [46]
L. infantum продуцирует белки BRCA1 и RAD51, которые взаимодействуют друг с другом, способствуя гомологичной рекомбинационной репарации. [47] Эти белки играют ключевую роль в мейозе. Таким образом, мейотические события обеспечивают адаптивное преимущество эффективной рекомбинационной репарации повреждений ДНК, даже если они не приводят к ауткроссингу. [48]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ «лейшмания». Словарь Чемберса (9-е изд.). Чемберс. 2003. ISBN 0-550-10105-5 .
- ^ Jump up to: а б с Райан К.Дж.; Рэй К.Г. (редакторы) (2004). Медицинская микробиология Шерриса (4-е изд.). МакГроу Хилл. стр. 749–54. ISBN 0-8385-8529-9 .
{{cite book}}:|author=имеет общее имя ( справка ) CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Jump up to: а б Майлер П; Фазель Н. (редакторы) (2008). Лейшмания: после генома . Кайстер Академик Пресс. ISBN 978-1-904455-28-8 .
{{cite book}}:|author=имеет общее имя ( справка ) CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Ансари М.Ю., Экубал А., Дихит М.Р., Мансури Р., Рана С., Али В., Саху Г.К., Дас П. (ноябрь 2015 г.). «Установление корреляции между анализом испытаний in-silico и in-vitro против Leishmania HGPRT и ингибиторов». Международный журнал биологических макромолекул . 83 : 78–96. doi : 10.1016/j.ijbiomac.2015.11.051 . ПМИД 26616453 .
- ^ ВОЗ (2010) Годовой отчет. Женева
- ^ Пойнар, Г. (2008). «Lutzomyia adiketis sp. n. (Diptera: Phlebotomidae), переносчик Paleoleishmania neotropicum sp. n. (Kinetoplastida: Trypanosomatidae) в доминиканском янтаре» . Векторы паразитов . 1 (1): 2. дои : 10.1186/1756-3305-1-22 . ПМК 2491605 . ПМИД 18627624 .
- ^ Кокс, Ф.Е.Г (2002). «История паразитологии человека» . Обзоры клинической микробиологии . 15 (4): 595–612. doi : 10.1128/CMR.15.4.595-612.2002 . ПМК 126866 . ПМИД 12364371 .
- ^ Яник, М.; и др. (2004). «Психологическое воздействие кожного лейшманиоза». Клиническая и экспериментальная дерматология . 29 (5): 464–467. дои : 10.1111/j.1365-2230.2004.01605.x . ПМИД 15347324 . S2CID 11543741 .
- ^ Тхакур, Ловлеш; Сингх, Киран К.; Шанкер, Винай; Неги, Аджит; Джайн, Акланк; Матлашевски, Грег; Джайн, Манджу (2018). «Атипичный лейшманиоз: глобальная перспектива с акцентом на Индийский субконтинент» . PLOS Забытые тропические болезни . 12 (9): e0006659. дои : 10.1371/journal.pntd.0006659 . ISSN 1935-2735 . ПМК 6159859 . ПМИД 30260957 .
- ^ Тхакур, Ловлеш; Сингх, Киран К.; Кушваха, Хемант Р.; Шарма, Сударшан К.; Шанкар, Винай; Неги, Аджит; Верма, Ганшьям; Кумари, Сандхья; Джайн, Акланк; Джайн, Манджу (2020). «Инфекция Leishmania donovani с атипичными кожными проявлениями, Химачал-Прадеш, Индия, 2014-2018 гг.» . Новые инфекционные заболевания . 26 (8): 1864–1869. дои : 10.3201/eid2608.191761 . ISSN 1080-6059 . ПМК 7392404 . ПМИД 32687048 .
- ^ Стевердинг, Дитмар (2017). «История лейшманиоза» . Паразиты и переносчики . 10 (1): 82. дои : 10.1186/s13071-017-2028-5 . ISSN 1756-3305 . ПМЦ 5312593 . ПМИД 28202044 .
- ^ Кокс, Фрэнсис Э.Г. (2017). «Золотой век паразитологии-1875-1925: вклад Шотландии» . Паразитология . 144 (12): 1567–1581. дои : 10.1017/S0031182016001566 . ISSN 1469-8161 . ПМИД 27628769 . S2CID 30381476 .
- ^ Jump up to: а б Мэтисон, Блейн А.; Брэдбери, Ричард С.; Притт, Бобби С. (2021). «Обновление таксономии медицинской паразитологии, с января 2018 г. по май 2020 г.» . Журнал клинической микробиологии . 59 (2): e01308–20. дои : 10.1128/JCM.01308-20 . ISSN 1098-660X . ПМЦ 8111142 . ПМИД 33028601 .
- ^ «Морфология и жизненный цикл» . Калифорнийский университет в Лос-Анджелесе . Проверено 24 января 2014 г.
- ^ Пульвертафт, Р.Дж.; Хойл, Г.Ф. (1960). «Этапы жизненного цикла Leishmania donovani». Труды Королевского общества тропической медицины и гигиены . 54 (2): 191–6. дои : 10.1016/0035-9203(60)90057-2 . ПМИД 14435316 .
- ^ Хьюз, Алабама; Пионтковская, Х (2003). «Филогения Trypanosomatidae и Bodonidae (Kinetoplastida) на основе 18S рРНК: доказательства парафилии Trypanosoma и шести других родов» . Мол Биол Эвол . 20 (4): 644–652. дои : 10.1093/molbev/msg062 . ПМИД 12679543 .
- ^ Момен Х, Куполилло Э (2000). «Рассуждения о происхождении и эволюции рода Leishmania» . Память Инст. Освальдо Круз . 95 (4): 583–8. дои : 10.1590/S0074-02762000000400023 . ПМИД 10904419 .
- ^ Нойес Х.А., Моррисон Д.А., Ченс М.Л., Эллис Дж.Т. (2000). «Доказательства неотропического происхождения лейшмании» . Память Инст. Освальдо Круз . 95 (4): 575–8. дои : 10.1590/S0074-02762000000400021 . ПМИД 10904417 .
- ^ Керр С.Ф. (2000). «Палеарктическое происхождение лейшмании» . Память Инст. Освальдо Круз . 95 (1): 75–80. дои : 10.1590/S0074-02762000000100011 . ПМИД 10656708 .
- ^ Кульс, Катрин; Алам, Мохаммад Захангир; Куполильо, Элиза; Феррейра, Габриэль Эдуардо М.; Маурисио, Изабель Л.; Оддоне, Роландо; Фелисианжели, М. Дора; Вирт, Тьерри; Майлз, Майкл А.; Шёниан, Габриэле; Камхави, Шаден (7 июня 2011 г.). «Сравнительное микросателлитное типирование Leishmania infantum Нового Света показывает низкую гетерогенность популяций и ее недавнее происхождение из Старого Света» . PLOS Забытые тропические болезни . 5 (6): е1155. дои : 10.1371/journal.pntd.0001155 . ПМК 3110170 . PMID 21666787 .
- ^ Дюпри, З.Х.; Стирер, Ф.Дж.; Руни, Дж.А.; Кирхгоф, Л.В.; Джексон, Дж. Э.; Роутон, Эд; Шанц, премьер-министр (2006). «Висцеральный лейшманиоз собак, США и Канада, 2000–2003 гг.» . Новые инфекционные заболевания . 12 (3): 440–446. дои : 10.3201/eid1203.050811 . ПМК 3291440 . ПМИД 16704782 .
- ^ Нойес, ХА; Арана, бакалавр; Шанс, МЛ; Менгон, Р. (1997). « Комплекс Leishmania hertigi (Kinetoplastida; Trypanosomatidae) и ящерица Leishmania : их классификация и доказательства неотропического происхождения клады Leishmania - Endotrypanum ». J Эукариотная микробиол . 44 (5): 511–557. дои : 10.1111/j.1550-7408.1997.tb05732.x . ПМИД 9304821 . S2CID 27460253 .
- ^ Харкинс, Келли М; Шварц, Рэйчел С; Картрайт, Рид А; Стоун, Энн С. (2016). «Филогеномная реконструкция подтверждает происхождение лейшмании на суперконтиненте» . Инфекция, генетика и эволюция . 38 : 101–9. дои : 10.1016/j.meegid.2015.11.030 . ПМИД 26708057 .
- ^ Кроан, Дэвид Дж; Моррисон, Дэвид А; Эллис, Джон Т. (1997). «Эволюция рода Leishmania, выявленная путем сравнения последовательностей генов ДНК и РНК-полимеразы». Молекулярная и биохимическая паразитология . 89 (2): 149–59. дои : 10.1016/S0166-6851(97)00111-4 . ПМИД 9364962 .
- ^ Дженнингс, ЮЛ; де Соуза, ААА; Исикава, Э.А.; Шоу, Дж.; Лейнсон, Р.; Сильвейра, Ф. (2014). «Фенотипическая характеристика видов Leishmania , вызывающих кожный лейшманиоз в нижней части Амазонки, западный штат Пара, Бразилия, выявила предполагаемого гибридного паразита Leishmania (Viannia) Guyanensis × Leishmania (Viannia) shawi shawi » . Паразит . 21:39 . doi : 10.1051/parasite/2014039 . ПМК 4118625 . ПМИД 25083790 .
- ^ Эспиноза, ОА; Серрано, МГ; Камарго, EP; ММГ, Тейшейра; Джей Джей, Шоу (2016). «Оценка таксономии и номенклатуры трипаносоматид, которые в настоящее время классифицируются как Leishmania и Endotrypanum ». Паразитология . 145 (4): 430–442. дои : 10.1017/S0031182016002092 . ПМИД 27976601 . S2CID 41544524 .
- ^ Франко, AM; Гримальди, Дж. Младший (1999). «Характеристика Endotrypanum (Kinetoplastida: Trypanosomatidae), уникального паразита, поражающего неотропических древесных ленивцев (Edentata)» . Мем Инст Освальдо Круз . 94 (2): 261–268. дои : 10.1590/s0074-02761999000200026 . ПМИД 10224540 .
- ^ Момен, Х; Куполильо, Э (2000). «Рассуждения о происхождении и эволюции рода Leishmania » . Мем Инст Освальдо Круз . 95 (4): 583–588. дои : 10.1590/s0074-02762000000400023 . ПМИД 10904419 .
- ^ Джарияпан, Н.; Дарунтум, Т; Джайвонг, К; Чанмол, Ж; Интахан, Н; Сор-Суван, С; Сириясатиен, П; Сомбун, П; Бейтс, доктор медицины; Бейтс, Пенсильвания (2018). « Leishmania (Mundinia) orientalis n. sp. (Trypanosomatidae), паразит из Таиланда, вызывающий локализованный кожный лейшманиоз» . Векторы паразитов . 11 (1): 351. doi : 10.1186/s13071-018-2908-3 . ПМК 6006788 . ПМИД 29914526 .
- ^ Бонилья, Мариана; Крулл, Эрика; Иригоин, Флоренция; Салинас, Густаво; Комини, Марсело А. (2016). «Селенопротеины африканских трипаносом незаменимы для выживания паразита у млекопитающего-хозяина». Молекулярная и биохимическая паразитология . 206 (1–2): 13–19. дои : 10.1016/j.molbiopara.2016.03.002 . ПМИД 26975431 .
- ^ Дебуа, Николь; Пратлонг, Франсин; Квист, Даниэль; Деде, Жан-Пьер (2014). « Leishmania (Leishmania) martiniquensis n. sp. (Kinetoplastida: Trypanosomatidae), описание паразита, вызывающего кожный лейшманиоз на острове Мартиника (Французская Вест-Индия)» . Паразит . 21:12 . doi : 10.1051/parasite/2014011 . ISSN 1776-1042 . ПМЦ 3952653 . ПМИД 24626346 .

- ^ Эспиноза, ОА; Серрано, МГ; Камарго, EP; Тейшейра, ММГ; Шоу, Джей-Джей (2018). «Оценка таксономии и номенклатуры трипаносоматид, которые в настоящее время классифицируются как Leishmania и Endotrypanum» . Паразитология . 145 (4): 430–442. дои : 10.1017/S0031182016002092 . ISSN 1469-8161 . ПМИД 27976601 . S2CID 41544524 .
- ^ Родригес-Бонфанте, Клаудина; Бонфанте-Гарридо, Рафаэль; Гримальди, Габриэль; Момен, Хуман; Куполильо, Элиза (2003). «Генотипически различные изоляты Leishmania colombiensis из Венесуэлы вызывают у людей как кожный, так и висцеральный лейшманиоз» . Инфекция, генетика и эволюция: журнал молекулярной эпидемиологии и эволюционной генетики инфекционных заболеваний . 3 (2): 119–124. дои : 10.1016/s1567-1348(03)00012-1 . ISSN 1567-1348 . ПМИД 12809806 .
- ^ Висцеральный лейшмниоз: болезнь. Архивировано 28 апреля 2005 г. в Wayback Machine.
- ^ Кала-азар. Архивировано 10 февраля 2009 г. в Wayback Machine . Словарь английского языка американского наследия
- ^ Ваннье-Сантос, Массачусетс; Мартини А; де Соуза В. (август 2002 г.). «Клеточная биология видов Leishmania: вторжение и уклонение». Текущий фармацевтический дизайн . 8 (4): 297–318. дои : 10.2174/1381612023396230 . ПМИД 11860368 .
- ^ Пол, Уильям Э. (сентябрь 1993 г.). «Инфекционные болезни и иммунная система». Научный американец . 269 (3): 94–95. Бибкод : 1993SciAm.269c..90P . doi : 10.1038/scientificamerican0993-90 . ПМИД 8211095 .
- ^ Ласкай Т. и др. (2003). «Нейтрофильные гранулоциты – троянские кони для Leishmania major и других внутриклеточных микробов?». Тенденции в микробиологии . 11 (5): 210–4. дои : 10.1016/S0966-842X(03)00075-1 . ПМИД 12781523 .
- ^ Мартинес-Лопес М. и др. (2018). «Лейшмания захватывает миелоидные клетки для спасения иммунитета» . Границы микробиологии . 9 : 883. дои : 10.3389/fmicb.2018.00883 . ПМЦ 5949370 . ПМИД 29867798 .
- ^ Иборра С. и др. (2016). «Leishmania использует Mincle для воздействия на ингибирующий сигнальный путь ITAM в дендритных клетках, который ослабляет адаптивный иммунитет к инфекции» . Иммунитет . 45 (4): 788–801. doi : 10.1016/j.immuni.2016.09.012 . ПМК 5074365 . ПМИД 27742545 .
- ^ Дэвид, М; Габданк, я; Бен-Давид, М; Зилка, А; Орр, я; Бараш, Д; Шапира, М. (февраль 2010 г.). «Предпочтительная трансляция Hsp83 у Leishmania требует термочувствительного элемента, богатого полипиримидином, в 3'-UTR и включает сканирование 5'-UTR» . РНК . 16 (2): 364–74. дои : 10.1261/rna.1874710 . ПМЦ 2811665 . ПМИД 20040590 .
- ^ Буссотти, Джованни; Пиль, Лаура; Пешер, Паскаль; Домагальска, Малгожата А.; Раджан, К. Шанмуга; Коэн-Чаламиш, Смадар; Донигер, Тирза; Хиреганге, Диша-Гаджанан; Майлер, Питер Дж.; Унгер, Рон; Михаэли, Суламит; Шпет, Джеральд Ф. (21 декабря 2021 г.). «Нестабильность генома стимулирует эпистатическую адаптацию человеческого патогена Leishmania» . Труды Национальной академии наук . 118 (51): e2113744118. Бибкод : 2021PNAS..11813744B . дои : 10.1073/pnas.2113744118 . ISSN 0027-8424 . ПМЦ 8713814 . ПМИД 34903666 .
- ^ Ружерон В., Де Меес Т., Како Урага С., Хиде М., Баньюлс А.Л. (2010). « Все, что вы всегда хотели знать о сексе (но боялись спросить)» в Лейшмании после двух десятилетий лабораторных и полевых анализов» . ПЛОС Патог . 6 (8): e1001004. дои : 10.1371/journal.ppat.1001004 . ПМЦ 2924324 . ПМИД 20808896 .
- ^ Jump up to: а б Акопьянц Н.С., Кимблин Н., Секундино Н., Патрик Р., Питерс Н., Юрист П., Добсон Д.Е., Беверли С.М., Сакс Д.Л. (апрель 2009 г.). «Демонстрация генетического обмена во время циклического развития Leishmania у переносчика москитов» . Наука . 324 (5924): 265–8. Бибкод : 2009Sci...324..265A . дои : 10.1126/science.1169464 . ПМК 2729066 . ПМИД 19359589 .
- ^ Ружерон В., Де Меес Т., Хиде М., Валек Э., Бермудес Х., Аревало Х., Льянос-Куэнтас А., Дюжарден Х.К., Де Донкер С., Ле Рэй Д., Аяла Ф.Дж., Баньюлс А.Л. (июнь 2009 г.). «Чрезвычайный инбридинг у Leishmania braziliensis» . Учеб. Натл. Воскресенье. Лыжи. США . 106 (25): 10224–9. Бибкод : 2009PNAS..10610224R . дои : 10.1073/pnas.0904420106 . ПМК 2700931 . ПМИД 19497885 .
- ^ Роджерс М.Б., Даунинг Т., Смит Б.А., Имамура Х., Сандерс М., Свободова М., Вольф П., Берриман М., Коттон Дж.А., Смит Д.Ф. (январь 2014 г.). «Геномное подтверждение гибридизации и недавнего инбридинга в изолированной от вектора популяции Leishmania» . ПЛОС Генет . 10 (1): e1004092. дои : 10.1371/journal.pgen.1004092 . ПМЦ 3894156 . ПМИД 24453988 .
- ^ Женуа М.М., Мукерджи А., Убеда Дж.М., Бюиссон Р., Пакет Э., Рой Г., Плурд М., Куломб Ю., Уэллетт М., Массон Дж.Ю. (август 2012 г.). «Взаимодействие между BRCA2 и RAD51 для содействия гомологичной рекомбинации у Leishmania infantum» . Нуклеиновые кислоты Рез . 40 (14): 6570–84. дои : 10.1093/нар/gks306 . ПМЦ 3413117 . ПМИД 22505581 .
- ^ Бернштейн Х., Байерли Х.К., Хопф Ф.А., Мишод Р.Э. Генетические повреждения, мутации и эволюция пола. Наука. 1985, 20 сентября; 229 (4719): 1277-81. doi: 10.1126/science.3898363. ПМИД 3898363
Дальнейшее чтение
[ редактировать ]- Ван Зандберген, Г; Боллинджер, А; Венцель, А; Камхави, С; Фолл, Р; Клингер, М; Мюллер, А; Холшер, К; Херрманн, М; Сакс, Д; Сольбах, В; Ласкай, Т (2006). «Развитие болезни лейшмании зависит от наличия апоптотических промастигот в вирулентном инокуляте» . Труды Национальной академии наук . 103 (37): 13837–42. Бибкод : 2006PNAS..10313837V . дои : 10.1073/pnas.0600843103 . ПМЦ 1564231 . ПМИД 16945916 .
- Шоу, Джеффри Джон (1969). Гемофлагелляты ленивцев . HK Lewis & Co. Ltd .: Лондон.
- Ансари М.Ю., Дихит М.Р., Саху Г.К., Дас П. (2012). «Сравнительное моделирование фермента HGPRT L. donovani и аффинности связывания различных аналогов GMP». Int J Biol Macromol . 50 (3): 637–49. doi : 10.1016/j.ijbiomac.2012.01.010 . ПМИД 22327112 .
Внешние ссылки
[ редактировать ]- дискуссионный список (Leish-L) Также доступен , на который подписано более 600 человек, от молекулярных биологов до работников общественного здравоохранения из многих стран, как внутри, так и за пределами эндемичных регионов. Комментарии и вопросы приветствуются.
- KBD: Кинетопластидная биология и болезни — веб-сайт, посвященный лейшманиозу, сонной болезни и болезни Шагаса (американский трипаносомоз). Он содержит бесплатный доступ к полнотекстовым рецензируемым статьям по этим темам. На сайте размещено множество статей об уникальной органелле кинетопластид и содержащемся в них генетическом материале.
- Поиск лекарств от лейшманиоза Сетка мирового сообщества