Врожденная иммунная система
Эту статью необходимо обновить . ( март 2024 г. ) |
Эта статья нуждается в дополнительных цитатах для проверки . ( март 2024 г. ) |

Врожденная иммунная система или неспецифическая иммунная система [1] — одна из двух основных стратегий иммунитета (вторая — адаптивная иммунная система ) у позвоночных . Врожденная иммунная система представляет собой альтернативную защитную стратегию и является доминирующей реакцией иммунной системы, обнаруженной у растений , грибов , прокариот и беспозвоночных (см. «За пределами позвоночных »). [2]
К основным функциям врожденной иммунной системы относятся:
- рекрутируют иммунные клетки в места заражения путем производства химических факторов, включая химические медиаторы, называемые цитокинами.
- активировать каскад комплемента для идентификации бактерий , активации клеток и содействия удалению комплексов антител или мертвых клеток
- выявлять и удалять инородные вещества, присутствующие в органах, тканях, крови и лимфе , с помощью специализированных лейкоцитов
- активировать адаптивную иммунную систему посредством презентации антигена
- действовать как физический и химический барьер для инфекционных агентов; посредством физических мер, таких как кожа и слизь, и химических мер, таких как факторы свертывания крови и защитные пептиды хозяина .
Анатомические барьеры
[ редактировать ]Анатомические барьеры включают физические, химические и биологические барьеры. Эпителиальные поверхности образуют физический барьер, непроницаемый для большинства инфекционных агентов, выступая в качестве первой линии защиты от вторгающихся организмов. [3] Десквамация (отторжение) эпителия кожи также помогает удалить бактерии и другие инфекционные агенты, прикрепившиеся к поверхности эпителия. Отсутствие кровеносных сосудов, неспособность эпидермиса удерживать влагу и наличие в дерме сальных желез создают среду, непригодную для выживания микробов . [3] В желудочно-кишечном и дыхательном путях движение за счет перистальтики или ресничек соответственно способствует удалению инфекционных агентов. [3] Кроме того, слизь задерживает инфекционные агенты. [3] Кишечная флора может предотвращать колонизацию патогенных бактерий, выделяя токсичные вещества или конкурируя с патогенными бактериями за питательные вещества или места прикрепления к поверхности клеток. [3] Промывание слез и слюны помогает предотвратить заражение глаз и рта. [3]
| Анатомический барьер | Дополнительные защитные механизмы |
|---|---|
| Кожа | Пот (в т.ч. дермцидин ), кателицидин , шелушение, гиперемия, [3] органические кислоты, [3] флора кожи |
| Желудочно-кишечный тракт | Перистальтика , желудочная кислота , желчные кислоты , пищеварительный фермент , промывка, тиоцианат , [3] дефензины , [3] хорошая флора , [3] лизоцимы |
| Дыхательные пути и легкие | мукоцилиарный эскалатор, [4] поверхностно-активное вещество , [3] дефенсины [3] |
| Носоглотка | Слизь, слюна, лизоцим [3] |
| Глаза | Слезы [3] |
| Гематоэнцефалический барьер | эндотелиальные клетки (путем пассивной диффузии / осмоса и активной селекции). P-гликопротеин (механизм, с помощью которого активный транспорт осуществляется ) |
Воспаление
[ редактировать ]Воспаление является одной из первых реакций иммунной системы на инфекцию или раздражение. Воспаление стимулируется химическими факторами, выделяемыми поврежденными клетками. Он создает физический барьер против распространения инфекции и способствует заживлению любых поврежденных тканей после устранения патогена. [5]
Процесс острого воспаления инициируется клетками, уже присутствующими во всех тканях, главным образом резидентными макрофагами , дендритными клетками , гистиоцитами , клетками Купфера и тучными клетками . Эти клетки представляют рецепторы, содержащиеся на поверхности или внутри клетки, называемые рецепторами распознавания образов (PRR), которые распознают молекулы, которые в целом являются общими для патогенов, но отличаются от молекул-хозяев, которые в совокупности называются молекулярными паттернами, связанными с патогенами (PAMP). В начале инфекции, ожога или других повреждений эти клетки подвергаются активации (один из их PRR распознает PAMP) и выделяют медиаторы воспаления , такие как цитокины и хемокины, которые ответственны за клинические признаки воспаления. Активация PRR и ее клеточные последствия хорошо охарактеризованы как методы воспалительной гибели клеток, которые включают пироптоз , некроптоз и PANоптоз . Эти пути гибели клеток помогают очистить инфицированные или аберрантные клетки и высвободить клеточное содержимое и медиаторы воспаления.
Химические факторы, образующиеся при воспалении ( гистамин , брадикинин , серотонин , лейкотриены и простагландины ), сенсибилизируют болевые рецепторы , вызывают местное расширение кровеносных сосудов и привлекают фагоциты, особенно нейтрофилы. [5] Затем нейтрофилы запускают другие части иммунной системы, высвобождая факторы, вызывающие дополнительные лейкоциты и лимфоциты. Цитокины , продуцируемые макрофагами и другими клетками врожденной иммунной системы, опосредуют воспалительную реакцию. Эти цитокины включают TNF , HMGB1 и IL-1 . [6]
Воспалительная реакция характеризуется следующими симптомами:
- покраснение кожи вследствие местного усиления кровообращения;
- жар, либо повышение местной температуры, например ощущение тепла вокруг локализованной инфекции, либо системная лихорадка ;
- отек пораженных тканей, например, верхней части горла при простуде или суставов, пораженных ревматоидным артритом ;
- повышенное выделение слизи, что может вызывать такие симптомы, как насморк или продуктивный кашель ;
- боль, либо локальная боль, например, болезненные суставы или боль в горле , либо затрагивающая все тело, например, боли в теле ; и
- возможны нарушения функции вовлеченных органов/тканей.
Система дополнений
[ редактировать ]Система комплемента представляет собой биохимический каскад иммунной системы, который помогает или «дополняет» способность антител уничтожать патогены или маркировать их для уничтожения другими клетками. Каскад состоит из множества белков плазмы, синтезируемых в печени , преимущественно гепатоцитами . Белки работают вместе, чтобы:
- вызвать рекрутирование воспалительных клеток
- «помечать» патогены для уничтожения другими клетками путем опсонизации или покрытия поверхности патогена.
- образуют отверстия в плазматической мембране возбудителя, что приводит к цитолизу клетки возбудителя, вызывая ее гибель
- избавить организм от нейтрализованных комплексов антиген-антитело.
Три различные системы комплемента — классическая, альтернативная и лектиновая.
- Классический: начинается, когда антитело связывается с бактерией.
- Альтернатива: запускается «спонтанно»
- Лектин: начинается, когда лектины связываются с маннозой на бактериях.
Элементы каскада комплемента можно обнаружить у многих видов немлекопитающих, включая растения , птиц , рыб и некоторые виды беспозвоночных . [7]
Белые кровяные тельца
[ редактировать ]
Белые кровяные тельца (лейкоциты) также известны как лейкоциты . Большинство лейкоцитов отличаются от других клеток организма тем, что они не связаны прочно с тем или иным органом или тканью; таким образом, их функция аналогична функции независимых одноклеточных организмов. Большинство лейкоцитов способны свободно перемещаться, взаимодействовать и захватывать клеточный мусор, чужеродные частицы и вторгающиеся микроорганизмы (хотя макрофаги , тучные клетки и дендритные клетки менее подвижны). В отличие от многих других клеток, большинство лейкоцитов врожденного иммунитета не могут делиться или размножаться самостоятельно, а являются продуктами мультипотентных гемопоэтических стволовых клеток, присутствующих в костном мозге . [8] [9]
К врожденным лейкоцитам относятся: естественные клетки-киллеры , тучные клетки, эозинофилы , базофилы ; Фагоцитирующие клетки включают макрофаги , нейтрофилы и дендритные клетки и функционируют в иммунной системе, выявляя и устраняя патогены, которые могут вызвать инфекцию. [2]
Тучные клетки
[ редактировать ]Тучные клетки — это тип врожденных иммунных клеток, которые находятся в соединительной ткани и слизистых оболочках. Они тесно связаны с заживлением ран и защитой от патогенов, но также часто связаны с аллергией и анафилаксией . [5] характерные гранулы, богатые гистамином и гепарином , а также различными гормональными медиаторами и хемокинами или хемотаксическими цитокинами При активации тучные клетки быстро выделяют в окружающую среду . Гистамин расширяет кровеносные сосуды , вызывая характерные признаки воспаления, и привлекает нейтрофилы и макрофаги. [5]
Фагоциты
[ редактировать ]Слово «фагоцит» буквально означает «пожирающая клетка». Это иммунные клетки, которые поглощают или « фагоцитируют » патогены или частицы. Чтобы поглотить частицу или патоген, фагоцит расширяет части своей плазматической мембраны , оборачивая мембрану вокруг частицы до тех пор, пока она не будет окутана (т. е. частица теперь не окажется внутри клетки). Попав внутрь клетки, вторгшийся патоген содержится внутри фагосомы , которая сливается с лизосомой . [2] Лизосома содержит ферменты и кислоты, которые убивают и переваривают частицу или организм. В целом фагоциты патрулируют организм в поисках патогенов, но также способны реагировать на группу узкоспециализированных молекулярных сигналов, вырабатываемых другими клетками, называемых цитокинами . Фагоцитирующие клетки иммунной системы включают макрофаги, нейтрофилы и дендритные клетки.
Фагоцитоз собственных клеток хозяина является обычным явлением как часть регулярного развития и поддержания тканей. Когда клетки-хозяева умирают либо в результате апоптоза , либо в результате повреждения клеток вследствие инфекции, фагоцитарные клетки несут ответственность за их удаление из пораженного участка. [9] Помогая удалить мертвые клетки, предшествующие росту и развитию новых здоровых клеток, фагоцитоз является важной частью процесса заживления после повреждения тканей.

Макрофаги
[ редактировать ]Макрофаги, от греческого слова, означающего «крупные едоки», представляют собой крупные фагоцитирующие лейкоциты, которые способны выходить за пределы сосудистой системы, мигрируя через стенки капиллярных сосудов и проникая в области между клетками в поисках вторгшихся патогенов. В тканях органоспецифические макрофаги дифференцируются от фагоцитирующих клеток, присутствующих в крови, называемых моноцитами . Макрофаги являются наиболее эффективными фагоцитами и могут фагоцитировать значительное количество бактерий или других клеток или микробов. [2] Связывание бактериальных молекул с рецепторами на поверхности макрофага заставляет его поглощать и уничтожать бактерии посредством генерации « дыхательного взрыва », вызывающего высвобождение активных форм кислорода . Патогены также стимулируют макрофаги вырабатывать хемокины, которые привлекают другие клетки к месту инфекции. [2]
Нейтрофилы
[ редактировать ]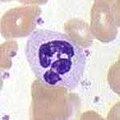
Нейтрофилы, наряду с эозинофилами и базофилами , известны как гранулоциты из-за наличия гранул в их цитоплазме или как полиморфно-ядерные клетки (ПМЯ) из-за их характерных дольчатых ядер . Гранулы нейтрофилов содержат множество токсичных веществ, которые убивают или подавляют рост бактерий и грибов. Подобно макрофагам, нейтрофилы атакуют патогены, активируя дыхательный взрыв . Основными продуктами респираторного взрыва нейтрофилов являются сильные окислители, в том числе перекись водорода , свободные радикалы кислорода и гипохлорит . Нейтрофилы представляют собой наиболее распространенный тип фагоцитов, обычно составляющие 50–60% от общего числа циркулирующих лейкоцитов, и обычно являются первыми клетками, прибывающими в место инфекции. [5] Костный мозг нормального здорового взрослого человека производит более 100 миллиардов нейтрофилов в день, а во время острого воспаления — более чем в 10 раз больше в день. [5]
Дендритные клетки
[ редактировать ]Дендритные клетки (ДК) — это фагоцитирующие клетки, присутствующие в тканях, контактирующих с внешней средой, главным образом в коже (где их часто называют клетками Лангерганса ), а также во внутренней слизистой оболочке носа , легких , желудка и кишечника . [9] Они названы так из-за сходства с нейронов дендритами , но дендритные клетки не связаны с нервной системой . Дендритные клетки играют очень важную роль в процессе презентации антигена и служат связующим звеном между врожденной и адаптивной иммунной системой .

Базофилы и эозинофилы
[ редактировать ]Базофилы и эозинофилы – это клетки, родственные нейтрофилам. Активируемые при встрече с патогеном базофилы, высвобождающие гистамин, играют важную роль в защите от паразитов и играют роль в аллергических реакциях , таких как астма . [2] При активации эозинофилы выделяют ряд высокотоксичных белков и свободных радикалов, которые очень эффективны в уничтожении паразитов, но могут также повредить ткани во время аллергической реакции. Таким образом, активация и высвобождение токсинов эозинофилами строго регулируются, чтобы предотвратить любое нежелательное разрушение тканей. [5]
Естественные клетки-киллеры
[ редактировать ]Естественные клетки-киллеры (NK-клетки) не атакуют напрямую вторгшиеся микробы. Скорее, NK-клетки уничтожают поврежденные клетки-хозяева, такие как опухолевые клетки или инфицированные вирусом клетки, распознавая такие клетки по состоянию, известному как «отсутствие себя». Этот термин описывает клетки с аномально низким уровнем маркера клеточной поверхности под названием MHC I ( главный комплекс гистосовместимости ) – ситуация, которая может возникнуть при вирусных инфекциях клеток-хозяев. [10] Их назвали «естественными киллерами» из-за первоначального представления о том, что им не требуется активация, чтобы убить клетки, «лишенные себя». Состав MHC на поверхности поврежденных клеток изменяется, и NK-клетки активируются, распознавая это. Нормальные клетки организма не распознаются и не подвергаются атаке NK-клеток, поскольку они экспрессируют интактные собственные антигены MHC. Эти антигены MHC распознаются рецепторами иммуноглобулинов киллеров (KIR), которые замедляют реакцию NK-клеток. Клеточная линия NK -92 не экспрессирует KIR и разработана для терапии опухолей. [11] [12] [13] [14]
γδ Т-клетки
[ редактировать ]Подобно другим «нетрадиционным» подмножествам Т-клеток, несущим инвариантные Т-клеточные рецепторы (TCR), таким как CD1d -рестриктированные Т-клетки естественных киллеров , γδ Т-клетки обладают характеристиками, которые ставят их на границу между врожденным и адаптивным иммунитетом. γδ Т-клетки можно рассматривать как компонент адаптивного иммунитета , поскольку они перестраивают гены TCR памяти для создания разнообразия соединений и развития фенотипа . Различные подгруппы можно рассматривать как часть врожденной иммунной системы, где ограниченные рецепторы TCR или NK могут использоваться в качестве рецепторов распознавания образов . Например, согласно этой парадигме, большое количество Т-клеток Vγ9/Vδ2 в течение нескольких часов реагируют на обычные молекулы, продуцируемые микробами, а сильно ограниченные внутриэпителиальные Т-клетки Vδ1 будут реагировать на стрессированные эпителиальные клетки.
Другие механизмы позвоночных
[ редактировать ]Система свертывания крови пересекается с иммунной системой. Некоторые продукты свертывающей системы могут способствовать неспецифической защите благодаря своей способности увеличивать проницаемость сосудов и действовать как хемотаксические агенты для фагоцитирующих клеток . Кроме того, некоторые продукты свертывающей системы обладают непосредственным противомикробным действием . Например, бета-лизин , белок, вырабатываемый тромбоцитами во время коагуляции , может вызывать лизис многих грамположительных бактерий , действуя как катионный детергент. [3] многие острой фазы воспаления белки В свертывающую систему вовлечены .
Повышенные уровни лактоферрина и трансферрина подавляют рост бактерий, связывая железо, важное питательное вещество для бактерий. [3]
Нейронная регуляция
[ редактировать ]Врожденный иммунный ответ на инфекционное и стерильное повреждение модулируется нервными цепями, которые контролируют период продукции цитокинов. представляет Воспалительный рефлекс собой прототип нейронной цепи, которая контролирует выработку цитокинов в селезенке . [15] Потенциалы действия, передаваемые через блуждающий нерв в селезенку, опосредуют высвобождение ацетилхолина , нейротрансмиттера , который ингибирует высвобождение цитокинов путем взаимодействия с никотиновыми рецепторами ацетилхолина альфа7 ( CHRNA7 ), экспрессируемыми на клетках, продуцирующих цитокины. [16] Двигательная дуга воспалительного рефлекса называется холинергическим противовоспалительным путем .
Специфичность патогена
[ редактировать ]Части врожденной иммунной системы проявляют специфичность к различным патогенам.
| Патоген | Основные примеры [17] | Фагоцитоз [17] | дополнять [17] | NK-клетки [17] |
|---|---|---|---|---|
| Внутриклеточный и цитоплазматический вирус | да | да [18] | да | |
| Внутриклеточные бактерии | да (в частности, нейтрофилы ) | да [19] | да | |
| нет | да | да | ||
| Внеклеточные бактерии | да | да | нет | |
| Внутриклеточные простейшие | нет | нет | да | |
| Внеклеточные простейшие | да | да | нет/да | |
| Внеклеточные грибы | нет | да | да [20] |
Уклонение от иммунитета
[ редактировать ]Клетки врожденной иммунной системы предотвращают свободный рост микроорганизмов в организме, но многие патогены выработали механизмы, позволяющие уклоняться от этого. [21] [22]
Одной из стратегий является внутриклеточная репликация, как это практикуется Mycobacterium Tuberculosis , или ношение защитной капсулы, которая предотвращает лизис комплементом и фагоцитами, как у Salmonella . [23] Виды Bacteroides обычно являются мутуалистическими бактериями, составляющими значительную часть желудочно-кишечной флоры млекопитающих . [24] Такие виды, как B. fragilis, являются условно-патогенными микроорганизмами , вызывающими инфекции брюшной полости . Они ингибируют фагоцитоз, воздействуя на рецепторы фагоцитов, используемые для поглощения бактерий. Они также могут имитировать клетки-хозяева, поэтому иммунная система не распознает их как чужеродные. Staphylococcus aureus подавляет способность фагоцитов реагировать на сигналы хемокинов. M.tuberculosis , Streptococcus pyogenes и Bacillus anthracis используют механизмы, которые непосредственно убивают фагоциты. [ нужна ссылка ]
Бактерии и грибы могут образовывать сложные биопленки , защищающие их от иммунных клеток и белков; Биопленки присутствуют при хронических инфекциях Pseudomonas aeruginosa и Burkholderia cenocepacia, характерных для муковисцидоза . [25]
Вирусы
[ редактировать ]I типа Интерфероны (ИФН), секретируемые преимущественно дендритными клетками , [26] играют центральную роль в противовирусной защите хозяина и противовирусном состоянии клетки. [27] Вирусные компоненты распознаются разными рецепторами: Toll-подобные рецепторы расположены в эндосомальной мембране и распознают двухцепочечную РНК (дцРНК), рецепторы MDA5 и RIG-I расположены в цитоплазме и распознают длинную дсРНК и фосфатсодержащую дсРНК соответственно. [28] Когда цитоплазматические рецепторы MDA5 и RIG-I распознают вирус, конформация между доменом рекрутирования каспазы (CARD) и CARD-содержащим адаптером MAVS изменяется. активация адаптерного белка TRIF Параллельно, когда TLR в эндоцитарных компартментах распознают вирус, индуцируется . Оба пути сходятся в рекрутировании и активации комплекса IKKε/TBK-1, индуцируя димеризацию транскрипционных факторов IRF3 и IRF7 , которые транслоцируются в ядре, где они индуцируют продукцию IFN в присутствии определенного фактора транскрипции и активируют фактор транскрипции. 2. ИФН секретируется через секреторные пузырьки , где он может активировать рецепторы как на клетке, из которой он был высвобожден ( аутокринный ), так и на соседних клетках (паракринный). Это вызывает экспрессию сотен стимулируемых интерфероном генов. Это приводит к выработке противовирусных белков, таких как протеинкиназа R , которая ингибирует синтез вирусного белка, или семейство 2',5'-олигоаденилатсинтетаз , которые разрушают вирусную РНК. [27]
Некоторые вирусы уклоняются от этого, производя молекулы, которые мешают выработке интерферона. Например, вирус гриппа А продуцирует белок NS1 , который может связываться с хозяином и вирусной РНК, взаимодействовать с иммунными сигнальными белками или блокировать их активацию путем убиквитинирования , ингибируя тем самым выработку IFN типа I. [29] Грипп А также блокирует активацию протеинкиназы R и установление противовирусного статуса. [30] Вирус денге также ингибирует выработку IFN типа I, блокируя IRF-3 фосфорилирование комплекса NS2B3 с помощью протеазного . [31]
За пределами позвоночных
[ редактировать ]Прокариоты
[ редактировать ]Бактерии (и, возможно, другие прокариотические организмы) используют уникальный защитный механизм, называемый системой рестрикции-модификации , чтобы защитить себя от патогенов, таких как бактериофаги . В этой системе бактерии производят ферменты , называемые эндонуклеазами рестрикции , которые атакуют и разрушают определенные области вирусной ДНК вторгшихся бактериофагов. Метилирование собственной ДНК хозяина помечает ее как «собственную» и предотвращает атаку эндонуклеаз. [32] Эндонуклеазы рестрикции и система модификации рестрикции существуют исключительно у прокариот. [33]
Беспозвоночные
[ редактировать ]Беспозвоночные не обладают лимфоцитами или гуморальной иммунной системой на основе антител, и вполне вероятно, что многокомпонентная адаптивная иммунная система возникла у первых позвоночных. [34] Тем не менее, беспозвоночные обладают механизмами, которые, по-видимому, являются предшественниками этих аспектов иммунитета позвоночных. Рецепторы распознавания образов (PRR) — это белки, используемые почти всеми организмами для идентификации молекул, связанных с микробными патогенами. TLR представляют собой основной класс рецепторов распознавания образов, который существует у всех целоматов (животных с полостью тела), включая человека. [35] Система комплемента существует у большинства форм жизни. Некоторые беспозвоночные, в том числе различные насекомые, крабы и черви, используют модифицированную форму ответа комплемента, известную как система профенолоксидазы (проПО). [34]
Антимикробные пептиды являются эволюционно консервативным компонентом врожденного иммунного ответа, обнаруженного у всех классов жизни, и представляют собой основную форму системного иммунитета беспозвоночных . Некоторые виды насекомых производят антимикробные пептиды, известные как дефензины и цекропины .
Протеолитические каскады
[ редактировать ]У беспозвоночных PRR запускают протеолитические каскады, которые разрушают белки и контролируют многие механизмы врожденной иммунной системы беспозвоночных, включая коагуляцию гемолимфы и меланизацию . Протеолитические каскады являются важными компонентами иммунной системы беспозвоночных, поскольку они активируются быстрее, чем другие врожденные иммунные реакции, поскольку не зависят от генных изменений. Протеолитические каскады функционируют как у позвоночных, так и у беспозвоночных, хотя в каскадах используются разные белки. [36]
Механизмы свертывания крови
[ редактировать ]В гемолимфе, составляющей жидкость кровеносной системы членистоногих , гелеобразная жидкость окружает захватчиков патогенов, подобно тому, как это происходит в крови у других животных. В свертывании крови у беспозвоночных участвуют различные белки и механизмы. У ракообразных трансглутаминаза из клеток крови и подвижные белки плазмы составляют систему свертывания крови, где трансглутаминаза полимеризует субъединицы белка свертывания плазмы массой 210 кДа. С другой стороны, в системе свертывания мечехвоста компоненты протеолитических каскадов сохраняются в виде неактивных форм в гранулах гемоцитов, которые высвобождаются при попадании чужеродных молекул, таких как липополисахариды . [36]
Растения
[ редактировать ]Представители каждого класса патогенов, поражающих человека, также заражают растения. Хотя точные патогенные виды различаются в зависимости от зараженного вида, бактерии, грибы, вирусы, нематоды и насекомые могут вызывать заболевания растений . Как и животные, растения, атакованные насекомыми или другими патогенами, используют набор сложных метаболических реакций, которые приводят к образованию защитных химических соединений, которые борются с инфекцией или делают растение менее привлекательным для насекомых и других травоядных животных . [37] (см.: Защита растений от травоядных ).
Как и беспозвоночные, растения не генерируют реакции антител или Т-клеток и не обладают мобильными клетками, которые обнаруживают и атакуют патогены. Кроме того, в случае заражения с частями некоторых растений обращаются как с одноразовыми и заменяемыми, что умеют немногие животные. Ограждение или выброс части растения помогает остановить распространение инфекции. [37]
Большинство иммунных реакций растений включают системные химические сигналы, посылаемые по всему растению. Растения используют PRR для распознавания консервативных микробных сигнатур. Это узнавание запускает иммунный ответ. Первые растительные рецепторы с консервативными микробными признаками были идентифицированы в рисе ( XA21 , 1995). [38] [39] и у Arabidopsis ( FLS2 , 2000). [40] Растения также несут иммунные рецепторы, которые распознают различные эффекторы патогенов. К ним относятся белки класса NBS-LRR. Когда часть растения заражается микробным или вирусным патогеном, в случае несовместимого взаимодействия, запускаемого специфическими элиситорами , растение вырабатывает локализованную гиперчувствительную реакцию (ЛР), при которой клетки в месте заражения подвергаются быстрому апоптозу для предотвращения распространиться на другие части растения. HR имеет некоторые сходства с пироптозом животных , например, потребность в каспазе подобной протеолитической активности VPEγ , -1, цистеиновой протеазе , которая регулирует разборку клеток во время клеточной гибели. [41]
Белки «резистентности» (R), кодируемые генами R , широко присутствуют в растениях и обнаруживают патогены. Эти белки содержат домены, аналогичные NOD-подобным рецепторам и TLR. Системная приобретенная устойчивость (SAR) — это тип защитной реакции, которая делает все растение устойчивым к широкому спектру инфекционных агентов. [42] САР включает производство химических медиаторов , таких как салициловая кислота или жасмоновая кислота . Некоторые из них проходят через растение и сигнализируют другим клеткам о необходимости вырабатывать защитные соединения для защиты неинфицированных частей, например, листьев. [43] Сама по себе салициловая кислота, хотя и необходима для экспрессии SAR, не является транслоцированным сигналом, ответственным за системный ответ. Недавние данные указывают на роль жасмоната в передаче сигнала к дистальным частям растения. Механизмы молчания РНК важны для системного ответа растений, поскольку они могут блокировать репликацию вируса. [44] Реакция жасмоновой кислоты стимулируется в листьях , поврежденных насекомыми, и включает выработку метилжасмоната . [37]
См. также
[ редактировать ]- Антимикробные пептиды
- Апоптоз
- Врожденная лимфоидная клетка
- NOD-подобный рецептор
- Тропизм эндотелиальных клеток
Ссылки
[ редактировать ]- ^ «Иммунный ответ: Медицинская энциклопедия MedlinePlus» . medlineplus.gov . Проверено 7 ноября 2021 г.
- ^ Jump up to: а б с д и ж Джейнвей С. , Пол С., Трэверс М., Уолпорт М., Шломчик М. (2001). Иммунобиология (Пятое изд.). Нью-Йорк и Лондон: Garland Science. ISBN 0-8153-4101-6 . .
- ^ Jump up to: а б с д и ж г час я дж к л м н тот п д Майер Г. «Врожденный (неспецифический) иммунитет» . Иммунология Секция микробиологии и иммунологии On-line . Университет Южной Каролины.
- ^ «Мукоцилиарный эскалатор» . Большой ветеринарный словарь Сондерса (3-е изд.). Эльзевир, Инк., 2007 г. Проверено 11 июня 2018 г.
- ^ Jump up to: а б с д и ж г Ствртинова В, Якубовский Ю, Хулин И (1995). «Воспаление и лихорадка» . Патофизиология: принципы болезни . Вычислительный центр Словацкой академии наук: Академическая электронная пресса. Архивировано из оригинала 18 июня 2007 года.
- ^ Лотце М.Т., Трейси К.Дж. (апрель 2005 г.). «Белок группы 1 с высокой мобильностью (HMGB1): ядерное оружие в иммунном арсенале». Обзоры природы. Иммунология . 5 (4): 331–342. дои : 10.1038/nri1594 . ПМИД 15803152 . S2CID 27691169 .
- ^ Джейнвей Калифорния, Трэверс П., Уолпорт М., Шломчик М.Дж. (2005). Иммунобиология (6-е изд.). Гирляндная наука. ISBN 0-443-07310-4 .
- ^ Монга I, Каур К., Дханда С. (март 2022 г.). «Возвращаясь к гемопоэзу: применение объемной и одноклеточной транскриптомики, анализирующей транскрипционную гетерогенность в гемопоэтических стволовых клетках». Брифинги по функциональной геномике . 21 (3): 159–176. дои : 10.1093/bfgp/elac002 . ПМИД 35265979 .
- ^ Jump up to: а б с Альбертс Б., Джонсон А., Льюис Дж., Рафф М., Робертс К., Уолтерс П. (2002). Молекулярная биология клетки (Четвертое изд.). Нью-Йорк и Лондон: Garland Science. ISBN 0815332181 .
- ^ Джейнвей С. (2005). Иммунобиология (6-е изд.). Гирляндная наука. ISBN 0-443-07310-4 .
- ^ Арай С., Мигер Р., Сверинген М., Мьинт Х., Рич Э., Мартинсон Дж., Клингеманн Х. (2008). «Инфузия аллогенной клеточной линии NK-92 пациентам с распространенным почечно-клеточным раком или меланомой: исследование фазы I». Цитотерапия . 10 (6): 625–632. дои : 10.1080/14653240802301872 . ПМИД 18836917 .
- ^ Тонн Т., Беккер С., Эссер Р., Швабе Д., Зейфрид Э. (август 2001 г.). «Клеточная иммунотерапия злокачественных новообразований с использованием клональной линии естественных киллеров NK-92». Журнал гематотерапии и исследований стволовых клеток . 10 (4): 535–544. дои : 10.1089/15258160152509145 . ПМИД 11522236 .
- ^ Гонг Дж.Х., Маки Дж., Клингеманн Х.Г. (апрель 1994 г.). «Характеристика линии клеток человека (NK-92) с фенотипическими и функциональными характеристиками активированных естественных клеток-киллеров». Лейкемия . 8 (4): 652–658. ПМИД 8152260 .
- ^ Клингеманн Х.Г. (2010). «Разработка и тестирование линий NK-клеток». В Лотце М.Т., Томпсон А.В. (ред.). Естественные клетки-киллеры – фундаментальная наука и клиническое применение . стр. 169–175.
- ^ Трейси К.Дж. (февраль 2007 г.). «Физиология и иммунология холинергического противовоспалительного пути» . Журнал клинических исследований . 117 (2): 289–296. дои : 10.1172/JCI30555 . ПМК 1783813 . ПМИД 17273548 .
- ^ Трейси К.Дж. (июнь 2009 г.). «Рефлекторный контроль иммунитета» . Обзоры природы. Иммунология . 9 (6): 418–428. дои : 10.1038/nri2566 . ПМЦ 4535331 . ПМИД 19461672 .
- ^ Jump up to: а б с д Доан Т. (2008). Иммунология . Липпинкотт Уильямс и Уилкинс. п. 172. ИСБН 978-0-7817-9543-2 .
- ^ Агравал П., Навадкар Р., Оджа Х., Кумар Дж., Саху А. (16 июня 2017 г.). «Дополнительные стратегии уклонения от вирусов: обзор» . Границы микробиологии . 8 : 1117. дои : 10.3389/fmicb.2017.01117 . ПМЦ 5472698 . ПМИД 28670306 .
- ^ Круаз Дж., Арвье Дж., Берш П., Коломб М.Г. (декабрь 1993 г.). «Активация альтернативного пути человеческого комплемента с помощью Listeria monocytogenes: доказательства прямого связывания и протеолиза компонента C3 на бактериях» . Инфекция и иммунитет . 61 (12): 5134–5139. дои : 10.1128/iai.61.12.5134-5139.1993 . ПМЦ 281293 . ПМИД 8225590 .
- ^ Ма Л.Л., Ван С.Л., Нили Г.Г., Эпельман С., Кренский А.М., Моди Ч.Х. (сентябрь 2004 г.). «NK-клетки используют перфорин, а не гранулизин для антикриптококковой активности» . Журнал иммунологии . 173 (5): 3357–3365. дои : 10.4049/jimmunol.173.5.3357 . ПМИД 15322199 . S2CID 43258057 .
- ^ Кеннеди А. «Уклонение бактерий от иммунитета» . Крони . Архивировано из оригинала 10 октября 2006 года . Проверено 25 октября 2006 г.
- ^ Финли Б.Б., Макфадден Дж. (февраль 2006 г.). «Антииммунология: уклонение от иммунной системы хозяина бактериальными и вирусными патогенами» . Клетка . 124 (4): 767–782. дои : 10.1016/j.cell.2006.01.034 . ПМИД 16497587 . S2CID 15418509 .
- ^ Финли Б.Б., Фальков С. (июнь 1997 г.). «Возвращение к общим темам микробной патогенности» . Обзоры микробиологии и молекулярной биологии . 61 (2): 136–169. дои : 10.1128/ммбр.61.2.136-169.1997 . ПМК 232605 . ПМИД 9184008 .
- ^ Дорланд В.А., изд. (2003). Иллюстрированный медицинский словарь Дорланда (30-е изд.). УБ Сондерс. ISBN 0-7216-0146-4 .
- ^ Кобаяши Х (2005). «Биопленки дыхательных путей: значение для патогенеза и терапии инфекций дыхательных путей». Лечение в респираторной медицине . 4 (4): 241–253. дои : 10.2165/00151829-200504040-00003 . ПМИД 16086598 . S2CID 31788349 .
- ^ Ле Бон А, Tough DF (август 2002 г.). «Связь между врожденным и адаптивным иммунитетом через интерферон I типа». Современное мнение в иммунологии . 14 (4): 432–436. дои : 10.1016/s0952-7915(02)00354-0 . ПМИД 12088676 .
- ^ Jump up to: а б Акира С., Уэмацу С., Такеучи О (февраль 2006 г.). «Распознавание патогенов и врожденный иммунитет» . Клетка . 124 (4): 783–801. дои : 10.1016/j.cell.2006.02.015 . ПМИД 16497588 . S2CID 14357403 .
- ^ Баум А., Гарсия-Састре А (май 2010 г.). «Индукция интерферона I типа РНК-вирусами: клеточные рецепторы и их субстраты» . Аминокислоты . 38 (5): 1283–1299. дои : 10.1007/s00726-009-0374-0 . ПМК 2860555 . ПМИД 19882216 .
- ^ Хитон С.М., Борг Н.А., Диксит В.М. (январь 2016 г.). «Убиквитин в активации и ослаблении врожденного противовирусного иммунитета» . Журнал экспериментальной медицины . 213 (1): 1–13. дои : 10.1084/jem.20151531 . ПМК 4710203 . ПМИД 26712804 .
- ^ Гарсиа-Састре А., Егоров А., Матасов Д., Брандт С., Леви Д.Е., Дурбин Дж.Е. и др. (декабрь 1998 г.). «Вирус гриппа А, лишенный гена NS1, реплицируется в системах с дефицитом интерферона» . Вирусология . 252 (2): 324–330. дои : 10.1006/виро.1998.9508 . ПМИД 9878611 .
- ^ Родригес-Мадос-младший, Белича-Вильянуэва А, Берналь-Рубио Д, Ашур Дж, Эйллон Дж, Фернандес-Сесма А (октябрь 2010 г.). «Ингибирование ответа интерферона типа I в дендритных клетках человека инфекцией вируса денге требует каталитически активного комплекса NS2B3» . Журнал вирусологии . 84 (19): 9760–9774. дои : 10.1128/jvi.01051-10 . ПМЦ 2937777 . ПМИД 20660196 .
- ^ Питерс П. «Ферменты рестрикции» . Справочный документ Access Excellence Classic Collection .
- ^ Оливейра PH, Touchon M, Rocha EP (2014). «Взаимодействие систем рестрикции-модификации с мобильными генетическими элементами и их прокариотическими хозяевами» . Исследования нуклеиновых кислот . 42 (16): 10618–10631. дои : 10.1093/nar/gku734 . ПМЦ 4176335 . ПМИД 25120263 .
- ^ Jump up to: а б Бек Г., Хабихт Г.С. (ноябрь 1996 г.). «Иммунитет и беспозвоночные». Научный американец . 275 (5): 60–63, 66. Бибкод : 1996SciAm.275e..60B . doi : 10.1038/scientificamerican1196-60 . ПМИД 8875808 .
- ^ Имлер Дж.Л., Хоффманн Дж.А. (июль 2001 г.). «Толл-рецепторы врожденного иммунитета». Тенденции клеточной биологии . 11 (7): 304–311. дои : 10.1016/S0962-8924(01)02004-9 . ПМИД 11413042 .
- ^ Jump up to: а б Церениус Л., Кавабата С., Ли Б.Л., Нонака М., Седерхалл К. (октябрь 2010 г.). «Протеолитические каскады и их участие в иммунитете беспозвоночных». Тенденции биохимических наук . 35 (10): 575–583. дои : 10.1016/j.tibs.2010.04.006 . ПМИД 20541942 .
- ^ Jump up to: а б с Шнайдер Д. (2005). «Иммунные реакции растений» . Кафедра микробиологии и иммунологии Стэнфордского университета. Архивировано из оригинала 9 июня 2007 года.
- ^ Сонг В.И., Ван Г.Л., Чен Л.Л., Ким Х.С., Пи Л.И., Хольстен Т. и др. (декабрь 1995 г.). «Рецепторно-киназоподобный белок, кодируемый геном устойчивости риса к болезням, Xa21» . Наука . 270 (5243): 1804–1806. Бибкод : 1995Sci...270.1804S . дои : 10.1126/science.270.5243.1804 . ПМИД 8525370 . S2CID 10548988 .
- ^ Рональд ПК, Бейтлер Б (ноябрь 2010 г.). «Растительные и животные сенсоры сохранившихся микробных сигнатур» . Наука . 330 (6007): 1061–1064. Бибкод : 2010Sci...330.1061R . дои : 10.1126/science.1189468 . ПМИД 21097929 . S2CID 18311102 .
- ^ Гомес-Гомес Л., Боллер Т. (июнь 2000 г.). «FLS2: киназа, подобная рецептору LRR, участвующая в восприятии бактериального элиситорного флагеллина у Arabidopsis» . Молекулярная клетка . 5 (6): 1003–1011. дои : 10.1016/S1097-2765(00)80265-8 . ПМИД 10911994 .
- ^ Рохо Э., Мартин Р., Картер С., Зухар Дж., Пан С., Плотникова Дж. и др. (ноябрь 2004 г.). «VPEgamma проявляет каспазоподобную активность, которая способствует защите от патогенов» . Современная биология . 14 (21): 1897–1906. Бибкод : 2004CBio...14.1897R . дои : 10.1016/j.cub.2004.09.056 . ПМИД 15530390 . S2CID 3231431 .
- ^ Хитозан # Использование в сельском хозяйстве и садоводстве.
- ^ Линден Дж.К., Стоунер Р.Дж., Натсон К.В., Гарднер-Хьюз, Калифорния (2000). «Элиситоры контроля органических заболеваний» (PDF) . Агропищевая промышленность Высокие технологии . 11 (5): 32–34. Архивировано из оригинала (PDF) 6 июля 2007 года.
- ^ Баулкомб Д. (сентябрь 2004 г.). «Замалчивание РНК у растений». Природа . 431 (7006): 356–363. Бибкод : 2004Natur.431..356B . дои : 10.1038/nature02874 . ПМИД 15372043 . S2CID 4421274 .
Внешние ссылки
[ редактировать ]- Брейер К., Форушани А.К., Лэрд М.Р., Чен С., Срибная А., Ло Р., Винзор Г.Л., Хэнкок Р.Э., Бринкман Ф.С., Линн Дж.Д. «InnateDB» .
база данных белков и их взаимодействий во врожденной иммунной
системе - Анимация врожденной иммунной системы XVIVO Научная анимация