Нейссерия
| Нейссерия | |||
|---|---|---|---|
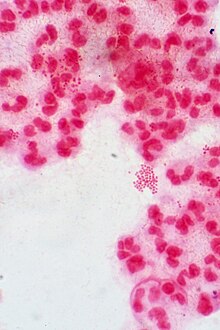 | |||
| Neisseria gonorrhoeae по Граму | |||
| Научная классификация | |||
| Домен: | Бактерии | ||
| Тип: | Псевдомонадота | ||
| Сорт: | Бетапротеобактерии | ||
| Заказ: | Нейсериалес | ||
| Семья: | Нейсериевые | ||
| Род: | Нейссерия Тревизан, 1885 г. | ||
| Разновидность | |||
| |||
Neisseria — большой род бактерий , колонизирующих слизистые оболочки многих животных. Из 11 видов, колонизирующих человека, только два являются патогенами : N. meningitidis и N. gonorrhoeae .
Neisseria Виды — грамотрицательные бактерии, входящие в состав Pseudomonadota — большой группы грамотрицательных форм. Neisseria diplococci напоминают кофейные зерна . при микроскопическом рассмотрении [1]
Патогенез и классификация
[ редактировать ]Патогены
[ редактировать ]Виды этого рода паразитических бактерий (семейство Neisseriaceae) растут парами, а иногда и четырьмя, и лучше всего развиваются при температуре 98,6 ° F (37 ° C) в теле животного или сыворотке.
Род включает в себя:
- N. gonorrhoeae (также называемый гонококком ) вызывает гонорею .
- N. meningitidis (также называемый менингококком) — одна из наиболее частых причин бактериального менингита и возбудитель менингококковой септицемии .
иммунной системы Функции нейтрофилов ограничены из-за способности Neisseria уклоняться от опсонизации антителами и реплицироваться внутри нейтрофилов, несмотря на фагоцитоз . Виды Neisseria также способны изменять свои антигены, чтобы избежать процесса, называемого антигенной вариацией , который наблюдается в основном в молекулах, расположенных на поверхности. Патогенные виды , а также некоторые комменсальные виды имеют пили типа IV , которые выполняют для этого организма множество функций. Некоторые функции пилей типа IV включают в себя: опосредование прикрепления к различным клеткам и тканям, подергивающуюся подвижность, естественную компетентность, образование микроколоний , обширную внутриштаммовую фазу и антигенную изменчивость.
Neisseria являются важным фактором на ранних стадиях развития бляшек у собак. Также было показано, что бактерии [2]

Непатогены
[ редактировать ]Этот род также включает несколько видов, считающихся комменсальными или непатогенными:
- Нейссерия бациллиформис
- Нейссерия синерея
- Нейссерия удлиненная
- Нейссерия желтая
- Нейссерия лактамская
- Нейссерия макаки
- Нейссерия слизистой оболочки
- Нейссерия оральная
- Нейссерия полисахарная
- Было бы сухо
- Нейссерия субфлава
- Нейссерия желтая
Однако некоторые из них могут быть связаны с болезнями. [4]
Биохимическая идентификация
[ редактировать ]Все значимые с медицинской точки зрения виды Neisseria положительны как по каталазе , так и по оксидазе . Различные виды Neisseria можно идентифицировать по набору сахаров, из которых они производят кислоту. Например, N. gonorrhoeae производит кислоту только из глюкозы , а N. meningitidis производит кислоту как из глюкозы, так и из мальтозы .
Полисахаридная капсула. N. meningitidis имеет полисахаридную капсулу, которая окружает внешнюю мембрану бактерии и защищает от растворимых иммунных эффекторных механизмов в сыворотке . Он считается важным фактором вирулентности бактерий. [5] У N. gonorrhoeae такой капсулы нет.
В отличие от большинства других грамотрицательных бактерий, которые обладают липополисахаридом (ЛПС), как патогенные, так и комменсальные виды Neisseria имеют липоолигосахарид (LOS), который состоит из основного полисахарида и липида А. Он действует как эндотоксин , защищает от антимикробных пептидов и прикрепляется к рецептору асиалогликопротеина на уретры эпителии . ЛОС оказывает сильное стимулирующее воздействие на иммунную систему человека. LOS Сиалирование (с помощью фермента Lst) предотвращает и отложение фагоцитоз нейтрофилов комплемента. Модификация LOS фосфоэтаноламином (ферментом LptA) обеспечивает устойчивость к антимикробным пептидам и комплементу. Штаммы одного и того же вида обладают способностью продуцировать разные гликоформы ЛОС . [6]
История
[ редактировать ]Род Neisseria . назван в честь немецкого бактериолога Альберта Нейссера , который в 1879 году обнаружил свой первый экземпляр, Neisseria gonorrhoeae , возбудитель, вызывающий у человека заболевание гонорею Нейссер также стал соавтором открытия возбудителя проказы — Mycobacterium leprae . Эти открытия стали возможными благодаря разработке новых методов окрашивания, в разработке которых он участвовал.
Геномы
[ редактировать ]Геномы как минимум 10 видов Neisseria были полностью секвенированы. [3] Наиболее изученными видами являются N. meningitidis с более чем 70 штаммами и N. gonorrhoeae с полностью секвенированными как минимум 10 штаммами. Другие полные геномы доступны для N. elongata , N. Lactamica , [7] и Н. weaveri . Полногеномные последовательности доступны для сотен других видов и штаммов. [8] N. meningitidis кодирует от 2440 до 2854 белков, тогда как N. gonorrhoeae кодирует от 2603 до 2871 белка. N. weaveri (штамм NCTC 13585) имеет самый маленький известный геном, содержащий всего 2060 кодируемых белков. [9] хотя N. meningitidis MC58 содержит только 2049 генов. сообщалось, что [3] Геномы в целом очень похожи. геном N. gonorrhoeae Например, если сравнить (штамм FA1090) с геномом N. meningitidis (штамм H44/76), окажется, что 68% их генов являются общими. [8]
| Свойства генома Neisseria sp. [3] | ||
|---|---|---|
| разновидность | Размер (б.п.) | номер гена |
| № удлиненный | 2,260,105 | 2589 |
| № сухой | 2,786,309 | 2842 |
| Н. слизистая оболочка | 2,542,952 | 2594 |
| Н. субфлава | 2,288,219 | 2303 |
| Н. желтая | 2,199,447 | 2240 |
| Н. ужин | 1,876,338 | 2050 |
| Н. полисахария | 2,043,594 | 2268 |
| № лактамика 23970 | 2,148,211 | 2359 |
| Н. гонорее FA1090 | 2,153,922 | 2002 |
| Н. менингитидис MC58 | 2,184,406 | 2049 |
Вакцина
[ редактировать ]Заболевания, вызываемые N. meningitidis и N. gonorrhoeae, представляют собой серьезные проблемы здравоохранения во всем мире, борьба с которыми во многом зависит от наличия и широкого использования комплексных менингококковых вакцин. Разработка нейссерийных вакцин оказалась сложной задачей из-за природы этих организмов, в частности, гетерогенности , изменчивости и/или плохой иммуногенности компонентов их внешней поверхности. хозяина Будучи исключительно человеческими патогенами, они хорошо адаптированы к среде хозяина, но выработали несколько механизмов, позволяющих оставаться адаптируемыми к изменяющейся микросреде и избегать элиминации иммунной системой . В настоящее время менингококковые инфекции серогрупп A, B, C, Y и W-135 можно предотвратить с помощью вакцин. [10] Однако перспектива разработки гонококковой вакцины маловероятна. [11]
Устойчивость к антибиотикам
[ редактировать ]Приобретение у N. gonorrhoeae резистентности к цефалоспоринам , особенно резистентности к цефтриаксону, значительно усложнило лечение гонореи, поскольку гонококк теперь классифицируется как « супербактерия ». [12]
Генетическая трансформация
[ редактировать ]Генетическая трансформация реципиента — это процесс, при котором бактериальная клетка-реципиент поглощает ДНК из соседней клетки и интегрирует эту ДНК в геном путем рекомбинации . У N. meningitidis и N. gonorrhoeae трансформация ДНК требует присутствия коротких последовательностей ДНК (9-10 мономеров, находящихся в кодирующих областях) донорской ДНК. Эти последовательности называются последовательностями поглощения ДНК (DUS). Специфическое распознавание DUS опосредуется пилином IV типа. [13] Дэвидсен и др. [14] сообщили, что у N. meningitidis и N. gonorrhoeae DUS встречаются со значительно более высокой плотностью в генах, участвующих в ДНК репарации и рекомбинации (а также в рестрикции-модификации и репликации ), чем в других аннотированных группах генов. Эти авторы предположили, что чрезмерное представительство DUS в генах репарации и рекомбинации ДНК может отражать пользу поддержания целостности механизма репарации и рекомбинации ДНК за счет преимущественного использования генов поддержания генома, которые могут заменить их поврежденные аналоги в клетке-реципиенте. Когант и Мейден отметили, что распределение DUS согласуется с тем, что рекомбинация является в первую очередь механизмом восстановления генома, который иногда может приводить к созданию разнообразия, которое еще чаще является адаптивным. [15] Это также было предложено Michod et al. [16] что важным преимуществом трансформации N. gonorrhoeae клеток хозяина является рекомбинационная репарация окислительных повреждений ДНК, вызванных окислительной атакой фагоцитирующих .
Международная по патогенным нейссериям конференция
[ редактировать ]Международная по патогенным нейссериям конференция (IPNC), проводимая каждые два года, является форумом для презентации передовых исследований по всем аспектам рода Neisseria . Сюда входят иммунология, вакцинология, а также физиология и метаболизм N. meningitidis , N. gonorrhoeae и комменсальных видов. Первый IPNC состоялся в 1978 году, а последний — в сентябре 2016 года. Обычно место проведения конференции меняется между Северной Америкой и Европой, но впервые она состоялась в Австралии в 2006 году, где и располагалось место проведения. в Кэрнсе . [17]
Ссылки
[ редактировать ]- ^ Райан К.Дж.; Рэй К.Г., ред. (2004). Медицинская микробиология Шерриса (4-е изд.). МакГроу Хилл. ISBN 978-0-8385-8529-0 .
- ^ Ранние биопленки собачьих бляшек: характеристика ключевых бактериальных взаимодействий, участвующих в первоначальной колонизации эмали. Люси Дж. Холкомб, Ниран Патель, Элисон Колайер, Оливер Дойш, Кьяран О'Флинн, Стивен Харрис. ПЛОС Один, 2014.
- ^ Jump up to: а б с д Марри, Прадип Редди; Паниск, Мария; Вейанд, Натан Дж.; Рендон, Мария А.; Калтон, Кристин М.; Эрнандес, Диана Р.; Хигаси, Дастин Л.; Содергрен, Эрика; Вайншток, Джордж М. (28 июля 2010 г.). «Секвенирование генома выявило широко распространенный обмен генами вирулентности среди видов Neisseria человека» . ПЛОС ОДИН . 5 (7): е11835. Бибкод : 2010PLoSO...511835M . дои : 10.1371/journal.pone.0011835 . ISSN 1932-6203 . ПМЦ 2911385 . ПМИД 20676376 .
- ^ Тронель Х., Шодеманш Х., Пешье Н., Дутрелан Л., Хоэн Б. (май 2001 г.). «Эндокардит, вызванный Neisseria слизистой оболочки после пирсинга языка» . Клин. Микробиол. Заразить . 7 (5): 275–6. дои : 10.1046/j.1469-0691.2001.00241.x . ПМИД 11422256 .
- ^ Ульрих, М., изд. (2009). Бактериальные полисахариды: современные инновации и будущие тенденции . Кайстер Академик Пресс. ISBN 978-1-904455-45-5 .
- ^ Уилсон, Бренда А.; Винклер, Малкольм Э.; Хо, Брайан Томас (2019). Бактериальный патогенез: молекулярный подход (4-е изд.). Вашингтон, округ Колумбия: ASM Press. п. 161. ИСБН 978-1-55581-940-8 .
- ^ Миноуг, ТД; Далиго, штат Ха; Давенпорт, КВ; Бишоп-Лилли, Калифорния; Брюс, округ Колумбия; Цепь, ПС; Чертков О.; Койн, СР; Фрейтас, Т. (25 сентября 2014 г.). «Проект сборки генома штамма Neisseria Lactamica типа A7515» . Геномные объявления . 2 (5): e00951–14. doi : 10.1128/genomeA.00951-14 . ПМК 4175205 . ПМИД 25291770 .
- ^ Jump up to: а б «Нейсерия в базе данных PATRIC» . ПАТРИК . 26 февраля 2017 г. Проверено 26 февраля 2017 г.
- ^ Александр, Сара; Фазал, Мохаммед-Аббас; Бернетт, Эдвард; Дехир-Грэм, Ана; Оливер, Карен; Холройд, Нэнси; Паркхилл, Джулиан; Рассел, Джули Э. (25 августа 2016 г.). «Полная последовательность генома штамма Neisseria weaveri NCTC13585» . Геномные объявления . 4 (4): e00815–16. doi : 10.1128/genomeA.00815-16 . ПМК 5000823 . ПМИД 27563039 .
- ^ «Вакцина против менингококка группы В» . Медскейп . ВебМД . Проверено 16 декабря 2015 г.
- ^ Сейб К.Л., Раппуоли Р. (2010). «Трудность в разработке вакцины против нейсериала». Neisseria: Молекулярные механизмы патогенеза . Кайстер Академик Пресс. ISBN 978-1-904455-51-6 .
- ^ Унемо М., Николас Р.А. (декабрь 2012 г.). «Появление гонореи с множественной лекарственной устойчивостью, широкой лекарственной устойчивостью и неизлечимой» . Будущая микробиол . 7 (12): 1401–1422. дои : 10.2217/fmb.12.117 . ПМЦ 3629839 . ПМИД 23231489 .
- ^ Чеховин А., Симпсон П.Дж., Макдауэлл М.А., Браун Д.Р., Ношезе Р., Паллетт М., Брэйди Дж., Болдуин Г.С., Леа С.М., Мэтьюз С.Дж., Пеличич В. (2013). «Специфическое распознавание ДНК, опосредованное пилином IV типа» . Учеб. Натл. акад. наук. США . 110 (8): 3065–70. Бибкод : 2013PNAS..110.3065C . дои : 10.1073/pnas.1218832110 . ПМК 3581936 . ПМИД 23386723 .
- ^ Дэвидсен Т., Родланд Э.А., Лагесен К., Сиберг Э., Рогнес Т., Тоньюм Т. (2004). «Смещенное распределение последовательностей поглощения ДНК в сторону генов поддержания генома» . Нуклеиновые кислоты Рез . 32 (3): 1050–8. дои : 10.1093/nar/gkh255 . ПМЦ 373393 . ПМИД 14960717 .
- ^ Каугант Д.А., Maiden MC (2009). «Менингококковое носительство и болезни – популяционная биология и эволюция» . Вакцина . 27 (Приложение 2): B64–70. doi : 10.1016/j.vaccine.2009.04.061 . ПМЦ 2719693 . ПМИД 19464092 .
- ^ Мишод Р.Э., Бернштейн Х., Недельку А.М. (2008). «Адаптационное значение пола у микробных патогенов». Заразить. Жене. Эвол . 8 (3): 267–85. дои : 10.1016/j.meegid.2008.01.002 . ПМИД 18295550 .
- ^ «IPNC-Neisseria.org» . neisseria.org . Проверено 02 января 2021 г.