Иммунная система
Иммунная система – это сеть биологических систем , защищающих организм от болезней . Он обнаруживает и реагирует на широкий спектр патогенов , от вирусов до паразитических червей , а также на раковые клетки и такие предметы, как щепки организма дерева, отличая их от собственных здоровых тканей . Многие виды имеют две основные подсистемы иммунной системы. Врожденная иммунная система обеспечивает заранее настроенный ответ на широкую группу ситуаций и стимулов. Адаптивная иммунная система обеспечивает индивидуальный ответ на каждый стимул, обучаясь распознавать молекулы, с которыми она ранее сталкивалась. Оба используют молекулы и клетки для выполнения своих функций.
Почти все организмы имеют ту или иную иммунную систему. Бактерии имеют рудиментарную иммунную систему в виде ферментов , защищающих от вирусных инфекций. Другие основные иммунные механизмы развились у древних растений и животных и сохраняются у их современных потомков. Эти механизмы включают фагоцитоз , антимикробные пептиды, называемые дефенсинами , и систему комплемента . Челюстные позвоночные , включая человека, обладают еще более сложными защитными механизмами, включая способность более эффективно адаптироваться к распознаванию патогенов. Адаптивный (или приобретенный) иммунитет создает иммунологическую память , приводящую к усилению реакции на последующие встречи с тем же патогеном. Этот процесс приобретения иммунитета лежит в основе вакцинации .
Дисфункция иммунной системы может вызвать аутоиммунные заболевания , воспалительные заболевания и рак . Иммунодефицит возникает, когда иммунная система менее активна, чем обычно, что приводит к рецидивирующим и опасным для жизни инфекциям. У людей иммунодефицит может быть результатом генетического заболевания, такого как тяжелый комбинированный иммунодефицит , приобретенных заболеваний, таких как ВИЧ / СПИД , или использования иммунодепрессантов . Аутоиммунитет возникает в результате того, что гиперактивная иммунная система атакует нормальные ткани, как если бы они были чужеродными организмами. Распространенные аутоиммунные заболевания включают тиреоидит Хашимото , ревматоидный артрит , сахарный диабет 1 типа и системную красную волчанку . Иммунология охватывает изучение всех аспектов иммунной системы.
Многоуровневая защита [ править ]
Иммунная система защищает своего хозяина от инфекции с помощью многоуровневой защиты с возрастающей специфичностью. патогенов, таких как бактерии и вирусы . Физические барьеры предотвращают проникновение в организм [1] Если патоген преодолевает эти барьеры, врожденная иммунная система обеспечивает немедленный, но неспецифический ответ. Врожденная иммунная система имеется у всех животных . [2] Если патогены успешно уклоняются от врожденного ответа, у позвоночных появляется второй уровень защиты — адаптивная иммунная система , которая активируется врожденным ответом. [3] Здесь иммунная система адаптирует свой ответ во время инфекции, чтобы улучшить распознавание возбудителя. Этот улучшенный ответ затем сохраняется после устранения патогена в форме иммунологической памяти и позволяет адаптивной иммунной системе проводить более быстрые и сильные атаки каждый раз, когда встречается этот патоген. [4] [5]
| Врожденная иммунная система | Адаптивная иммунная система |
|---|---|
| Ответ неспецифичен | на патоген и антиген Специфический ответ |
| Воздействие приводит к немедленному максимальному ответу | Время задержки между воздействием и максимальной реакцией |
| Клеточные и гуморальные компоненты | Клеточные и гуморальные компоненты |
| Нет иммунологической памяти. | Воздействие приводит к иммунологической памяти |
| Встречается почти во всех формах жизни | Встречается только у челюстных позвоночных. |
Как врожденный, так и адаптивный иммунитет зависят от способности иммунной системы различать собственные и чужие молекулы . В иммунологии собственные молекулы — это компоненты тела организма, которые иммунная система может отличить от чужеродных веществ. [6] И наоборот, чужие молекулы — это те, которые считаются чужеродными молекулами. Один класс чужих молекул называется антигенами (первоначально названными в честь антител генераторов ) и определяется как вещества, которые связываются со специфическими иммунными рецепторами и вызывают иммунный ответ. [7]
Поверхностные барьеры [ править ]
Несколько барьеров защищают организмы от инфекции, включая механические, химические и биологические барьеры. Восковая кутикула большинства листьев, экзоскелет насекомых, скорлупа и мембраны яиц, отложенных снаружи, а также кожа являются примерами механических барьеров, которые являются первой линией защиты от инфекции. [8] Организмы не могут быть полностью изолированы от окружающей среды, поэтому системы защищают такие отверстия тела, как легкие , кишечник и мочеполовые пути . В легких кашель и чихание механически выбрасывают болезнетворные микроорганизмы и другие раздражители из дыхательных путей . Смывающее действие слез и мочи также механически удаляет болезнетворные микроорганизмы, тогда как слизь, выделяемая дыхательными и желудочно-кишечными трактами, служит для улавливания и опутывания микроорганизмов . [9]
Химические барьеры также защищают от инфекции. Кожа и дыхательные пути секретируют антимикробные пептиды, такие как β- дефензины . [10] Такие ферменты , как лизоцим и фосфолипаза А2 в слюне , слезах и грудном молоке , также обладают антибактериальными свойствами . [11] [12] Вагинальные выделения служат химическим барьером после менархе , когда они становятся слегка кислыми , а сперма содержит дефенсины и цинк, убивающие болезнетворные микроорганизмы. [13] [14] В желудке . желудочная кислота служит химической защитой от проглатываемых патогенов [15]
В мочеполовом и желудочно-кишечном трактах комменсальная флора служит биологическими барьерами, конкурируя с патогенными бактериями за пищу и пространство и, в некоторых случаях, изменяя условия их среды, такие как pH или доступное железо. В результате вероятность того, что патогены достигнут достаточного количества, чтобы вызвать заболевание, снижается. [16]
Врожденная иммунная система [ править ]
Микроорганизмы или токсины, успешно проникающие в организм, сталкиваются с клетками и механизмами врожденной иммунной системы. Врожденный ответ обычно запускается, когда микробы идентифицируются рецепторами распознавания образов , которые распознают компоненты, консервативные среди широких групп микроорганизмов. [17] или когда поврежденные, поврежденные или находящиеся в стрессе клетки посылают сигналы тревоги, многие из которых распознаются теми же рецепторами, что и рецепторы, распознающие патогены. [18] Врожденная иммунная защита неспецифична, то есть эти системы реагируют на патогены общим образом. [19] Эта система не обеспечивает долговременного иммунитета против патогена. Врожденная иммунная система является доминирующей системой защиты хозяина у большинства организмов. [2] и единственный у растений. [20]
Иммунное зондирование [ править ]
Клетки врожденной иммунной системы используют рецепторы распознавания образов для распознавания молекулярных структур, продуцируемых патогенами. [21] Это белки , экспрессируемые, главным образом, клетками врожденной иммунной системы , такими как дендритные клетки, макрофаги, моноциты, нейтрофилы и эпителиальные клетки. [19] [22] идентифицировать два класса молекул: молекулярные паттерны, связанные с патогенами (PAMP), которые связаны с микробными патогенами , и молекулярные паттерны, связанные с повреждением (DAMP), которые связаны с компонентами клеток хозяина, которые высвобождаются во время повреждения или гибели клеток. . [23]
Распознавание внеклеточных или эндосомальных PAMP опосредуется трансмембранными белками, известными как toll-подобные рецепторы (TLR). [24] TLR имеют типичный структурный мотив — богатые лейцином повторы (LRR) , которые придают им изогнутую форму. [25] Toll-подобные рецепторы были впервые обнаружены у дрозофилы и запускают синтез и секрецию цитокинов , а также активацию других защитных программ хозяина, которые необходимы как для врожденных, так и для адаптивных иммунных реакций. У человека описаны десять толл-подобных рецепторов. [26]
Клетки врожденной иммунной системы имеют внутри рецепторы распознавания образов, которые обнаруживают инфекцию или повреждение клеток. Тремя основными классами этих «цитозольных» рецепторов являются NOD-подобные рецепторы , RIG (ген, индуцируемый ретиноевой кислотой)-подобные рецепторы и цитозольные ДНК-сенсоры. [27]
Клетки врожденного иммунитета [ править ]

Некоторые лейкоциты (лейкоциты) действуют как независимые одноклеточные организмы и являются вторым звеном врожденной иммунной системы. К врожденным лейкоцитам относятся «профессиональные» фагоциты ( макрофаги , нейтрофилы и дендритные клетки ). Эти клетки идентифицируют и уничтожают патогены, либо атакуя более крупные патогены посредством контакта, либо поглощая, а затем убивая микроорганизмы. Другие клетки, участвующие во врожденном ответе, включают врожденные лимфоидные клетки , тучные клетки , эозинофилы , базофилы и естественные клетки-киллеры . [28]
Фагоцитоз — важная особенность клеточного врожденного иммунитета, осуществляемая клетками, называемыми фагоцитами, которые поглощают патогены или частицы. Фагоциты обычно патрулируют организм в поисках патогенов, но могут быть вызваны в определенные места цитокинами. [29] Как только патоген поглощается фагоцитом, он попадает во внутриклеточную везикулу , называемую фагосомой , которая впоследствии сливается с другой везикулой, называемой лизосомой, образуя фаголизосому . Возбудитель погибает под действием пищеварительных ферментов или после дыхательного взрыва попадают , в результате которого свободные радикалы в фаголизосому. [30] [31] Фагоцитоз развился как средство приобретения питательных веществ , но эта роль была расширена в фагоцитах, включив в себя поглощение патогенов в качестве защитного механизма. [32] Фагоцитоз, вероятно, представляет собой старейшую форму защиты хозяина, поскольку фагоциты были идентифицированы как у позвоночных, так и у беспозвоночных животных. [33]
Нейтрофилы и макрофаги — это фагоциты, которые путешествуют по всему организму в поисках вторгающихся патогенов. [34] Нейтрофилы обычно обнаруживаются в кровотоке и представляют собой наиболее распространенный тип фагоцитов, составляя от 50% до 60% от общего числа циркулирующих лейкоцитов. [35] Во время острой фазы воспаления нейтрофилы мигрируют к месту воспаления в процессе, называемом хемотаксисом , и обычно являются первыми клетками, прибывающими на место инфекции. Макрофаги — это универсальные клетки, которые обитают в тканях и производят множество химических веществ, включая ферменты, белки комплемента и цитокины, а также могут действовать как мусорщики, избавляющие организм от изношенных клеток и другого мусора, а также как антигенпрезентирующие клетки . APC), которые активируют адаптивную иммунную систему. [36]
Дендритные клетки — фагоциты в тканях, контактирующих с внешней средой; следовательно, они расположены в основном в коже , носу , легких, желудке и кишечнике. [37] Они названы в честь сходства с нейронов дендритами , поскольку оба имеют множество отростков, похожих на шипы. Дендритные клетки служат связующим звеном между тканями организма и врожденной и адаптивной иммунной системой, поскольку они представляют антигены , Т-клеткам одному из ключевых типов клеток адаптивной иммунной системы. [37]
Гранулоциты – это лейкоциты, имеющие в цитоплазме гранулы. К этой категории относятся нейтрофилы, тучные клетки, базофилы и эозинофилы. Тучные клетки находятся в соединительных тканях и слизистых оболочках и регулируют воспалительную реакцию. [38] Они чаще всего связаны с аллергией и анафилаксией . [35] Базофилы и эозинофилы родственны нейтрофилам. Они выделяют химические медиаторы, которые участвуют в защите от паразитов и играют роль в аллергических реакциях, таких как астма . [39]
Врожденные лимфоидные клетки (ILC) представляют собой группу врожденных иммунных клеток, которые происходят от общего лимфоидного предшественника и принадлежат к лимфоидной линии . Эти клетки характеризуются отсутствием антигенспецифического В- или Т-клеточного рецептора (TCR) из-за отсутствия гена, активирующего рекомбинацию . ILC не экспрессируют маркеры миелоидных или дендритных клеток. [40]
Естественные клетки-киллеры (NK-клетки) представляют собой лимфоциты и компонент врожденной иммунной системы, который не атакует напрямую вторгающиеся микробы. [41] Скорее, NK-клетки уничтожают поврежденные клетки-хозяева, такие как опухолевые клетки или инфицированные вирусом клетки, распознавая такие клетки по состоянию, известному как «отсутствие себя». Этот термин описывает клетки с низким уровнем маркера клеточной поверхности, называемого MHC I ( главный комплекс гистосовместимости ) — ситуация, которая может возникнуть при вирусных инфекциях клеток-хозяев. [42] Нормальные клетки организма не распознаются и не подвергаются атаке NK-клеток, поскольку они экспрессируют интактные собственные антигены MHC. Эти антигены MHC распознаются рецепторами иммуноглобулинов клеток-киллеров, которые, по сути, тормозят NK-клетки. [43]
Воспаление [ править ]
Воспаление является одной из первых реакций иммунной системы на инфекцию. [44] Симптомами воспаления являются покраснение, отек, жар и боль, которые вызваны увеличением притока крови к тканям. Воспаление вызывают эйкозаноиды и цитокины , которые выделяются поврежденными или инфицированными клетками. Эйкозаноиды включают простагландины , вызывающие лихорадку и расширение кровеносных сосудов , связанное с воспалением, а также лейкотриены , привлекающие определенные лейкоциты (лейкоциты). [45] [46] Общие цитокины включают интерлейкины , которые отвечают за связь между лейкоцитами; хемокины , которые способствуют хемотаксису ; и интерфероны , обладающие противовирусным действием, например, останавливающие синтез белка в клетке-хозяине. [47] факторы роста Также могут высвобождаться и цитотоксические факторы. Эти цитокины и другие химические вещества привлекают иммунные клетки к месту инфекции и способствуют заживлению любых поврежденных тканей после удаления патогенов. [48] Рецепторы распознавания образов, называемые инфламмасомами, представляют собой мультибелковые комплексы (состоящие из NLR, адапторного белка ASC и эффекторной молекулы прокаспазы-1), образующиеся в ответ на цитозольные PAMP и DAMP, функция которых заключается в генерации активных форм воспалительные цитокины IL-1β и IL-18. [49]
Гуморальная защита [ править ]
Система комплемента представляет собой биохимический каскад , который атакует поверхности чужеродных клеток. Он содержит более 20 различных белков и назван в честь своей способности «дополнять» уничтожение патогенов антителами . Комплемент является основным гуморальным компонентом врожденного иммунного ответа. [50] [51] Системы комплемента есть у многих видов, в том числе у немлекопитающих , таких как растения, рыбы и некоторые беспозвоночные . [52] У людей этот ответ активируется связыванием комплемента с антителами, прикрепившимися к этим микробам, или связыванием белков комплемента с углеводами на поверхности микробов . Этот сигнал распознавания вызывает быструю реакцию убийства. [53] Скорость ответа является результатом усиления сигнала, которое происходит после последовательной протеолитической активации молекул комплемента, которые также являются протеазами. После того, как белки комплемента первоначально связываются с микробом, они активируют свою протеазную активность, которая, в свою очередь, активирует другие протеазы комплемента и так далее. Это создает каталитический каскад, который усиливает первоначальный сигнал посредством контролируемой положительной обратной связи . [54] В результате каскада вырабатываются пептиды, которые привлекают иммунные клетки, увеличивают проницаемость сосудов и опсонизируют (покрывают) поверхность патогена, маркируя его для уничтожения. Такое отложение комплемента может также убивать клетки напрямую, разрушая их плазматическую мембрану посредством образования мембраноатакующего комплекса . [50]
Адаптивная иммунная система [ править ]

Адаптивная иммунная система развилась у ранних позвоночных и обеспечивает более сильный иммунный ответ, а также иммунологическую память , при которой каждый патоген «запоминается» с помощью сигнатурного антигена. [55] Адаптивный иммунный ответ является антигенспецифичным и требует распознавания специфических «чужих» антигенов во время процесса, называемого презентацией антигена . Специфичность антигена позволяет генерировать ответы, адаптированные к конкретным патогенам или инфицированным патогеном клеткам. Способность создавать эти адаптированные реакции поддерживается в организме «клетками памяти». Если возбудитель заразил организм более одного раза, эти специфические клетки памяти используются для его быстрой ликвидации. [56]
Распознавание антигена [ править ]
Клетки адаптивной иммунной системы представляют собой особые виды лейкоцитов, называемые лимфоцитами. В-клетки и Т-клетки являются основными типами лимфоцитов и происходят из гемопоэтических стволовых клеток костного мозга . [57] В-клетки участвуют в гуморальном иммунном ответе , тогда как Т-клетки участвуют в клеточно-опосредованном иммунном ответе . Т-клетки-киллеры распознают только антигены, связанные с молекулами MHC класса I , тогда как Т-хелперы и регуляторные Т-клетки распознают только антигены, связанные с молекулами MHC класса II . Эти два механизма презентации антигена отражают разные роли двух типов Т-клеток. Третий, второстепенный подтип — это γδ Т-клетки , которые распознают интактные антигены, не связанные с рецепторами MHC. [58] Дважды положительные Т-клетки подвергаются воздействию широкого спектра аутоантигенов в тимусе , которым йод необходим для развития и активности тимуса. [59] Напротив, антиген-специфический рецептор В-клеток представляет собой молекулу антитела на поверхности В-клетки и распознает нативный (непроцессированный) антиген без какой-либо необходимости процессинга антигена . Такие антигены могут представлять собой крупные молекулы, обнаруженные на поверхности патогенов, но также могут представлять собой небольшие гаптены (например, пенициллин), прикрепленные к молекуле-носителю. [60] Каждая линия В-клеток экспрессирует разные антитела, поэтому полный набор рецепторов антигена В-клеток представляет собой все антитела, которые может вырабатывать организм. [57] Когда В- или Т-клетки встречают родственные им антигены, они размножаются, и образуется множество «клонов» клеток, нацеленных на один и тот же антиген. Это называется клональной селекцией . [61]
лимфоцитам антигена Т - Презентация
И В-клетки, и Т-клетки несут рецепторные молекулы, которые распознают определенные цели. Т-клетки распознают «чужую» мишень, такую как патоген, только после того, как антигены (небольшие фрагменты патогена) были процессированы и представлены в сочетании с «собственным» рецептором, называемым молекулой главного комплекса гистосовместимости (MHC). [62]
Клеточный иммунитет [ править ]
Существует два основных подтипа Т-клеток: Т-клетки-киллеры и Т-хелперы . Кроме того, существуют регуляторные Т-клетки , которые играют роль в модуляции иммунного ответа. [63]
Т-клетки-киллеры [ править ]
Т-клетки-киллеры представляют собой подгруппу Т-клеток, которые убивают клетки, инфицированные вирусами (и другими патогенами) или иным образом поврежденные или дисфункциональные. [64] Как и в случае с В-клетками, каждый тип Т-клеток распознает свой антиген. Т-клетки-киллеры активируются, когда их Т-клеточный рецептор связывается с этим специфическим антигеном в комплексе с рецептором MHC класса I другой клетки. Распознаванию этого комплекса MHC:антиген способствует корецептор Т -клетки, называемый CD8 . Затем Т-клетка путешествует по всему организму в поисках клеток, в которых рецепторы MHC I несут этот антиген. Когда активированная Т-клетка контактирует с такими клетками, она высвобождает цитотоксины , такие как перфорин клетки-мишени , которые образуют поры в плазматической мембране , позволяя ионам проникать , воде и токсинам. Введение другого токсина, называемого гранулизином (протеаза), вызывает апоптоз клетки- мишени . [65] Уничтожение клеток-хозяев Т-клетками особенно важно для предотвращения репликации вирусов. Активация Т-клеток строго контролируется и обычно требует очень сильного сигнала активации MHC/антигена или дополнительных сигналов активации, обеспечиваемых «хелперными» Т-клетками (см. ниже). [65]
Т-хелперы [ править ]

Т-хелперы регулируют как врожденные, так и адаптивные иммунные реакции и помогают определить, какие иммунные реакции организм дает на конкретный патоген. [66] [67] Эти клетки не обладают цитотоксической активностью и не убивают инфицированные клетки или непосредственно уничтожают патогены. Вместо этого они контролируют иммунный ответ, направляя другие клетки на выполнение этих задач. [68]
Т-хелперы экспрессируют рецепторы Т-клеток, которые распознают антиген, связанный с молекулами MHC класса II. Комплекс MHC:антиген также распознается корецептором CD4 хелперной клетки , который рекрутирует молекулы внутри Т-клетки (такие как Lck ), ответственные за активацию Т-клетки. Т-хелперы имеют более слабую связь с комплексом MHC:антиген, чем наблюдается для Т-клеток-киллеров, а это означает, что многие рецепторы (около 200–300) на Т-хелперах должны быть связаны с MHC:антигеном, чтобы активировать хелперную клетку, в то время как киллеры Т-клетки могут быть активированы путем взаимодействия одной молекулы MHC:антиген. Активация хелперных Т-клеток также требует более длительного взаимодействия с антигенпрезентирующей клеткой. [69] Активация покоящейся Т-хелперной клетки заставляет ее высвобождать цитокины, которые влияют на активность многих типов клеток. Сигналы цитокинов, продуцируемые Т-хелперами, усиливают микробицидную функцию макрофагов и активность Т-клеток-киллеров. [70] Кроме того, активация хелперных Т-клеток вызывает усиление экспрессии молекул на поверхности Т-клеток, таких как лиганд CD40 (также называемый CD154 ), которые обеспечивают дополнительные стимулирующие сигналы, обычно необходимые для активации В-клеток, продуцирующих антитела. [71]
Гамма-дельта Т-клетки [ править ]
Гамма-дельта-Т-клетки (γδ-Т-клетки) обладают альтернативным Т-клеточным рецептором (TCR) в отличие от CD4+ и CD8+ (αβ) Т-клеток и имеют общие характеристики Т-хелперов, цитотоксических Т-клеток и NK-клеток. Условия, вызывающие реакцию γδ Т-клеток, до конца не изучены. Подобно другим «нетрадиционным» подгруппам Т-клеток, несущих инвариантные TCR, таким как CD1d -рестриктированные естественные Т-киллеры Т-клетки , γδ-Т-клетки находятся на границе между врожденным и адаптивным иммунитетом. [72] С одной стороны, γδ Т-клетки являются компонентом адаптивного иммунитета, поскольку они перестраивают гены TCR для создания разнообразия рецепторов, а также могут развивать фенотип памяти. С другой стороны, различные подгруппы также являются частью врожденной иммунной системы, поскольку ограниченные рецепторы TCR или NK могут использоваться в качестве рецепторов распознавания образов . Например, большое количество человеческих Т-клеток Vγ9/Vδ2 в течение нескольких часов реагируют на обычные молекулы , продуцируемые микробами, а сильно ограниченные Т-клетки Vδ1+ в эпителии реагируют на стрессированные эпителиальные клетки. [58]
иммунный Гуморальный ответ
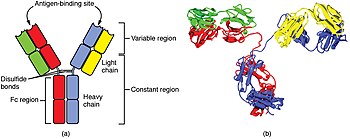
В - клетка идентифицирует патогены, когда антитела на ее поверхности связываются со специфическим чужеродным антигеном. [74] Этот комплекс антиген/антитело поглощается В-клеткой и посредством протеолиза перерабатывается в пептиды . Затем В-клетка отображает эти антигенные пептиды на своих поверхностных молекулах MHC класса II. Эта комбинация MHC и антигена привлекает соответствующую Т-хелперную клетку, которая высвобождает лимфокины и активирует В-клетку. [75] Когда активированная В-клетка начинает делиться , ее потомство ( плазматические клетки ) секретируют миллионы копий антитела, распознающего этот антиген. Эти антитела циркулируют в плазме крови и лимфе , связываются с патогенами, экспрессирующими антиген, и маркируют их для разрушения путем активации комплемента или для поглощения и разрушения фагоцитами . Антитела также могут напрямую нейтрализовать проблемы, связываясь с бактериальными токсинами или воздействуя на рецепторы, которые вирусы и бактерии используют для заражения клеток. [76]
Новорожденные младенцы ранее не подвергались воздействию микробов и особенно уязвимы для инфекций. Мать обеспечивает несколько уровней пассивной защиты. Во время беременности антитела определенного типа, называемые IgG , передаются от матери к ребенку непосредственно через плаценту , поэтому человеческие младенцы имеют высокий уровень антител даже при рождении, с тем же диапазоном антигенной специфичности, что и у их матери. [77] Грудное молоко или молозиво также содержат антитела, которые передаются в кишечник ребенка и защищают от бактериальных инфекций до тех пор, пока новорожденный не сможет синтезировать собственные антитела. [78] Это пассивный иммунитет , поскольку плод на самом деле не вырабатывает никаких клеток памяти или антител, а лишь заимствует их. Этот пассивный иммунитет обычно кратковременный, от нескольких дней до нескольких месяцев. В медицине защитный пассивный иммунитет может передаваться и искусственно от одного человека к другому. [79]
Иммунологическая память [ править ]
Когда В-клетки и Т-клетки активируются и начинают размножаться, некоторые из их потомков становятся долгоживущими клетками памяти. На протяжении всей жизни животного эти клетки памяти запоминают каждый встреченный конкретный патоген и могут дать сильный ответ, если патоген будет обнаружен снова. Т-клетки распознают патогены с помощью небольших белковых сигналов инфекции, называемых антигенами, которые непосредственно связываются с поверхностными рецепторами Т-клеток. [80] В-клетки используют белок иммуноглобулин для распознавания патогенов по их антигенам. [81] Это «адаптивный», потому что он происходит в течение жизни человека как адаптация к заражению этим патогеном и подготавливает иммунную систему к будущим вызовам. Иммунологическая память может быть в форме пассивной кратковременной памяти или активной долговременной памяти. [82]
Физиологическая регуляция [ править ]

Иммунная система участвует во многих аспектах физиологической регуляции организма. Иммунная система тесно взаимодействует с другими системами, такими как эндокринная. [83] [84] и нервный [85] [86] [87] системы. Иммунная система также играет решающую роль в эмбриогенезе (развитии эмбриона), а также в тканей восстановлении и регенерации . [88]
Гормоны [ править ]
Гормоны могут действовать как иммуномодуляторы , изменяя чувствительность иммунной системы. Например, женские половые гормоны являются известными иммуностимуляторами как адаптивной, так и иммунной системы. [89] и врожденные иммунные реакции. [90] Некоторые аутоиммунные заболевания, такие как красная волчанка, поражают преимущественно женщин, и их начало часто совпадает с периодом полового созревания . Напротив, мужские половые гормоны , такие как тестостерон, оказывают иммунодепрессивное действие . [91] Другие гормоны, по-видимому, также регулируют иммунную систему, в первую очередь пролактин , гормон роста и витамин D. [92] [93]
Витамин D [ править ]
Хотя клеточные исследования показывают, что витамин D имеет рецепторы и возможные функции в иммунной системе, нет клинических доказательств того, что дефицит витамина D увеличивает риск иммунных заболеваний, а прием добавок с витамином D снижает риск иммунных заболеваний. [94] США за 2011 год В отчете Института медицины говорится, что «результаты, связанные с... функционированием иммунной системы, аутоиммунными нарушениями и инфекциями... не могут быть надежно связаны с потреблением кальция или витамина D и часто противоречивы». [95] : 5
Сон и отдых [ править ]
На иммунную систему влияют сон и отдых, а лишение сна вредно для иммунной функции. [96] Сложные петли обратной связи с участием цитокинов , таких как интерлейкин-1 и фактор некроза опухоли-α, вырабатываемые в ответ на инфекцию, по-видимому, также играют роль в регуляции сна с медленными движениями глаз ( REM ). [97] Таким образом, иммунный ответ на инфекцию может привести к изменениям в цикле сна, включая увеличение медленноволнового сна по сравнению с быстрым сном. [98]
У людей с депривацией сна активная иммунизация может иметь меньший эффект и может привести к снижению выработки антител и более низкому иммунному ответу, чем было бы отмечено у хорошо отдохнувшего человека. [99] Кроме того, такие белки, как NFIL3 , которые, как было показано, тесно связаны как с дифференцировкой Т-клеток, так и с циркадными ритмами , могут подвергаться воздействию из-за нарушения естественного цикла освещения и темноты в результате лишения сна. Эти нарушения могут привести к увеличению числа хронических заболеваний, таких как болезни сердца, хронические боли и астма. [100]
Было показано, что помимо негативных последствий лишения сна сон и взаимосвязанная циркадная система оказывают сильное регуляторное воздействие на иммунологические функции, влияя как на врожденный, так и на адаптивный иммунитет. Во-первых, на ранней стадии медленноволнового сна внезапное падение уровня кортизола , адреналина и норадреналина в крови вызывает повышение уровня в крови гормонов лептина , гормона роста гипофиза и пролактина . Эти сигналы вызывают провоспалительное состояние посредством продукции провоспалительных цитокинов интерлейкина-1, интерлейкина-12 , TNF-альфа и IFN-гамма . Эти цитокины затем стимулируют иммунные функции, такие как активация, пролиферация и дифференцировка иммунных клеток . В это время медленно развивающегося адаптивного иммунного ответа наблюдается пик недифференцированных или менее дифференцированных клеток, таких как наивные и центральные Т-клетки памяти. Помимо этих эффектов, среда вырабатываемых в это время гормонов (лептина, гормона роста гипофиза и пролактина) поддерживает взаимодействие между АПК и Т-клетками, сдвиг Th 1 1/T h 2 Баланс цитокинов приближается к тому, который поддерживает Th , увеличение общей пролиферации клеток Th и наивной миграции Т-клеток в лимфатические узлы. Считается также, что это способствует формированию долговременной иммунной памяти посредством инициации иммунных ответов Th1. [101]
В периоды бодрствования дифференцированные эффекторные клетки, такие как цитотоксические естественные клетки-киллеры и цитотоксические Т-лимфоциты, достигают пика, вызывая эффективный ответ против любых вторгшихся патогенов. Противовоспалительные молекулы, такие как кортизол и катехоламины , также достигают пика во время активного бодрствования. Воспаление может вызвать серьезные когнитивные и физические нарушения, если оно произойдет во время бодрствования, а воспаление может возникнуть во время сна из-за присутствия мелатонина . Воспаление вызывает сильный окислительный стресс , и присутствие мелатонина во время сна может активно противодействовать выработке свободных радикалов в это время. [101] [102]
Физические упражнения [ править ]
Физические нагрузки положительно влияют на иммунную систему и в зависимости от частоты и интенсивности смягчают патогенное воздействие заболеваний, вызванных бактериями и вирусами. [103] Сразу после интенсивных тренировок возникает временная иммунодепрессия, при которой снижается количество циркулирующих лимфоцитов и снижается выработка антител. Это может открыть окно возможностей для заражения и реактивации латентных вирусных инфекций. [104] но доказательства неубедительны. [105] [106]
Изменения на клеточном уровне [ править ]

Во время физических упражнений увеличивается количество циркулирующих лейкоцитов всех типов. Это вызвано силой трения крови, текущей по поверхности эндотелиальных клеток , и катехоламинами, влияющими на β-адренергические рецепторы (βAR). [104] Количество нейтрофилов в крови увеличивается и остается повышенным до шести часов, незрелые формы присутствуют . Хотя увеличение количества нейтрофилов (« нейтрофилия ») аналогично тому, которое наблюдается при бактериальных инфекциях, после тренировки популяция клеток возвращается к норме примерно через 24 часа. [104]
Количество циркулирующих лимфоцитов (в основном естественных клеток-киллеров ) снижается во время интенсивных упражнений, но возвращается к норме через 4–6 часов. Хотя до 2% клеток погибают, большинство из них мигрирует из крови в ткани, главным образом в кишечник и легкие, где возбудителей . наиболее вероятно появление [104]
Некоторые моноциты покидают кровообращение и мигрируют в мышцы, где дифференцируются и становятся макрофагами . [104] Эти клетки дифференцируются на два типа: пролиферативные макрофаги, отвечающие за увеличение количества стволовых клеток , и восстановительные макрофаги, участвующие в их созревании до мышечных клеток. [107]
Ремонт и регенерация [ править ]
Иммунная система, особенно ее врожденный компонент, играет решающую роль в восстановлении тканей после повреждения . Ключевые действующие лица включают макрофаги и нейтрофилы другие клеточные действующие лица, в том числе γδ Т-клетки , врожденные лимфоидные клетки (ILC) и регуляторные Т-клетки , но также важны и (Treg). Пластичность иммунных клеток и баланс между провоспалительными и противовоспалительными сигналами являются важнейшими аспектами эффективного восстановления тканей. Иммунные компоненты и пути также участвуют в регенерации, например, у амфибий, таких как регенерация конечностей аксолотля . Согласно одной из гипотез, организмы, способные к регенерации ( например , аксолотли ), могут быть менее иммунокомпетентными, чем организмы, которые не могут регенерировать. [108]
Нарушения иммунитета человека [ править ]
Сбои защиты хозяина происходят и делятся на три широкие категории: иммунодефициты, [109] аутоиммунитет, [110] и гиперчувствительность. [111]
Иммунодефициты [ править ]
Иммунодефициты возникают, когда один или несколько компонентов иммунной системы неактивны. Способность иммунной системы реагировать на патогены снижается как у молодых, так и у пожилых людей , причем иммунные реакции начинают снижаться примерно в 50 лет из-за иммуностарения . [112] [113] В развитых странах ожирение , алкоголизм и употребление наркотиков являются распространенными причинами плохой иммунной функции, а недостаточное питание наиболее распространенной причиной иммунодефицита является в развивающихся странах . [113] Диеты с недостатком белка связаны с нарушением клеточного иммунитета, активности комплемента, функции фагоцитов, концентрации антител IgA и продукции цитокинов. Кроме того, потеря тимуса в раннем возрасте в результате генетической мутации или хирургического удаления приводит к тяжелому иммунодефициту и высокой восприимчивости к инфекциям. [114] Иммунодефициты также могут быть наследственными или « приобретенными ». [115] Тяжелый комбинированный иммунодефицит — редкое генетическое заболевание, характеризующееся нарушением развития функциональных Т- и В-клеток, вызванное многочисленными генетическими мутациями. [116] Хроническая гранулематозная болезнь , при которой фагоциты имеют сниженную способность уничтожать возбудители, является примером наследственного или врожденного иммунодефицита . СПИД и некоторые виды рака вызывают приобретенный иммунодефицит. [117] [118]
Аутоиммунитет [ править ]

Сверхактивные иммунные реакции образуют другой конец иммунной дисфункции, особенно аутоиммунных заболеваний . Здесь иммунная система не может правильно отличить свое от чужого и атакует часть тела. В нормальных условиях многие Т-клетки и антитела реагируют с «собственными» пептидами. [119] Одна из функций специализированных клеток (расположенных в тимусе и костном мозге) — снабжать молодые лимфоциты аутоантигенами, вырабатываемыми во всем организме, и элиминировать те клетки, которые распознают аутоантигены , предотвращая аутоиммунитет. [74] Распространенные аутоиммунные заболевания включают тиреоидит Хашимото , [120] ревматоидный артрит , [121] сахарный диабет 1 типа , [122] и системная красная волчанка . [123]
Гиперчувствительность [ править ]
Гиперчувствительность – это иммунный ответ, который повреждает собственные ткани организма. Ее разделяют на четыре класса (тип I – IV) в зависимости от задействованных механизмов и течения реакции гиперчувствительности. Гиперчувствительность I типа представляет собой реакцию немедленного типа или анафилактическую реакцию, часто связанную с аллергией. Симптомы могут варьироваться от легкого дискомфорта до смерти. Гиперчувствительность I типа опосредуется IgE , который запускает дегрануляцию тучных клеток и базофилов при их сшивании антигеном. [124] Гиперчувствительность II типа возникает, когда антитела связываются с антигенами на собственных клетках человека, маркируя их для разрушения. Это также называется антителозависимой (или цитотоксической) гиперчувствительностью и опосредовано антителами IgG и IgM . [124] Иммунные комплексы (агрегаты антигенов, белков комплемента и антител IgG и IgM), отложившиеся в различных тканях, вызывают реакции гиперчувствительности III типа. [124] Гиперчувствительность IV типа (также известная как гиперчувствительность клеточно-опосредованного или замедленного типа ) обычно развивается через два-три дня. Реакции IV типа участвуют во многих аутоиммунных и инфекционных заболеваниях, но могут также включать контактный дерматит . Эти реакции опосредуются Т-клетками , моноцитами и макрофагами . [124]
воспаление Идиопатическое
Воспаление является одной из первых реакций иммунной системы на инфекцию. [44] но оно может появиться без известной причины.
Воспаление вызывают эйкозаноиды и цитокины , которые выделяются поврежденными или инфицированными клетками. Эйкозаноиды включают простагландины , вызывающие лихорадку и расширение кровеносных сосудов , связанное с воспалением, а также лейкотриены , которые привлекают определенные лейкоциты (лейкоциты). [45] [46] Общие цитокины включают интерлейкины , которые отвечают за связь между лейкоцитами; хемокины , которые способствуют хемотаксису ; и интерфероны , обладающие противовирусным действием, например, останавливающие синтез белка в клетке-хозяине. [47] факторы роста Также могут высвобождаться и цитотоксические факторы. Эти цитокины и другие химические вещества привлекают иммунные клетки к месту инфекции и способствуют заживлению любых поврежденных тканей после удаления патогенов. [48]
Манипуляция в медицине [ править ]

Иммунным ответом можно манипулировать, чтобы подавить нежелательные реакции, возникающие в результате аутоиммунитета, аллергии и отторжения трансплантата , а также стимулировать защитные реакции против патогенов, которые в значительной степени ускользают от иммунной системы (см. иммунизация ) или рака. [125]
Иммуносупрессия [ править ]
Иммунодепрессанты используются для контроля аутоиммунных нарушений или воспалений при чрезмерном повреждении тканей, а также для предотвращения отторжения после трансплантации органов . [126] [127]
Противовоспалительные препараты часто используются для контроля последствий воспаления. Глюкокортикоиды являются наиболее мощными из этих препаратов и могут иметь множество нежелательных побочных эффектов , таких как центральное ожирение , гипергликемия и остеопороз . [128] Их использование строго контролируется. Более низкие дозы противовоспалительных препаратов часто используются в сочетании с цитотоксическими или иммунодепрессантами, такими как метотрексат или азатиоприн .
Цитотоксические препараты подавляют иммунный ответ, убивая делящиеся клетки, такие как активированные Т-клетки. Это убийство носит неизбирательный характер и другие постоянно делящиеся клетки и их органы, что вызывает токсические побочные эффекты. затрагивает [127] Иммуносупрессивные препараты, такие как циклоспорин, не позволяют Т-клеткам правильно реагировать на сигналы, ингибируя пути передачи сигнала . [129]
Иммуностимуляция [ править ]
Заявления продавцов различных продуктов и поставщиков альтернативных медицинских услуг , таких как мануальные терапевты , гомеопаты и иглотерапевты, о том, что они способны стимулировать или «повышать» иммунную систему, обычно не имеют значимого объяснения и доказательств эффективности. [130]
Вакцинация [ править ]

Долговременная активная память приобретается после инфекции путем активации В- и Т-клеток. Активный иммунитет можно создать и искусственно, путем вакцинации . Принцип вакцинации (также называемый иммунизацией ) заключается во введении антигена возбудителя для стимуляции иммунной системы и развития специфического иммунитета против этого конкретного возбудителя, не вызывая при этом заболевания, связанного с этим организмом. [131] Эта преднамеренная индукция иммунного ответа является успешной, поскольку она использует естественную специфичность иммунной системы, а также ее индуцируемость. Поскольку инфекционные заболевания остаются одной из основных причин смертности населения, вакцинация представляет собой наиболее эффективную манипуляцию иммунной системой, разработанную человечеством. [57] [132]
Многие вакцины основаны на бесклеточных компонентах микроорганизмов, в том числе на безвредных токсинных компонентах. [131] Поскольку многие антигены, полученные из бесклеточных вакцин, не вызывают сильного адаптивного ответа, большинство бактериальных вакцин снабжены дополнительными адъювантами , которые активируют антигенпрезентирующие клетки врожденной иммунной системы и максимизируют иммуногенность . [133]
Иммунология опухолей
Другая важная роль иммунной системы – выявление и устранение опухолей . Это называется иммунным надзором . Трансформированные клетки опухолей экспрессируют антигены , не встречающиеся в нормальных клетках. Для иммунной системы эти антигены кажутся чужеродными, и их присутствие заставляет иммунные клетки атаковать трансформированные опухолевые клетки. Антигены, экспрессируемые опухолями, имеют несколько источников; [134] некоторые происходят из онкогенных вирусов, таких как вирус папилломы человека , вызывающий рак шейки матки ; [135] вульва , влагалище , пенис , анус , рот и горло , [136] в то время как другие представляют собой собственные белки организма, которые присутствуют на низких уровнях в нормальных клетках, но достигают высоких уровней в опухолевых клетках. Одним из примеров является фермент тирозиназа , который при высоком уровне экспрессии превращает определенные клетки кожи (например, меланоциты ) в опухоли, называемые меланомами . [137] [138] Третьим возможным источником опухолевых антигенов являются белки, обычно важные для регуляции роста и выживания клеток , которые обычно мутируют в вызывающие рак молекулы, называемые онкогенами . [134] [139] [140]

Основной реакцией иммунной системы на опухоли является уничтожение аномальных клеток с помощью Т-клеток-киллеров, иногда с помощью Т-хелперов. [138] [142] Опухолевые антигены представлены на молекулах MHC класса I аналогично вирусным антигенам. Это позволяет Т-киллерам распознавать опухолевую клетку как аномальную. [143] NK-клетки также убивают опухолевые клетки аналогичным образом, особенно если опухолевые клетки имеют на поверхности меньше молекул MHC класса I, чем обычно; это обычное явление при опухолях. [144] Иногда антитела генерируются против опухолевых клеток, что позволяет системе комплемента уничтожить их . [139]
Некоторые опухоли уклоняются от иммунной системы и перерастают в рак. [145] [146] Опухолевые клетки часто имеют на своей поверхности уменьшенное количество молекул MHC класса I, что позволяет избежать обнаружения Т-клетками-киллерами. [143] [145] Некоторые опухолевые клетки также выделяют продукты, подавляющие иммунный ответ; например, секретируя цитокин TGF-β , который подавляет активность макрофагов и лимфоцитов . [145] [147] Кроме того, к опухолевым антигенам может развиться иммунологическая толерантность , поэтому иммунная система больше не атакует опухолевые клетки. [145] [146]
Парадоксально, но макрофаги могут способствовать росту опухоли. [148] когда опухолевые клетки посылают цитокины, которые привлекают макрофаги, которые затем генерируют цитокины и факторы роста, такие как фактор некроза опухоли альфа , которые способствуют развитию опухоли или способствуют пластичности стволовых клеток. [145] Кроме того, сочетание гипоксии в опухоли и цитокина, продуцируемого макрофагами, побуждает опухолевые клетки снижать выработку белка, который блокирует метастазирование и тем самым способствует распространению раковых клеток. [145] Противоопухолевые макрофаги М1 рекрутируются на ранних стадиях развития опухоли, но постепенно дифференцируются в М2 с проопухолевым эффектом, переключая иммуносупрессор. Гипоксия снижает выработку цитокинов для противоопухолевого ответа, и макрофаги постепенно приобретают проопухолевые функции М2, управляемые микроокружением опухоли, включая IL-4 и IL-10. [149] Иммунотерапия рака охватывает медицинские способы стимуляции иммунной системы для борьбы с раковыми опухолями. [150]
иммуногенности Прогнозирование
Некоторые лекарства могут вызывать нейтрализующий иммунный ответ, то есть иммунная система вырабатывает нейтрализующие антитела , которые противодействуют действию лекарств, особенно если лекарства вводятся неоднократно или в больших дозах. Это ограничивает эффективность препаратов на основе более крупных пептидов и белков (которые обычно имеют размер более 6000 Да ). [151] В некоторых случаях препарат сам по себе не является иммуногенным, но его можно вводить совместно с иммуногенным соединением, как это иногда бывает с Таксолом . Были разработаны вычислительные методы для прогнозирования иммуногенности пептидов и белков, которые особенно полезны при разработке терапевтических антител, оценке вероятной вирулентности мутаций в частицах вирусной оболочки и проверке предлагаемых лекарственных средств на основе пептидов. Ранние методы основывались главным образом на наблюдении, что гидрофильные аминокислоты более представлены в эпитопных областях, чем гидрофобные аминокислоты; [152] однако более поздние разработки основаны на методах машинного обучения с использованием баз данных существующих известных эпитопов, обычно на хорошо изученных вирусных белках, в качестве обучающего набора . [153] Была создана общедоступная база данных для каталогизации эпитопов патогенов, о которых известно, что они распознаются В-клетками. [154] Развивающаяся область исследований иммуногенности, основанная на биоинформатике, называется иммуноинформатикой . [155] Иммунопротеомика — это изучение больших наборов белков ( протеомика ), участвующих в иммунном ответе. [156]
Эволюция и другие механизмы [ править ]
Эволюция иммунной системы [ править ]
Вполне вероятно, что многокомпонентная адаптивная иммунная система возникла у первых позвоночных , поскольку беспозвоночные не генерируют лимфоциты или гуморальный ответ на основе антител. [157] развилась, Иммунная система у вторичноротых как показано на кладограмме. [157]
Однако многие виды используют механизмы, которые, по-видимому, являются предшественниками этих аспектов иммунитета позвоночных. Иммунные системы появляются даже у простейших в структурном отношении форм жизни: бактерии используют уникальный защитный механизм, называемый системой модификации рестрикции, для защиты от вирусных патогенов, называемых бактериофагами . [158] Прокариоты ( бактерии и археи ) также обладают приобретенным иммунитетом благодаря системе, которая использует последовательности CRISPR для сохранения фрагментов геномов фагов, с которыми они контактировали в прошлом, что позволяет им блокировать репликацию вируса посредством формы РНК-интерференции. . [159] [160] Прокариоты обладают и другими защитными механизмами. [161] [162] Наступательные элементы иммунной системы также присутствуют у одноклеточных эукариот , но исследований их роли в защите мало. [163]
Рецепторы распознавания образов — это белки, используемые почти всеми организмами для идентификации молекул, связанных с патогенами. Антимикробные пептиды , называемые дефенсинами, являются эволюционно консервативным компонентом врожденного иммунного ответа, обнаруженного у всех животных и растений, и представляют собой основную форму системного иммунитета беспозвоночных. [157] Система комплемента и фагоцитарные клетки также используются большинством форм жизни беспозвоночных. Рибонуклеазы и путь РНК-интерференции консервативны у всех эукариот и, как полагают, играют роль в иммунном ответе на вирусы. [164]
В отличие от животных, растениям не хватает фагоцитирующих клеток, но многие иммунные реакции растений включают системные химические сигналы, которые передаются через растение. [165] Отдельные растительные клетки реагируют на молекулы, связанные с патогенами, известные как молекулярные паттерны, связанные с патогенами, или PAMP. [166] Когда часть растения заражается, растение вызывает локализованную гиперчувствительную реакцию , при которой клетки в месте заражения подвергаются быстрому апоптозу , чтобы предотвратить распространение заболевания на другие части растения. Системная приобретенная устойчивость — это тип защитной реакции, используемой растениями, которая делает все растение устойчивым к определенному инфекционному агенту. [165] Механизмы подавления РНК особенно важны в этом системном ответе, поскольку они могут блокировать репликацию вируса . [167]
иммунная Альтернативная система адаптивная
Эволюция адаптивной иммунной системы произошла у предка челюстных позвоночных . Многие классические молекулы адаптивной иммунной системы (например, иммуноглобулины и Т-клеточные рецепторы ) существуют только у челюстных позвоночных. Отдельная молекула, происходящая из лимфоцитов , была обнаружена у примитивных бесчелюстных позвоночных , таких как минога и миксина . Эти животные обладают большим набором молекул, называемых вариабельными рецепторами лимфоцитов (VLR), которые, как и рецепторы антигенов челюстных позвоночных, производятся лишь из небольшого числа (одного или двух) генов . Считается, что эти молекулы связывают патогенные антигены аналогично антителам и с той же степенью специфичности. [168]
Манипуляция патогенами [ править ]
Успех любого патогена зависит от его способности ускользать от иммунного ответа хозяина. Таким образом, патогены разработали несколько методов, которые позволяют им успешно заражать хозяина, избегая при этом обнаружения или уничтожения иммунной системой. [169] Бактерии часто преодолевают физические барьеры, выделяя ферменты, расщепляющие барьер, например, используя систему секреции II типа . [170] Альтернативно, используя систему секреции типа III , они могут вставить полую трубку в клетку-хозяина, обеспечивая прямой путь перемещения белков от патогена к хозяину. Эти белки часто используются для отключения защиты хозяина. [171]
Стратегия уклонения, используемая некоторыми патогенами, чтобы избежать воздействия врожденной иммунной системы, заключается в сокрытии внутри клеток хозяина (также называемая внутриклеточным патогенезом ). Здесь патоген проводит большую часть своего жизненного цикла внутри клеток-хозяев, где он защищен от прямого контакта с иммунными клетками, антителами и комплементом. Некоторые примеры внутриклеточных патогенов включают вирусы, пищевого отравления бактерию Salmonella и эукариотических паразитов, вызывающих малярию ( Plasmodium виды ) и лейшманиоз ( Leishmania виды ). Другие бактерии, такие как Mycobacterium Tuberculosis , живут внутри защитной капсулы, которая предотвращает лизис комплементом. [172] Многие патогены выделяют соединения, которые ослабляют или неправильно направляют иммунный ответ хозяина. [169] Некоторые бактерии образуют биопленки , чтобы защитить себя от клеток и белков иммунной системы. Такие биопленки присутствуют при многих успешных инфекциях, таких как хронические инфекции Pseudomonas aeruginosa и Burkholderia cenocepacia, характерные для муковисцидоза . [173] Другие бактерии генерируют поверхностные белки, которые связываются с антителами, делая их неэффективными; примеры включают Streptococcus (белок G), Staphylococcus aureus (белок A) и Peptostreptococcus magnus (белок L). [174]
Механизмы, используемые для уклонения от адаптивной иммунной системы, более сложны. Самый простой подход — быстро заменить несущественные эпитопы ( аминокислоты и/или сахара) на поверхности патогена, сохраняя при этом незаменимые эпитопы скрытыми. Это называется антигенной вариацией . Примером является ВИЧ, который быстро мутирует, поэтому белки его вирусной оболочки , необходимые для проникновения в клетку-мишень, постоянно меняются. Эти частые изменения антигенов могут объяснить неудачи вакцин, направленных против этого вируса. [175] Паразит Trypanosoma brucei использует аналогичную стратегию, постоянно переключая один тип поверхностного белка на другой, что позволяет ему оставаться на шаг впереди реакции антител. [176] Маскирование антигенов молекулами хозяина — еще одна распространенная стратегия предотвращения обнаружения иммунной системой. При ВИЧ оболочка, покрывающая вирион, формируется из внешней мембраны клетки-хозяина; такие «самозамаскированные» вирусы мешают иммунной системе идентифицировать их как «чужие» структуры. [177]
История иммунологии [ править ]

Иммунология – наука, изучающая строение и функции иммунной системы. Оно берет свое начало в медицине и ранних исследованиях причин иммунитета к болезням. Самое раннее известное упоминание об иммунитете было во время афинской чумы в 430 году до нашей эры. Фукидид отмечал, что люди, выздоровевшие от предыдущего приступа болезни, могут выхаживать больных, не заражаясь болезнью во второй раз. [179] В 18 веке Пьер-Луи Моро де Мопертюи экспериментировал с ядом скорпиона и заметил, что некоторые собаки и мыши невосприимчивы к этому яду. [180] В 10 веке персидский врач ар-Рази (также известный как Разес) написал первую зарегистрированную теорию приобретенного иммунитета. [181] [182] отметив, что оспа защитила выживших от будущих инфекций. Хотя он объяснил иммунитет тем, что «лишняя влага» выводится из крови, что предотвращает повторное возникновение заболевания, эта теория объяснила многие наблюдения об оспе, известные в то время. [183]
Эти и другие наблюдения приобретенного иммунитета позже были использованы Луи Пастером при разработке вакцинации и предложенной им микробной теории болезней . [184] Теория Пастера находилась в прямом противоречии с современными теориями болезней, такими как теория миазмов . Лишь после Роберта Коха в 1891 году доказательств , за которые он был удостоен Нобелевской премии в 1905 году, микроорганизмы были подтверждены как причина инфекционных заболеваний . [185] открыл желтой лихорадки вирус Вирусы были признаны патогенными для человека в 1901 году, когда Уолтер Рид . [186]
К концу XIX века иммунология добилась большого прогресса благодаря быстрому развитию исследований гуморального и клеточного иммунитета . [187] Особенно важной была работа Пауля Эрлиха , который предложил теорию боковой цепи для объяснения специфичности реакции антиген-антитело ; его вклад в понимание гуморального иммунитета был отмечен присуждением совместной Нобелевской премии в 1908 году вместе с основателем клеточной иммунологии Эли Мечниковым . [178] В 1974 году Нильс Кай Йерне разработал теорию иммунной сети ; он разделил Нобелевскую премию в 1984 году с Жоржем Кёлером и Сезаром Мильштейном за теории, связанные с иммунной системой. [188] [189]
См. также [ править ]
- Fc-рецептор
- Иммуностимулятор
- Список различных типов клеток в организме взрослого человека
- Нейроиммунная система
- Первородный антигенный грех – когда иммунная система использует иммунологическую память при встрече с немного другим патогеном.
- Устойчивость растений к болезням
- Поликлональный ответ
- Опухолевые антигены
Ссылки [ править ]
Цитаты [ править ]
- ^ Sompayrac 2019 , с. 1.
- ^ Jump up to: Перейти обратно: а б Литман Г.В., Кэннон Дж.П., Дишоу Л.Дж. (ноябрь 2005 г.). «Реконструкция иммунной филогении: новые перспективы» . Обзоры природы. Иммунология . 5 (11): 866–79. дои : 10.1038/nri1712 . ПМЦ 3683834 . ПМИД 16261174 .
- ^ Sompayrac 2019 , с. 4.
- ^ Рестифо Н.П., Гаттинони Л. (октябрь 2013 г.). «Происхождение эффекторных Т-клеток и Т-клеток памяти» . Современное мнение в иммунологии . 25 (5): 556–63. дои : 10.1016/j.coi.2013.09.003 . ПМЦ 3858177 . ПМИД 24148236 .
- ^ Куросаки Т., Кометани К., Исэ В. (март 2015 г.). «В-клетки памяти». Обзоры природы. Иммунология . 15 (3): 149–59. дои : 10.1038/nri3802 . ПМИД 25677494 . S2CID 20825732 .
- ^ Sompayrac 2019 , с. 11.
- ^ Sompayrac 2019 , с. 146.
- ^ Альбертс и др. 2002 г. , с. «Патогены преодолевают защитные барьеры и колонизируют хозяина» .
- ^ Бойтон Р.Дж., Опеншоу П.Дж. (2002). «Легочная защита при острой респираторной инфекции» . Британский медицинский бюллетень . 61 (1): 1–12. дои : 10.1093/bmb/61.1.1 . ПМИД 11997295 .
- ^ Агерберт Б., Гудмундссон Г.Х. (2006). «Пептиды противомикробной защиты хозяина при заболеваниях человека». Антимикробные пептиды и болезни человека . Актуальные темы микробиологии и иммунологии. Том. 306. стр. 67–90. дои : 10.1007/3-540-29916-5_3 . ISBN 978-3-540-29915-8 . ПМИД 16909918 .
- ^ Моро Дж.М., Гиргис Д.О., Хьюм Э.Б., Дайкс Дж.Дж., Остин М.С., О'Каллаган Р.Дж. (сентябрь 2001 г.). «Фосфолипаза А (2) в слезах кролика: защита хозяина от золотистого стафилококка» . Исследовательская офтальмология и визуальные науки . 42 (10): 2347–54. ПМИД 11527949 .
- ^ Ханкевич Дж., Сверчек Э. (декабрь 1974 г.). «Лизоцим в жидкостях организма человека». Клиника Химика Акта; Международный журнал клинической химии . 57 (3): 205–09. дои : 10.1016/0009-8981(74)90398-2 . ПМИД 4434640 .
- ^ Фэйр В.Р., Коуч Дж., Венер Н. (февраль 1976 г.). «Простатический антибактериальный фактор. Идентичность и значение». Урология . 7 (2): 169–77. дои : 10.1016/0090-4295(76)90305-8 . ПМИД 54972 .
- ^ Йенугу С., Хамиль К.Г., Бирсе С.Э., Рубен С.М., Френч Ф.С., Холл Ш.Х. (июнь 2003 г.). «Антибактериальные свойства спермосвязывающих белков и пептидов семейства придатков яичка 2 (НЕ2) человека; чувствительность к соли, структурная зависимость и их взаимодействие с внешними и цитоплазматическими мембранами Escherichia coli» . Биохимический журнал . 372 (Часть 2): 473–83. дои : 10.1042/BJ20030225 . ПМЦ 1223422 . ПМИД 12628001 .
- ^ Смит Дж.Л. (2003). «Роль желудочной кислоты в предотвращении болезней пищевого происхождения и то, как бактерии преодолевают кислотную среду» . J Пищевая прот . 66 (7): 1292–1303. дои : 10.4315/0362-028X-66.7.1292 . ПМИД 12870767 .
- ^ Горбач С.Л. (февраль 1990 г.). «Молочнокислые бактерии и здоровье человека». Анналы медицины . 22 (1): 37–41. дои : 10.3109/07853899009147239 . ПМИД 2109988 .
- ^ Меджитов Р. (октябрь 2007 г.). «Распознавание микроорганизмов и активация иммунного ответа» . Природа . 449 (7164): 819–26. Бибкод : 2007Natur.449..819M . дои : 10.1038/nature06246 . ПМИД 17943118 . S2CID 4392839 .
- ^ Мацингер П. (апрель 2002 г.). «Модель опасности: обновленное самоощущение» (PDF) . Наука . 296 (5566): 301–05. Бибкод : 2002Sci...296..301M . дои : 10.1126/science.1071059 . ПМИД 11951032 . S2CID 13615808 .
- ^ Jump up to: Перейти обратно: а б Альбертс и др. 2002 г. , Глава: «Врожденный иммунитет» .
- ^ Открытие 2019 , с. xi.
- ^ Кумар Х., Каваи Т., Акира С. (февраль 2011 г.). «Распознавание патогена врожденной иммунной системой». Международные обзоры иммунологии . 30 (1): 16–34. дои : 10.3109/08830185.2010.529976 . ПМИД 21235323 . S2CID 42000671 .
- ^ Шредер К., Чопп Дж. (март 2010 г.). «Инфламмасомы» . Клетка . 140 (6): 821–32. дои : 10.1016/j.cell.2010.01.040 . ПМИД 20303873 . S2CID 16916572 .
- ^ Sompayrac 2019 , с. 20.
- ^ Бейтлер Б., Цзян З., Джорджель П., Кроза К., Крокер Б., Ручманн С., Ду Икс, Хоэбе К. (2006). «Генетический анализ устойчивости хозяина: передача сигналов Toll-подобных рецепторов и иммунитет в целом». Ежегодный обзор иммунологии . 24 : 353–89. doi : 10.1146/annurev.immunol.24.021605.090552 . ПМИД 16551253 . S2CID 20991617 .
- ^ Ботос I, Сигал Д.М., Дэвис Д.Р. (апрель 2011 г.). «Структурная биология Toll-подобных рецепторов» . Структура . 19 (4): 447–59. дои : 10.1016/j.str.2011.02.004 . ПМК 3075535 . ПМИД 21481769 .
- ^ Виджай К. (июнь 2018 г.). «Толл-подобные рецепторы в иммунитете и воспалительных заболеваниях: прошлое, настоящее и будущее» . Интер Иммунофармакол . 59 : 391–412. дои : 10.1016/j.intimp.2018.03.002 . ПМК 7106078 . ПМИД 29730580 .
- ^ Томпсон М.Р., Камински Дж.Дж., Курт-Джонс Э.А., Фицджеральд К.А. (июнь 2011 г.). «Рецепторы распознавания образов и врожденный иммунный ответ на вирусную инфекцию» . Вирусы . 3 (6): 920–40. дои : 10.3390/v3060920 . ПМК 3186011 . ПМИД 21994762 .
- ^ Sompayrac 2019 , стр. 1–4.
- ^ Альбертс и др. 2002 г. , с. «Фагоцитарные клетки ищут, поглощают и уничтожают патогены» .
- ^ Райтер А. (1985). «Связь между ультраструктурой и специфическими функциями макрофагов». Сравнительная иммунология, микробиология и инфекционные болезни . 8 (2): 119–33. дои : 10.1016/0147-9571(85)90039-6 . ПМИД 3910340 .
- ^ Лангерманс Дж.А., Хазенбос В.Л., ван Фюрт Р. (сентябрь 1994 г.). «Антимикробные функции мононуклеарных фагоцитов». Журнал иммунологических методов . 174 (1–2): 185–94. дои : 10.1016/0022-1759(94)90021-3 . ПМИД 8083520 .
- ^ Мэй Р.К., Мачески Л.М. (март 2001 г.). «Фагоцитоз и актиновый цитоскелет» . Журнал клеточной науки . 114 (Часть 6): 1061–77. дои : 10.1242/jcs.114.6.1061 . ПМИД 11228151 . Архивировано из оригинала 31 марта 2020 года . Проверено 6 ноября 2009 г.
- ^ Зальцет М., Тасимски А., Купер Э. (2006). «Врожденный иммунитет у лофотрохозой: кольчатые черви» (PDF) . Текущий фармацевтический дизайн . 12 (24): 3043–50. дои : 10.2174/138161206777947551 . ПМИД 16918433 . S2CID 28520695 . Архивировано из оригинала (PDF) 31 марта 2020 года.
- ^ Зен К., Паркос, Калифорния (октябрь 2003 г.). «Лейкоцитарно-эпителиальные взаимодействия». Современное мнение в области клеточной биологии . 15 (5): 557–64. дои : 10.1016/S0955-0674(03)00103-0 . ПМИД 14519390 .
- ^ Jump up to: Перейти обратно: а б Ствртинова, Якубовский и Хулин 1995 , Глава: Воспаление и лихорадка .
- ^ Руа Р., McGavern DB (сентябрь 2015 г.). «Выяснение динамики и функции моноцитов/макрофагов с помощью прижизненной визуализации» . Журнал биологии лейкоцитов . 98 (3): 319–32. doi : 10.1189/jlb.4RI0115-006RR . ПМЦ 4763596 . ПМИД 26162402 .
- ^ Jump up to: Перейти обратно: а б Гермонпре П., Валладо Дж., Зитвогель Л., Тери С., Амигорена С. (2002). «Презентация антигена и стимуляция Т-клеток дендритными клетками». Ежегодный обзор иммунологии . 20 (1): 621–67. doi : 10.1146/annurev.immunol.20.100301.064828 . ПМИД 11861614 .
- ^ Кришнасвами, Аджитави и Чи 2006 , стр. 13–34.
- ^ Кариявасам Х.Х., Робинсон Д.С. (апрель 2006 г.). «Эозинофил: клетка и ее оружие, цитокины, ее расположение». Семинары по респираторной медицине и медицине интенсивной терапии . 27 (2): 117–27. дои : 10.1055/s-2006-939514 . ПМИД 16612762 . S2CID 260317790 .
- ^ Спитс Х, Купедо Т (2012). «Врожденные лимфоидные клетки: новые знания о развитии, родственных отношениях и функциях». Ежегодный обзор иммунологии . 30 : 647–75. doi : 10.1146/annurev-immunol-020711-075053 . ПМИД 22224763 .
- ^ Габриэлли С., Ортолани С., Дель Зотто Г., Лучетти Ф., Канонико Б., Буччелла Ф., Артиджианато М., Папа С., Замаи Л. (2016). «Воспоминания NK-клеток: внутренние перекрестные помехи врожденно-адаптивного иммунитета» . Журнал иммунологических исследований . 2016 : 1376595. дои : 10.1155/2016/1376595 . ПМК 5204097 . ПМИД 28078307 .
- ^ Берток и Чоу 2005 , с. 17 .
- ^ Раджалингам 2012 , Глава: Обзор системы иммуноглобулиноподобных рецепторов клеток-киллеров.
- ^ Jump up to: Перейти обратно: а б Каваи Т., Акира С. (февраль 2006 г.). «Врожденное иммунное распознавание вирусной инфекции» . Природная иммунология . 7 (2): 131–37. дои : 10.1038/ni1303 . ПМИД 16424890 . S2CID 9567407 .
- ^ Jump up to: Перейти обратно: а б Миллер С.Б. (август 2006 г.). «Простагландины в здоровье и болезни: обзор». Семинары по артриту и ревматизму . 36 (1): 37–49. дои : 10.1016/j.semarthrit.2006.03.005 . ПМИД 16887467 .
- ^ Jump up to: Перейти обратно: а б Огава Ю., Кэлхун В.Дж. (октябрь 2006 г.). «Роль лейкотриенов в воспалении дыхательных путей» . Журнал аллергии и клинической иммунологии . 118 (4): 789–98, викторина 799–800. дои : 10.1016/j.jaci.2006.08.009 . ПМИД 17030228 .
- ^ Jump up to: Перейти обратно: а б Ле Ю, Чжоу Ю, Ирибаррен П, Ван Дж (апрель 2004 г.). «Хемокины и хемокиновые рецепторы: их разнообразная роль в гомеостазе и заболеваниях» (PDF) . Клеточная и молекулярная иммунология . 1 (2): 95–104. ПМИД 16212895 .
- ^ Jump up to: Перейти обратно: а б Мартин П., Лейбович С.Дж. (ноябрь 2005 г.). «Воспалительные клетки при заживлении ран: хорошие, плохие и ужасные». Тенденции в клеточной биологии . 15 (11): 599–607. дои : 10.1016/j.tcb.2005.09.002 . ПМИД 16202600 .
- ^ Платнич Дж. М., Муруве Д. А. (февраль 2019 г.). «NOD-подобные рецепторы и воспалительные процессы: обзор их канонических и неканонических сигнальных путей». Архив биохимии и биофизики . 670 : 4–14. дои : 10.1016/j.abb.2019.02.008 . ПМИД 30772258 . S2CID 73464235 .
- ^ Jump up to: Перейти обратно: а б Рус Х, Кудричи С, Никулеску Ф (2005). «Роль системы комплемента во врожденном иммунитете». Иммунологические исследования . 33 (2): 103–12. дои : 10.1385/IR:33:2:103 . ПМИД 16234578 . S2CID 46096567 .
- ^ Дегн С.Е., Тиль С. (август 2013 г.). «Распознавание гуморальных образов и система комплемента» . Скандинавский журнал иммунологии . 78 (2): 181–93. дои : 10.1111/sji.12070 . ПМИД 23672641 .
- ^ Берток и Чоу 2005 , стр. 112–113 .
- ^ Лишевски М.К., Фаррис Т.К., Люблин Д.М., Руни И.А., Аткинсон Дж.П. (1996). Контроль системы комплемента . Достижения иммунологии. Том. 61. С. 201–283. дои : 10.1016/S0065-2776(08)60868-8 . ISBN 978-0-12-022461-6 . ПМИД 8834497 .
- ^ Сим Р.Б., Цифтсоглу С.А. (февраль 2004 г.). «Протеазы системы комплемента» (PDF) . Труды Биохимического общества . 32 (Часть 1): 21–27. дои : 10.1042/BST0320021 . ПМИД 14748705 . S2CID 24505041 . Архивировано из оригинала (PDF) 2 марта 2019 года.
- ^ Пансер З, Купер, доктор медицины (2006). «Эволюция адаптивного иммунитета». Ежегодный обзор иммунологии . 24 (1): 497–518. doi : 10.1146/annurev.immunol.24.021605.090542 . ПМИД 16551257 .
- ^ Sompayrac 2019 , с. 38.
- ^ Jump up to: Перейти обратно: а б с Джейнвей 2005 .
- ^ Jump up to: Перейти обратно: а б Хольтмайер В., Кабелиц Д. (2005). «Гаммадельта Т-клетки связывают врожденные и адаптивные иммунные реакции». Химическая иммунология и аллергия . 86 : 151–83. дои : 10.1159/000086659 . ISBN 3-8055-7862-8 . ПМИД 15976493 .
- ^ Вентури С., Вентури М. (сентябрь 2009 г.). «Йод, тимус и иммунитет». Питание . 25 (9): 977–79. дои : 10.1016/j.nut.2009.06.002 . ПМИД 19647627 .
- ^ Джейнвей, Трэверс и Уолпорт 2001 , сек. 12-10 .
- ^ Sompayrac 2019 , стр. 5–6.
- ^ Sompayrac 2019 , стр. 51–53.
- ^ Sompayrac 2019 , стр. 7–8.
- ^ Харти Дж.Т., Твиннерейм А.Р., Уайт Д.В. (2000). «Эффекторные механизмы CD8 + Т-клеток в устойчивости к инфекции». Ежегодный обзор иммунологии . 18 (1): 275–308. doi : 10.1146/annurev.immunol.18.1.275 . ПМИД 10837060 .
- ^ Jump up to: Перейти обратно: а б Радоя С., Фрей А.Б., Вукманович С. (2006). «События передачи сигналов Т-клеточного рецептора, запускающие экзоцитоз гранул». Критические обзоры по иммунологии . 26 (3): 265–90. doi : 10.1615/CritRevImmunol.v26.i3.40 . ПМИД 16928189 .
- ^ Аббас А.К., Мерфи К.М., Шер А. (октябрь 1996 г.). «Функциональное разнообразие Т-хелперных лимфоцитов». Природа . 383 (6603): 787–93. Бибкод : 1996Natur.383..787A . дои : 10.1038/383787a0 . ПМИД 8893001 . S2CID 4319699 .
- ^ Макхейзер-Уильямс Л.Дж., Малерб Л.П., МакХейзер-Уильямс М.Г. (2006). «В-клеточный иммунитет, регулируемый Т-хелперами». От врожденного иммунитета к иммунологической памяти . Актуальные темы микробиологии и иммунологии. Том. 311. стр. 59–83. дои : 10.1007/3-540-32636-7_3 . ISBN 978-3-540-32635-9 . ПМИД 17048705 .
- ^ Sompayrac 2019 , с. 8.
- ^ Ковач Б., Маус М.В., Райли Дж.Л., Дериманов Г.С., Корецкий Г.А., Джун Ч.Х., Финкель Т.Х. (ноябрь 2002 г.). «Человеческие CD8+ Т-клетки не требуют поляризации липидных рафтов для активации и пролиферации» . Труды Национальной академии наук Соединенных Штатов Америки . 99 (23): 15006–11. Бибкод : 2002PNAS...9915006K . дои : 10.1073/pnas.232058599 . ПМЦ 137535 . ПМИД 12419850 .
- ^ Альбертс и др. 2002 г. , Глава. «Т-хелперы и активация лимфоцитов» .
- ^ Гревал И.С., Флавелл Р.А. (1998). «CD40 и CD154 в клеточном иммунитете». Ежегодный обзор иммунологии . 16 (1): 111–35. doi : 10.1146/annurev.immunol.16.1.111 . ПМИД 9597126 .
- ^ Жирарди М. (январь 2006 г.). «Иммунонадзор и иммунорегуляция гаммадельта Т-клетками» . Журнал исследовательской дерматологии . 126 (1): 25–31. дои : 10.1038/sj.jid.5700003 . ПМИД 16417214 .
- ^ «Понимание иммунной системы: как она работает» (PDF) . Национальный институт аллергии и инфекционных заболеваний (НИАИД). Архивировано из оригинала (PDF) 3 января 2007 года . Проверено 1 января 2007 г.
- ^ Jump up to: Перейти обратно: а б Спроул Т.В., Ченг ПК, Дайкстра М.Л., Пирс С.К. (2000). «Роль процессинга антигена MHC класса II в развитии B-клеток». Международные обзоры иммунологии . 19 (2–3): 139–55. дои : 10.3109/08830180009088502 . ПМИД 10763706 . S2CID 6550357 .
- ^ Паркер, округ Колумбия (1993). «Т-клеточно-зависимая активация В-клеток». Ежегодный обзор иммунологии . 11 : 331–60. дои : 10.1146/annurev.iy.11.040193.001555 . ПМИД 8476565 .
- ^ Murphy & Weaver 2016 , Глава 10: Гуморальный иммунный ответ.
- ^ Саджи Ф., Самедзима Ю., Камиура С., Кояма М. (май 1999 г.). «Динамика иммуноглобулинов на границе плода и матери» (PDF) . Отзывы о репродукции . 4 (2): 81–89. дои : 10.1530/ror.0.0040081 . ПМИД 10357095 . S2CID 31099552 . Архивировано из оригинала (PDF) 30 января 2021 года.
- ^ Ван де Перре П. (июль 2003 г.). «Перенос антител через материнское молоко». Вакцина . 21 (24): 3374–76. дои : 10.1016/S0264-410X(03)00336-0 . ПМИД 12850343 .
- ^ Келлер М.А., Штим Э.Р. (октябрь 2000 г.). «Пассивный иммунитет в профилактике и лечении инфекционных заболеваний» . Обзоры клинической микробиологии . 13 (4): 602–14. дои : 10.1128/CMR.13.4.602-614.2000 . ПМЦ 88952 . ПМИД 11023960 .
- ^ Саулс Р.С., Маккосленд С., Тейлор Б.Н. Гистология, Т-клеточный лимфоцит. В: StatPearls. Издательство СтатПерлс; 2023. По состоянию на 15 ноября 2023 г. http://www.ncbi.nlm.nih.gov/books/NBK535433/
- ^ Альтвайкеб С.А., Бордони Б. Гистология, В-клеточные лимфоциты. В: StatPearls. Издательство СтатПерлс; 2023. По состоянию на 15 ноября 2023 г. http://www.ncbi.nlm.nih.gov/books/NBK560905/.
- ^ Sompayrac 2019 , с. 98.
- ^ Вик Дж., Ху Ю., Шварц С., Кремер Г. (октябрь 1993 г.). «Иммуноэндокринная связь через ось гипоталамо-гипофиз-надпочечники при аутоиммунных заболеваниях». Эндокринные обзоры . 14 (5): 539–63. дои : 10.1210/edrv-14-5-539 . ПМИД 8262005 .
- ^ Кремер Г., Брезинчек Х.П., Фесслер Р., Шауэнштайн К., Вик Г. (июнь 1988 г.). «Физиология и патология иммуноэндокринной обратной связи». Иммунология сегодня . 9 (6): 163–5. дои : 10.1016/0167-5699(88)91289-3 . ПМИД 3256322 .
- ^ Трахтенберг Э.Ф., Гольдберг Дж.Л. (октябрь 2011 г.). «Иммунология. Нейроиммунная коммуникация». Наука . 334 (6052): 47–8. Бибкод : 2011Sci...334...47T . дои : 10.1126/science.1213099 . ПМИД 21980100 . S2CID 36504684 .
- ^ Вейга-Фернандес Х., Мусида Д. (май 2016 г.). «Нейро-иммунные взаимодействия на барьерных поверхностях» . Клетка . 165 (4): 801–11. дои : 10.1016/j.cell.2016.04.041 . ПМЦ 4871617 . ПМИД 27153494 .
- ^ «Нейроиммунная коммуникация» . Природная неврология . 20 (2): 127. Февраль 2017 г. doi : 10.1038/nn.4496 . ПМИД 28092662 .
- ^ Уилкокс С.М., Арора Х., Манро Л., Синь Дж., Феннингер Ф., Джонсон Л.А., Пфайфер К.Г., Чой К.Б., Хоу Дж., Худлесс П.А., Джеффрис В.А. (2017). «Роль регуляторного гена врожденного иммунного ответа ABCF1 в эмбриогенезе и развитии млекопитающих» . ПЛОС ОДИН . 12 (5): e0175918. Бибкод : 2017PLoSO..1275918W . дои : 10.1371/journal.pone.0175918 . ПМЦ 5438103 . ПМИД 28542262 .
- ^ Вира, Крейн-Годро и Грант 2004 , Глава: Эндокринная регуляция иммунной системы слизистой оболочки женских репродуктивных путей.
- ^ Ланг Т.Дж. (декабрь 2004 г.). «Эстроген как иммуномодулятор». Клиническая иммунология . 113 (3): 224–30. дои : 10.1016/j.clim.2004.05.011 . ПМИД 15507385 .
Морияма А, Симоя К, Огата И, Кимура Т, Накамура Т, Вада Х, Охаши К, Адзума С, Саджи Ф, Мурата Ю (июль 1999 г.). «Концентрация ингибитора секреторной лейкоцитарной протеазы (SLPI) в цервикальной слизи женщин с нормальным менструальным циклом» . Молекулярная репродукция человека . 5 (7): 656–61. дои : 10.1093/моль/5.7.656 . ПМИД 10381821 .
Кутоло М., Сулли А., Капеллино С., Вилладжо Б., Монтанья П., Сериоло Б., Штрауб Р.Х. (2004). «Влияние половых гормонов на иммунную систему: основные и клинические аспекты аутоиммунитета». Волчанка . 13 (9): 635–38. дои : 10.1191/0961203304lu1094oa . ПМИД 15485092 . S2CID 23941507 .
Кинг А.Е., Кричли Х.О., Келли Р.В. (февраль 2000 г.). «Присутствие ингибитора секреторной лейкоцитарной протеазы в эндометрии человека и децидуальной оболочке первого триместра предполагает антибактериальную защитную роль» . Молекулярная репродукция человека . 6 (2): 191–96. дои : 10.1093/моль/6.2.191 . ПМИД 10655462 . - ^ Фиммел С., Зубулис CC (2005). «Влияние физиологического уровня андрогенов на заживление ран и иммунный статус у мужчин». Стареющий мужчина . 8 (3–4): 166–74. дои : 10.1080/13685530500233847 . ПМИД 16390741 . S2CID 1021367 .
- ^ Доршкинд К., Всадник Н.Д. (июнь 2000 г.). «Роль пролактина, гормона роста, инсулиноподобного фактора роста-I и гормонов щитовидной железы в развитии и функционировании лимфоцитов: данные генетических моделей дефицита гормонов и гормональных рецепторов» . Эндокринные обзоры . 21 (3): 292–312. дои : 10.1210/edrv.21.3.0397 . ПМИД 10857555 .
- ^ Нагпал С., На С., Ратначалам Р. (август 2005 г.). «Некальцемические действия лигандов рецептора витамина D» . Эндокринные обзоры . 26 (5): 662–87. дои : 10.1210/er.2004-0002 . ПМИД 15798098 .
- ^ «Витамин D. Информационный бюллетень для медицинских работников» . Управление пищевых добавок, Национальные институты здравоохранения США. 17 августа 2021 г. Проверено 31 марта 2022 г.
- ^ Медицинский институт (2011). «8. Последствия и особые опасения» . Росс AC, Тейлор CL, Яктин А.Л., Дель Валле HB (ред.). Рекомендуемая диетическая норма кальция и витамина D. Коллекция национальных академий: отчеты, финансируемые Национальными институтами здравоохранения. Пресса национальных академий. дои : 10.17226/13050 . ISBN 978-0-309-16394-1 . ПМИД 21796828 . S2CID 58721779 .
- ^ Брайант П.А., Триндер Дж., Кертис Н. (июнь 2004 г.). «Больной и уставший: играет ли сон жизненно важную роль в иммунной системе?». Обзоры природы. Иммунология . 4 (6): 457–67. дои : 10.1038/nri1369 . ПМИД 15173834 . S2CID 29318345 .
- ^ Крюгер Дж. М., Мажде Дж. А. (май 2003 г.). «Гуморальные связи между сном и иммунной системой: вопросы исследования». Анналы Нью-Йоркской академии наук . 992 (1): 9–20. Бибкод : 2003NYASA.992....9K . дои : 10.1111/j.1749-6632.2003.tb03133.x . ПМИД 12794042 . S2CID 24508121 .
- ^ Мажде Дж. А., Крюгер Дж. М. (декабрь 2005 г.). «Связь между врожденной иммунной системой и сном» . Журнал аллергии и клинической иммунологии . 116 (6): 1188–98. дои : 10.1016/j.jaci.2005.08.005 . ПМИД 16337444 .
- ^ Тейлор DJ, Келли К., Кохут М.Л., Сонг К.С. (2017). «Является ли бессонница фактором риска снижения реакции на вакцину против гриппа?» . Поведенческая медицина сна . 15 (4): 270–287. дои : 10.1080/15402002.2015.1126596 . ПМЦ 5554442 . ПМИД 27077395 .
- ^ Крюгер Дж. М. (2008). «Роль цитокинов в регуляции сна» . Текущий фармацевтический дизайн . 14 (32): 3408–16. дои : 10.2174/138161208786549281 . ПМЦ 2692603 . ПМИД 19075717 .
- ^ Jump up to: Перейти обратно: а б Беседовский Л., Ланге Т., Борн Дж. (январь 2012 г.). «Сон и иммунная функция» . Архив Пфлюгерса . 463 (1): 121–37. дои : 10.1007/s00424-011-1044-0 . ПМЦ 3256323 . ПМИД 22071480 .
- ^ «Может ли лучший сон означать меньше простуд?» . Архивировано из оригинала 9 мая 2014 года . Проверено 28 апреля 2014 г.
- ^ да Силвейра, член парламента, да Силва Фагундес К.К., Бизути М.Р., Старк Э, Росси Р.К., де Резенде Э., Силва Д.Т. (февраль 2021 г.). «Физические упражнения как инструмент помощи иммунной системе в борьбе с COVID-19: комплексный обзор современной литературы» . Клиническая и экспериментальная медицина . 21 (1): 15–28. дои : 10.1007/s10238-020-00650-3 . ПМЦ 7387807 . ПМИД 32728975 .
- ^ Jump up to: Перейти обратно: а б с д и Пик Дж. М., Нойбауэр О., Уолш Н. П., Симпсон Р. Дж. (май 2017 г.). «Восстановление иммунной системы после физических упражнений» (PDF) . Журнал прикладной физиологии . 122 (5): 1077–1087. doi : 10.1152/japplphysicalol.00622.2016 . ПМИД 27909225 . S2CID 3521624 .
- ^ Кэмпбелл Дж. П., Тернер Дж. Э. (2018). «Развенчивание мифа о подавлении иммунитета, вызванном физическими упражнениями: новое определение влияния физических упражнений на иммунологическое здоровье на протяжении всей жизни» . Границы в иммунологии . 9 : 648. дои : 10.3389/fimmu.2018.00648 . ПМК 5911985 . ПМИД 29713319 .
- ^ Симпсон Р.Дж., Кэмпбелл Дж.П., Глисон М., Крюгер К., Ниман Д.Б., Пайн Д.Б., Тернер Дж.Э., Уолш Н.П. (2020). «Могут ли физические упражнения повлиять на иммунную функцию и повысить восприимчивость к инфекции?». Обзор иммунологии упражнений . 26 :8–22. ПМИД 32139352 .
- ^ Минари А.Л., Томатиэли-Сантос Р.В. (январь 2022 г.). «От повреждения и регенерации скелетных мышц до гипертрофии, вызванной физическими упражнениями: какова роль различных подмножеств макрофагов?». Американский журнал физиологии. Регуляторная, интегративная и сравнительная физиология . 322 (1): Р41–Р54. дои : 10.1152/ajpregu.00038.2021 . ПМИД 34786967 . S2CID 244369441 .
- ^ Годвин Дж.В., Пинто А.Р., Розенталь Н.А. (январь 2017 г.). «В поисках рецепта прорегенеративной иммунной системы» . Семинары по клеточной биологии и биологии развития . Пути врожденного иммунитета при заживлении ран/Promyscus как модельная система. 61 : 71–79. дои : 10.1016/j.semcdb.2016.08.008 . ПМЦ 5338634 . ПМИД 27521522 .
- ^ Sompayrac 2019 , стр. 120–24.
- ^ Sompayrac 2019 , стр. 114–18.
- ^ Sompayrac 2019 , стр. 111–14.
- ^ Оу Д., Сильва А.Б., Палмер Д.Б. (апрель 2007 г.). «Иммуностарение: новые проблемы для стареющего населения» . Иммунология . 120 (4): 435–46. дои : 10.1111/j.1365-2567.2007.02555.x . ПМК 2265901 . ПМИД 17313487 .
- ^ Jump up to: Перейти обратно: а б Чандра РК (август 1997 г.). «Питание и иммунная система: введение» . Американский журнал клинического питания . 66 (2): 460С–63С. дои : 10.1093/ajcn/66.2.460S . ПМИД 9250133 .
- ^ Миллер Дж. Ф. (июль 2002 г.). «Открытие функции тимуса и лимфоцитов, происходящих из тимуса». Иммунологические обзоры . 185 (1): 7–14. дои : 10.1034/j.1600-065X.2002.18502.x . ПМИД 12190917 . S2CID 12108587 .
- ^ Рис 2011 , с. 967.
- ^ Бург М., Дженнери А.Р. (2011). «Учебная статья: Расширение клинико-иммунологического спектра тяжелого комбинированного иммунодефицита» . Eur J Педиатр . 170 (5): 561–571. дои : 10.1007/s00431-011-1452-3 . ПМК 3078321 . ПМИД 21479529 .
- ^ Йоос Л., Тамм М. (2005). «Нарушение защиты легких у хозяина с ослабленным иммунитетом: химиотерапия рака». Труды Американского торакального общества . 2 (5): 445–48. doi : 10.1513/pats.200508-097JS . ПМИД 16322598 .
- ^ Коупленд К.Ф., Хини Дж.Л. (декабрь 1996 г.). «Активация Т-хелперных клеток и патогенез ретровирусов человека» . Микробиологические обзоры . 60 (4): 722–42. дои : 10.1128/MMBR.60.4.722-742.1996 . ПМК 239461 . ПМИД 8987361 .
- ^ Миллер Дж. Ф. (1993). «Я-несамостоятельная дискриминация и толерантность в Т- и В-лимфоцитах». Иммунологические исследования . 12 (2): 115–30. дои : 10.1007/BF02918299 . ПМИД 8254222 . S2CID 32476323 .
- ^
 В эту статью включен текст из этого источника, который находится в свободном доступе : «Болезнь Хашимото» . Управление по здоровью женщин Министерства здравоохранения и социальных служб США. 12 июня 2017 года. Архивировано из оригинала 28 июля 2017 года . Проверено 17 июля 2017 г.
В эту статью включен текст из этого источника, который находится в свободном доступе : «Болезнь Хашимото» . Управление по здоровью женщин Министерства здравоохранения и социальных служб США. 12 июня 2017 года. Архивировано из оригинала 28 июля 2017 года . Проверено 17 июля 2017 г. - ^ Смолен Дж.С., Алетаха Д., Макиннес И.Б. (октябрь 2016 г.). «Ревматоидный артрит» (PDF) . Ланцет . 388 (10055): 2023–2038. дои : 10.1016/S0140-6736(16)30173-8 . ПМИД 27156434 . S2CID 37973054 .
- ^ Фари Л.С., МакКолл А.Л. (июль 2015 г.). «Глюкагон - новый инсулин в патофизиологии диабета». Текущее мнение о клиническом питании и метаболической помощи . 18 (4): 407–14. doi : 10.1097/mco.0000000000000192 . ПМИД 26049639 . S2CID 19872862 .
- ^ «Раздаточный материал по здоровью: системная красная волчанка» . www.niams.nih.gov . Февраль 2015. Архивировано из оригинала 17 июня 2016 года . Проверено 12 июня 2016 г.
- ^ Jump up to: Перейти обратно: а б с д Гаффар А. (2006). «Иммунология – Глава семнадцатая: Состояния гиперчувствительности» . Микробиология и иммунология онлайн . Медицинский факультет Университета Южной Каролины . Проверено 29 мая 2016 г.
- ^ Sompayrac 2019 , стр. 83–85.
- ^ Чикконе 2015 , Глава 37 .
- ^ Jump up to: Перейти обратно: а б Тейлор А.Л., Уотсон С.Дж., Брэдли Дж.А. (октябрь 2005 г.). «Иммуносупрессивные средства при трансплантации паренхиматозных органов: механизмы действия и терапевтическая эффективность». Критические обзоры по онкологии/гематологии . 56 (1): 23–46. doi : 10.1016/j.critrevonc.2005.03.012 . ПМИД 16039869 .
- ^ Барнс П.Дж. (март 2006 г.). «Кортикостероиды: лекарства, которые нужно победить». Европейский журнал фармакологии . 533 (1–3): 2–14. дои : 10.1016/j.ejphar.2005.12.052 . ПМИД 16436275 .
- ^ Масри М.А. (июль 2003 г.). «Мозаика иммунодепрессантов». Молекулярная иммунология . 39 (17–18): 1073–77. дои : 10.1016/S0161-5890(03)00075-0 . ПМИД 12835079 .
- ^ Зал H (июль – август 2020 г.). «Как действительно повысить свою иммунную систему» . Скептический исследователь . Амхерст, Нью-Йорк: Центр исследований . Архивировано из оригинала 21 января 2021 года . Проверено 21 января 2021 г.
- ^ Jump up to: Перейти обратно: а б Рис 2011 , с. 965.
- ^ Оценки смертности и DALY за 2002 г. по причинам для государств-членов ВОЗ. Архивировано 21 октября 2008 года во Wayback Machine Всемирной организации здравоохранения . Проверено 1 января 2007 г.
- ^ Сингх М., О'Хаган Д. (ноябрь 1999 г.). «Достижения в области вакцинных адъювантов» . Природная биотехнология . 17 (11): 1075–81. дои : 10.1038/15058 . ПМИД 10545912 . S2CID 21346647 .
- ^ Jump up to: Перейти обратно: а б Андерсен М.Х., Шрама Д., Тор Стратен П., Беккер Дж.К. (январь 2006 г.). «Цитотоксические Т-клетки» . Журнал исследовательской дерматологии . 126 (1): 32–41. дои : 10.1038/sj.jid.5700001 . ПМИД 16417215 .
- ^ Бун Т., ван дер Брюгген П. (март 1996 г.). «Человеческие опухолевые антигены, распознаваемые Т-лимфоцитами» . Журнал экспериментальной медицины . 183 (3): 725–29. дои : 10.1084/jem.183.3.725 . ПМК 2192342 . ПМИД 8642276 .
- ^ Любоевич С, Скерлев М (2014). «Заболевания, связанные с ВПЧ». Клиники по дерматологии . 32 (2): 227–34. doi : 10.1016/j.clindermatol.2013.08.007 . ПМИД 24559558 .
- ^ Кастелли С., Риволтини Л., Андреола Г., Каррабба М., Ренквист Н., Пармиани Г. (март 2000 г.). «Т-клеточное распознавание антигенов, связанных с меланомой». Журнал клеточной физиологии . 182 (3): 323–31. doi : 10.1002/(SICI)1097-4652(200003)182:3<323::AID-JCP2>3.0.CO;2-# . ПМИД 10653598 . S2CID 196590144 .
- ^ Jump up to: Перейти обратно: а б Ромеро П., Чероттини Дж.К., Спайзер Д.Э. (2006). Ответ Т-клеток человека на антигены меланомы . Достижения иммунологии. Том. 92. стр. 187–224. дои : 10.1016/S0065-2776(06)92005-7 . ISBN 978-0-12-373636-9 . ПМИД 17145305 .
- ^ Jump up to: Перейти обратно: а б Гевара-Патиньо Х.А., Тёрк М.Ю., Волчок Дж.Д., Хоутон А.Н. (2003). «Иммунитет к раку посредством иммунного распознавания измененного себя: исследования меланомы». Достижения в области исследований рака . 90 : 157–77. дои : 10.1016/S0065-230X(03)90005-4 . ISBN 978-0-12-006690-2 . ПМИД 14710950 .
- ^ Ренквист Н., Кастелли С., Роббинс П.Ф., Пармиани Дж. (март 2001 г.). «Список опухолевых антигенов человека, распознаваемых Т-клетками» . Иммунология рака, иммунотерапия . 50 (1): 3–15. дои : 10.1007/s002620000169 . ПМЦ 11036832 . ПМИД 11315507 . S2CID 42681479 .
- ^ Морган Р.А., Дадли М.Э., Вундерлих Дж.Р. и др. (октябрь 2006 г.). «Регрессия рака у пациентов после переноса генно-инженерных лимфоцитов» . Наука . 314 (5796): 126–29. Бибкод : 2006Sci...314..126M . дои : 10.1126/science.1129003 . ПМК 2267026 . ПМИД 16946036 .
- ^ Герлони М., Занетти М. (июнь 2005 г.). «CD4 Т-клетки в опухолевом иммунитете» . Семинары Спрингера по иммунопатологии . 27 (1): 37–48. дои : 10.1007/s00281-004-0193-z . ПМИД 15965712 . S2CID 25182066 .
- ^ Jump up to: Перейти обратно: а б Селигер Б., Ритц У., Ферроне С. (январь 2006 г.). «Молекулярные механизмы нарушений антигена HLA класса I после вирусной инфекции и трансформации» . Международный журнал рака . 118 (1): 129–38. дои : 10.1002/ijc.21312 . ПМИД 16003759 . S2CID 5655726 .
- ^ Хаякава Ю., Смит М.Дж. (2006). «Врожденное иммунное распознавание и подавление опухолей». Достижения в области исследований рака . 95 : 293–322. дои : 10.1016/S0065-230X(06)95008-8 . ISBN 978-0-12-006695-7 . ПМИД 16860661 .
- ^ Jump up to: Перейти обратно: а б с д и ж Син Н.Л., Тенг М.В., Мок Т.С., Су Р.А. (декабрь 2017 г.). «De-novo и приобретенная устойчивость к нацеливанию на иммунные контрольные точки». «Ланцет». Онкология . 18 (12): е731–е741. дои : 10.1016/s1470-2045(17)30607-1 . ПМИД 29208439 .
- ^ Jump up to: Перейти обратно: а б Селигер Б (2005). «Стратегии уклонения опухоли от иммунитета». Биопрепараты . 19 (6): 347–54. дои : 10.2165/00063030-200519060-00002 . ПМИД 16392887 . S2CID 1838144 .
- ^ Фрументо Дж., Пьяцца Т., Ди Карло Э., Феррини С. (сентябрь 2006 г.). «Нацеливание на иммуносупрессию, связанную с опухолью, для иммунотерапии рака». Целевые препараты для лечения эндокринных, метаболических и иммунных расстройств . 6 (3): 233–7. дои : 10.2174/187153006778250019 . ПМИД 17017974 .
- ^ Стикс Джи (июль 2007 г.). «Злокачественное пламя. Понимание хронического воспаления, которое способствует развитию сердечно-сосудистых заболеваний, болезни Альцгеймера и ряда других заболеваний, может стать ключом к разгадке тайн рака» (PDF) . Научный американец . 297 (1): 60–67. Бибкод : 2007SciAm.297a..60S . doi : 10.1038/scientificamerican0707-60 . ПМИД 17695843 . Архивировано из оригинала (PDF) 16 июля 2011 года.
- ^ Сервантес-Вильяграна РД, Альборес-Гарсия Д, Сервантес-Вильяграна АР, Гарсиа-Асевес СХ (18 июня 2020 г.). «Вызванный опухолью нейрогенез и уклонение от иммунитета как цели инновационных противораковых методов лечения» . Цель передачи сигнала Ther . 5 (1): 99. дои : 10.1038/s41392-020-0205-z . ПМК 7303203 . ПМИД 32555170 .
- ^ Ян Ю (сентябрь 2015 г.). «Иммунотерапия рака: использование иммунной системы для борьбы с раком» . Журнал клинических исследований . 125 (9): 3335–7. дои : 10.1172/JCI83871 . ПМЦ 4588312 . ПМИД 26325031 .
- ^ Бейкер, член парламента, Рейнольдс Х.М., Лумичиси Б., Брайсон С.Дж. (октябрь 2010 г.). «Иммуногенность белковой терапии: ключевые причины, последствия и проблемы» . Я/Несобственный . 1 (4): 314–322. дои : 10.4161/self.1.4.13904 . ПМК 3062386 . ПМИД 21487506 .
- ^ Веллинг Г.В., Вейер В.Дж., ван дер Зи Р., Веллинг-Вестер С. (сентябрь 1985 г.). «Прогнозирование последовательных антигенных областей в белках» . Письма ФЭБС . 188 (2): 215–18. дои : 10.1016/0014-5793(85)80374-4 . ПМИД 2411595 .
- ^ Зёлльнер Дж, Майер Б (2006). «Подходы машинного обучения для прогнозирования линейных эпитопов B-клеток на белках». Журнал молекулярного распознавания . 19 (3): 200–08. дои : 10.1002/jmr.771 . ПМИД 16598694 . S2CID 18197810 .
- ^ Саха С., Бхасин М., Рагхава Г.П. (2005). «Bcipep: база данных эпитопов B-клеток» . БМК Геномика . 6:79 . дои : 10.1186/1471-2164-6-79 . ПМЦ 1173103 . ПМИД 15921533 .
- ^ Цветок Д.Р., Дойчинова И.А. (2002). «Иммуноинформатика и прогнозирование иммуногенности». Прикладная биоинформатика . 1 (4): 167–76. ПМИД 15130835 .
- ^ Кандук Д. (сентябрь 2019 г.). «От иммунопротеомики вируса гепатита С до ревматологии через перекрестную реактивность в одной таблице». Современное мнение в ревматологии . 31 (5): 488–492. doi : 10.1097/BOR.0000000000000606 . ПМИД 31356379 . S2CID 198982175 .
- ^ Jump up to: Перейти обратно: а б с Флажник М.Ф., Касахара М. (январь 2010 г.). «Происхождение и эволюция адаптивной иммунной системы: генетические события и селективное давление» . Обзоры природы. Генетика . 11 (1): 47–59. дои : 10.1038/nrg2703 . ПМК 3805090 . ПМИД 19997068 .
- ^ Бикл Т.А., Крюгер Д.Х. (июнь 1993 г.). «Биология рестрикции ДНК» . Микробиологические обзоры . 57 (2): 434–50. дои : 10.1128/MMBR.57.2.434-450.1993 . ПМК 372918 . ПМИД 8336674 .
- ^ Баррангу Р., Фремо С., Дево Х., Ричардс М., Бояваль П., Муано С., Ромеро Д.А., Хорват П. (март 2007 г.). «CRISPR обеспечивает приобретенную устойчивость прокариот к вирусам». Наука . 315 (5819): 1709–12. Бибкод : 2007Sci...315.1709B . дои : 10.1126/science.1138140 . hdl : 20.500.11794/38902 . ПМИД 17379808 . S2CID 3888761 .
- ^ Браунс С.Дж., Джор М.М., Лундгрен М., Вестра Э.Р., Слейкхейс Р.Дж., Снейдерс А.П., Дикман М.Дж., Макарова К.С., Кунин Е.В., ван дер Оост Дж. (август 2008 г.). «Маленькие РНК CRISPR обеспечивают противовирусную защиту у прокариот» . Наука . 321 (5891): 960–64. Стартовый код : 2008Sci...321..960B . дои : 10.1126/science.1159689 . ПМЦ 5898235 . ПМИД 18703739 .
- ^ Хилле Ф., Шарпантье Э (ноябрь 2016 г.). «CRISPR-Cas: биология, механизмы и актуальность» . Философские труды Лондонского королевского общества. Серия Б, Биологические науки . 371 (1707): 20150496. doi : 10.1098/rstb.2015.0496 . ПМК 5052741 . ПМИД 27672148 .
- ^ Кунин Е.В. (февраль 2017). «Эволюция систем антивирусной защиты, управляемых РНК и ДНК, у прокариот и эукариот: общее происхождение против конвергенции» . Биология Директ . 12 (1): 5. дои : 10.1186/s13062-017-0177-2 . ПМК 5303251 . ПМИД 28187792 .
- ^ Бейн CJ (2003). «Происхождение и эволюционные взаимоотношения между врожденными и адаптивными звеньями иммунной системы» . Интегр. Комп. Биол . 43 (2): 293–99. дои : 10.1093/icb/43.2.293 . ПМИД 21680436 .
- ^ Страм Ю., Кузцова Л. (июнь 2006 г.). «Ингибирование вирусов интерференцией РНК» . Гены вирусов . 32 (3): 299–306. дои : 10.1007/s11262-005-6914-0 . ПМЦ 7088519 . ПМИД 16732482 .
- ^ Jump up to: Перейти обратно: а б Шнайдер Д. «Врожденный иммунитет. Лекция 4: Иммунные реакции растений» (PDF) . Кафедра микробиологии и иммунологии Стэнфордского университета . Проверено 1 января 2007 г.
- ^ Джонс Дж.Д., Дангл Дж.Л. (ноябрь 2006 г.). «Имунная система растений» . Природа . 444 (7117): 323–29. Бибкод : 2006Natur.444..323J . дои : 10.1038/nature05286 . ПМИД 17108957 .
- ^ Баулкомб Д. (сентябрь 2004 г.). «Замалчивание РНК у растений». Природа . 431 (7006): 356–63. Бибкод : 2004Natur.431..356B . дои : 10.1038/nature02874 . ПМИД 15372043 . S2CID 4421274 .
- ^ Олдер М.Н., Рогозин И.Б., Айер Л.М., Глазко Г.В., Купер М.Д., Панцер З. (декабрь 2005 г.). «Разнообразие и функции рецепторов адаптивного иммунитета у бесчелюстных позвоночных» . Наука . 310 (5756): 1970–73. Бибкод : 2005Sci...310.1970A . дои : 10.1126/science.1119420 . ПМИД 16373579 .
- ^ Jump up to: Перейти обратно: а б Финли Б.Б., Макфадден Дж. (февраль 2006 г.). «Антииммунология: уклонение от иммунной системы хозяина бактериальными и вирусными патогенами» . Клетка . 124 (4): 767–82. дои : 10.1016/j.cell.2006.01.034 . ПМИД 16497587 . S2CID 15418509 .
- ^ Чианчиотто NP (декабрь 2005 г.). «Секреция типа II: система секреции белка для всех сезонов». Тенденции в микробиологии . 13 (12): 581–88. дои : 10.1016/j.tim.2005.09.005 . ПМИД 16216510 .
- ^ Уинстенли С., Харт, Калифорния (февраль 2001 г.). «Системы секреции III типа и острова патогенности». Журнал медицинской микробиологии . 50 (2): 116–26. дои : 10.1099/0022-1317-50-2-116 . ПМИД 11211218 .
- ^ Финли Б.Б., Фальков С. (июнь 1997 г.). «Возвращение к общим темам микробной патогенности» . Обзоры микробиологии и молекулярной биологии . 61 (2): 136–69. дои : 10.1128/ммбр.61.2.136-169.1997 . ПМК 232605 . ПМИД 9184008 .
- ^ Кобаяши Х (2005). «Биопленки дыхательных путей: значение для патогенеза и терапии инфекций дыхательных путей». Лечение в респираторной медицине . 4 (4): 241–53. дои : 10.2165/00151829-200504040-00003 . ПМИД 16086598 . S2CID 31788349 .
- ^ Хаусден Н.Г., Харрисон С., Робертс С.Е., Бекингем Дж.А., Грайль М., Стура Э., Гор М.Г. (июнь 2003 г.). «Иммуноглобулин-связывающие домены: белок L из Peptostreptococcus magnus» (PDF) . Труды Биохимического общества . 31 (Часть 3): 716–18. дои : 10.1042/BST0310716 . ПМИД 12773190 . S2CID 10322322 . Архивировано из оригинала (PDF) 2 марта 2019 года.
- ^ Бертон Д.Р., Стэнфилд Р.Л., Уилсон И.А. (октябрь 2005 г.). «Антитела против ВИЧ в схватке эволюционных титанов» . Труды Национальной академии наук Соединенных Штатов Америки . 102 (42): 14943–48. Бибкод : 2005PNAS..10214943B . дои : 10.1073/pnas.0505126102 . ПМЦ 1257708 . ПМИД 16219699 .
- ^ Тейлор Дж. Э., Руденко Г. (ноябрь 2006 г.). «Смена трипаносомных пальто: что в гардеробе?». Тенденции в генетике . 22 (11): 614–20. дои : 10.1016/j.tig.2006.08.003 . ПМИД 16908087 .
- ^ Кантен Р., Мето С., Трамбле MJ (июнь 2005 г.). «Грабеж и безбилетные пассажиры: включение клеточных белков вирусами в оболочке» . Журнал вирусологии . 79 (11): 6577–87. doi : 10.1128/JVI.79.11.6577-6587.2005 . ПМЦ 1112128 . ПМИД 15890896 .
- ^ Jump up to: Перейти обратно: а б «Нобелевская премия по физиологии и медицине 1908 года» . Нобелевская премия . Проверено 8 января 2007 г.
- ^ Ретиф Ф.П., Сильерс Л. (январь 1998 г.). «Эпидемия в Афинах, 430–426 гг. до н.э.». Южноафриканский медицинский журнал = Южноафриканский медицинский журнал . 88 (1): 50–53. ПМИД 9539938 .
- ^ Остоя П (1954). «Мопертюи и биология». Обзор истории наук и их приложений . 7 (1): 60–78. дои : 10.3406/rhs.1954.3379 .
- ^ Доэрти М., Робертсон М.Дж. (декабрь 2004 г.). «Некоторые ранние тенденции в иммунологии». Тенденции в иммунологии . 25 (12): 623–31. дои : 10.1016/j.it.2004.10.008 . ПМИД 15530829 .
- ^ Сильверстайн 1989 , с. 6.
- ^ Сильверстайн 1989 , с. 7.
- ^ Плоткин С.А. (апрель 2005 г.). «Вакцины: прошлое, настоящее и будущее» . Природная медицина . 11 (4 дополнения): С5–11. дои : 10.1038/nm1209 . ПМК 7095920 . ПМИД 15812490 .
- ^ Нобелевская премия по физиологии и медицине 1905 г. Архивировано 10 декабря 2006 г. на Wayback Machine Nobelprize.org. Проверено 8 января 2009 г.
- ^ Майор Уолтер Рид, Медицинский корпус, Армейский медицинский центр Уолтера Рида армии США. Проверено 8 января 2007 г.
- ^ Мечников Э (1905). Иммунитет при инфекционных заболеваниях (Полнотекстовая версия: Интернет-архив) . Перевод Бинни Ф.Г. Издательство Кембриджского университета. LCCN 68025143 .
История гуморального иммунитета.
- ^ «Нильс К. Йерне» . Нобелевская премия . Проверено 27 ноября 2020 г.
- ^ Юделл Дж. (4 октября 2003 г.). «Он поместил идентификатор в Идиотип» . Отчеты EMBO (Рецензия на книгу). 4 (10): 931. doi : 10.1038/sj.embor.embor951 . ПМК 1326409 .
Общая библиография [ править ]
- Альбертс Б., Джонсон А., Льюис Дж., Рафф М., Робертс К., Уолтерс П. (2002). Молекулярная биология клетки (Четвертое изд.). Нью-Йорк и Лондон: Garland Science. ISBN 978-0-8153-3218-3 .
- Берток Л., Чоу Д. (2005). Берток Л., Чоу Д. (ред.). Естественный иммунитет . Том. 5 (1-е изд.). Эльзевир Наука. ISBN 978-0-44451-755-5 .
- Ирити М (2019). Врожденный иммунитет растений 2.0 . Базель: MDPI. дои : 10.3390/books978-3-03897-581-6 . ISBN 978-3-03897-580-9 . OCLC 1105775088 .
- Компакт-диск Чикконе (2015). Фармакология в реабилитации (Современные перспективы реабилитации) (5-е изд.). Компания Ф.А. Дэвиса. ISBN 978-0-80364-029-0 .
- Джейнвей Калифорния, Трэверс П., Уолпорт М. (2001). Иммунобиология (5-е изд.). Гирляндная наука.
- Джейнвей, Калифорния (2005). Иммунобиология (6-е изд.). Гирляндная наука. ISBN 0-443-07310-4 .
- Кришнасвами Г., Аджитави О., Чи Д.С. (2006). «Тучная клетка человека: обзор». Тучные клетки . Методы молекулярной биологии. Том. 315. стр. 13–34. дои : 10.1385/1-59259-967-2:013 . ISBN 1-59259-967-2 . ПМИД 16110146 .
- Мерфи К., Уивер С. (2016). Иммунобиология (9-е изд.). Гирляндная наука. ISBN 978-0-8153-4505-3 .
- Раджалингам Р. (2012). «Обзор системы рецепторов, подобных иммуноглобулину-киллерной клетке». Иммуногенетика . Методы молекулярной биологии. Том. 882. стр. 391–414. дои : 10.1007/978-1-61779-842-9_23 . ISBN 978-1-61779-841-2 . ПМИД 22665247 .
- Рис Дж (2011). Биология Кэмпбелла . Френчс Форест, Новый Южный Уэльс: Pearson Australia. ISBN 978-1-4425-3176-5 . OCLC 712136178 .
- Сильверстайн А.М. (1989). История иммунологии . Академическая пресса . ISBN 978-0-08-092583-7 .
- Сомпайрак Л (2019). Как работает иммунная система . Хобокен, Нью-Джерси: Уайли-Блэквелл. ISBN 978-1-119-54212-4 . OCLC 1083261548 .
- Ствртинова В, Якубовский Ю, Хулин И (1995). Патофизиология: принципы болезни . Вычислительный центр Словацкой академии наук: Академическая электронная пресса.
- Вира Ч.Р., Крейн-Годро М., Грант К. (2004). Огра П.Л., Местецки Дж., Ламм М.Е., Стробер В., МакГи Дж.Р., Биненсток Дж. (ред.). Иммунология слизистой оболочки . Сан-Франциско: Эльзевир. ISBN 0-12-491543-4 .
Дальнейшее чтение [ править ]
- Деттмер П. (2021). Иммунитет: путешествие в загадочную систему, которая сохраняет вам жизнь . Филип Лайбахер (иллюстрации). Нью-Йорк: Рэндом Хаус. ISBN 9780593241318 . OCLC 1263845194 . Архивировано из оригинала 24 ноября 2021 года . Проверено 4 января 2022 г. книги ( Источники доступны только в Интернете.) Научно-популярное объяснение иммунной системы.