Химиотерапия
| Химиотерапия | |
|---|---|
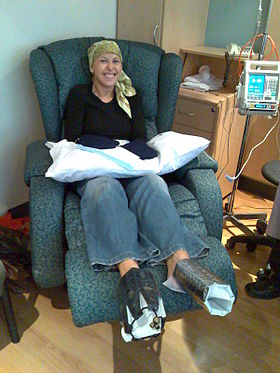 A woman being treated with docetaxel chemotherapy for breast cancer. Cold mittens and cold booties are placed on her hands and feet to reduce harm to her nails. | |
| Other names | chemo, CTX, CTx |
Химиотерапия (часто сокращенно химиотерапия , иногда CTX и CTx ) — это тип лечения рака используется один или несколько противораковых препаратов ( химиотерапевтических агентов или алкилирующих агентов , при котором в стандартной схеме ) . Химиотерапия может проводиться с лечебной целью (которая почти всегда включает в себя комбинацию препаратов) или может быть направлена только на продление жизни или уменьшение симптомов ( паллиативная химиотерапия). Химиотерапия — одна из основных категорий медицинской дисциплины, специально посвященной , которая фармакотерапии рака называется медицинской онкологией . [1] [2]
Термин «химиотерапия» теперь означает неспецифическое использование внутриклеточных ядов для ингибирования митоза (деление клеток) или для индукции повреждения ДНК (так что восстановление ДНК может дополнять химиотерапию). [3] Это значение исключает более селективные агенты, которые блокируют внеклеточные сигналы ( сигнальная трансдукция ). Терапия со специфическими молекулярными или генетическими мишенями, которая подавляет стимулирующие рост сигналы классических эндокринных гормонов (в первую очередь эстрогенов при раке молочной железы и андрогенов при раке простаты), теперь называется гормональной терапией . Другие ингибиции сигналов роста, например, связанные с рецепторными тирозинкиназами , представляют собой таргетную терапию .
The use of drugs (whether chemotherapy, hormonal therapy, or targeted therapy) is systemic therapy for cancer: they are introduced into the blood stream (the system) and therefore can treat cancer anywhere in the body. Systemic therapy is often used with other, local therapy (treatments that work only where they are applied), such as radiation, surgery, and hyperthermia.
Traditional chemotherapeutic agents are cytotoxic by means of interfering with cell division (mitosis) but cancer cells vary widely in their susceptibility to these agents. To a large extent, chemotherapy can be thought of as a way to damage or stress cells, which may then lead to cell death if apoptosis is initiated. Many of the side effects of chemotherapy can be traced to damage to normal cells that divide rapidly and are thus sensitive to anti-mitotic drugs: cells in the bone marrow, digestive tract and hair follicles. This results in the most common side-effects of chemotherapy: myelosuppression (decreased production of blood cells, hence that also immunosuppression), mucositis (inflammation of the lining of the digestive tract), and alopecia (hair loss). Because of the effect on immune cells (especially lymphocytes), chemotherapy drugs often find use in a host of diseases that result from harmful overactivity of the immune system against self (so-called autoimmunity). These include rheumatoid arthritis, systemic lupus erythematosus, multiple sclerosis, vasculitis and many others.
Treatment strategies[edit]
There are a number of strategies in the administration of chemotherapeutic drugs used today. Chemotherapy may be given with a curative intent or it may aim to prolong life or to palliate symptoms.
- Induction chemotherapy is the first line treatment of cancer with a chemotherapeutic drug. This type of chemotherapy is used for curative intent.[1][6]: 55–59
- Combined modality chemotherapy is the use of drugs with other cancer treatments, such as surgery, radiation therapy, or hyperthermia therapy.
- Consolidation chemotherapy is given after remission in order to prolong the overall disease-free time and improve overall survival. The drug that is administered is the same as the drug that achieved remission.[6]: 55–59
- Intensification chemotherapy is identical to consolidation chemotherapy but a different drug than the induction chemotherapy is used.[6]: 55–59
- Combination chemotherapy involves treating a person with a number of different drugs simultaneously. The drugs differ in their mechanism and side-effects. The biggest advantage is minimising the chances of resistance developing to any one agent. Also, the drugs can often be used at lower doses, reducing toxicity.[6]: 55–59 [7]: 17–18 [5]
- Neoadjuvant chemotherapy is given prior to a local treatment such as surgery, and is designed to shrink the primary tumor.[6]: 55–59 It is also given for cancers with a high risk of micrometastatic disease.[8]: 42
- Adjuvant chemotherapy is given after a local treatment (radiotherapy or surgery). It can be used when there is little evidence of cancer present, but there is risk of recurrence.[6]: 55–59 It is also useful in killing any cancerous cells that have spread to other parts of the body. These micrometastases can be treated with adjuvant chemotherapy and can reduce relapse rates caused by these disseminated cells.[9]
- Maintenance chemotherapy is a repeated low-dose treatment to prolong remission.[5][6]: 55–59
- Salvage chemotherapy or palliative chemotherapy is given without curative intent, but simply to decrease tumor load and increase life expectancy. For these regimens, in general, a better toxicity profile is expected.[6]: 55–59
All chemotherapy regimens require that the recipient be capable of undergoing the treatment. Performance status is often used as a measure to determine whether a person can receive chemotherapy, or whether dose reduction is required. Because only a fraction of the cells in a tumor die with each treatment (fractional kill), repeated doses must be administered to continue to reduce the size of the tumor.[10] Current chemotherapy regimens apply drug treatment in cycles, with the frequency and duration of treatments limited by toxicity.[11]
Effectiveness[edit]
The effectiveness of chemotherapy depends on the type of cancer and the stage. The overall effectiveness ranges from being curative for some cancers, such as some leukemias,[12][13] to being ineffective, such as in some brain tumors,[14] to being needless in others, like most non-melanoma skin cancers.[15]
Dosage[edit]

Dosage of chemotherapy can be difficult: If the dose is too low, it will be ineffective against the tumor, whereas, at excessive doses, the toxicity (side-effects) will be intolerable to the person receiving it.[4] The standard method of determining chemotherapy dosage is based on calculated body surface area (BSA). The BSA is usually calculated with a mathematical formula or a nomogram, using the recipient's weight and height, rather than by direct measurement of body area. This formula was originally derived in a 1916 study and attempted to translate medicinal doses established with laboratory animals to equivalent doses for humans.[16] The study only included nine human subjects.[17] When chemotherapy was introduced in the 1950s, the BSA formula was adopted as the official standard for chemotherapy dosing for lack of a better option.[18][19]
The validity of this method in calculating uniform doses has been questioned because the formula only takes into account the individual's weight and height. Drug absorption and clearance are influenced by multiple factors, including age, sex, metabolism, disease state, organ function, drug-to-drug interactions, genetics, and obesity, which have major impacts on the actual concentration of the drug in the person's bloodstream.[18][20][21] As a result, there is high variability in the systemic chemotherapy drug concentration in people dosed by BSA, and this variability has been demonstrated to be more than ten-fold for many drugs.[17][22] In other words, if two people receive the same dose of a given drug based on BSA, the concentration of that drug in the bloodstream of one person may be 10 times higher or lower compared to that of the other person.[22] This variability is typical with many chemotherapy drugs dosed by BSA, and, as shown below, was demonstrated in a study of 14 common chemotherapy drugs.[17]
The result of this pharmacokinetic variability among people is that many people do not receive the right dose to achieve optimal treatment effectiveness with minimized toxic side effects. Some people are overdosed while others are underdosed.[18][20][21][23][24][25][26] For example, in a randomized clinical trial, investigators found 85% of metastatic colorectal cancer patients treated with 5-fluorouracil (5-FU) did not receive the optimal therapeutic dose when dosed by the BSA standard—68% were underdosed and 17% were overdosed.[23]
There has been controversy over the use of BSA to calculate chemotherapy doses for people who are obese.[27] Because of their higher BSA, clinicians often arbitrarily reduce the dose prescribed by the BSA formula for fear of overdosing.[27] In many cases, this can result in sub-optimal treatment.[27]
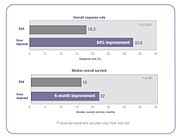
Several clinical studies have demonstrated that when chemotherapy dosing is individualized to achieve optimal systemic drug exposure, treatment outcomes are improved and toxic side effects are reduced.[23][25] In the 5-FU clinical study cited above, people whose dose was adjusted to achieve a pre-determined target exposure realized an 84% improvement in treatment response rate and a six-month improvement in overall survival (OS) compared with those dosed by BSA.[23]

In the same study, investigators compared the incidence of common 5-FU-associated grade 3/4 toxicities between the dose-adjusted people and people dosed per BSA.[23] The incidence of debilitating grades of diarrhea was reduced from 18% in the BSA-dosed group to 4% in the dose-adjusted group and serious hematologic side effects were eliminated.[23] Because of the reduced toxicity, dose-adjusted patients were able to be treated for longer periods of time.[23] BSA-dosed people were treated for a total of 680 months while people in the dose-adjusted group were treated for a total of 791 months.[23] Completing the course of treatment is an important factor in achieving better treatment outcomes.
Similar results were found in a study involving people with colorectal cancer who have been treated with the popular FOLFOX regimen.[25] The incidence of serious diarrhea was reduced from 12% in the BSA-dosed group of patients to 1.7% in the dose-adjusted group, and the incidence of severe mucositis was reduced from 15% to 0.8%.[25]
The FOLFOX study also demonstrated an improvement in treatment outcomes.[25] Positive response increased from 46% in the BSA-dosed group to 70% in the dose-adjusted group. Median progression free survival (PFS) and overall survival (OS) both improved by six months in the dose adjusted group.[25]
One approach that can help clinicians individualize chemotherapy dosing is to measure the drug levels in blood plasma over time and adjust dose according to a formula or algorithm to achieve optimal exposure. With an established target exposure for optimized treatment effectiveness with minimized toxicities, dosing can be personalized to achieve target exposure and optimal results for each person. Such an algorithm was used in the clinical trials cited above and resulted in significantly improved treatment outcomes.[28]
Oncologists are already individualizing dosing of some cancer drugs based on exposure. Carboplatin[29]: 4 and busulfan[30][31] dosing rely upon results from blood tests to calculate the optimal dose for each person. Simple blood tests are also available for dose optimization of methotrexate,[32] 5-FU, paclitaxel, and docetaxel.[33][34]
The serum albumin level immediately prior to chemotherapy administration is an independent prognostic predictor of survival in various cancer types.[35]
Types[edit]

Alkylating agents[edit]
Alkylating agents are the oldest group of chemotherapeutics in use today. Originally derived from mustard gas used in World War I, there are now many types of alkylating agents in use.[4] They are so named because of their ability to alkylate many molecules, including proteins, RNA and DNA. This ability to bind covalently to DNA via their alkyl group is the primary cause for their anti-cancer effects.[37] DNA is made of two strands and the molecules may either bind twice to one strand of DNA (intrastrand crosslink) or may bind once to both strands (interstrand crosslink). If the cell tries to replicate crosslinked DNA during cell division, or tries to repair it, the DNA strands can break. This leads to a form of programmed cell death called apoptosis.[36][38] Alkylating agents will work at any point in the cell cycle and thus are known as cell cycle-independent drugs. For this reason, the effect on the cell is dose dependent; the fraction of cells that die is directly proportional to the dose of drug.[39]
The subtypes of alkylating agents are the nitrogen mustards, nitrosoureas, tetrazines, aziridines,[40] cisplatins and derivatives, and non-classical alkylating agents. Nitrogen mustards include mechlorethamine, cyclophosphamide, melphalan, chlorambucil, ifosfamide and busulfan. Nitrosoureas include N-Nitroso-N-methylurea (MNU), carmustine (BCNU), lomustine (CCNU) and semustine (MeCCNU), fotemustine and streptozotocin. Tetrazines include dacarbazine, mitozolomide and temozolomide. Aziridines include thiotepa, mytomycin and diaziquone (AZQ). Cisplatin and derivatives include cisplatin, carboplatin and oxaliplatin.[37][38] They impair cell function by forming covalent bonds with the amino, carboxyl, sulfhydryl, and phosphate groups in biologically important molecules.[41] Non-classical alkylating agents include procarbazine and hexamethylmelamine.[37][38]
Antimetabolites[edit]

Anti-metabolites are a group of molecules that impede DNA and RNA synthesis. Many of them have a similar structure to the building blocks of DNA and RNA. The building blocks are nucleotides; a molecule comprising a nucleobase, a sugar and a phosphate group. The nucleobases are divided into purines (guanine and adenine) and pyrimidines (cytosine, thymine and uracil). Anti-metabolites resemble either nucleobases or nucleosides (a nucleotide without the phosphate group), but have altered chemical groups.[42] These drugs exert their effect by either blocking the enzymes required for DNA synthesis or becoming incorporated into DNA or RNA. By inhibiting the enzymes involved in DNA synthesis, they prevent mitosis because the DNA cannot duplicate itself. Also, after misincorporation of the molecules into DNA, DNA damage can occur and programmed cell death (apoptosis) is induced. Unlike alkylating agents, anti-metabolites are cell cycle dependent. This means that they only work during a specific part of the cell cycle, in this case S-phase (the DNA synthesis phase). For this reason, at a certain dose, the effect plateaus and proportionally no more cell death occurs with increased doses. Subtypes of the anti-metabolites are the anti-folates, fluoropyrimidines, deoxynucleoside analogues and thiopurines.[37][42]
The anti-folates include methotrexate and pemetrexed. Methotrexate inhibits dihydrofolate reductase (DHFR), an enzyme that regenerates tetrahydrofolate from dihydrofolate. When the enzyme is inhibited by methotrexate, the cellular levels of folate coenzymes diminish. These are required for thymidylate and purine production, which are both essential for DNA synthesis and cell division.[6]: 55–59 [7]: 11 Pemetrexed is another anti-metabolite that affects purine and pyrimidine production, and therefore also inhibits DNA synthesis. It primarily inhibits the enzyme thymidylate synthase, but also has effects on DHFR, aminoimidazole carboxamide ribonucleotide formyltransferase and glycinamide ribonucleotide formyltransferase.[43] The fluoropyrimidines include fluorouracil and capecitabine. Fluorouracil is a nucleobase analogue that is metabolised in cells to form at least two active products; 5-fluourouridine monophosphate (FUMP) and 5-fluoro-2'-deoxyuridine 5'-phosphate (fdUMP). FUMP becomes incorporated into RNA and fdUMP inhibits the enzyme thymidylate synthase; both of which lead to cell death.[7]: 11 Capecitabine is a prodrug of 5-fluorouracil that is broken down in cells to produce the active drug.[44] The deoxynucleoside analogues include cytarabine, gemcitabine, decitabine, azacitidine, fludarabine, nelarabine, cladribine, clofarabine, and pentostatin. The thiopurines include thioguanine and mercaptopurine.[37][42]
Anti-microtubule agents[edit]

Anti-microtubule agents are plant-derived chemicals that block cell division by preventing microtubule function. Microtubules are an important cellular structure composed of two proteins, α-tubulin and β-tubulin. They are hollow, rod-shaped structures that are required for cell division, among other cellular functions.[45] Microtubules are dynamic structures, which means that they are permanently in a state of assembly and disassembly. Vinca alkaloids and taxanes are the two main groups of anti-microtubule agents, and although both of these groups of drugs cause microtubule dysfunction, their mechanisms of action are completely opposite: Vinca alkaloids prevent the assembly of microtubules, whereas taxanes prevent their disassembly. By doing so, they can induce mitotic catastrophe in the cancer cells.[46] Following this, cell cycle arrest occurs, which induces programmed cell death (apoptosis).[37][47] These drugs can also affect blood vessel growth, an essential process that tumours utilise in order to grow and metastasise.[47]
Vinca alkaloids are derived from the Madagascar periwinkle, Catharanthus roseus,[48][49] formerly known as Vinca rosea. They bind to specific sites on tubulin, inhibiting the assembly of tubulin into microtubules. The original vinca alkaloids are natural products that include vincristine and vinblastine.[50][51][52][53] Following the success of these drugs, semi-synthetic vinca alkaloids were produced: vinorelbine (used in the treatment of non-small-cell lung cancer[52][54][55]), vindesine, and vinflunine.[47] These drugs are cell cycle-specific. They bind to the tubulin molecules in S-phase and prevent proper microtubule formation required for M-phase.[39]
Taxanes are natural and semi-synthetic drugs. The first drug of their class, paclitaxel, was originally extracted from Taxus brevifolia, the Pacific yew. Now this drug and another in this class, docetaxel, are produced semi-synthetically from a chemical found in the bark of another yew tree, Taxus baccata.[56]
Podophyllotoxin is an antineoplastic lignan obtained primarily from the American mayapple (Podophyllum peltatum) and Himalayan mayapple (Sinopodophyllum hexandrum). It has anti-microtubule activity, and its mechanism is similar to that of vinca alkaloids in that they bind to tubulin, inhibiting microtubule formation. Podophyllotoxin is used to produce two other drugs with different mechanisms of action: etoposide and teniposide.[57][58]
Topoisomerase inhibitors[edit]

Topoisomerase inhibitors are drugs that affect the activity of two enzymes: topoisomerase I and topoisomerase II. When the DNA double-strand helix is unwound, during DNA replication or transcription, for example, the adjacent unopened DNA winds tighter (supercoils), like opening the middle of a twisted rope. The stress caused by this effect is in part aided by the topoisomerase enzymes. They produce single- or double-strand breaks into DNA, reducing the tension in the DNA strand. This allows the normal unwinding of DNA to occur during replication or transcription. Inhibition of topoisomerase I or II interferes with both of these processes.[59][60]
Two topoisomerase I inhibitors, irinotecan and topotecan, are semi-synthetically derived from camptothecin, which is obtained from the Chinese ornamental tree Camptotheca acuminata.[39] Drugs that target topoisomerase II can be divided into two groups. The topoisomerase II poisons cause increased levels enzymes bound to DNA. This prevents DNA replication and transcription, causes DNA strand breaks, and leads to programmed cell death (apoptosis). These agents include etoposide, doxorubicin, mitoxantrone and teniposide. The second group, catalytic inhibitors, are drugs that block the activity of topoisomerase II, and therefore prevent DNA synthesis and translation because the DNA cannot unwind properly. This group includes novobiocin, merbarone, and aclarubicin, which also have other significant mechanisms of action.[61]
Cytotoxic antibiotics[edit]
The cytotoxic antibiotics are a varied group of drugs that have various mechanisms of action. The common theme that they share in their chemotherapy indication is that they interrupt cell division. The most important subgroup is the anthracyclines and the bleomycins; other prominent examples include mitomycin C and actinomycin.[62]
Among the anthracyclines, doxorubicin and daunorubicin were the first, and were obtained from the bacterium Streptomyces peucetius.[63] Derivatives of these compounds include epirubicin and idarubicin. Other clinically used drugs in the anthracycline group are pirarubicin, aclarubicin, and mitoxantrone.[64] The mechanisms of anthracyclines include DNA intercalation (molecules insert between the two strands of DNA), generation of highly reactive free radicals that damage intercellular molecules and topoisomerase inhibition.[65]
Actinomycin is a complex molecule that intercalates DNA and prevents RNA synthesis.[66]
Bleomycin, a glycopeptide isolated from Streptomyces verticillus, also intercalates DNA, but produces free radicals that damage DNA. This occurs when bleomycin binds to a metal ion, becomes chemically reduced and reacts with oxygen.[67][6]: 87
Mitomycin is a cytotoxic antibiotic with the ability to alkylate DNA.[68]
Delivery[edit]

Most chemotherapy is delivered intravenously, although a number of agents can be administered orally (e.g., melphalan, busulfan, capecitabine). According to a recent (2016) systematic review, oral therapies present additional challenges for patients and care teams to maintain and support adherence to treatment plans.[69]
There are many intravenous methods of drug delivery, known as vascular access devices. These include the winged infusion device, peripheral venous catheter, midline catheter, peripherally inserted central catheter (PICC), central venous catheter and implantable port. The devices have different applications regarding duration of chemotherapy treatment, method of delivery and types of chemotherapeutic agent.[7]: 94–95
Depending on the person, the cancer, the stage of cancer, the type of chemotherapy, and the dosage, intravenous chemotherapy may be given on either an inpatient or an outpatient basis. For continuous, frequent or prolonged intravenous chemotherapy administration, various systems may be surgically inserted into the vasculature to maintain access.[7]: 113–118 Commonly used systems are the Hickman line, the Port-a-Cath, and the PICC line. These have a lower infection risk, are much less prone to phlebitis or extravasation, and eliminate the need for repeated insertion of peripheral cannulae.[70]
Isolated limb perfusion (often used in melanoma),[71] or isolated infusion of chemotherapy into the liver[72] or the lung have been used to treat some tumors. The main purpose of these approaches is to deliver a very high dose of chemotherapy to tumor sites without causing overwhelming systemic damage.[73] These approaches can help control solitary or limited metastases, but they are by definition not systemic, and, therefore, do not treat distributed metastases or micrometastases.[citation needed]
Topical chemotherapies, such as 5-fluorouracil, are used to treat some cases of non-melanoma skin cancer.[74]
If the cancer has central nervous system involvement, or with meningeal disease, intrathecal chemotherapy may be administered.[4]
Adverse effects[edit]
Chemotherapeutic techniques have a range of side effects that depend on the type of medications used. The most common medications affect mainly the fast-dividing cells of the body, such as blood cells and the cells lining the mouth, stomach, and intestines. Chemotherapy-related toxicities can occur acutely after administration, within hours or days, or chronically, from weeks to years.[6]: 265
Immunosuppression and myelosuppression[edit]
Virtually all chemotherapeutic regimens can cause depression of the immune system, often by paralysing the bone marrow and leading to a decrease of white blood cells, red blood cells, and platelets.Anemia and thrombocytopenia may require blood transfusion. Neutropenia (a decrease of the neutrophil granulocyte count below 0.5 x 109/litre) can be improved with synthetic G-CSF (granulocyte-colony-stimulating factor, e.g., filgrastim, lenograstim, efbemalenograstim alfa).[75]
In very severe myelosuppression, which occurs in some regimens, almost all the bone marrow stem cells (cells that produce white and red blood cells) are destroyed, meaning allogenic or autologous bone marrow cell transplants are necessary. (In autologous BMTs, cells are removed from the person before the treatment, multiplied and then re-injected afterward; in allogenic BMTs, the source is a donor.) However, some people still develop diseases because of this interference with bone marrow.[76]
Although people receiving chemotherapy are encouraged to wash their hands, avoid sick people, and take other infection-reducing steps, about 85% of infections are due to naturally occurring microorganisms in the person's own gastrointestinal tract (including oral cavity) and skin.[77]: 130 This may manifest as systemic infections, such as sepsis, or as localized outbreaks, such as Herpes simplex, shingles, or other members of the Herpesviridea.[78] The risk of illness and death can be reduced by taking common antibiotics such as quinolones or trimethoprim/sulfamethoxazole before any fever or sign of infection appears.[79] Quinolones show effective prophylaxis mainly with hematological cancer.[79] However, in general, for every five people who are immunosuppressed following chemotherapy who take an antibiotic, one fever can be prevented; for every 34 who take an antibiotic, one death can be prevented.[79] Sometimes, chemotherapy treatments are postponed because the immune system is suppressed to a critically low level.[citation needed]
In Japan, the government has approved the use of some medicinal mushrooms like Trametes versicolor, to counteract depression of the immune system in people undergoing chemotherapy.[80]
Trilaciclib is an inhibitor of cyclin-dependent kinase 4/6 approved for the prevention of myelosuppression caused by chemotherapy. The drug is given before chemotherapy to protect bone marrow function.[81]
Neutropenic enterocolitis[edit]
Due to immune system suppression, neutropenic enterocolitis (typhlitis) is a "life-threatening gastrointestinal complication of chemotherapy."[82] Typhlitis is an intestinal infection which may manifest itself through symptoms including nausea, vomiting, diarrhea, a distended abdomen, fever, chills, or abdominal pain and tenderness.[83]
Typhlitis is a medical emergency. It has a very poor prognosis and is often fatal unless promptly recognized and aggressively treated.[84] Successful treatment hinges on early diagnosis provided by a high index of suspicion and the use of CT scanning, nonoperative treatment for uncomplicated cases, and sometimes elective right hemicolectomy to prevent recurrence.[84]
Gastrointestinal distress[edit]
Nausea, vomiting, anorexia, diarrhea, abdominal cramps, and constipation are common side-effects of chemotherapeutic medications that kill fast-dividing cells.[85] Malnutrition and dehydration can result when the recipient does not eat or drink enough, or when the person vomits frequently, because of gastrointestinal damage. This can result in rapid weight loss, or occasionally in weight gain, if the person eats too much in an effort to allay nausea or heartburn. Weight gain can also be caused by some steroid medications. These side-effects can frequently be reduced or eliminated with antiemetic drugs. Low-certainty evidence also suggests that probiotics may have a preventative and treatment effect of diarrhoea related to chemotherapy alone and with radiotherapy.[86] However, a high index of suspicion is appropriate, since diarrhoea and bloating are also symptoms of typhlitis, a very serious and potentially life-threatening medical emergency that requires immediate treatment.[87]
Anemia[edit]
Anemia can be a combined outcome caused by myelosuppressive chemotherapy, and possible cancer-related causes such as bleeding, blood cell destruction (hemolysis), hereditary disease, kidney dysfunction, nutritional deficiencies or anemia of chronic disease. Treatments to mitigate anemia include hormones to boost blood production (erythropoietin), iron supplements, and blood transfusions.[88][89][90] Myelosuppressive therapy can cause a tendency to bleed easily, leading to anemia. Medications that kill rapidly dividing cells or blood cells can reduce the number of platelets in the blood, which can result in bruises and bleeding. Extremely low platelet counts may be temporarily boosted through platelet transfusions and new drugs to increase platelet counts during chemotherapy are being developed.[91][92][93][94] Sometimes, chemotherapy treatments are postponed to allow platelet counts to recover.
Fatigue may be a consequence of the cancer or its treatment, and can last for months to years after treatment. One physiological cause of fatigue is anemia, which can be caused by chemotherapy, surgery, radiotherapy, primary and metastatic disease or nutritional depletion.[95][96] Aerobic exercise has been found to be beneficial in reducing fatigue in people with solid tumours.[97]
Nausea and vomiting[edit]
Nausea and vomiting are two of the most feared cancer treatment-related side-effects for people with cancer and their families. In 1983, Coates et al. found that people receiving chemotherapy ranked nausea and vomiting as the first and second most severe side-effects, respectively.[98] Up to 20% of people receiving highly emetogenic agents in this era postponed, or even refused potentially curative treatments.[99] Chemotherapy-induced nausea and vomiting (CINV) are common with many treatments and some forms of cancer. Since the 1990s, several novel classes of antiemetics have been developed and commercialized, becoming a nearly universal standard in chemotherapy regimens, and helping to successfully manage these symptoms in many people. Effective mediation of these unpleasant and sometimes debilitating symptoms results in increased quality of life for the recipient and more efficient treatment cycles, due to less stoppage of treatment due to better tolerance and better overall health.[100]
Hair loss[edit]

Hair loss (alopecia) can be caused by chemotherapy that kills rapidly dividing cells; other medications may cause hair to thin. These are most often temporary effects: hair usually starts to regrow a few weeks after the last treatment, but sometimes with a change in color, texture, thickness or style. Sometimes hair has a tendency to curl after regrowth, resulting in "chemo curls." Severe hair loss occurs most often with drugs such as doxorubicin, daunorubicin, paclitaxel, docetaxel, cyclophosphamide, ifosfamide and etoposide. Permanent thinning or hair loss can result from some standard chemotherapy regimens.[101]
Chemotherapy induced hair loss occurs by a non-androgenic mechanism, and can manifest as alopecia totalis, telogen effluvium, or less often alopecia areata.[102] It is usually associated with systemic treatment due to the high mitotic rate of hair follicles, and more reversible than androgenic hair loss,[103][104] although permanent cases can occur.[105] Chemotherapy induces hair loss in women more often than men.[106]
Scalp cooling offers a means of preventing both permanent and temporary hair loss; however, concerns about this method have been raised.[107][108]
Secondary neoplasm[edit]
Development of secondary neoplasia after successful chemotherapy or radiotherapy treatment can occur. The most common secondary neoplasm is secondary acute myeloid leukemia, which develops primarily after treatment with alkylating agents or topoisomerase inhibitors.[109] Survivors of childhood cancer are more than 13 times as likely to get a secondary neoplasm during the 30 years after treatment than the general population.[110] Not all of this increase can be attributed to chemotherapy.
Infertility[edit]
Some types of chemotherapy are gonadotoxic and may cause infertility.[111] Chemotherapies with high risk include procarbazine and other alkylating drugs such as cyclophosphamide, ifosfamide, busulfan, melphalan, chlorambucil, and chlormethine.[111] Drugs with medium risk include doxorubicin and platinum analogs such as cisplatin and carboplatin.[111] On the other hand, therapies with low risk of gonadotoxicity include plant derivatives such as vincristine and vinblastine, antibiotics such as bleomycin and dactinomycin, and antimetabolites such as methotrexate, mercaptopurine, and 5-fluorouracil.[111]
Female infertility by chemotherapy appears to be secondary to premature ovarian failure by loss of primordial follicles.[112] This loss is not necessarily a direct effect of the chemotherapeutic agents, but could be due to an increased rate of growth initiation to replace damaged developing follicles.[112]
People may choose between several methods of fertility preservation prior to chemotherapy, including cryopreservation of semen, ovarian tissue, oocytes, or embryos.[113] As more than half of cancer patients are elderly, this adverse effect is only relevant for a minority of patients. A study in France between 1999 and 2011 came to the result that embryo freezing before administration of gonadotoxic agents to females caused a delay of treatment in 34% of cases, and a live birth in 27% of surviving cases who wanted to become pregnant, with the follow-up time varying between 1 and 13 years.[114]
Potential protective or attenuating agents include GnRH analogs, where several studies have shown a protective effect in vivo in humans, but some studies show no such effect. Sphingosine-1-phosphate (S1P) has shown similar effect, but its mechanism of inhibiting the sphingomyelin apoptotic pathway may also interfere with the apoptosis action of chemotherapy drugs.[115]
In chemotherapy as a conditioning regimen in hematopoietic stem cell transplantation, a study of people conditioned with cyclophosphamide alone for severe aplastic anemia came to the result that ovarian recovery occurred in all women younger than 26 years at time of transplantation, but only in five of 16 women older than 26 years.[116]
Teratogenicity[edit]
Chemotherapy is teratogenic during pregnancy, especially during the first trimester, to the extent that abortion usually is recommended if pregnancy in this period is found during chemotherapy.[117] Second- and third-trimester exposure does not usually increase the teratogenic risk and adverse effects on cognitive development, but it may increase the risk of various complications of pregnancy and fetal myelosuppression.[117]
In males previously having undergone chemotherapy or radiotherapy, there appears to be no increase in genetic defects or congenital malformations in their children conceived after therapy.[117] The use of assisted reproductive technologies and micromanipulation techniques might increase this risk.[117] In females previously having undergone chemotherapy, miscarriage and congenital malformations are not increased in subsequent conceptions.[117] However, when in vitro fertilization and embryo cryopreservation is practised between or shortly after treatment, possible genetic risks to the growing oocytes exist, and hence it has been recommended that the babies be screened.[117]
Peripheral neuropathy[edit]
Between 30 and 40 percent of people undergoing chemotherapy experience chemotherapy-induced peripheral neuropathy (CIPN), a progressive, enduring, and often irreversible condition, causing pain, tingling, numbness and sensitivity to cold, beginning in the hands and feet and sometimes progressing to the arms and legs.[118] Chemotherapy drugs associated with CIPN include thalidomide, epothilones, vinca alkaloids, taxanes, proteasome inhibitors, and the platinum-based drugs.[118][119] Whether CIPN arises, and to what degree, is determined by the choice of drug, duration of use, the total amount consumed and whether the person already has peripheral neuropathy. Though the symptoms are mainly sensory, in some cases motor nerves and the autonomic nervous system are affected.[120] CIPN often follows the first chemotherapy dose and increases in severity as treatment continues, but this progression usually levels off at completion of treatment. The platinum-based drugs are the exception; with these drugs, sensation may continue to deteriorate for several months after the end of treatment.[121] Some CIPN appears to be irreversible.[121] Pain can often be managed with drug or other treatment but the numbness is usually resistant to treatment.[122]
Cognitive impairment[edit]
Some people receiving chemotherapy report fatigue or non-specific neurocognitive problems, such as an inability to concentrate; this is sometimes called post-chemotherapy cognitive impairment, referred to as "chemo brain" in popular and social media.[123]
Tumor lysis syndrome[edit]
In particularly large tumors and cancers with high white cell counts, such as lymphomas, teratomas, and some leukemias, some people develop tumor lysis syndrome. The rapid breakdown of cancer cells causes the release of chemicals from the inside of the cells. Following this, high levels of uric acid, potassium and phosphate are found in the blood. High levels of phosphate induce secondary hypoparathyroidism, resulting in low levels of calcium in the blood.[124] This causes kidney damage and the high levels of potassium can cause cardiac arrhythmia. Although prophylaxis is available and is often initiated in people with large tumors, this is a dangerous side-effect that can lead to death if left untreated.[7]: 202
Organ damage[edit]
Cardiotoxicity (heart damage) is especially prominent with the use of anthracycline drugs (doxorubicin, epirubicin, idarubicin, and liposomal doxorubicin). The cause of this is most likely due to the production of free radicals in the cell and subsequent DNA damage. Other chemotherapeutic agents that cause cardiotoxicity, but at a lower incidence, are cyclophosphamide, docetaxel and clofarabine.[125]
Hepatotoxicity (liver damage) can be caused by many cytotoxic drugs. The susceptibility of an individual to liver damage can be altered by other factors such as the cancer itself, viral hepatitis, immunosuppression and nutritional deficiency. The liver damage can consist of damage to liver cells, hepatic sinusoidal syndrome (obstruction of the veins in the liver), cholestasis (where bile does not flow from the liver to the intestine) and liver fibrosis.[126][127]
Nephrotoxicity (kidney damage) can be caused by tumor lysis syndrome and also due direct effects of drug clearance by the kidneys. Different drugs will affect different parts of the kidney and the toxicity may be asymptomatic (only seen on blood or urine tests) or may cause acute kidney injury.[128][129]
Ototoxicity (damage to the inner ear) is a common side effect of platinum based drugs that can produce symptoms such as dizziness and vertigo.[130][131] Children treated with platinum analogues have been found to be at risk for developing hearing loss.[132][133][134]
Other side-effects[edit]
Less common side-effects include red skin (erythema), dry skin, damaged fingernails, a dry mouth (xerostomia), water retention, and sexual impotence. Some medications can trigger allergic or pseudoallergic reactions.
Specific chemotherapeutic agents are associated with organ-specific toxicities, including cardiovascular disease (e.g., doxorubicin), interstitial lung disease (e.g., bleomycin) and occasionally secondary neoplasm (e.g., MOPP therapy for Hodgkin's disease).[135]
Hand-foot syndrome is another side effect to cytotoxic chemotherapy.[136]
Nutritional problems are also frequently seen in cancer patients at diagnosis and through chemotherapy treatment. Research suggests that in children and young people undergoing cancer treatment, parenteral nutrition may help with this leading to weight gain and increased calorie and protein intake, when compared to enteral nutrition.[137]
Limitations[edit]
Chemotherapy does not always work, and even when it is useful, it may not completely destroy the cancer. People frequently fail to understand its limitations. In one study of people who had been newly diagnosed with incurable, stage 4 cancer, more than two-thirds of people with lung cancer and more than four-fifths of people with colorectal cancer still believed that chemotherapy was likely to cure their cancer.[138]
The blood–brain barrier poses an obstacle to delivery of chemotherapy to the brain. This is because the brain has an extensive system in place to protect it from harmful chemicals. Drug transporters can pump out drugs from the brain and brain's blood vessel cells into the cerebrospinal fluid and blood circulation. These transporters pump out most chemotherapy drugs, which reduces their efficacy for treatment of brain tumors. Only small lipophilic alkylating agents such as lomustine or temozolomide are able to cross this blood–brain barrier.[139][140][141]
Blood vessels in tumors are very different from those seen in normal tissues. As a tumor grows, tumor cells furthest away from the blood vessels become low in oxygen (hypoxic). To counteract this they then signal for new blood vessels to grow. The newly formed tumor vasculature is poorly formed and does not deliver an adequate blood supply to all areas of the tumor. This leads to issues with drug delivery because many drugs will be delivered to the tumor by the circulatory system.[142]
Resistance[edit]
Resistance is a major cause of treatment failure in chemotherapeutic drugs. There are a few possible causes of resistance in cancer, one of which is the presence of small pumps on the surface of cancer cells that actively move chemotherapy from inside the cell to the outside. Cancer cells produce high amounts of these pumps, known as p-glycoprotein, in order to protect themselves from chemotherapeutics. Research on p-glycoprotein and other such chemotherapy efflux pumps is currently ongoing. Medications to inhibit the function of p-glycoprotein are undergoing investigation, but due to toxicities and interactions with anti-cancer drugs their development has been difficult.[143][144] Another mechanism of resistance is gene amplification, a process in which multiple copies of a gene are produced by cancer cells. This overcomes the effect of drugs that reduce the expression of genes involved in replication. With more copies of the gene, the drug can not prevent all expression of the gene and therefore the cell can restore its proliferative ability. Cancer cells can also cause defects in the cellular pathways of apoptosis (programmed cell death). As most chemotherapy drugs kill cancer cells in this manner, defective apoptosis allows survival of these cells, making them resistant. Many chemotherapy drugs also cause DNA damage, which can be repaired by enzymes in the cell that carry out DNA repair. Upregulation of these genes can overcome the DNA damage and prevent the induction of apoptosis. Mutations in genes that produce drug target proteins, such as tubulin, can occur which prevent the drugs from binding to the protein, leading to resistance to these types of drugs.[145] Drugs used in chemotherapy can induce cell stress, which can kill a cancer cell; however, under certain conditions, cells stress can induce changes in gene expression that enables resistance to several types of drugs.[146] In lung cancer, the transcription factor NFκB is thought to play a role in resistance to chemotherapy, via inflammatory pathways.[147][148][149]
Cytotoxics and targeted therapies[edit]
Targeted therapies are a relatively new class of cancer drugs that can overcome many of the issues seen with the use of cytotoxics. They are divided into two groups: small molecule and antibodies. The massive toxicity seen with the use of cytotoxics is due to the lack of cell specificity of the drugs. They will kill any rapidly dividing cell, tumor or normal. Targeted therapies are designed to affect cellular proteins or processes that are utilised by the cancer cells.[150] This allows a high dose to cancer tissues with a relatively low dose to other tissues. Although the side effects are often less severe than that seen of cytotoxic chemotherapeutics, life-threatening effects can occur. Initially, the targeted therapeutics were supposed to be solely selective for one protein. Now it is clear that there is often a range of protein targets that the drug can bind. An example target for targeted therapy is the BCR-ABL1 protein produced from the Philadelphia chromosome, a genetic lesion found commonly in chronic myelogenous leukemia and in some patients with acute lymphoblastic leukemia. This fusion protein has enzyme activity that can be inhibited by imatinib, a small molecule drug.[151][152][153][154]
Mechanism of action[edit]

Cancer is the uncontrolled growth of cells coupled with malignant behaviour: invasion and metastasis (among other features).[155] It is caused by the interaction between genetic susceptibility and environmental factors.[156][157] These factors lead to accumulations of genetic mutations in oncogenes (genes that control the growth rate of cells) and tumor suppressor genes (genes that help to prevent cancer), which gives cancer cells their malignant characteristics, such as uncontrolled growth.[158]: 93–94
In the broad sense, most chemotherapeutic drugs work by impairing mitosis (cell division), effectively targeting fast-dividing cells. As these drugs cause damage to cells, they are termed cytotoxic. They prevent mitosis by various mechanisms including damaging DNA and inhibition of the cellular machinery involved in cell division.[39][159] One theory as to why these drugs kill cancer cells is that they induce a programmed form of cell death known as apoptosis.[160]
Поскольку химиотерапия влияет на деление клеток, опухоли с высокими темпами роста (такие как острый миелогенный лейкоз и агрессивные лимфомы , включая болезнь Ходжкина ) более чувствительны к химиотерапии, поскольку большая часть клеток-мишеней подвергается клеточному делению в любое время. Злокачественные новообразования с более медленными темпами роста, такие как индолентные лимфомы, как правило, реагируют на химиотерапию гораздо скромнее. [4] Гетерогенные опухоли также могут проявлять различную чувствительность к химиотерапевтическим агентам в зависимости от субклональных популяций внутри опухоли. [161]
Клетки иммунной системы также вносят решающий вклад в противоопухолевый эффект химиотерапии. [162] Например, химиотерапевтические препараты оксалиплатин и циклофосфамид могут вызывать гибель опухолевых клеток способом, который обнаруживается иммунной системой (так называемая иммуногенная смерть клеток ), которая мобилизует иммунные клетки с противоопухолевыми функциями. [163] Химиотерапевтические препараты, вызывающие иммуногенную гибель раковых опухолевых клеток, могут сделать невосприимчивые опухоли чувствительными к терапии иммунных контрольных точек . [164]
Другое использование [ править ]
Некоторые химиотерапевтические препараты используются при заболеваниях, отличных от рака, например, при аутоиммунных заболеваниях, [165] и нераковая дискразия плазматических клеток . В некоторых случаях их часто используют в более низких дозах, что означает, что побочные эффекты сведены к минимуму. [165] в то время как в других случаях используются дозы, аналогичные тем, которые используются для лечения рака. Метотрексат применяют при лечении ревматоидного артрита (РА). [166] псориаз , [167] анкилозирующий спондилоартрит [168] и рассеянный склероз . [169] [170] Считается, что противовоспалительный ответ, наблюдаемый при РА, обусловлен увеличением уровня аденозина , который вызывает иммуносупрессию ; воздействие на иммунорегуляторные циклооксигеназы пути фермента -2; снижение провоспалительных цитокинов ; и антипролиферативные свойства. [166] Хотя метотрексат используется для лечения как рассеянного склероза, так и анкилозирующего спондилита, его эффективность при этих заболеваниях до сих пор не определена. [168] [169] [170] Циклофосфамид иногда используется для лечения волчаночного нефрита , распространенного симптома системной красной волчанки . [171] Дексаметазон вместе с бортезомибом или мелфаланом обычно используется для лечения AL-амилоидоза . Недавно бортезомид в сочетании с циклофосфамидом и дексаметазоном также оказался перспективным для лечения AL-амилоидоза. Другие препараты, используемые для лечения миеломы , такие как леналидомид, показали многообещающую эффективность в лечении AL-амилоидоза. [172]
Химиотерапевтические препараты также используются в схемах кондиционирования перед трансплантацией костного мозга ( трансплантация гемопоэтических стволовых клеток ). Схемы кондиционирования используются для подавления иммунной системы реципиента, чтобы обеспечить приживление трансплантата. Циклофосфамид является распространенным цитотоксическим препаратом, используемым таким образом, и его часто применяют в сочетании с общим облучением тела . Химиотерапевтические препараты могут использоваться в высоких дозах для окончательного удаления клеток костного мозга реципиента (миелоаблативное кондиционирование) или в более низких дозах, чтобы предотвратить необратимую потерю костного мозга (немиелоаблативное кондиционирование и кондиционирование пониженной интенсивности). [173] При использовании в нераковых условиях лечение по-прежнему называется «химиотерапией» и часто проводится в тех же лечебных центрах, которые используются для людей, больных раком.
Профессиональное воздействие и безопасное обращение [ править ]
Этот раздел написан как руководство или руководство . ( июнь 2023 г. ) |
В 1970-х годах противоопухолевые (химиотерапевтические) препараты были признаны опасными, и с тех пор Американское общество фармацевтов системы здравоохранения (ASHP) ввело концепцию опасных лекарств после публикации в 1983 году рекомендации относительно обращения с опасными лекарствами. Адаптация федеральных правил произошла, когда Управление по охране труда США (OSHA) впервые опубликовало свои рекомендации в 1986 году, а затем обновило их в 1996, 1999 годах и, совсем недавно, в 2006 году. [174]
С тех пор Национальный институт безопасности и гигиены труда (NIOSH) проводит оценку на рабочем месте в отношении этих препаратов. Профессиональное воздействие противоопухолевых препаратов связано с многочисленными последствиями для здоровья, включая бесплодие и возможные канцерогенные эффекты. В отчете NIOSH сообщалось о нескольких случаях, например, о случае, когда у женщины-фармацевта был диагностирован папиллярный переходно-клеточный рак. За двенадцать лет до того, как у фармацевта диагностировали это заболевание, она проработала 20 месяцев в больнице, где отвечала за приготовление нескольких противоопухолевых препаратов. [175] У фармацевта не было других факторов риска развития рака, и поэтому ее рак был связан с воздействием противоопухолевых препаратов, хотя причинно-следственная связь в литературе не установлена. Другой случай произошел, когда предположительно неисправность в шкафах биобезопасности привела к воздействию противоопухолевых препаратов на медперсонал. Расследования выявили наличие генотоксичных биомаркеров через два и девять месяцев после воздействия.
Пути воздействия [ править ]
Противоопухолевые препараты обычно вводятся внутривенно , внутримышечно , интратекально или подкожно . В большинстве случаев, прежде чем лекарство будет введено пациенту, его необходимо подготовить и обработать несколькими работниками. Любой работник, который занимается обращением, приготовлением или введением лекарств, а также чисткой предметов, контактировавших с противоопухолевыми препаратами, потенциально подвергается воздействию опасных лекарств. Медицинские работники подвергаются воздействию лекарств при различных обстоятельствах, например, когда фармацевты и фармацевты готовят и обрабатывают противоопухолевые препараты, а также когда медсестры и врачи вводят лекарства пациентам. Кроме того, риску заражения подвергаются и те, кто отвечает за утилизацию противоопухолевых препаратов в медицинских учреждениях. [176]
Считается, что основным путем воздействия является кожное воздействие, поскольку значительные количества противоопухолевых агентов были обнаружены в перчатках, которые носят медицинские работники, которые готовят, обрабатывают и вводят эти агенты. Еще один заслуживающий внимания путь воздействия – вдыхание паров наркотиков. В многочисленных исследованиях ингаляционный путь изучался как путь воздействия, и хотя пробы воздуха не выявили каких-либо опасных уровней, это все еще потенциальный путь воздействия. Проглатывание через руки в рот представляет собой путь заражения, который менее вероятен по сравнению с другими из-за жестких гигиенических стандартов в медицинских учреждениях. Тем не менее, это все еще потенциальный путь, особенно на рабочем месте, за пределами медицинского учреждения. Человек также может подвергнуться воздействию этих опасных наркотиков при инъекции иглой . Исследования, проведенные в этой области, установили, что профессиональное воздействие происходит путем изучения доказательств в многочисленных пробах мочи медицинских работников. [177]
Опасности [ править ]
Опасные лекарства подвергают медицинских работников серьезному риску для здоровья. Многие исследования показывают, что противоопухолевые препараты могут иметь множество побочных эффектов на репродуктивную систему, такие как потеря плода, врожденные пороки развития и бесплодие. Работники здравоохранения, которые во многих случаях подвергаются воздействию противоопухолевых препаратов, имеют неблагоприятные репродуктивные последствия, такие как самопроизвольные аборты, мертворождения и врожденные пороки развития. Более того, исследования показали, что воздействие этих препаратов приводит к нарушениям менструального цикла. Противоопухолевые препараты также могут увеличить риск нарушений обучаемости среди детей работников здравоохранения, которые подвергаются воздействию этих опасных веществ. [178]
Более того, эти препараты обладают канцерогенным действием. За последние пять десятилетий многочисленные исследования показали канцерогенные эффекты воздействия противоопухолевых препаратов. Аналогичным образом, были проведены исследования, которые связали алкилирующие агенты с развитием у людей лейкемии. Исследования показали повышенный риск развития рака молочной железы, немеланомного рака кожи и рака прямой кишки среди медсестер, подвергающихся воздействию этих препаратов. Другие исследования показали, что существует потенциальный генотоксический эффект противоопухолевых препаратов для работников медицинских учреждений. [175]
Безопасное обращение в медицинских учреждениях [ править ]
По состоянию на 2018 год не было установлено никаких пределов профессионального воздействия для противоопухолевых препаратов, то есть OSHA или Американская конференция правительственных специалистов по промышленной гигиене (ACGIH) не установили руководящие принципы безопасности на рабочем месте. [179]
Подготовка [ править ]
NIOSH рекомендует использовать вентилируемый шкаф , предназначенный для снижения воздействия на работников. Кроме того, он рекомендует провести обучение всего персонала, использовать шкафы, провести первоначальную оценку техники программы безопасности и носить защитные перчатки и халаты при открытии упаковки лекарств, обращении с флаконами или маркировке. При ношении средств индивидуальной защиты перед использованием следует проверять перчатки на наличие физических дефектов и всегда надевать двойные перчатки и защитные халаты. Медицинские работники также обязаны мыть руки с водой и мылом до и после работы с противоопухолевыми препаратами, менять перчатки каждые 30 минут или при каждом проколе и немедленно выбрасывать их в контейнер для химиотерапевтических отходов. [180]
Используемые халаты должны быть одноразовыми, изготовленными из полипропилена с полиэтиленовым покрытием. Нося халаты, люди должны убедиться, что они закрыты и имеют длинные рукава. Когда подготовка завершена, конечный продукт следует полностью запечатать в полиэтиленовый пакет. [181]
Медицинский работник также должен протирать все контейнеры для отходов внутри вентилируемого шкафа, прежде чем вынимать их из шкафа. Наконец, работникам следует снять всю защитную одежду и положить ее в мешок для утилизации внутри вентилируемого шкафа. [176]
Администрация [ править ]
Лекарственные препараты следует вводить только с использованием защитных медицинских устройств, таких как списки игл и закрытых систем, а также таких методов, как заполнение внутривенных трубок персоналом аптеки внутри вентилируемого шкафа. Работники всегда должны носить средства индивидуальной защиты, такие как двойные перчатки, очки и защитные халаты, при открытии внешней сумки и сборке системы доставки для доставки препарата пациенту, а также при утилизации всех материалов, использованных при введении лекарств. [179]
Больничным работникам никогда не следует вынимать трубки из капельного мешка, содержащего противоопухолевый препарат, а при отсоединении трубок системы они должны убедиться, что трубки тщательно промыты. После извлечения капельного мешка работники должны поместить его вместе с другими одноразовыми предметами непосредственно в желтый контейнер для отходов химиотерапии с закрытой крышкой. Защитные средства следует снять и положить в одноразовый контейнер для химиотерапевтических отходов. После этого следует собрать отходы химиотерапии в двойной пакет до или после снятия внутренних перчаток. Кроме того, перед тем как покинуть место введения препарата, необходимо всегда мыть руки с мылом. [182]
Обучение сотрудников [ править ]
Все сотрудники, чья работа в медицинских учреждениях подвергает их воздействию опасных наркотиков, должны пройти обучение. Обучение должно охватывать персонал, занимающийся транспортировкой и приемкой, домработниц, фармацевтов, помощников и всех лиц, участвующих в транспортировке и хранении противоопухолевых препаратов. Эти люди должны получить информацию и пройти обучение, чтобы информировать их об опасностях наркотиков, присутствующих в их сферах работы. Они должны быть проинформированы и обучены операциям и процедурам на своих рабочих местах, где они могут столкнуться с опасностями, различным методам, используемым для обнаружения присутствия опасных наркотиков и тому, как высвобождаются опасности, а также физическим опасностям и опасностям для здоровья, связанным с наркотиками, включая их репродуктивную функцию. и потенциал канцерогенной опасности. Кроме того, их следует проинформировать и обучить мерам, которые им следует принять, чтобы избежать этих опасностей и защитить себя от них. Эту информацию необходимо предоставлять при контакте медицинских работников с лекарственными средствами, то есть при выполнении первоначального задания на рабочем месте с опасными лекарственными средствами. Кроме того, обучение должно проводиться при появлении новых опасностей, а также при внедрении новых лекарств, процедур или оборудования. [179]
Уборка и вывоз мусора [ править ]
При проведении уборки и обеззараживания рабочей зоны, где применяются противоопухолевые препараты, следует обеспечить достаточную вентиляцию для предотвращения накопления концентраций передающихся по воздуху препаратов. При очистке рабочей поверхности работники больницы должны использовать деактивирующие и чистящие средства до и после каждого вида деятельности, а также в конце смены. Уборку всегда следует производить в двойных защитных перчатках и одноразовых халатах. После того, как сотрудники завершат уборку, им следует выбросить использованные при этом предметы в желтый контейнер для отходов химиотерапии, надев при этом защитные перчатки. После снятия перчаток следует тщательно вымыть руки с мылом. Все, что вступало в контакт или имело следы противоопухолевых препаратов, например иглы, пустые флаконы, шприцы, халаты и перчатки, следует поместить в контейнер для отходов химиотерапии. [183]
Контроль разливов [ править ]
Необходимо иметь письменную политику на случай разлива противоопухолевых препаратов. Политика должна учитывать возможность разливов разного размера, а также процедуры и средства индивидуальной защиты, необходимые для каждого размера. Обученный работник должен справиться с большой утечкой и всегда выбрасывать все чистящие материалы в контейнер для химических отходов в соответствии с правилами EPA, а не в желтый контейнер для отходов химиотерапии. [184]
Профессиональный мониторинг [ править ]
медицинского наблюдения Необходимо разработать программу . В случае воздействия специалисты по гигиене труда должны запросить подробный анамнез и провести тщательный медицинский осмотр. Им следует проверить мочу потенциально подвергшегося воздействию работника с помощью щупа или микроскопического исследования, в основном на наличие крови, поскольку известно, что некоторые противоопухолевые препараты вызывают повреждение мочевого пузыря. [175]
Мутагенность мочи является маркером воздействия противоопухолевых препаратов, который впервые был использован Фальком и его коллегами в 1979 году с использованием анализов бактериальной мутагенности. Помимо того, что тест неспецифичен, на него могут влиять посторонние факторы, такие как рацион питания и курение, поэтому его используют с осторожностью. Однако испытание сыграло значительную роль в изменении использования боксов с горизонтальным потоком на боксы биологической безопасности с вертикальным потоком при приготовлении противоопухолевых препаратов, поскольку первые подвергали медицинских работников воздействию высоких доз лекарств. Это изменило обращение с лекарствами и эффективно снизило воздействие противоопухолевых препаратов на рабочих. [175]
Биомаркеры воздействия противоопухолевых препаратов обычно включают платину в моче , метотрексат , циклофосфамид и ифосфамид в моче , а также метаболит 5-фторурацила в моче . Помимо этого, существуют и другие препараты, позволяющие измерять содержание лекарств непосредственно в моче, хотя они используются редко. Измерение содержания этих препаратов непосредственно в моче является признаком высокого уровня воздействия и того, что попадание наркотиков происходит либо через дыхательные пути, либо через кожу. [175]
Доступные агенты [ править ]
Существует обширный список противоопухолевых средств . Для разделения лекарств, применяемых против рака, на несколько различных типов использовалось несколько классификационных схем. [185] [186]
История [ править ]
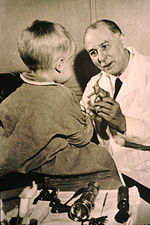

Впервые низкомолекулярные препараты для лечения рака были использованы в начале 20-го века, хотя конкретные химические вещества изначально не предназначались для этой цели. Горчичный газ использовался в качестве боевого отравляющего вещества во время Первой мировой войны , и было обнаружено, что он является мощным подавителем кроветворения (производства крови). [187] Подобное семейство соединений, известное как азотистые иприты, дополнительно изучалось во время Второй мировой войны в Йельской медицинской школе . [188] Было высказано предположение, что агент, повреждающий быстро растущие лейкоциты, может оказывать аналогичный эффект на рак. [188] Поэтому в декабре 1942 года нескольким людям с запущенными лимфомами (раком лимфатической системы и лимфатических узлов) препарат вводили внутривенно, а не вдыхая раздражающий газ. [188] Их улучшение, хотя и временное, было замечательным. [189] Одновременно с этим во время военной операции во время Второй мировой войны, после налета немецкой авиации на итальянскую гавань Бари , несколько сотен человек случайно подверглись воздействию горчичного газа, который был доставлен туда союзными войсками для подготовки к возможному возмездию в случае использования Германией химического оружия. Позже выяснилось, что у выживших было очень низкое количество лейкоцитов. [190] После того, как Вторая мировая война закончилась и отчеты были рассекречены, опыты совпали и побудили исследователей искать другие вещества, которые могли бы оказывать аналогичное воздействие на рак. Первым химиотерапевтическим препаратом, разработанным в рамках этого направления исследований, был мустин . С тех пор было разработано множество других лекарств для лечения рака, и разработка лекарств превратилась в многомиллиардную индустрию, хотя принципы и ограничения химиотерапии, открытые ранними исследователями, все еще применимы. [191]
Термин химиотерапия [ править ]
Слово «химиотерапия без модификатора» обычно относится к лечению рака, но его историческое значение было более широким. Этот термин был придуман в начале 1900-х годов Полом Эрлихом и означал любое использование химических веществ для лечения любого заболевания ( химио - + -терапия ), например, использование антибиотиков ( антибактериальная химиотерапия ). [192] Эрлих не верил в то, что будут найдены эффективные химиотерапевтические препараты для лечения рака. [192] Первым современным химиотерапевтическим средством был арсфенамин , соединение мышьяка, открытое в 1907 году и используемое для лечения сифилиса . [193] Позже последовали сульфаниламиды (сульфамидные препараты) и пенициллин . В сегодняшнем использовании смысл « «любое лечение заболеваний лекарственными средствами» часто выражается словом фармакотерапия» . С точки зрения метафорического языка, «химиотерапию» можно сравнить с идеей «шторма», поскольку и то и другое может вызвать страдания, но впоследствии может иметь лечебный/очищающий эффект.
Исследования [ править ]

Средства целевой доставки [ править ]
Специально направленные средства доставки направлены на повышение эффективных уровней химиотерапии для опухолевых клеток при одновременном снижении эффективных уровней для других клеток. Это должно привести к увеличению гибели опухоли или снижению токсичности, или к тому и другому. [194]
Конъюгаты антитело-лекарственное средство [ править ]
Конъюгаты антитело-лекарственное средство (ADC) содержат антитело , лекарственное средство и линкер между ними. Антитело будет нацелено на белок, преимущественно экспрессируемый в опухолевых клетках (известный как опухолевый антиген ) или на клетки, которые опухоль может использовать, например, эндотелиальные клетки кровеносных сосудов . Они связываются с опухолевым антигеном и интернализуются, при этом линкер высвобождает лекарство в клетку. Эти специально направленные средства доставки различаются по своей стабильности, селективности и выбору мишени, но, по сути, все они направлены на увеличение максимальной эффективной дозы, которая может быть доставлена в опухолевые клетки. [195] Снижение системной токсичности означает, что их также можно использовать у более больных людей и что они могут нести новые химиотерапевтические агенты, которые были бы слишком токсичными для введения традиционными системными подходами. [196]
Первым одобренным препаратом этого типа был гемтузумаб озогамицин (Милотарг), выпущенный компанией Wyeth (ныне Pfizer ). Препарат одобрен для лечения острого миелолейкоза . [197] Два других препарата, трастузумаб эмтанзин и брентуксимаб ведотин , находятся на поздних клинических испытаниях, а последний получил ускоренное одобрение для лечения рефрактерной лимфомы Ходжкина и системной анапластической крупноклеточной лимфомы . [195]
Наночастицы [ править ]
Наночастицы — это частицы размером от 1 до 1000 нанометров (нм), которые могут способствовать селективности опухоли и способствовать доставке малорастворимых лекарств . Наночастицы могут быть нацелены пассивно или активно. Пассивное нацеливание использует разницу между кровеносными сосудами опухоли и нормальными кровеносными сосудами. Кровеносные сосуды в опухолях являются «дырявыми», поскольку имеют щели размером от 200 до 2000 нм, которые позволяют наночастицам проникать в опухоль. Активное нацеливание использует биологические молекулы ( антитела , белки , ДНК и лиганды рецепторов ) для преимущественного нацеливания наночастиц на опухолевые клетки. Существует множество типов систем доставки наночастиц, таких как диоксид кремния , полимеры , липосомы. [198] и магнитные частицы. Наночастицы из магнитного материала также можно использовать для концентрации агентов в местах опухоли с помощью внешнего магнитного поля. [194] Они стали полезным средством магнитной доставки плохо растворимых веществ, таких как паклитаксел . [199]
Электрохимиотерапия [ править ]
Электрохимиотерапия — это комбинированное лечение, при котором за инъекцией химиотерапевтического препарата следует локальное воздействие высоковольтных электрических импульсов на опухоль. Лечение позволяет химиотерапевтическим препаратам, которые в противном случае не могут или с трудом проходят через мембрану клеток (таким как блеомицин и цисплатин), проникнуть в раковые клетки. Следовательно, достигается большая эффективность противоопухолевого лечения. [200]
Клиническая электрохимиотерапия успешно применяется для лечения опухолей кожи и подкожной клетчатки независимо от их гистологического происхождения. [201] [202] Во всех отчетах о клиническом использовании электрохимиотерапии метод отмечен как безопасный, простой и высокоэффективный. По проекту ESOPE (Европейские стандартные операционные процедуры электрохимиотерапии) были подготовлены Стандартные операционные процедуры (СОП) электрохимиотерапии, основанные на опыте ведущих европейских онкологических центров по электрохимиотерапии. [203] [204] Недавно были разработаны новые методы электрохимиотерапии для лечения внутренних опухолей с использованием хирургических процедур, эндоскопических методов или чрескожных подходов для получения доступа к области лечения. [205] [206]
терапия Гипертермическая
Гипертермическая терапия — это тепловое лечение рака, которое может стать мощным инструментом в сочетании с химиотерапией (термохимиотерапией) или лучевой терапией для борьбы с различными видами рака. Тепло можно приложить локально к месту опухоли, что расширит кровеносные сосуды опухоли, позволяя большему количеству химиотерапевтических препаратов проникнуть в опухоль. Кроме того, мембрана опухолевой клетки станет более пористой, что позволит большему количеству химиотерапевтического препарата проникнуть в опухолевую клетку.
Также было показано, что гипертермия помогает предотвратить или обратить вспять «химиорезистентность». Устойчивость к химиотерапии иногда развивается с течением времени, поскольку опухоли адаптируются и могут преодолеть токсичность химиопрепаратов. «Преодоление химиорезистентности широко изучалось в прошлом, особенно с использованием клеток, устойчивых к CDDP. Что касается потенциальной выгоды, заключающейся в том, что устойчивые к лекарствам клетки могут быть задействованы для эффективной терапии путем сочетания химиотерапии с гипертермией, было важно показать, что химиорезистентность против нескольких противораковые препараты (например, митомицин С, антрациклины, BCNU, мелфалан), включая CDDP, можно, по крайней мере частично, обратить вспять путем добавления тепла. [207]
Другие животные [ править ]
Химиотерапия используется в ветеринарии так же, как и в медицине человека. [208]
См. также [ править ]
- Противораковые препараты (журнал)
- Антимикробная химиотерапия
- Рак и тошнота
- Усталость, связанная с раком
- Химия мозга
- Схемы химиотерапии
- Цитостаз
- Экспериментальные методы лечения рака
- Безопасное обращение с опасными лекарствами
- Доставка лекарств
- Гипертермическая терапия
- Иммунотерапия
- Национальная комплексная онкологическая сеть
- Снижение когнитивных функций, вызванное радиацией
- Лучевая терапия
- Виротерапия
Ссылки [ править ]
- ↑ Перейти обратно: Перейти обратно: а б Альфарук К.О., Сток К.М., Тейлор С., Уолш М., Муддатир А.К., Вердуско Д. и др. (15 июля 2015 г.). «Устойчивость к химиотерапии рака: отсутствие реакции на лекарство от ADME до P-gp» . Международная организация раковых клеток . 15 (1): 71. дои : 10.1186/s12935-015-0221-1 . ПМЦ 4502609 . ПМИД 26180516 .
- ^ Джонстон Р.В., Рюфли А.А., Лоу С.В. (январь 2002 г.). «Апоптоз: связь между генетикой рака и химиотерапией» . Клетка . 108 (2): 153–64. дои : 10.1016/S0092-8674(02)00625-6 . ПМИД 11832206 . S2CID 7429296 .
- ^ Раджман Л., Чвалек К., Синклер Д.А. (2018). «Терапевтический потенциал молекул, усиливающих НАД: данные in vivo» . Клеточный метаболизм . 27 (3): 529–547. дои : 10.1016/j.cmet.2018.02.011 . ПМК 6342515 . ПМИД 29514064 .
- ↑ Перейти обратно: Перейти обратно: а б с д и ж Корри П.Г., Пиппа Г. (2008). «Цитотоксическая химиотерапия: клинические аспекты». Лекарство . 36 (1): 24–28. дои : 10.1016/j.mpmed.2007.10.012 .
- ↑ Перейти обратно: Перейти обратно: а б с Вагнер А.Д., Син Н.Л., Мёлер М., Гроте В., Йонг В.П., Тай Б.К., Хо Дж., Унверзагт С. (август 2017 г.). «Химиотерапия распространенного рака желудка» . Кокрановская база данных систематических обзоров . 2017 (8): CD004064. дои : 10.1002/14651858.cd004064.pub4 . ПМК 6483552 . ПМИД 28850174 .
- ↑ Перейти обратно: Перейти обратно: а б с д и ж г час я дж к Рэйчел Эйрли (2009). Химиотерапия рака . Уайли-Блэквелл. ISBN 978-0-470-09254-5 .
- ↑ Перейти обратно: Перейти обратно: а б с д и ж Вуд М., Брайтон Д. (2005). Справочник Королевской больницы Марсдена по химиотерапии рака: руководство для многопрофильной команды . Сент-Луис, Миссури: Эльзевир Черчилль Ливингстон. ISBN 978-0-443-07101-0 .
- ^ Перри, Майкл Дж. (2008). Справочник по химиотерапии . Филадельфия: Wolters Kluwer Health/Lippincott Williams & Wilkins. ISBN 978-0-7817-7328-7 .
- ^ Эпштейн Р.Дж. (август 2005 г.). «Поддерживающая терапия для подавления микрометастазирования: новая задача адъювантного лечения рака» . Клинические исследования рака . 11 (15): 5337–41. дои : 10.1158/1078-0432.CCR-05-0437 . ПМИД 16061845 .
- ^ Скил РТ (2003). Справочник по химиотерапии рака (мягкая обложка) (6-е изд.). Липпинкотт Уильямс и Уилкинс. ISBN 978-0-7817-3629-9 .
- ^ Чабнер Б., Лонго Д.Л. (2005). Химиотерапия и биотерапия рака: принципы и практика (4-е изд.). Филадельфия: Липпинкотт Виллианс и Уилкинс. ISBN 978-0-7817-5628-0 .
- ^ Наступиль Ж.Дж., Роуз AC, Flowers CR (май 2012 г.). «Диффузная крупноклеточная В-клеточная лимфома: современные подходы к лечению». Онкология . 26 (5): 488–95. ПМИД 22730604 .
- ^ Фридман А. (октябрь 2012 г.). «Фолликулярная лимфома: обновленная информация о диагностике и лечении 2012 г.» . Американский журнал гематологии . 87 (10): 988–95. дои : 10.1002/ajh.23313 . ПМИД 23001911 . S2CID 35447562 .
- ^ Рэмплинг Р., Джеймс А., Папанастассиу В. (июнь 2004 г.). «Современное и будущее лечение злокачественных опухолей головного мозга: хирургия, лучевая терапия, химиотерапия» . Журнал неврологии, нейрохирургии и психиатрии . 75 (Приложение 2): ii24-30. дои : 10.1136/jnnp.2004.040535 . ПМЦ 1765659 . ПМИД 15146036 .
- ^ Мадан В., Лир Дж. Т., Сеймис Р. М. (февраль 2010 г.). «Немеланомный рак кожи» . Ланцет . 375 (9715): 673–85. дои : 10.1016/S0140-6736(09)61196-X . ПМК 3339125 . ПМИД 20171403 .
- ^ Дюбуа Д., Дюбуа Э.Ф. (1989). «Формула для оценки приблизительной площади поверхности, если известны рост и вес. 1916». Питание . 5 (5): 303–11, обсуждение 312–3. ПМИД 2520314 .
- ↑ Перейти обратно: Перейти обратно: а б с Феличи А., Вервей Дж., Спарребум А. (сентябрь 2002 г.). «Стратегии дозирования противораковых препаратов: хорошие, плохие и поверхность тела». Европейский журнал рака . 38 (13): 1677–84. дои : 10.1016/s0959-8049(02)00151-x . ПМИД 12175683 .
- ↑ Перейти обратно: Перейти обратно: а б с Кестнер С.А., Сьюэлл Г.Дж. (февраль 2007 г.). «Дозирование химиотерапии, часть I: научная основа современной практики и использования площади поверхности тела». Клиническая онкология . 19 (1): 23–37. дои : 10.1016/j.clon.2006.10.010 . hdl : 10026.1/3714 . ПМИД 17305252 .
- ^ Пинкель Д. (август 1958 г.). «Использование площади поверхности тела как критерия дозировки лекарств при химиотерапии рака». Исследования рака . 18 (7): 853–6. ПМИД 13573353 .
- ↑ Перейти обратно: Перейти обратно: а б Герни Х. (апрель 2002 г.). «Как рассчитать дозу химиотерапии» . Британский журнал рака . 86 (8): 1297–302. дои : 10.1038/sj.bjc.6600139 . ПМЦ 2375356 . ПМИД 11953888 .
- ↑ Перейти обратно: Перейти обратно: а б Боймер Дж. Х., Чу Э., Саламоне С. Дж. (ноябрь 2012 г.). «Дозирование химиотерапии в зависимости от площади поверхности тела: целесообразно в 21 веке?» . Журнал клинической онкологии . 30 (31): 3896–7. дои : 10.1200/JCO.2012.44.2863 . ПМИД 22965963 .
- ↑ Перейти обратно: Перейти обратно: а б Бейкер С.Д., Вервей Дж., Ровински Е.К., Донхауэр Р.К., Шелленс Дж.Х., Грохов Л.Б., Спарребум А. (декабрь 2002 г.). «Роль площади поверхности тела в дозировании исследуемых противораковых препаратов у взрослых, 1991-2001 гг.» . Журнал Национального института рака . 94 (24): 1883–8. дои : 10.1093/jnci/94.24.1883 . ПМИД 12488482 .
- ↑ Перейти обратно: Перейти обратно: а б с д и ж г час я дж Гамелен Э., Дельва Р., Джейкоб Дж., Мерруш Ю., Рауль Дж.Л., Пезе Д., Дорваль Э., Пиот Г., Морель А., Буасдрон-Селле М. (май 2008 г.). «Индивидуальная корректировка дозы фторурацила на основе фармакокинетического наблюдения по сравнению с обычной дозировкой: результаты многоцентрового рандомизированного исследования пациентов с метастатическим колоректальным раком» . Журнал клинической онкологии . 26 (13): 2099–105. дои : 10.1200/jco.2007.13.3934 . ПМИД 18445839 . S2CID 9557055 .
- ^ Саам Дж., Кричфилд Г.К., Гамильтон С.А., Роа Б.Б., Венструп Р.Дж., Калдате Р.Р. (сентябрь 2011 г.). «Дозирование 5-фторурацила в зависимости от площади поверхности тела приводит к значительной межиндивидуальной вариабельности воздействия 5-фторурацила у пациентов с колоректальным раком, получающих схемы FOLFOX». Клинический колоректальный рак . 10 (3): 203–6. дои : 10.1016/j.clcc.2011.03.015 . ПМИД 21855044 .
- ↑ Перейти обратно: Перейти обратно: а б с д и ж г Капитан О, Асевоая А, Буасдрон-Селле М, Пуарье А.Л., Морель А., Гамелен Е (декабрь 2012 г.). «Индивидуальная корректировка дозы фторурацила в FOLFOX на основе фармакокинетического наблюдения по сравнению с обычным дозированием на поверхность тела: фаза II, исследование, подтверждающее концепцию». Клинический колоректальный рак . 11 (4): 263–7. дои : 10.1016/j.clcc.2012.05.004 . ПМИД 22683364 .
- ^ Калдате Р.Р., Харегевойн А., Гриер К.Э., Гамильтон С.А., Маклеод Х.Л. (2012). «Моделирование площади 5-фторурацила под кривой зависимости от дозы для разработки фармакокинетического алгоритма дозирования для пациентов с колоректальным раком, получающих FOLFOX6» . Онколог . 17 (3): 296–302. doi : 10.1634/теонколог.2011-0357 . ПМК 3316912 . ПМИД 22382460 .
- ↑ Перейти обратно: Перейти обратно: а б с Хантер Р.Дж., Наво М.А., Такер П.Х., Бодурка Д.К., Вольф Дж.К., Смит Дж.А. (февраль 2009 г.). «Дозирование химиотерапии у пациентов с ожирением: фактическая и назначенная площадь поверхности тела (BSA)». Обзоры лечения рака . 35 (1): 69–78. дои : 10.1016/j.ctrv.2008.07.005 . ПМИД 18922643 .
- ^ Канал, П.; Шатлю, Э.; Гишар, С. (1998). «Практическое руководство по индивидуализации дозы при химиотерапии рака» . Наркотики . 56 (6): 1019–1038. дои : 10.2165/00003495-199856060-00006 . ISSN 0012-6667 . ПМИД 9878990 . S2CID 36211632 .
- ^ Ханна, Луиза; Кросби, Том; Фергюс Макбет, ред. (2008). Практическая клиническая онкология . Кембридж, Великобритания: Издательство Кембриджского университета. ISBN 978-0-521-61816-8 .
- ^ Баффери П.Дж., Аллен К.М., Чин П.К., Мур Г.А., Барклай М.Л., Бегг Э.Дж. (февраль 2014 г.). «Тринадцатилетний опыт фармакокинетического мониторинга и дозирования бусульфана: можно ли улучшить стратегию?». Терапевтический лекарственный мониторинг . 36 (1): 86–92. дои : 10.1097/FTD.0b013e31829dc940 . ПМИД 24299921 . S2CID 28646787 .
- ^ Бартелинк И.Х., Бредиус Р.Г., Белицер С.В., Сутторп М.М., Бирингс М., Книббе К.А. и др. (2014). «Связь между воздействием бусульфана и исходом у детей, получающих внутривенный бусульфан перед трансплантацией гемопоэтических стволовых клеток». The Drug Monit . 36 (1): 93–99. дои : 10.1097/FTD.0b013e3182a04fc7 . ПМИД 24061446 . S2CID 21072472 .
- ^ «Анализ метотрексата ARK» . Арк Диагностика. Архивировано из оригинала 28 апреля 2014 года . Проверено 28 апреля 2014 г.
- ^ «Настройка химиотерапии для лучшего лечения рака» . Мой уход Диагностика. Архивировано из оригинала 28 апреля 2014 года . Проверено 25 ноября 2018 г.
- ^ «Краткая история дозирования БСА» . Мой уход Диагностика.
- ^ Ашер В., Ли Дж., Бали А. (сентябрь 2012 г.). «Предоперационный сывороточный альбумин является независимым прогностическим предиктором выживаемости при раке яичников». Медицинская онкология . 29 (3): 2005–9. дои : 10.1007/s12032-011-0019-5 . ПМИД 21735143 . S2CID 19558612 .
- ↑ Перейти обратно: Перейти обратно: а б Сиддик Ж. (2005). «Механизмы действия химиотерапевтических средств против рака: ДНК-интерактивные алкилирующие агенты и противоопухолевые препараты на основе платины». Справочник по раку . John Wiley & Sons, Ltd. doi : 10.1002/0470025077.chap84b . ISBN 978-0470025062 .
- ↑ Перейти обратно: Перейти обратно: а б с д и ж Линд М.Дж., М.Дж. (2008). «Принципы цитотоксической химиотерапии». Лекарство . 36 (1): 19–23. дои : 10.1016/j.mpmed.2007.10.003 .
- ↑ Перейти обратно: Перейти обратно: а б с Дамиа Дж., Д'Инкальци М. (сентябрь 1998 г.). «Механизмы устойчивости к алкилирующим агентам» . Цитотехнология . 27 (1–3): 165–73. дои : 10.1023/A:1008060720608 . ПМЦ 3449574 . ПМИД 19002790 .
- ↑ Перейти обратно: Перейти обратно: а б с д Малхотра В., Перри MC (2003). «Классическая химиотерапия: механизмы, токсичность и терапевтическое окно» . Биология и терапия рака . 2 (4 Доп. 1): С2-4. дои : 10.4161/cbt.199 . ПМИД 14508075 .
- ^ Джорджи-Рено С., Рено Дж., Барон М., Гебель-Серволлес П., Делик Дж., Крос С., Паолетти С. (1988). «Гетероциклические хиноны XIII. Димеризация в ряду 5,8-хиназолиндионов: Синтез и противоопухолевые эффекты бис(4-амино-5,8-хиназолиндионов)» . хим. Фарм. Бык . 36 (10): 3933–3947. дои : 10.1248/cpb.36.3933 . ПМИД 3245973 .
- ^ Такимото Ч., Кальво Э (2008). «Принципы онкологической фармакотерапии» . В Паздуре Р., Вагмане Л.Д., Кампхаузене К.А., Хоскинсе В.Дж. (ред.). Лечение рака: междисциплинарный подход (11-е изд.). Архивировано из оригинала 15 мая 2009 года . Проверено 18 июня 2009 г.
- ↑ Перейти обратно: Перейти обратно: а б с Паркер ВБ (июль 2009 г.). «Энзимология пуриновых и пиримидиновых антиметаболитов, применяемых при лечении рака» . Химические обзоры . 109 (7): 2880–93. дои : 10.1021/cr900028p . ПМЦ 2827868 . ПМИД 19476376 .
- ^ Аджей А.А. (июнь 2004 г.). «Пеметрексед (АЛИМТА), новый противоопухолевый препарат многоцелевого действия». Клинические исследования рака . 10 (12, часть 2): 4276–4280 гг. дои : 10.1158/1078-0432.CCR-040010 . ПМИД 15217974 . S2CID 31467685 .
- ^ Вагстафф А.Дж., Ибботсон Т., Гоа К.Л. (2003). «Капецитабин: обзор его фармакологии и терапевтической эффективности при лечении распространенного рака молочной железы». Наркотики . 63 (2): 217–36. дои : 10.2165/00003495-200363020-00009 . ПМИД 12515569 .
- ^ Ровински Е.К., Донхауэр Р.С. (октябрь 1991 г.). «Клиническая фармакология и использование антимикротрубочковых агентов в химиотерапии рака». Фармакология и терапия . 52 (1): 35–84. дои : 10.1016/0163-7258(91)90086-2 . ПМИД 1687171 .
- ^ Витале, Илио; Галлуцци, Лоренцо; Кастедо, Мария; Кремер, Гвидо (июнь 2011 г.). «Митотическая катастрофа: механизм предотвращения геномной нестабильности» . Nature Reviews Молекулярно-клеточная биология . 12 (6): 385–392. дои : 10.1038/nrm3115 . ISSN 1471-0072 . ПМИД 21527953 . S2CID 22483746 .
- ↑ Перейти обратно: Перейти обратно: а б с Юэ QX, Лю X, Го ДА (август 2010 г.). «Натуральные продукты, связывающие микротрубочки, для терапии рака» . Планта Медика . 76 (11): 1037–43. дои : 10.1055/s-0030-1250073 . ПМИД 20577942 .
- ^ Хирата К., Миямото К., Миура Ю. (1994). « Catharanthus roseus L. (Барвинок): производство виндолина и катарантина в многопобеговых культурах» . В Баджадже Ю.П. (ред.). Биотехнология в сельском и лесном хозяйстве 26 . Лекарственные и ароматические растения. Том. VI. Спрингер-Верлаг . стр. 46–55 . ISBN 9783540563914 .
- ^ ван дер Хейден Р., Джейкобс Д.И., Снойер В., Халлард Д., Верпорте Р. (март 2004 г.). «Алкалоиды катаранта: фармакогнозия и биотехнология». Современная медицинская химия . 11 (5): 607–28. дои : 10.2174/0929867043455846 . ПМИД 15032608 .
- ^ Ганзауэр А., Юстиция Дж., Фан К.А., Воргалл Д., Пистерт Ф. (2007). «Образование восстановительной связи C—C после раскрытия эпоксида посредством переноса электрона» . В Крише М.Ю. (ред.). Образование восстановительной связи C—C, катализируемое металлом: отличие от предварительно полученных металлоорганических реагентов . Темы современной химии. Том. 279. Springer Science & Business Media . стр. 25–52. дои : 10.1007/128_2007_130 . ISBN 9783540728795 .
- ^ Купер Р., Дикин Дж.Дж. (2016). «Подарок Африки миру» . Ботанические чудеса: химия растений, изменивших мир . ЦРК Пресс . стр. 46–51. ISBN 9781498704304 .
- ↑ Перейти обратно: Перейти обратно: а б Кеглевич П., Хазай Л., Калаус Г., Сантай С. (май 2012 г.). «Модификации основных скелетов винбластина и винкристина» . Молекулы . 17 (5): 5893–914. дои : 10.3390/molecules17055893 . ПМК 6268133 . ПМИД 22609781 .
- ^ Равинья, Энрике (2011). «Алкалоиды барвинка» . Эволюция открытия лекарств: от традиционных лекарств к современным лекарствам . Джон Уайли и сыновья . стр. 157–159. ISBN 9783527326693 .
- ^ Фаллер Б.А., Пандит Т.Н. (2011). «Безопасность и эффективность винорелбина при лечении немелкоклеточного рака легких» . Клиническая медицина: онкология . 5 : 131–44. дои : 10.4137/CMO.S5074 . ПМК 3117629 . ПМИД 21695100 .
- ^ Нго QA, Русси Ф, Кормье А, Торет С, Кноссов М, Генар Д, Герит Ф (январь 2009 г.). «Синтез и биологическая оценка алкалоидов барвинка и гибридов фомопсина». Журнал медицинской химии . 52 (1): 134–42. дои : 10.1021/jm801064y . ПМИД 19072542 .
- ^ Крото, Родни; Кетчам, Раймонд Э.Б.; Лонг, Роберт М.; Каспера, Рюдигер; Вильдунг, Марк Р. (2006). «Биосинтез таксола и молекулярная генетика» . Обзоры фитохимии . 5 (1): 75–97. Бибкод : 2006ПЧРв...5...75С . дои : 10.1007/s11101-005-3748-2 . ISSN 1568-7767 . ПМК 2901146 . ПМИД 20622989 .
- ^ Дамаянти Ю., Лоун Дж.В. (июнь 1998 г.). «Подофиллотоксины: современное состояние и последние разработки». Современная медицинская химия . 5 (3): 205–52. дои : 10.2174/0929867305666220314204426 . ПМИД 9562603 . S2CID 247493530 .
- ^ Лю Ю., Ян Л., Тянь Икс (2007). «Подофиллотоксин: современные перспективы». Современные биологически активные соединения . 3 (1): 37–66. дои : 10.1016/j.jallcom.2006.06.070 .
- ^ Лодиш Х., Берк А., Зипурски С.Л. и др. (2000). Молекулярно-клеточная биология. 4-е издание. Роль топоизомераз в репликации ДНК . Нью-Йорк: WH Freeman.
- ^ Гудселл Д.С. (2002). «Молекулярная перспектива: ДНК-топоизомеразы» . Стволовые клетки . 20 (5): 470–1. doi : 10.1634/stemcells.20-5-470 . ПМИД 12351817 . S2CID 9257158 .
- ^ Нитисс Дж.Л. (май 2009 г.). «Нацеливание на ДНК-топоизомеразу II при химиотерапии рака» . Обзоры природы. Рак . 9 (5): 338–50. дои : 10.1038/nrc2607 . ПМЦ 2748742 . ПМИД 19377506 .
- ^ Офферманнс С., Розенталь В. (14 августа 2008 г.). Энциклопедия молекулярной фармакологии . Springer Science & Business Media. п. 155. ИСБН 9783540389163 .
- ^ Офферманнс С., Розенталь В. (14 августа 2008 г.). Энциклопедия молекулярной фармакологии . Springer Science & Business Media. стр. 91 и далее. ISBN 9783540389163 .
- ^ Келлер Дж., Эбл М. (1988). «Митоксантрон: новое производное антрациклина». Клиническая аптека . 7 (8): 574–81. ПМИД 3048848 .
- ^ Минотти Дж., Менна П., Сальваторелли Э., Каиро Дж., Джанни Л. (июнь 2004 г.). «Антрациклины: молекулярные достижения и фармакологические разработки в области противоопухолевой активности и кардиотоксичности». Фармакологические обзоры . 56 (2): 185–229. дои : 10.1124/пр.56.2.6 . ПМИД 15169927 . S2CID 13138853 .
- ^ Собелл Х.М. (август 1985 г.). «Актиномицин и транскрипция ДНК» . Труды Национальной академии наук Соединенных Штатов Америки . 82 (16): 5328–31. Бибкод : 1985PNAS...82.5328S . дои : 10.1073/pnas.82.16.5328 . ПМК 390561 . ПМИД 2410919 .
- ^ Дорр RT (апрель 1992 г.). «Фармакология блеомицина: механизм действия и резистентность, клиническая фармакокинетика». Семинары по онкологии . 19 (2 Приложение 5): 3–8. ПМИД 1384141 .
- ^ Вервей Дж., Пинедо Х.М. (октябрь 1990 г.). «Митомицин С: механизм действия, полезность и ограничения». Противораковые препараты . 1 (1): 5–13. дои : 10.1097/00001813-199010000-00002 . ПМИД 2131038 .
- ^ Грир Дж.А., Амоял Н., Нисотель Л., Фишбейн Дж.Н., Макдональд Дж., Стагль Дж. и др. (март 2016 г.). «Систематический обзор приверженности пероральной противоопухолевой терапии» . Онколог . 21 (3): 354–76. doi : 10.1634/теонколог.2015-0405 . ПМЦ 4786357 . ПМИД 26921292 .
- ^ О'Грэйди, Наоми П.; Александр, Мария; Бернс, Лилиан А.; Деллинджер, Э. Патчен; Гарланд, Джеффри; Херд, Стивен О.; Липсетт, Памела А.; Мазур, Генри; Мермель, Леонард А.; Пирсон, Мишель Л.; Раад, Иссам И.; Рэндольф, Адриенн Г.; Рупп, Марк Э.; Святой, Санджай (1 мая 2011 г.). «Руководство по профилактике внутрисосудистых катетер-ассоциированных инфекций» . Клинические инфекционные болезни . 52 (9): e162–e193. дои : 10.1093/cid/cir257 . ISSN 1058-4838 . ПМК 3106269 . ПМИД 21460264 .
- ^ Морено-Рамирес Д., де ла Крус-Мерино Л., Феррандис Л., Вильегас-Портеро Р., Ньето-Гарсия А. (2010). «Изолированная перфузия конечностей при злокачественной меланоме: систематический обзор эффективности и безопасности» . Онколог . 15 (4): 416–27. doi : 10.1634/теонколог.2009-0325 . ПМК 3227960 . ПМИД 20348274 .
- ^ Верхуф К., де Вилт Дж. Х., тен Хаген Т. Л., Эггермонт А. М. (октябрь 2008 г.). «Изолированная печеночная перфузия для лечения опухолей печени: закат или восход солнца?». Клиники хирургической онкологии Северной Америки . 17 (4): 877–94, xi. дои : 10.1016/j.soc.2008.04.007 . ПМИД 18722924 .
- ^ Хендрикс Дж. М., Ван Шил П. Е. (1998). «Изолированная перфузия легких для лечения легочных метастазов». Хирургическая онкология . 7 (1–2): 59–63. дои : 10.1016/S0960-7404(98)00028-0 . ПМИД 10421507 .
- ^ Читвуд К., Эцкорн Дж., Коэн Дж. (сентябрь 2013 г.). «Местное и внутриочаговое лечение немеланомного рака кожи: сравнение эффективности и стоимости». Дерматологическая хирургия . 39 (9): 1306–16. дои : 10.1111/dsu.12300 . ПМИД 23915332 . S2CID 597295 .
- ^ Эсткур, Лиз Дж; Стэнворт, Саймон Дж; Хоупвелл, Салли; Дори, Кэролайн; Тривелла, Мариалена; Мэсси, Эдвин (29 апреля 2016 г.). «Переливание гранулоцитов для лечения инфекций у людей с нейтропенией или дисфункцией нейтрофилов» . Кокрановская база данных систематических обзоров . 2016 (4): CD005339. дои : 10.1002/14651858.CD005339.pub2 . ISSN 1469-493X . ПМЦ 4930145 . ПМИД 27128488 .
- ^ Леже, Шанталь С.; Невилл, Томас Дж. (11 мая 2004 г.). «Трансплантация гемопоэтических стволовых клеток: учебник для врача первичной медико-санитарной помощи» . Журнал Канадской медицинской ассоциации . 170 (10): 1569–1577. дои : 10.1503/cmaj.1011625 . ISSN 0820-3946 . ПМК 400723 . ПМИД 15136552 .
- ^ Хуан ES (2000). Внутренняя медицина: справочник для врачей, руководство по выживанию ординатора . Арлингтон, Вирджиния: Scrub Hill Press. п. 130. ИСБН 978-0-9645467-5-2 .
- ^ Элад С., Задик Ю., Хьюсон И., Хован А., Корреа М.Э., Логан Р., Элтинг Л.С., Спийкервет Ф.К., Бреннан М.Т. (август 2010 г.). «Систематический обзор вирусных инфекций, связанных с поражением полости рта у онкологических больных: внимание к Herpesviridea». Поддерживающая терапия при раке . 18 (8): 993–1006. дои : 10.1007/s00520-010-0900-3 . ПМИД 20544224 . S2CID 2969472 .
- ↑ Перейти обратно: Перейти обратно: а б с Гафтер-Гвили А., Фрейзер А., Пол М., Видал Л., Лори Т.А., ван де Ветеринг, доктор медицинских наук, Кремер Л.К., Лейбовичи Л. (январь 2012 г.). «Антибиотикопрофилактика бактериальных инфекций у пациентов с афебрильной нейтропенией после химиотерапии» . Кокрановская база данных систематических обзоров . 1 (1): CD004386. дои : 10.1002/14651858.CD004386.pub3 . ПМК 4170789 . ПМИД 22258955 .
- ^ «Кориолус разноцветный» . Рак.орг. 10 июня 2008 года. Архивировано из оригинала 25 июня 2010 года . Проверено 7 августа 2012 г.
- ^ Комиссар Управления (12 февраля 2021 г.). «FDA одобрило препарат для уменьшения подавления функции костного мозга, вызванного химиотерапией» . FDA . Проверено 9 марта 2021 г.
- ^ Давила М.Л. (январь 2006 г.). «Нейтропенический энтероколит». Современное мнение в гастроэнтерологии . 22 (1): 44–7. дои : 10.1097/01.mog.0000198073.14169.3b . ПМИД 16319675 . S2CID 25479771 .
- ^ Синикроп, Фрэнк А. (2003). «Тифлит» . Холланд-Фрай, онкологическая медицина. 6-е издание .
- ↑ Перейти обратно: Перейти обратно: а б Кейдан Р.Д., Фаннинг Дж., Гейтенби Р.А., Уиз Дж.Л. (март 1989 г.). «Рецидивирующий тифлит. Заболевание, возникающее в результате агрессивной химиотерапии». Заболевания толстой и прямой кишки . 32 (3): 206–9. дои : 10.1007/BF02554529 . ПМИД 2920627 . S2CID 46090832 .
- ^ Гибсон Р.Дж., Киф DM (сентябрь 2006 г.). «Диарея и запор, вызванные химиотерапией рака: механизмы повреждения и стратегии профилактики». Поддерживающая терапия при раке . 14 (9): 890–900. дои : 10.1007/s00520-006-0040-y . ПМИД 16604351 . S2CID 109778 .
- ^ Вей Д., Хеус П., ван де Ветеринг Ф.Т., ван Тьенховен Г., Верли Л., Шолтен Р.Дж. (август 2018 г.). «Пробиотики для профилактики или лечения диареи, связанной с химиотерапией или лучевой терапией, у людей, больных раком» . Кокрановская база данных систематических обзоров . 2018 (8): CD008831. дои : 10.1002/14651858.cd008831.pub3 . ПМЦ 6513393 . ПМИД 30168576 .
- ^ Родригес, Фабио Дж; Дасильва, Джованна; Векснер, Стивен Д. (7 января 2017 г.). «Нейтропенический энтероколит» . Всемирный журнал гастроэнтерологии . 23 (1): 42–47. дои : 10.3748/wjg.v23.i1.42 . ISSN 1007-9327 . ПМК 5221285 . ПМИД 28104979 .
- ^ Групман Дж. Э., Итри Л. М. (октябрь 1999 г.). «Анемия, вызванная химиотерапией, у взрослых: заболеваемость и лечение» . Журнал Национального института рака . 91 (19): 1616–34. дои : 10.1093/jnci/91.19.1616 . ПМИД 10511589 .
- ^ Генри Д.Х. (июль 2006 г.). «Роль внутривенного введения железа в анемии, связанной с раком». Онкология . 20 (8 Приложение 6): 21–4. ПМИД 16925107 .
- ^ Роджерс ГМ, Беккер П.С., Беннетт С.Л., Селла Д., Чанан-Хан А., Чесни С., Клиланд С., Кочча П.Ф., Джулбегович Б., Гарст Дж.Л., Гилрит Дж.А., Краут Э.Х., Лин У.К., Матулонис У., Милленсон М., Рейнке Д., Розенталь Дж., Саббатини П., Шварц Р.Н., Штейн Р.С., Видж Р. (июль 2008 г.). «Анемия, вызванная раком и химиотерапией». Журнал Национальной комплексной онкологической сети . 6 (6): 536–64. дои : 10.6004/jnccn.2008.0042 . ПМИД 18597709 .
- ^ Вадхан-Радж С. (январь 2009 г.). «Лечение тромбоцитопении, вызванной химиотерапией: современный статус тромбопоэтических агентов». Семинары по гематологии . 46 (1 Приложение 2): С26-32. doi : 10.1053/j.seminhematol.2008.12.007 . ПМИД 19245931 .
- ^ Сехон СС, Рой В. (май 2006 г.). «Тромбоцитопения у взрослых: практический подход к оценке и лечению». Южный медицинский журнал . 99 (5): 491–8, викторина 499–500, 533. doi : 10.1097/01.smj.0000209275.75045.d4 . ПМИД 16711312 . S2CID 16527763 .
- ^ Эсткорт Л., Стэнворт С., Дори С., Хоупвелл С., Мерфи М.Ф., Тинмут А., Хеддл Н. и др. (Кокрейновская группа по гематологическим злокачественным новообразованиям) (май 2012 г.). «Профилактическое переливание тромбоцитов для профилактики кровотечений у больных с гематологическими заболеваниями после химиотерапии и трансплантации стволовых клеток» . Кокрейновская база данных систематических обзоров (5): CD004269. дои : 10.1002/14651858.CD004269.pub3 . ПМИД 22592695 .
- ^ Эсткорт Л.Дж., Стэнворт С.Дж., Дори С., Хоупвелл С., Тривелла М., Мерфи М.Ф. и др. (Кокрейновская группа по гематологическим злокачественным новообразованиям) (ноябрь 2015 г.). «Сравнение различных пороговых значений количества тромбоцитов для определения профилактического переливания тромбоцитов для предотвращения кровотечений у людей с гематологическими заболеваниями после миелосупрессивной химиотерапии или трансплантации стволовых клеток» . Кокрановская база данных систематических обзоров . 2015 (11): CD010983. дои : 10.1002/14651858.CD010983.pub2 . ПМЦ 4717525 . ПМИД 26576687 .
- ^ Бергер А.М., Абернети А.П., Аткинсон А., Барсевик А.М., Брейтбарт В.С., Селла Д., Симприх Б., Клиланд С., Айзенбергер М.А., Эскаланте С.П., Якобсен П.Б., Калдор П., Лигибель Дж.А., Мерфи Б.А., О'Коннор Т., Пирл В.Ф., Родлер Э., Руго Х.С., Томас Дж., Вагнер Л.И. (август 2010 г.). «Руководство по клинической практике NCCN, усталость, связанная с раком» . Журнал Национальной комплексной онкологической сети . 8 (8): 904–31. дои : 10.6004/jnccn.2010.0067 . ПМИД 20870636 . S2CID 70400559 .
- ^ Франклин DJ, Packel L (март 2006 г.). «Усталость, связанная с раком». Архив физической медицины и реабилитации . 87 (3 Приложение 1): С91–3, викторина С94–5. дои : 10.1016/j.apmr.2005.12.015 . ПМИД 16500197 .
- ^ Крамп Ф., Байрон-Дэниел Дж. (ноябрь 2012 г.). Судорога F (ред.). «Упражнения для борьбы с усталостью, связанной с раком, у взрослых» . Кокрановская база данных систематических обзоров . 11 (9): CD006145. дои : 10.1002/14651858.CD006145.pub3 . ПМЦ 8480137 . ПМИД 23152233 .
- ^ Редакционный совет PDQ по поддерживающей и паллиативной помощи (2002), «Тошнота и рвота, связанные с лечением рака (PDQ®): версия для медицинских работников» , Сводки информации о раке PDQ , Бетесда (Мэриленд): Национальный институт рака (США), PMID 26389491 , получено 8 ноября 2022 г.
- ^ Гилл П., Гроти А., Лопринци С. (2006). «Тошнота и рвота у онкологических больных». Онкология : 1482–1496. дои : 10.1007/0-387-31056-8_83 . ISBN 978-0-387-24291-0 .
Тошнота и рвота являются двумя наиболее опасными побочными эффектами, связанными с лечением рака, для больных раком и их семей.
- ^ Сэнгер, Гарет Дж.; Эндрюс, Пол ЛР (4 сентября 2018 г.). «История открытия лекарств для лечения тошноты и рвоты и последствия для будущих исследований» . Границы в фармакологии . 9 : 913. дои : 10.3389/fphar.2018.00913 . ISSN 1663-9812 . ПМК 6131675 . ПМИД 30233361 .
- ^ «Выпадение волос (алопеция) у детей, связанное с химиотерапией - Энциклопедия здоровья - Медицинский центр Университета Рочестера» . www.urmc.rochester.edu . Проверено 8 ноября 2022 г.
- ^ Чадха В., Шеной С.Д. (2003). «Выпадение волос у больных раком, получающих химиотерапию». Индийский журнал дерматологии, венерологии и лепрологии . 69 (2): 131–2. ПМИД 17642856 .
- ^ Лемье Ж (октябрь 2012 г.). «Уменьшение алопеции, вызванной химиотерапией, с помощью охлаждения кожи головы». Клинические достижения в гематологии и онкологии . 10 (10): 681–2. ПМИД 23187775 .
- ^ Шапиро Дж., Прайс В.Х. (апрель 1998 г.). «Возобновление роста волос. Лечебные средства». Дерматологические клиники . 16 (2): 341–56. дои : 10.1016/S0733-8635(05)70017-6 . ПМИД 9589208 .
- ^ Аль-Моханна Х., Аль-Хенаизан С. (2010). «Постоянная алопеция после краниального облучения у ребенка». Журнал кожной медицины и хирургии . 14 (3): 141–3. дои : 10.2310/7750.2010.09014 . ПМИД 20487675 . S2CID 43583651 .
- ^ Джан Г, Демир М, Эрол О, Айдинер А (июнь 2013 г.). «Сравнение опыта мужчин и женщин с алопецией, вызванной химиотерапией». Европейский журнал сестринского дела в онкологии . 17 (3): 255–60. дои : 10.1016/j.ejon.2012.06.003 . ПМИД 22901547 .
- ^ Трюеб Р.М. (март 2009 г.). «Алопеция, вызванная химиотерапией». Семинары по кожной медицине и хирургии . 28 (1): 11–4. дои : 10.1016/j.sder.2008.12.001 . ПМИД 19341937 .
- ^ Чон С.Ю., Чемпион RW, Геддес Э.Р., Рашид Р.М. (июль 2012 г.). «Алопеция, вызванная химиотерапией». Журнал Американской академии дерматологии . 67 (1): е37–47. дои : 10.1016/j.jaad.2011.02.026 . ПМИД 22178150 .
- ^ Вторичные новообразования после химиотерапии, лучевой терапии и иммуносупрессии . Том. 55. Базель: Каргер. 2000. ISBN 9783318006155 . OCLC 606559421 .
- ^ Хиджия Н., Хадсон М.М., Ленсинг С., Захер М., Ончиу М., Бем Ф.Г., Раззук Б.И., Рибейро Р.К., Рубниц Дж.Э., Сандлунд Дж.Т., Ривера Г.К., Эванс В.Е., Реллинг М.В., Пуи Ч. (март 2007 г.). «Кумулятивная заболеваемость вторичными новообразованиями как первое событие после детского острого лимфобластного лейкоза» . ДЖАМА . 297 (11): 1207–15. дои : 10.1001/jama.297.11.1207 . ПМИД 17374815 .
- ↑ Перейти обратно: Перейти обратно: а б с д Бридой М., Фоссо С.Д., Даль О., Бьёро Т. (2007). «Дисфункция половых желез и проблемы с фертильностью у больных раком». Акта Онкологика . 46 (4): 480–9. дои : 10.1080/02841860601166958 . ПМИД 17497315 . S2CID 20672988 .
- ↑ Перейти обратно: Перейти обратно: а б Морган С., Андерсон Р.А., Горли С., Уоллес В.Х., Спирс Н. (2012). «Как химиотерапевтические средства повреждают яичник?» . Обновление репродукции человека . 18 (5): 525–35. дои : 10.1093/humupd/dms022 . hdl : 1842/9543 . ПМИД 22647504 .
- ^ Гурган Т., Салман С., Демирол А. (октябрь 2008 г.). «Беременность и методы вспомогательной репродукции у мужчин и женщин после лечения рака». Плацента . 29 Приложение Б: 152–9. дои : 10.1016/j.placenta.2008.07.007 . ПМИД 18790328 .
- ^ Курбьер Б, Декантер С, Брингер-Дойч С, Ривс Н, Миралле С, Пеш Х.К., Де Зиглер Д, Карре-Пижон Ф, Мэй-Панлуп П., Сифер С., Амис В., Швейцер Т., Порку-Бюиссон Г., Пуаро С. (сентябрь 2013 г.). «Экстренное ЭКО для замораживания эмбрионов для сохранения женской фертильности: французское многоцентровое когортное исследование» . Репродукция человека . 28 (9): 2381–8. дои : 10.1093/humrep/det268 . ПМИД 23832792 .
- ^ Ронесс Х., Калич-Философ Л., Мейров Д. (2014). «Профилактика повреждения яичников, вызванного химиотерапией: возможная роль гормональных и негормональных ослабляющих агентов» . Обновление репродукции человека . 20 (5): 759–74. дои : 10.1093/humupd/dmu019 . ПМИД 24833728 .
- ^ Тичелли А., Рово А. (август 2013 г.). «Проблемы фертильности после трансплантации гемопоэтических стволовых клеток». Экспертное обозрение гематологии . 6 (4): 375–88. дои : 10.1586/17474086.2013.816507 . ПМИД 23991924 . S2CID 25139582 .
В свою очередь, цитируя: Сандерс Дж. Э., Хоули Дж., Леви В., Гули Т., Бакнер К.Д., Диг Х.Дж., Дони К., Сторб Р., Салливан К., Уизерспун Р., Аппелбаум Ф.Р. (апрель 1996 г.). «Беременность после высоких доз циклофосфамида с высокими дозами бусульфана или без них или общего облучения тела и трансплантации костного мозга» . Кровь . 87 (7): 3045–52. doi : 10.1182/blood.V87.7.3045.bloodjournal8773045 . ПМИД 8639928 . - ↑ Перейти обратно: Перейти обратно: а б с д и ж Арнон Дж., Мейроу Д., Льюис-Ронесс Х., Орной А. (2001). «Генетические и тератогенные эффекты лечения рака на гаметы и эмбрионы» . Обновление репродукции человека . 7 (4): 394–403. дои : 10.1093/humupd/7.4.394 . ПМИД 11476352 .
- ↑ Перейти обратно: Перейти обратно: а б дель Пино Б.М. (23 февраля 2010 г.). «Периферическая невропатия, вызванная химиотерапией» . Бюллетень рака NCI . 7 (4): 6.
- ^ Грисольд В., Оберндорфер С., Виндебанк А.Дж. (2012). «Химиотерапия и полинейропатии» (PDF) . Журнал Европейской ассоциации нейроонкологии . 12 (1). Архивировано (PDF) из оригинала 12 августа 2012 года.
- ^ Бейерс А.Дж., Йонген Дж.Л., Фреугденхил Г. (январь 2012 г.). «Нейротоксичность, вызванная химиотерапией: ценность нейропротекторных стратегий» . Нидерландский медицинский журнал . 70 (1): 18–25. ПМИД 22271810 .
- ↑ Перейти обратно: Перейти обратно: а б Виндебанк А.Дж., Грисольд В. (март 2008 г.). «Невропатия, вызванная химиотерапией». Журнал периферической нервной системы . 13 (1): 27–46. дои : 10.1111/j.1529-8027.2008.00156.x . ПМИД 18346229 . S2CID 20411101 .
- ^ Сэвидж Л. (июль 2007 г.). «Боль, вызванная химиотерапией, озадачивает ученых» . Журнал Национального института рака . 99 (14): 1070–1. дои : 10.1093/jnci/djm072 . ПМИД 17623791 .
- ^ Таннок И.Ф., Алес Т.А., Ганц П.А., Ван Дам Ф.С. (июнь 2004 г.). «Когнитивные нарушения, связанные с химиотерапией рака: отчет семинара» . Журнал клинической онкологии . 22 (11): 2233–9. дои : 10.1200/JCO.2004.08.094 . ПМИД 15169812 .
- ^ Адейинка, Адебайо; Башир, Халид (2022 г.), «Синдром лизиса опухоли» , StatPearls , Остров сокровищ (Флорида): StatPearls Publishing, PMID 30085527 , получено 8 ноября 2022 г.
- ^ Шейх А.Ю., Ши Дж.А. (июнь 2012 г.). «Кардиотоксичность, вызванная химиотерапией». Текущие отчеты о сердечной недостаточности . 9 (2): 117–27. дои : 10.1007/s11897-012-0083-y . ПМИД 22382639 . S2CID 35723897 .
- ^ Татишетти А.В., Агрести Н., О'Брайен CB (ноябрь 2013 г.). «Гепатотоксичность, вызванная химиотерапией». Клиники заболеваний печени . 17 (4): 671–86, ix–x. дои : 10.1016/j.cld.2013.07.010 . ПМИД 24099024 .
- ^ Кинг П.Д., Перри MC (2001). «Гепатотоксичность химиотерапии» (PDF) . Онколог . 6 (2): 162–76. doi : 10.1634/теонколог.6-2-162 . ПМИД 11306728 . S2CID 39518402 .
- ^ де Йонге MJ, Вервей Дж (февраль 2006 г.). «Почечная токсичность химиотерапии». Семинары по онкологии . 33 (1): 68–73. doi : 10.1053/j.seminoncol.2005.11.011 . ПМИД 16473645 .
- ^ Хамфрис Б.Д., Сойффер Р.Дж., Маги CC (январь 2005 г.). «Почечная недостаточность, связанная с раком, и ее лечение: обновленная информация» . Журнал Американского общества нефрологов . 16 (1): 151–61. дои : 10.1681/ASN.2004100843 . ПМИД 15574506 .
- ^ Брок П.С., Найт К.Р., Фрейер Д.Р., Кэмпбелл К.С., Стейгер П.С., Блейкли Б.В. и др. (июль 2012 г.). «Вызванная платиной ототоксичность у детей: консенсусный обзор механизмов, предрасположенности и защиты, включая новую Бостонскую шкалу ототоксичности Международного общества детской онкологии» . Журнал клинической онкологии . 30 (19): 2408–17. дои : 10.1200/JCO.2011.39.1110 . ПМЦ 3675696 . ПМИД 22547603 .
- ^ Рыбак Л.П., Мукерджи Д., Джаджу С., Рамкумар В. (ноябрь 2009 г.). «Ототоксичность и защита цисплатина: клинические и экспериментальные исследования» . Журнал экспериментальной медицины Тохоку . 219 (3): 177–86. дои : 10.1620/tjem.219.177 . ПМЦ 2927105 . ПМИД 19851045 .
- ^ ван Ас Дж.В., ван ден Берг Х., ван Дален ЕС (январь 2020 г.). «Различная продолжительность инфузии для предотвращения потери слуха, вызванной приемом платины, у детей, больных раком» . Кокрановская база данных систематических обзоров . 1 (1): CD010885. дои : 10.1002/14651858.CD010885.pub5 . ПМК 6984653 . ПМИД 31961948 .
- ^ ван Ас Дж.В., ван ден Берг Х., ван Дален Э.К. (август 2016 г.). «Платиновая потеря слуха после лечения детского рака» . Кокрановская база данных систематических обзоров . 2019 (8): CD010181. дои : 10.1002/14651858.cd010181.pub2 . ПМК 6466671 . ПМИД 27486906 .
- ^ ван Ас Дж.В., ван ден Берг Х., ван Дален ЕС (май 2019 г.). «Медицинские вмешательства для профилактики вызванной платиной тугоухости у детей с онкологическими заболеваниями» . Кокрановская база данных систематических обзоров . 2019 (5): CD009219. дои : 10.1002/14651858.cd009219.pub5 . ПМК 6504134 . ПМИД 31063591 .
- ^ Шеннон, Вики Р. (9 июля 2019 г.). «Повреждение легких, связанное с лечением рака». Онкологическая реанимационная помощь . стр. 531–556. дои : 10.1007/978-3-319-74588-6_52 . ISBN 978-3-319-74587-9 . ПМК 7123056 .
- ^ Квакман, Йоханнес Дж.М.; Элшот, Янник С.; Пунт, Корнелис Дж.А.; Купман, Мириам (13 мая 2020 г.). «Лечение синдрома руки-ноги, вызванного цитотоксической химиотерапией» . Обзоры онкологии . 14 (1): 442. doi : 10.4081/oncol.2020.442 . ISSN 1970-5565 . ПМК 7232019 . ПМИД 32431787 .
- ^ Уорд Э.Дж., Генри Л.М., Френд Эй.Дж., Уилкинс С., Филлипс Р.С. (август 2015 г.). «Пищевая поддержка у детей и молодых людей с онкологическими заболеваниями, проходящих химиотерапию» . Кокрановская база данных систематических обзоров . 2015 (8): CD003298. дои : 10.1002/14651858.cd003298.pub3 . ПМЦ 8752126 . ПМИД 26301790 .
- ^ Уикс Дж.С., Каталано П.Дж., Кронин А., Финкельман М.Д., Мак Дж.В., Китинг Н.Л., Шраг Д. (октябрь 2012 г.). «Ожидания пациентов относительно эффектов химиотерапии при запущенном раке» . Медицинский журнал Новой Англии . 367 (17): 1616–25. дои : 10.1056/NEJMoa1204410 . ПМЦ 3613151 . ПМИД 23094723 .
- ^ Дикен Дж. Ф., Лёшер В. (март 2007 г.). «Гематоэнцефалический барьер и рак: переносчики, лечение и троянские кони» . Клинические исследования рака . 13 (6): 1663–74. дои : 10.1158/1078-0432.CCR-06-2854 . ПМИД 17363519 .
- ^ Агарвала СС, Кирквуд Дж. М. (2000). «Темозоломид, новый алкилирующий агент, обладающий активностью в центральной нервной системе, может улучшить лечение метастатической меланомы на поздних стадиях» . Онколог . 5 (2): 144–51. doi : 10.1634/теонколог.5-2-144 . ПМИД 10794805 . S2CID 25331035 .
- ^ Герстнер Э.Р., Файн Р.Л. (июнь 2007 г.). «Повышенная проницаемость гематоэнцефалического барьера для химиотерапии при метастатических опухолях головного мозга: создание парадигмы лечения». Журнал клинической онкологии . 25 (16): 2306–12. дои : 10.1200/JCO.2006.10.0677 . ПМИД 17538177 .
- ^ Минчинтон А.И., Таннок ИФ (август 2006 г.). «Проникновение лекарств в солидные опухоли». Обзоры природы. Рак . 6 (8): 583–92. дои : 10.1038/nrc1893 . ПМИД 16862189 . S2CID 42818461 .
- ^ Голдман Б. (февраль 2003 г.). «Множественная лекарственная устойчивость: могут ли новые лекарства помочь химиотерапии победить рак?» . Журнал Национального института рака . 95 (4): 255–7. дои : 10.1093/jnci/95.4.255 . ПМИД 12591977 .
- ^ Кроули Э., Макдевитт Калифорния, Каллаган Р. (2009). Множественная лекарственная устойчивость при раке. Генерация ингибиторов P-гликопротеина: куда и сейчас? . Спрингерские протоколы. стр. 405–432.
- ^ Лукмани Я.А. (2005). «Механизмы лекарственной устойчивости при химиотерапии рака» . Медицинские принципы и практика . 14 (Приложение 1): 35–48. дои : 10.1159/000086183 . ПМИД 16103712 .
- ^ Мошови М., Крицелис Е., Цен О, Адамаки М., Ламброу Г.И., Хрусос Г.П., Влахопулос С. (2015). «Препараты, влияющие на гомеостаз: вызов адаптации раковых клеток». Экспертный обзор противораковой терапии . 15 (12): 1405–17. дои : 10.1586/14737140.2015.1095095 . ПМИД 26523494 . S2CID 28992964 .
- ^ Хиви С., Годвин П., Бэрд А.М., Барр М.П., Умезава К., Кафф С. и др. (октябрь 2014 г.). «Стратегическое нацеливание оси PI3K-NFκB при цисплатин-резистентном НМРЛ» . Биология и терапия рака . 15 (10): 1367–77. дои : 10.4161/cbt.29841 . ПМК 4130730 . ПМИД 25025901 .
- ^ Райан С.Л., Берд С., Барр М.П., Умезава К., Хиви С., Годвин П. и др. (сентябрь 2019 г.). «Нацеливание на NF-κB-опосредованные воспалительные пути при цисплатин-резистентном НМРЛ» (PDF) . Рак легких . 135 : 217–227. дои : 10.1016/j.lungcan.2019.07.006 . ПМИД 31446998 . S2CID 199025494 .
- ^ Годвин П., Бэрд А.М., Хиви С., Барр М.П., О'Бирн К.Дж., Гейтли К. (2013). «Нацеливание на ядерный фактор каппа B на преодоление устойчивости к химиотерапии» . Границы онкологии . 3 : 120. doi : 10.3389/fonc.2013.00120 . ПМЦ 3655421 . ПМИД 23720710 .
- ^ Ваннеман, Мэтью; Дранофф, Гленн (22 марта 2012 г.). «Сочетание иммунотерапии и таргетной терапии в лечении рака» . Обзоры природы. Рак . 12 (4): 237–251. дои : 10.1038/nrc3237 . ISSN 1474-175Х . ПМЦ 3967236 . ПМИД 22437869 .
- ^ Гербер Д.Е. (февраль 2008 г.). «Таргетная терапия: новое поколение методов лечения рака». Американский семейный врач . 77 (3): 311–9. ПМИД 18297955 .
- ^ Аллен Т.М. (октябрь 2002 г.). «Лиганд-таргетная терапия в противораковой терапии». Обзоры природы. Рак . 2 (10): 750–63. дои : 10.1038/nrc903 . ПМИД 12360278 . S2CID 21014917 .
- ^ Чен Х.С., Клек Дж.Н. (август 2009 г.). «Побочные эффекты противораковых агентов, нацеленных на путь VEGF» . Обзоры природы. Клиническая онкология . 6 (8): 465–77. дои : 10.1038/nrclinonc.2009.94 . ПМИД 19581909 . S2CID 30482752 .
- ^ Чжан Дж., Ян П.Л., Грей Н.С. (январь 2009 г.). «Нацеливание на рак с помощью низкомолекулярных ингибиторов киназ». Обзоры природы. Рак . 9 (1): 28–39. дои : 10.1038/nrc2559 . ПМИД 19104514 . S2CID 17934366 .
- ^ Ханахан Д., Вайнберг Р.А. (январь 2000 г.). «Признаки рака» . Клетка . 100 (1): 57–70. дои : 10.1016/S0092-8674(00)81683-9 . ПМИД 10647931 . S2CID 1478778 .
- ^ Ходжсон С. (январь 2008 г.). «Механизмы наследственной предрасположенности к раку» . Журнал науки Чжэцзянского университета B. 9 (1): 1–4. дои : 10.1631/jzus.B073001 . ПМК 2170461 . ПМИД 18196605 .
- ^ Перера Ф.П. (ноябрь 1997 г.). «Окружающая среда и рак: кто восприимчив?». Наука . 278 (5340): 1068–73. Бибкод : 1997Sci...278.1068P . дои : 10.1126/science.278.5340.1068 . ПМИД 9353182 .
- ^ Хоскинс В.Дж., Перес К.А., Янг Р.К., Баракат Р.Р., Маркман М., Рэндалл М.Э., ред. (2005). Принципы и практика гинекологической онкологии (4-е изд.). Балтимор, Мэриленд: Липпинкотт Уильямс и Уилкинс. ISBN 978-0-7817-4689-2 .
- ^ Кехе К., Бальцувейт Ф., Штайнритц Д., Тирманн Х. (сентябрь 2009 г.). «Молекулярная токсикология кожного воспаления и волдырей, вызванных сернистым ипритом». Токсикология . 263 (1): 12–9. дои : 10.1016/j.tox.2009.01.019 . ПМИД 19651324 .
- ^ Макин Дж., Хикман Дж. А. (июль 2000 г.). «Апоптоз и химиотерапия рака». Исследования клеток и тканей . 301 (1): 143–52. Бибкод : 1994RSPTB.345..319H . дои : 10.1007/s004419900160 . ПМИД 10928287 . S2CID 22909070 .
- ^ Фишер, Р.; Пуштаи, Л; Суонтон, К. (19 февраля 2013 г.). «Гетерогенность рака: последствия для таргетной терапии» . Британский журнал рака . 108 (3): 479–485. дои : 10.1038/bjc.2012.581 . ISSN 0007-0920 . ПМЦ 3593543 . ПМИД 23299535 .
- ^ Зитвогель Л., Апето Л., Гирингелли Ф., Кремер Г. (январь 2008 г.). «Иммунологические аспекты химиотерапии рака» . Обзоры природы. Иммунология . 8 (1): 59–73. дои : 10.1038/nri2216 . ПМИД 18097448 . S2CID 205490545 .
- ^ Галлуцци Л., Буке А., Кепп О., Зитвогель Л., Кремер Г. (февраль 2017 г.). «Иммуногенная гибель клеток при раке и инфекционных заболеваниях». Обзоры природы. Иммунология . 17 (2): 97–111. дои : 10.1038/nri.2016.107 . ПМИД 27748397 . S2CID 4045072 .
- ^ Пфиршке С, Энгблом С, Рикельт С, Кортес-Ретамозо В, Гаррис С, Пуччи Ф, Ямазаки Т, Пуарье-Колам В, Ньютон А, Редуан Ю, Лин Ю.Дж., Войткевич Г, Ивамото Ю, Мино-Кенудсон М, Хюнь Т.Г. , Хайнс Р.О., Фриман Г.Дж., Кремер Г., Зитвогель Л., Вайсследер Р., Питтет М.Дж. (февраль 2016 г.). «Иммуногенная химиотерапия повышает чувствительность опухолей к блокадной терапии контрольных точек» . Иммунитет . 44 (2): 343–54. doi : 10.1016/j.immuni.2015.11.024 . ПМЦ 4758865 . ПМИД 26872698 .
- ↑ Перейти обратно: Перейти обратно: а б Бен-Ари ET (апрель 2004 г.). «Двойное назначение: некоторые методы лечения рака, используемые для лечения аутоиммунных заболеваний» . Журнал Национального института рака . 96 (8): 577–9. дои : 10.1093/jnci/96.8.577 . ПМИД 15100330 .
- ↑ Перейти обратно: Перейти обратно: а б Кутоло М., Сулли А., Пиццорни С., Сериоло Б., Штрауб Р.Х. (август 2001 г.). «Противовоспалительные механизмы метотрексата при ревматоидном артрите» . Анналы ревматических болезней . 60 (8): 729–35. дои : 10.1136/ard.60.8.729 . ПМК 1753808 . ПМИД 11454634 .
- ^ Монтауди Х., Сбидиан Э., Поль С., Маза А., Галлини А., Арактинги С., Обен Ф., Бачелес Х., Крибье Б., Жоли П., Жюльен Д., Ле Мэтр М., Мизери Л., Ричард М.А., Ортонн Дж.П. (май 2011 г.). «Метотрексат при псориазе: систематический обзор методов лечения, заболеваемости, факторов риска и мониторинга токсичности для печени». Журнал Европейской академии дерматологии и венерологии . 25 (Приложение 2): 12–8. дои : 10.1111/j.1468-3083.2011.03991.x . ПМИД 21388454 . S2CID 13015911 .
- ↑ Перейти обратно: Перейти обратно: а б Чен Дж., Верас М.М., Лю С., Линь Дж. (февраль 2013 г.). Чен Дж (ред.). «Метотрексат при болезни Бехтерева». Кокрановская база данных систематических обзоров . 2 (2): CD004524. дои : 10.1002/14651858.CD004524.pub4 . ПМИД 23450553 .
- ↑ Перейти обратно: Перейти обратно: а б Грей О, Макдоннелл Г.В., Forbes RB (2004). Грей О (ред.). «Метотрексат при рассеянном склерозе» . Кокрановская база данных систематических обзоров . 2010 (2): CD003208. дои : 10.1002/14651858.CD003208.pub2 . ПМЦ 9006525 . ПМИД 15106195 .
- ↑ Перейти обратно: Перейти обратно: а б Грей О.М., Макдоннелл Г.В., Forbes RB (август 2006 г.). «Систематический обзор перорального метотрексата при рассеянном склерозе». Рассеянный склероз . 12 (4): 507–10. дои : 10.1191/1352458506ms1299oa . ПМИД 16900766 . S2CID 46120577 .
- ^ Нтали С., Берциас Г., Бумпас Д.Т. (июнь 2011 г.). «Циклофосфамид и волчаночный нефрит: когда, как, как долго?». Клинические обзоры по аллергии и иммунологии . 40 (3): 181–91. дои : 10.1007/s12016-009-8196-0 . ПМИД 20107927 . S2CID 11902371 .
- ^ «Руководство NCCN: системный амилоидоз легких цепей» (PDF) . Национальная комплексная онкологическая сеть. Архивировано из оригинала (PDF) 25 июня 2021 года . Проверено 25 февраля 2015 г.
- ^ Бачигалупо А., Баллен К., Риццо Д., Жиральт С., Лазарус Х., Хо В., Апперли Дж., Славин С., Паскини М., Сандмайер Б.М., Барретт Дж., Блейз Д., Лоуски Р., Горовиц М. (декабрь 2009 г.). «Определение интенсивности режимов кондиционирования: рабочие определения» . Биология трансплантации крови и костного мозга . 15 (12): 1628–33. дои : 10.1016/j.bbmt.2009.07.004 . ПМК 2861656 . ПМИД 19896087 .
- ^ Сорса М., Хямейля М., Ярвилуома Э. (сентябрь 2006 г.). «Обращение с противораковыми препаратами: от выявления опасностей к управлению рисками?». Анналы Нью-Йоркской академии наук . 1076 (1): 628–34. Бибкод : 2006NYASA1076..628S . дои : 10.1196/анналы.1371.008 . ПМИД 17119240 . S2CID 7081365 .
- ↑ Перейти обратно: Перейти обратно: а б с д и Томас х. Коннор, доктор философии (март 2014 г.). «Хиотерапия: биомаркеры воздействия, эффекта, репродуктивных рисков и рака» . Фармацевт онкологии . Архивировано из оригинала 25 июня 2021 года . Проверено 22 ноября 2018 г.
- ↑ Перейти обратно: Перейти обратно: а б «Средства индивидуальной защиты для медицинских работников, работающих с опасными лекарственными средствами» (Документ). НИОШ. Октябрь 2008 г. doi : 10.26616/NIOSHPUB2009106 .
- ^ Противоопухолевые препараты: профессиональное воздействие и риски для здоровья . 2006. ISBN 978-90-393-4331-9 .
- ^ Коннор, Томас Х.; Лоусон, Кристина С.; Полович, Марта; МакДиармид, Мелисса А. (2014). «Риски репродуктивному здоровью, связанные с профессиональным воздействием противоопухолевых препаратов в медицинских учреждениях: обзор фактических данных» . Журнал профессиональной и экологической медицины . 56 (9): 901–910. дои : 10.1097/JOM.0000000000000249 . ISSN 1076-2752 . ПМК 4569003 . ПМИД 25153300 .
- ↑ Перейти обратно: Перейти обратно: а б с «Предотвращение профессионального воздействия противоопухолевых и других опасных препаратов в медицинских учреждениях» (PDF) . Архивировано (PDF) из оригинала 13 сентября 2004 г.
- ^ «Руководства по программе по опасным наркотикам» . lni.wa.gov . Архивировано из оригинала 27 октября 2019 года . Проверено 22 ноября 2018 г.
- ^ Килинч, Ф. Селцен (2015). «Обзор изолирующих халатов в здравоохранении: свойства тканей и халатов» . Журнал инженерных волокон и тканей . 10 (3): 180–190. дои : 10.1177/155892501501000313 . ISSN 1558-9250 . ПМЦ 4791533 . ПМИД 26989351 .
- ^ Рейнхардт, Питер А. (29 ноября 2017 г.). Управление инфекционными и медицинскими отходами . ЦРК Пресс. ISBN 9781315894430 . [ нужна страница ]
- ^ «Безопасное обращение с отходами медицинской деятельности» (PDF) . ВОЗ .
- ^ ДеДжой Д.М., Смит Т.Д., Волду Х., Дьял М.А., Стидж А.Л., Бойано Дж.М. (июль 2017 г.). «Влияние организационных мер безопасности и воспринимаемого климата безопасности на использование СИЗ, инженерный контроль и побочные эффекты, связанные с жидкими противоопухолевыми препаратами среди медсестер». Журнал гигиены труда и окружающей среды . 14 (7): 485–493. дои : 10.1080/15459624.2017.1285496 . ПМИД 28326998 . S2CID 3879822 .
- ^ Ян Олвер (19 октября 2010 г.). Учебник MASCC по поддерживающей терапии рака и выживанию . Springer Science & Business Media. п. 351. ИСБН 978-1-4419-1225-1 .
- ^ Холланд Дж. Ф., Поллок Р. Э. (2010). Холланд-Фрай онкологическая медицина 8 . PMPH-США. п. 1758. ISBN 978-1-60795-014-1 .
- ^ Крумбхаар Э.Б. (1919). «Роль крови и костного мозга при некоторых формах газовых отравлений» . ДЖАМА . 72 : 39–41. дои : 10.1001/jama.1919.26110010018009f .
- ↑ Перейти обратно: Перейти обратно: а б с Фенн Дж. Э., Удельсман Р. (март 2011 г.). «Первое применение внутривенной химиотерапии для лечения рака: исправление рекорда». Журнал Американского колледжа хирургов . 212 (3): 413–7. дои : 10.1016/j.jamcollsurg.2010.10.018 . ПМИД 21247779 .
- ^ Чабнер Б.А., Робертс Т.Г. (январь 2005 г.). «Хронология: химиотерапия и война с раком». Обзоры природы. Рак . 5 (1): 65–72. дои : 10.1038/nrc1529 . ПМИД 15630416 . S2CID 205467419 .
- ^ Фаге ГБ (2005). Война с раком . Спрингер. п. 71 . ISBN 978-1-4020-3618-7 .
- ^ Йоэнсуу Х (март 2008 г.). «Системная химиотерапия рака: от оружия к лечению». «Ланцет». Онкология . 9 (3): 304. doi : 10.1016/S1470-2045(08)70075-5 . ПМИД 18308256 .
- ↑ Перейти обратно: Перейти обратно: а б ДеВита В.Т., Чу Э (ноябрь 2008 г.). «История химиотерапии рака» . Исследования рака . 68 (21): 8643–53. дои : 10.1158/0008-5472.CAN-07-6611 . ПМИД 18974103 .
- ^ Николс Х.Дж., Уокер Дж.Э. (март 1923 г.). «Экспериментальные наблюдения по профилактике и лечению сифилиса» . Журнал экспериментальной медицины . 37 (4): 525–42. дои : 10.1084/jem.37.4.525 . ПМК 2128372 . ПМИД 19868743 .
- ↑ Перейти обратно: Перейти обратно: а б Чидамбарам М., Манавалан Р., Катиресан К. (2011). «Нанотерапия для преодоления ограничений традиционной химиотерапии рака» . Журнал фармации и фармацевтических наук . 14 (1): 67–77. дои : 10.18433/J30C7D . ПМИД 21501554 .
- ↑ Перейти обратно: Перейти обратно: а б Тейчер Б.А., Чари Р.В. (октябрь 2011 г.). «Терапия на основе конъюгатов антител: проблемы и потенциал» . Клинические исследования рака . 17 (20): 6389–97. дои : 10.1158/1078-0432.CCR-11-1417 . ПМИД 22003066 .
- ^ Мохтари, Реза Баят; Хомаюни, Тина С.; Балух, Наргес; Моргацкая, Евгения; Кумар, Сушил; Дас, Бикул; Йегер, Герман (30 марта 2017 г.). «Комбинированная терапия в борьбе с раком» . Онкотаргет . 8 (23): 38022–38043. дои : 10.18632/oncotarget.16723 . ISSN 1949-2553 . ПМЦ 5514969 . ПМИД 28410237 .
- ^ Сиверс Э.Л., Линенбергер М. (ноябрь 2001 г.). «Милотарг: химиотерапия, нацеленная на антитела, достигает совершеннолетия». Современное мнение в онкологии . 13 (6): 522–7. дои : 10.1097/00001622-200111000-00016 . ПМИД 11673694 . S2CID 27827980 .
- ^ Таленс-Висконти Р., Диес-Салес О, де Хулиан-Ортис Й.В., Накер А. (апрель 2022 г.). «Нанолипосомы в терапии рака: продаваемые продукты и текущие клинические испытания» . Международный журнал молекулярных наук . 23 (8): 4249. doi : 10.3390/ijms23084249 . ПМК 9030431 . ПМИД 35457065 .
- ^ Вайнс Т., Фонс Т. (май 2009 г.). «Оценка безопасности и экономической эффективности ранних нанопрепаратов». Журнал права и медицины . 16 (5): 822–45. ПМИД 19554862 .
- ^ Ларкин, Джон О.; Коллинз, Кристофер Г.; Ааронс, Саймон; Тангни, Марк; Уилан, Мария; О'Рейли, Симус; Бретнах, Оскар; Соден, Деклан М.; О'Салливан, Джеральд К. (2007). «Электрохимиотерапия» . Анналы хирургии . 245 (3): 469–479. дои : 10.1097/01.sla.0000250419.36053.33 . ISSN 0003-4932 . ПМК 1877027 . ПМИД 17435555 .
- ^ Ларкин Дж.О., Коллинз К.Г., Ааронс С., Тэнгни М., Уилан М., О'Рейли С., Бретнак О., Соден Д.М., О'Салливан Г.К. (март 2007 г.). «Электрохимиотерапия: аспекты доклинической разработки и ранний клинический опыт» . Анналы хирургии . 245 (3): 469–79. дои : 10.1097/01.sla.0000250419.36053.33 . ПМК 1877027 . ПМИД 17435555 .
- ^ Тестори А, Тости Г, Мартиноли С, Спадола Г, Катальдо Ф, Верреккья Ф, Бальдини Ф, Москони М, Сотельдо Дж, Тедески И, Пассони С, Пари С, Ди Пьетро А, Ферруччи ПФ (2010). «Электрохимиотерапия кожных и подкожных опухолевых поражений: новый терапевтический подход» . Дерматологическая терапия . 23 (6): 651–61. дои : 10.1111/j.1529-8019.2010.01370.x . ПМИД 21054709 . S2CID 46534637 .
- ^ Марти М, Серса Дж., Гарбей Дж.Р., Гель Дж., Коллинз К.Г., Сной М., Биллард В., Герцен П.Ф., Ларкин Дж.О., Миклавчич Д., Павлович И., Полин-Кошир С.М., Семазар М., Морсли Н., Соден Д.М., Рудольф З., Роберт С., О'Салливан Г.К., Мир Л.М. (2006). «Электрохимиотерапия – простое, высокоэффективное и безопасное лечение кожных и подкожных метастазов». Eur J Cancer Suppl . 4 (11): 3–13. дои : 10.1016/j.ejcsup.2006.08.002 .
- ^ Мир Л.М., Гейл Дж., Серса Г., Коллинз К.Г., Гарбей Дж.Р., Биллард В., Герцен П.Ф., Рудольф З., О'Салливан Г.К., Марти М. (2006). «Стандартные операционные процедуры электрохимиотерапии: инструкции по применению блеомицина или цисплатина, вводимых системно или местно, и электрических импульсов, подаваемых с помощью Cliniporator™ с помощью инвазивных или неинвазивных электродов». Eur J Cancer Suppl . 4 (11): 14–25. дои : 10.1016/j.ejcsup.2006.08.003 .
- ^ Соден Д.М., Ларкин Дж.О., Коллинз К.Г., Тэнгни М., Ааронс С., Пигготт Дж., Моррисси А., Данн С., О'Салливан Г.К. (февраль 2006 г.). «Успешное применение таргетной электрохимиотерапии с использованием новых гибких электродов и низких доз блеомицина при лечении солидных опухолей». Письма о раке . 232 (2): 300–10. дои : 10.1016/j.canlet.2005.03.057 . ПМИД 15964138 .
- ^ Миклавчич Д., Сной М., Зупанич А., Кос Б., Чемазар М., Кропивник М., Брако М., Печник Т., Гаджиев Е., Серса Г. (февраль 2010 г.). «К планированию лечения и лечению глубоких солидных опухолей методом электрохимиотерапии» . Биомедицинская инженерия онлайн . 9 (1): 10. дои : 10.1186/1475-925X-9-10 . ПМЦ 2843684 . ПМИД 20178589 .
- ^ Исселс Р. (1999). «Гипертермия в сочетании с химиотерапией – биологическое обоснование, клиническое применение и результаты лечения» . Онкология . 22 (5): 374–381. дои : 10.1159/000026986 . S2CID 37581171 .
- ^ Макнайт Дж. А. (май 2003 г.). «Принципы химиотерапии». Клинические методы в практике мелких животных . 18 (2): 67–72. дои : 10.1053/svms.2003.36617 . ПМИД 12831063 . S2CID 39060053 .
Внешние ссылки [ править ]
- Химиотерапия , Американское онкологическое общество
- Опасное воздействие наркотиков в здравоохранении , Национальный институт безопасности и гигиены труда
- Список противоопухолевых и других опасных препаратов NIOSH в медицинских учреждениях, 2016 г., Национальный институт безопасности и гигиены труда.