гемцитабин
 | |
 | |
| Клинические данные | |
|---|---|
| Произношение | / dʒ ɛ m ˈ s aɪ t ə b iː n / |
| Торговые названия | Гемзар, другие [1] |
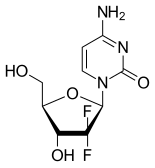
| Другие имена | 2',2'-дифтор-2'дезоксицитидин, dFdC |
| AHFS / Drugs.com | Монография |
| Беременность категория |
|
| Маршруты администрация | внутривенный |
| код АТС | |
| Юридический статус | |
| Юридический статус | |
| Фармакокинетические данные | |
| Связывание с белками | <10% |
| Период полувыведения | Короткие инфузии: 32–94 минуты. Длительные инфузии: 245–638 минут. |
| Идентификаторы | |
| Номер CAS | |
| ПабХим CID | |
| ИЮФАР/БПС | |
| Лекарственный Банк | |
| ХимическийПаук | |
| НЕКОТОРЫЙ | |
| КЕГГ | |
| ЧЭБИ | |
| ЧЕМБЛ | |
| Панель управления CompTox ( EPA ) | |
| Информационная карта ECHA | 100.124.343 |
| Химические и физические данные | |
| Формула | С 9 Ч 11 Ж 2 Н 3 О 4 |
| Молярная масса | 263.201 g·mol −1 |
| 3D model ( JSmol ) | |
| (проверять) | |
Гемцитабин под торговой маркой Gemzar . , продаваемый , среди прочего, [1] это химиотерапевтический препарат, используемый для лечения рака . [2] Его применяют для лечения рака яичек , [3] рак молочной железы , рак яичников , немелкоклеточный рак легких , рак поджелудочной железы и рак мочевого пузыря . [2] [4] Его вводят внутривенно . [2] Он действует против роста опухолей и ингибирует репликацию ортогепевируса А , возбудителя гепатита Е , посредством усиления передачи сигналов интерферона . [5]
Общие побочные эффекты включают подавление функции костного мозга , проблемы с печенью и почками, тошноту , лихорадку , сыпь , одышку , язвы во рту, диарею , невропатию и выпадение волос . [2] Использование во время беременности , вероятно, приведет к вреду для плода . [2] Гемцитабин относится к семейству аналогов нуклеозидов . [2] Он работает, блокируя создание новой ДНК , что приводит к гибели клеток. [2]
Гемцитабин был запатентован в 1983 году и одобрен для медицинского применения в 1995 году. [6] Общие версии были представлены в Европе в 2009 году и в США в 2010 году. [7] [8] Он включен в Примерный список основных лекарственных средств ВОЗ . [9]
Медицинское использование
Гемцитабин лечит различные карциномы . Он используется в качестве терапии первой линии отдельно при раке поджелудочной железы и в сочетании с цисплатином при распространенном или метастатическом раке мочевого пузыря и распространенном или метастатическом немелкоклеточном раке легкого . Он используется в качестве терапии второй линии в сочетании с карбоплатином при раке яичников и в сочетании с паклитакселом при раке молочной железы , который имеет метастазы или не может быть удален хирургическим путем. [10] [11] [12]
Он используется не по назначению для лечения холангиокарциномы. [13] и другие виды рака желчных путей . [14]
Противопоказания и взаимодействие [ править ]
Прием гемцитабина также может повлиять на фертильность у мужчин и женщин, сексуальную жизнь и менструацию. Женщинам, принимающим гемцитабин, не следует беременеть, а беременным и кормящим женщинам его не следует принимать. [15]
По состоянию на 2014 год взаимодействие лекарств не изучалось. [11] [10]
Побочные эффекты [ править ]
Гемцитабин — это химиотерапевтический препарат, который убивает любые делящиеся клетки. [10] Раковые клетки быстро делятся, и поэтому гемцитабин подвергается более высокому воздействию, но многие важные клетки также быстро делятся, включая клетки кожи, кожи головы, слизистой оболочки желудка и костного мозга, что приводит к побочным эффектам. [16] : 265
На этикетке гемцитабина имеется предупреждение о том, что он может подавлять функцию костного мозга и вызывать потерю лейкоцитов , тромбоцитов и эритроцитов , и что его следует с осторожностью использовать у людей с заболеваниями печени, почек или сердечно-сосудистой системы. Люди, принимающие его, не должны принимать живые вакцины. На предупреждающей этикетке также указано, что он может вызвать синдром задней обратимой энцефалопатии , синдром утечки капилляров , тяжелые заболевания легких, такие как отек легких , пневмония и респираторный дистресс-синдром у взрослых , а также может нанести вред сперме. [10] [17]
Более чем у 10% пользователей развиваются побочные эффекты, включая затрудненное дыхание, низкое количество лейкоцитов и эритроцитов, низкое количество тромбоцитов, рвоту и тошноту, повышение уровня трансаминаз , сыпь и зуд кожи, выпадение волос, кровь и белок в моче, гриппоподобные симптомы. симптомы и отеки . [10] [15]
Общие побочные эффекты (встречающиеся у 1–10% пользователей) включают лихорадку, потерю аппетита, головную боль, проблемы со сном, усталость, кашель, насморк, диарею, язвы во рту и губах, потливость, боли в спине и мышечные боли. [10]
Тромботическая тромбоцитопеническая пурпура (ТТП) — редкий, но серьезный побочный эффект, связанный с применением определенных химиотерапевтических препаратов, включая гемцитабин. ТТП представляет собой заболевание крови и может привести к микроангипатической гемолитической анемии (МАГА), неврологическим нарушениям, лихорадке и заболеванию почек. [18]
Фармакология [ править ]
Гемцитабин гидрофилен и должен транспортироваться в клетки с помощью молекулярных переносчиков нуклеозидов (наиболее распространенными переносчиками гемцитабина являются SLC29A1 , SLC28A1 и SLC28A3). [19] [20] После попадания в клетку гемцитабин сначала модифицируется путем присоединения к нему фосфата , и таким образом он становится монофосфатом гемцитабина (dFdCMP). [19] [20] Это определяющая скорость стадия , катализируемая ферментом дезоксицитидинкиназой ( DCK). [19] [20] Еще два фосфата добавляются другими ферментами. После присоединения трех фосфатов гемцитабин наконец становится фармакологически активным как гемцитабинтрифосфат (dFdCTP). [19] [21]
После трехкратного фосфорилирования гемцитабин может маскироваться под дезоксицитидинтрифосфат и включаться в новые цепи ДНК, синтезируемые по мере репликации клеток . [2] [19] [20]
Когда гемцитабин включается в ДНК, он позволяет добавить к нему нативное или нормальное нуклеозидное основание. Это приводит к «замаскированному обрыву цепи», поскольку гемцитабин является «дефектным» основанием, но из-за соседнего нативного нуклеозида он ускользает от нормальной системы восстановления клетки ( восстановление с вырезанием основания ). Таким образом, включение гемцитабина в ДНК клетки создает непоправимую ошибку, которая приводит к ингибированию дальнейшего синтеза ДНК и тем самым приводит к гибели клетки. [2] [19] [20]
Форма гемцитабина с двумя присоединенными фосфатами (dFdCDP) также обладает активностью; он ингибирует фермент рибонуклеотидредуктазу (RNR), который необходим для создания новых нуклеотидов ДНК. Недостаток нуклеотидов заставляет клетку поглощать больше компонентов, необходимых для производства нуклеотидов, извне клетки, что также увеличивает поглощение гемцитабина. [2] [19] [20] [22]
Химия [ править ]
собой синтетическое пиримидиннуклеозида Гемцитабин представляет пролекарство — аналог нуклеозида , в котором водорода атомы на 2'-углероде дезоксицитидина заменены атомами фтора . [2] [23] [24]
Синтез, описанный и изображенный ниже, является оригинальным синтезом, выполненным в лабораториях компании Eli Lilly. Синтез начинается с энантиочистого D-глицеральдегида (R)-2 в качестве исходного материала, который можно получить из D-маннита в 2–7 этапов. Затем фтор вводится методом «строительного блока» с использованием этилбромдифторацетата . Затем реакция Реформатского в стандартных условиях даст диастереомерную смесь анти/син 3:1 с одним основным продуктом. Разделение диастереомеров проводят с помощью ВЭЖХ, получая таким образом гемцитабин анти-3 с выходом 65%. [23] [24] По крайней мере, два других метода полного синтеза также были разработаны разными группами. [24]

История [ править ]
Гемцитабин был впервые синтезирован в лаборатории Ларри Хертеля компании Eli Lilly and Company в начале 1980-х годов. Он задумывался как противовирусный препарат , но доклинические испытания показали, что он убивает клетки лейкемии in vitro . [25]
В начале 1990-х годов гемцитабин изучался в клинических испытаниях. Испытания рака поджелудочной железы показали, что гемцитабин значительно увеличивает годовую выживаемость, и он был одобрен в Великобритании в 1995 году. [10] и одобрен FDA в 1996 году для лечения рака поджелудочной железы. [4] В 1998 году гемцитабин получил одобрение FDA для лечения немелкоклеточного рака легких, а в 2004 году — для лечения метастатического рака молочной железы. [4]
Европейские маркировки были гармонизированы EMA в 2008 году. [26]
К 2008 году мировые продажи гемцитабина компании Lilly составили около 1,7 миллиарда долларов; на тот момент срок действия ее патентов в США истекал в 2013 году, а европейских патентов - в 2009 году. [27] Первый дженерик, выпущенный в Европе в 2009 году. [7] В США возникли проблемы с патентами, что привело к признанию недействительным ключевого патента Lilly на метод производства препарата. [28] [29] Компании-генерики начали продавать препарат в США в 2010 году, когда истек срок действия патента на само химическое вещество. [29] [8] Патентный спор в Китае попал в заголовки газет и был разрешен в 2010 году. [30]
и Общество культура
По состоянию на 2017 год гемцитабин продавался под многими торговыми марками по всему миру: Abine, Accogem, Acytabin, Antoril, axigem, Bendacitabine, Biogem, Boligem, Celzar, Citegin, Cytigem, Cytogem, Daplax, DBL, Demozar, Dercin, Emcitab, Erio, Engemamub. , Fotinex, Gebina, Gemalata, Gembin, Gembine, Gembio, Gemcel, Gemcetin, Gemcibine, Gemcical, Gemcipen, Gemcired, Gemcirena, Gemcit, Gemcitabine, Gemcitabine, Gemcitabine, Gemcitabine, Gemcitabinum, Gemcitan, Gemedac, Gemf, Gemfulcolor, Gemcolor, д , Гемцитан, Геммис, Гемнил, Гемтабин, Гемсол, Гемстад, Гемстада, Гемтабин, Гемтавис, Гемтаз, Гемтеро, Гемтра, Гемтро, Гемвик, Гемксит, Гемзар, Гентабим, Генутен, Генвир, Героам, Гестредос, Гетаносан, Гетмиси, Гез Гез, Гимаген, Грагенбин, Хаксанит, Джемта, Кальбезар, Медигем, Медитабин, Набигем, Наллиан, Онкогем, Онкорил, Памигено, Рибозар, Сантабин, Ситагем, Симтабин, Ю Цзе, Зе Фей и Зефей. [1]
Исследования [ править ]
Поскольку он клинически ценен и полезен только при внутривенном введении, предметом исследований стали методы изменения его состава для перорального введения. [31] [32] [33]
Исследования в области фармакогеномики и фармакогенетики продолжаются. По состоянию на 2014 год не было ясно, могут ли генетические тесты быть полезными для определения дозировки и какие люди лучше всего реагируют на гемцитабин. [19] Однако оказывается, что изменения в экспрессии белков ( SLC29A1 , SLC29A2 , SLC28A1 и SLC28A3), используемых для транспорта гемцитабина в клетку, приводят к изменениям его эффективности. Аналогичным образом, гены, которые экспрессируют белки, которые приводят к его инактивации ( дезоксицитидиндезаминаза , цитидиндезаминаза и NT5C ) и которые экспрессируют другие его внутриклеточные мишени ( RRM1 , RRM2 и RRM2B ), приводят к вариациям реакции на препарат. [19] Также продолжаются исследования, направленные на то, чтобы понять, как мутации при раке поджелудочной железы сами по себе определяют реакцию на гемцитабин. [34]
Его изучали как средство лечения саркомы Капоши , распространенного рака у людей со СПИДом , который редко встречается в развитых странах, но не редкость в развивающихся странах. [35]
Ссылки [ править ]
- ↑ Перейти обратно: Перейти обратно: а б с «Международные бренды гемцитабина» . Наркотики.com. Архивировано из оригинала 25 мая 2014 года . Проверено 6 мая 2017 г.
- ↑ Перейти обратно: Перейти обратно: а б с д и ж г час я дж к «Гемцитабина гидрохлорид» . Американское общество фармацевтов системы здравоохранения. Архивировано из оригинала 2 февраля 2017 года . Проверено 8 декабря 2016 г.
- ^ «Лекарственный формуляр/Лекарственные препараты/гемцитабин – Монография поставщика» . Лечение рака Онтарио . Проверено 6 декабря 2020 г.
- ↑ Перейти обратно: Перейти обратно: а б с «Одобрение FDA на гемцитабина гидрохлорид» . Национальный институт рака . 05.10.2006. Архивировано из оригинала 5 апреля 2017 года . Проверено 22 апреля 2017 г.
- ^ Ли Й, Ли П, Ли Й, Чжан Р, Ю П, Ма З и др. (декабрь 2020 г.). «Скрининг лекарств выявил, что гемцитабин ингибирует вирус гепатита Е, индуцируя интерфероноподобный ответ посредством активации фосфорилирования STAT1» . Противовирусные исследования . 184 : 104967. doi : 10.1016/j.antiviral.2020.104967 . hdl : 1765/133780 . ПМИД 33137361 .
- ^ Фишер Дж., Ганеллин С.Р. (2006). Открытие аналоговых лекарств . Джон Уайли и сыновья. п. 511. ИСБН 9783527607495 .
- ↑ Перейти обратно: Перейти обратно: а б Майерс С. (13 марта 2009 г.). «Гемцитабин от Actavis выпущен на рынки ЕС после истечения срока действия патента» . Жестокая биотехнология . Архивировано из оригинала 11 сентября 2017 года.
- ↑ Перейти обратно: Перейти обратно: а б «Пресс-релиз: Hospira выпускает двухграммовый флакон гемцитабина гидрохлорида для инъекций» . Хоспира через News-Medical.Net. 16 ноября 2010 г. Архивировано из оригинала 2 октября 2015 г.
- ^ Всемирная организация здравоохранения (2023 г.). Выбор и использование основных лекарств на 2023 г.: веб-приложение A: Типовой список основных лекарств Всемирной организации здравоохранения: 23-й список (2023 г.) . Женева: Всемирная организация здравоохранения. hdl : 10665/371090 . ВОЗ/MHP/HPS/EML/2023.02.
- ↑ Перейти обратно: Перейти обратно: а б с д и ж г «Британский лейбл» . Справочник электронных лекарств Великобритании. 5 июня 2014 года. Архивировано из оригинала 10 июля 2017 года . Проверено 6 мая 2017 г.
- ↑ Перейти обратно: Перейти обратно: а б «US formLabel» (PDF) . FDA. Июнь 2014 г. Архивировано (PDF) из оригинала 16 февраля 2017 г. Проверено 6 мая 2017 г. Обновления этикеток см. на индексной странице FDA для NDA 020509. Архивировано 29 апреля 2017 г. на Wayback Machine.
- ^ Чжан XW, Ма YX, Сунь Ю, Цао ЮБ, Ли Ц, Сюй Калифорния (июнь 2017 г.). «Гемцитабин в сочетании со вторым цитотоксическим агентом в лечении первой линии местно-распространенного или метастатического рака поджелудочной железы: систематический обзор и метаанализ». Таргетная онкология . 12 (3): 309–321. дои : 10.1007/s11523-017-0486-5 . ПМИД 28353074 . S2CID 3833614 .
- ^ Пленц Р.Р., Малек Н.П. (декабрь 2016 г.). «Системная терапия холангиокарциномы» . Висцеральная медицина . 32 (6): 427–430. дои : 10.1159/000453084 . ПМК 5290432 . ПМИД 28229078 .
- ^ Джайн А., Квонг Л.Н., Джавле М. (ноябрь 2016 г.). «Геномное профилирование рака желчных путей и его значение для клинической практики». Современные возможности лечения онкологии . 17 (11): 58. дои : 10.1007/s11864-016-0432-2 . ПМИД 27658789 . S2CID 25477593 .
- ↑ Перейти обратно: Перейти обратно: а б «Гемцитабин» . Поддержка рака Macmillan . Архивировано из оригинала 25 марта 2017 года . Проверено 6 мая 2017 г.
- ^ Рэйчел Эйрли (2009). Химиотерапия рака . Уайли-Блэквелл. ISBN 978-0-470-09254-5 .
- ^ Сиддалл Э., Хатри М., Радхакришнан Дж. (июль 2017 г.). «Синдром капиллярной утечки: этиология, патофизиология и лечение» . Почки Интернешнл . 92 (1): 37–46. дои : 10.1016/j.kint.2016.11.029 . ПМИД 28318633 .
- ^ Каси П.М. (январь 2011 г.). «Тромботическая тромбоцитопеническая пурпура и гемцитабин» . Отчеты о случаях онкологии . 4 (1): 143–148. дои : 10.1159/000326801 . ПМЦ 3114619 . ПМИД 21691573 .
- ↑ Перейти обратно: Перейти обратно: а б с д и ж г час я Альвареллос М.Л., Ламба Дж., Сангкул К., Торн К.Ф., Ван Л., Кляйн Дж.Д. и др. (ноябрь 2014 г.). «Краткое содержание ФармГКБ: путь гемцитабина» . Фармакогенетика и геномика . 24 (11): 564–574. дои : 10.1097/fpc.0000000000000086 . ПМК 4189987 . ПМИД 25162786 .
- ↑ Перейти обратно: Перейти обратно: а б с д и ж Мини Е, Нобили С, Качиагли Б, Ландини И, Маццеи Т (май 2006 г.). «Клеточная фармакология гемцитабина» . Анналы онкологии . 17 (Приложение 5): v7-12. дои : 10.1093/annonc/mdj941 . ПМИД 16807468 .
- ^ Фатима М., Икбал Ахмед ММ, Батул Ф., Риаз А., Али М., Мунк-Петерсен Б. и Мутахир З. (2019). Рекомбинантная дезоксирибонуклеозидкиназа Drosophila melanogaster может улучшить комбинированную генно-химиотерапию на основе гемцитабина для воздействия на раковые клетки. Боснийский журнал фундаментальных медицинских наук, 19(4), 342-349. https://doi.org/10.17305/bjbms.2019.4136
- ^ Серкейра Н.М., Фернандес П.А., Рамос М.Дж. (2007). «Понимание инактивации рибонуклеотидредуктазы гемцитабином». Химия: Европейский журнал . 13 (30): 8507–8515. дои : 10.1002/chem.200700260 . ПМИД 17636467 .
- ↑ Перейти обратно: Перейти обратно: а б Браун К., Уэймут-Уилсон А, Линклау Б (апрель 2015 г.). «Линейный синтез гемцитабина» . Исследование углеводов . 406 : 71–75. дои : 10.1016/j.carres.2015.01.001 . ПМИД 25681996 .
- ↑ Перейти обратно: Перейти обратно: а б с Браун К., Дикси М., Уэймут-Уилсон А., Линклау Б. (март 2014 г.). «Синтез гемцитабина» . Исследование углеводов . 387 : 59–73. дои : 10.1016/j.carres.2014.01.024 . ПМИД 24636495 .
- ^ Снидер, Уолтер (2005). Открытие лекарств: история . Нью-Йорк: Уайли. п. 259. ИСБН 978-0-471-89979-2 .
- ^ «Гемзар» . Европейское агентство лекарственных средств. 24 сентября 2008 г. Архивировано из оригинала 11 сентября 2017 г.
- ^ Майерс С. (18 августа 2009 г.). «Патент на лекарство Лилли Гемзар от рака признан недействительным» . ФиерсФарма . Архивировано из оригинала 11 сентября 2017 года.
- ^ Холман CM (лето 2011 г.). «Непредсказуемость патентного права и ее влияние на фармацевтические инновации» (PDF) . Обзор законодательства штата Миссури . 76 (3): 645–693. Архивировано из оригинала (PDF) 11 сентября 2017 г. Проверено 6 мая 2017 г.
- ↑ Перейти обратно: Перейти обратно: а б Равичер Д.Б. (28 июля 2010 г.). «О патентной борьбе на дженерик Гемзар» . В поисках Альфа . Архивировано из оригинала 9 декабря 2012 года.
- ^ Ван М.Х., Александр Д. (2015). «Анализ дел о нарушении фармацевтических патентов в Великом Китае» . В Iimura T, Wang MH, Voit TJ, Rader RR (ред.). Право, политика и получение доходов от интеллектуальной собственности . Издательство Кембриджских ученых. п. 119. ИСБН 9781443879262 . Архивировано из оригинала 11 сентября 2017 г.
- ^ Дьяванапелли С., Кумар А., Чурасия МК (2017). «Уроки, извлеченные из гемцитабина: влияние терапевтических систем-носителей и конъюгатов с лекарственными средствами гемцитабина на терапию рака». Критические обзоры терапевтических систем-носителей лекарств . 34 (1): 63–96. doi : 10.1615/CritRevTherDrugCarrierSyst.2017017912 . ПМИД 28322141 .
- ^ Бирхану Г., Джавар Х.А., Сейеджафари Э., Занди-Карими А. (апрель 2017 г.). «Нанотехнология доставки гемцитабина для лечения рака поджелудочной железы». Биомедицина и фармакотерапия . 88 : 635–643. doi : 10.1016/j.biopha.2017.01.071 . ПМИД 28142120 .
- ^ Дубей Р.Д., Санеха А., Гупта ПК, Гупта П.Н. (октябрь 2016 г.). «Последние достижения в стратегиях доставки лекарств для повышения терапевтической эффективности гемцитабина». Европейский журнал фармацевтических наук . 93 : 147–162. дои : 10.1016/j.ejps.2016.08.021 . ПМИД 27531553 .
- ^ Пишвайан М.Ю., Броуди-младший (март 2017 г.). «Терапевтическое значение молекулярного подтипирования рака поджелудочной железы» . Онкология . 31 (3): 159–66, 168. PMID 28299752 . Архивировано из оригинала 3 июля 2017 года.
- ^ Krown SE (сентябрь 2011 г.). «Стратегии лечения саркомы Капоши в странах Африки к югу от Сахары: проблемы и возможности» . Современное мнение в онкологии . 23 (5): 463–468. дои : 10.1097/cco.0b013e328349428d . ПМЦ 3465839 . ПМИД 21681092 .