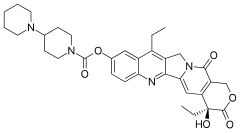
Иринотекан
 | |
 | |
| Клинические данные | |
|---|---|
| Торговые названия | Камптосар, Кампто, Онивиде и другие. |
| AHFS / Drugs.com | Монография |
| Медлайн Плюс | а608043 |
| Данные лицензии |
|
| Беременность категория |
|
| Маршруты администрация | внутривенный |
| код АТС | |
| Юридический статус | |
| Юридический статус | |
| Фармакокинетические данные | |
| Биодоступность | ЧТО |
| Метаболизм | печени Глюкуронидация |
| Период полувыведения | от 6 до 12 часов |
| Экскреция | Желчные протоки и почки |
| Идентификаторы | |
| Номер CAS | |
| ПабХим CID | |
| ИЮФАР/БПС | |
| Лекарственный Банк | |
| ХимическийПаук | |
| НЕКОТОРЫЙ | |
| КЕГГ | |
| ЧЭБИ | |
| ЧЕМБЛ | |
| Панель управления CompTox ( EPA ) | |
| Информационная карта ECHA | 100.219.260 |
| Химические и физические данные | |
| Формула | С 33 Н 38 Н 4 О 6 |
| Молярная масса | 586.689 g·mol −1 |
| 3D model ( JSmol ) | |
| | |
Иринотекан под торговой маркой Камптосар , продаваемый , среди прочего, , представляет собой противораковый препарат, используемый для лечения рака толстой кишки и мелкоклеточного рака легких . [8] При раке толстой кишки его применяют отдельно или в сочетании с фторурацилом . [8] При мелкоклеточном раке легких его применяют в сочетании с цисплатином . [8] Его вводят внутривенно . [8]
Общие побочные эффекты включают диарею , рвоту , угнетение функции костного мозга , выпадение волос, одышку и лихорадку. [8] Другие серьезные побочные эффекты включают образование тромбов , воспаление толстой кишки и аллергические реакции . [8] Те, у кого есть две копии варианта гена UGT1A1*28, подвергаются более высокому риску побочных эффектов. [8] Использование во время беременности может нанести вред ребенку. [8] Иринотекан – ингибитор топоизомеразы. [9] — он блокирует фермент топоизомеразу I , что приводит к повреждению ДНК и гибели клеток . [8]
Иринотекан был одобрен для медицинского применения в США в 1996 году. [8] Он включен в Список основных лекарственных средств Всемирной организации здравоохранения . [10] Он изготовлен из природного соединения камптотецина , содержащегося в китайском декоративном дереве Camptotheca acuminata . [8] [11]
Медицинское использование
[ редактировать ]Основное его применение — при раке толстой кишки , в частности, в сочетании с другими химиотерапевтическими средствами. [5] Сюда входит режим FOLFIRI , который состоит из инфузионного 5-фторурацила , лейковорина и иринотекана. Схема XELIRI состоит из капецитабина и иринотекана. [12] [13]
Его также можно использовать вместе с фторурацилом и фолиновой кислотой при раке поджелудочной железы после неудачного первоначального лечения. [6]
США В феврале 2024 года Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) одобрило липосомы иринотекана в сочетании с оксалиплатином , фторурацилом и лейковорином в качестве терапии первой линии метастатической аденокарциномы поджелудочной железы. [14] [6]
Побочные эффекты
[ редактировать ]Наиболее значимые побочные эффекты иринотекана включают диарею, тошноту и рвоту, нейтропению и лихорадку, инфекции крови или легких (сепсис, пневмония), шок, обезвоживание, почечную недостаточность и тромбоцитопению (низкий уровень тромбоцитов в крови). [7] [15]
Диарея
[ редактировать ]Ранняя диарея возникает во время или вскоре после инфузии иринотекана и обычно носит преходящий характер и редко бывает тяжелой. Поздняя диарея возникает более чем через 24 часа после введения иринотекана и может быть опасной для жизни, иногда приводя к тяжелому обезвоживанию, требующему госпитализации или помещения в отделение интенсивной терапии. Этот побочный эффект купируется агрессивным применением противодиарейных средств, таких как лоперамид или атропин, при первом опорожнении кишечника. [16] [17]
Иммуносупрессия
[ редактировать ]Иринотекан отрицательно влияет на иммунную систему. Это отражается на снижении количества лейкоцитов в крови, в частности нейтрофилов . [16] [17]
Механизм действия
[ редактировать ]Камптотецин, одна из четырех основных структурных классификаций противораковых соединений растительного происхождения, представляет собой цитотоксический алкалоид, который состоит из пентациклической кольцевой структуры, содержащей пиррольный (3, 4 β) хинолиновый фрагмент, S-конфигурированную лактонную форму и карбоксилатная форма. [18] Камптотецин является ингибитором топоизомеразы I. Его аналог, иринотекан, активируется путем гидролиза до SN-38 , а затем инактивируется путем глюкуронидации уридиндифосфатглюкуронозилтрансферазой 1А1 ( UGT1A1 ). Ингибирование топоизомеразы I активным метаболитом SN-38 в конечном итоге приводит к ингибированию как репликации, так и транскрипции ДНК. [15]
Молекулярное действие иринотекана происходит путем улавливания подмножества комплексов расщепления топоизомераза -1-ДНК, тех, которые содержат гуанин +1 в последовательности ДНК. [19] Одна молекула иринотекана укладывается против пар оснований, фланкирующих сайт расщепления, индуцированного топоизомеразой, и отравляет (инактивирует) фермент топоизомеразы 1. [19]
Интерактивный путь
[ редактировать ]Нажмите на гены, белки и метаболиты ниже, чтобы перейти к соответствующим статьям. [§ 1]
- ^ Интерактивную карту маршрутов можно редактировать на WikiPathways: «IrinotecanPathway_WP229» .
Фармакокинетика
[ редактировать ]Администрация
[ редактировать ]Иринотекан можно вводить путем внутривенной инфузии в дозе 125 мг/м в течение 30 или 90 минут. 2 еженедельно в течение четырех из шести недель или 350 мг/м 2 каждые три недели. [20]
Распределение
[ редактировать ]Иринотекан – гидрофильное соединение с большим объемом распределения (400 л/м2). 2 ). [20] [21] При физиологическом pH иринотекан и его активный метаболит этил-10-гидроксикамптотецин (SN-38) присутствуют в двух зависимых от pH равновесных изоформах; противоопухолевое активное лактонное кольцо, гидролизующееся до карбоксилатной изоформы. [21]
В плазме большая часть иринотекана и SN-38 связана с альбумином, что стабилизирует их лактонные формы. В крови иринотекан и SN-38 связываются с тромбоцитами и эритроцитами. [21]
Иринотекан имеет линейную фармакокинетику. Популяционные фармакокинетические модели предполагали трехкамерную модель для иринотекана и двухкамерную модель для SN-38. [21]
SN-38 имеет короткий период полувыведения (около 8 минут). Он достиг своей максимальной концентрации в плазме в течение 2 часов после инфузии. Также SN-38 демонстрирует второй пик концентрации в плазме из-за его энтерогепатической рециркуляции и высвобождения из эритроцитов. [21]
Метаболизм
[ редактировать ]Активация карбоксилэстеразами и бутирилхолинэстеразами.
[ редактировать ]Около 2–5% пролекарства иринотекана гидролизуется до его активного метаболита SN-38 в печени двумя ферментами, конвертирующими карбоксилэстеразу (CES1 и CES2), а в плазме — бутирилхолинэстеразой (hBChE). [21] [22] CES2 имеет сродство к иринотекану в 12,5 раз выше, чем CES1. В то время как бутирилхолинэстераза имеет в 6 раз более высокую активность по отношению к иринотекану, чем CES. [21] После преобразования SN-38 активно транспортируется в печень с помощью переносчика полипептида, переносящего органические анионы (OATP) 1B1. [21] [22]
Инактивация уридиндифосфатглюкуронозилтрансферазами
[ редактировать ]SN-38 инактивируется путем глюкуронидации до SN-38G (конъюгат β-глюкуронида) с помощью нескольких ферментов уридиндифосфатглюкуронозилтрансферазы (UGT) в печени (UGT1A1, UGT1A9) и внепеченочных (UGT1A1, UGT1A7, UGT1A10) и выводится в желчь. . [21] [22] Некоторые полиморфизмы UGT влияют на фармакокинетику иринотекана, например, снижение активности UGT1 может привести к тяжелой токсичности. Кроме того, конъюгаты UGT1A1 с билирубином и глюкуронидация билирубина являются еще одним фактором риска повышенной токсичности. [21]
Деконъюгация β-глюкуронидазой
[ редактировать ]Кишечные бактерии продуцируют β-глюкуронидазы, которые деконъюгируют SN-38G в SN-38, что приводит к энтеро-печеночной рециркуляции SN-38. [21] [22]
Метаболизм ферментами цитохрома P450.
[ редактировать ]Иринотекан метаболизируется внутрипеченочными ферментами цитохрома P450, CYP3A4 и CYP3A5 с образованием неактивных метаболитов APC (7-этил-10-[4-N-(5-аминопентановая кислота)-1-пиперидино]карбонилоксикамптотецин) и NPC (7-этил-10- [4-амино-1-пиперидино]карбонилоксикамптотецин). NPC может быть дополнительно преобразован CES1 и CES2 в печени в SN-38. [21] [22] Индукция или ингибирование ферментов CYP3A курением, некоторыми травами и лекарствами может приводить к взаимодействию с иринотеканом. [21]
Транспорт в желчь
[ редактировать ]Иринотекан транспортируется в желчь с помощью белков-переносчиков АТФ-связывающей кассеты (ABC): ABCB1, ABCC1, ABCC2 и ABCG2. [21] [22]
Устранение
[ редактировать ]Клиренс иринотекана преимущественно желчный (66%) и составляет 12–21 л/ч/м. 2 . [21] Все метаболиты, кроме SN-38G, выводятся преимущественно с калом. [21] [22] Сообщалось, что период полувыведения иринотекана составляет от 5 до 18 часов. Сообщалось, что период полураспада SN-38 составляет от 6 до 32 часов. [21]
Существует высокая (30%) межиндивидуальная вариабельность фармакокинетических параметров иринотекана, которые могут изменяться под действием нескольких факторов, включая возраст, пол, дозу, время введения, функцию печени, активность ферментов или уровни гематокрита. [21] [22]
Фармакогеномика
[ редактировать ]Иринотекан преобразуется ферментом в его активный метаболит SN-38, который, в свою очередь, инактивируется ферментом UGT1A1 путем глюкуронидации.
*28 вариантов пациентов
[ редактировать ]Люди с вариантами UGT1A1, называемыми TA 7 , также известными как «вариант *28», экспрессируют меньше ферментов UGT1A1 в печени и часто страдают синдромом Жильбера . Во время химиотерапии они фактически получают дозу, превышающую ожидаемую, поскольку их организм не способен выводить иринотекан так быстро, как другие. В исследованиях это соответствует более высокой частоте случаев тяжелой нейтропении и диареи. [23]
В 2004 году было проведено клиническое исследование, которое проспективно подтвердило связь варианта *28 с большей токсичностью и способность генетического тестирования прогнозировать эту токсичность перед назначением химиотерапии. [23]
В 2005 году FDA внесло изменения в маркировку иринотекана, добавив рекомендации по фармакогеномике , например, реципиентов иринотекана с гомозиготным (обеих двух копий гена) полиморфизмом в гене UGT1A1, а точнее, вариантом *28, следует рассматривать для снижение доз препарата. [5] Иринотекан — один из первых широко используемых химиотерапевтических препаратов, дозировка которого зависит от генотипа реципиента. [24]
История
[ редактировать ]В феврале 2024 года FDA одобрило липосомы иринотекана в сочетании с оксалиплатином , фторурацилом и лейковорином в качестве терапии первой линии метастатической аденокарциномы поджелудочной железы. [14] Эффективность оценивалась в NAPOLI 3 (NCT04083235), рандомизированном многоцентровом открытом исследовании с активным контролем с участием 770 участников с метастатической аденокарциномой поджелудочной железы, которые ранее не получали химиотерапию при метастазах. [14] Рандомизация была стратифицирована по региону, метастазам в печени и состоянию показателей ECOG. [14] Участники были рандомизированы (1:1) для получения одного из следующих методов лечения: НАЛИРИФОКС: иринотекановая липосома 50 мг/м2 в виде внутривенной инфузии в течение 90 минут, затем оксалиплатин 60 мг/м2 в виде внутривенной инфузии в течение 120 минут, а затем лейковорин. 400 мг/м2 внутривенно в течение 30 минут с последующим введением фторурацила 2400 мг/м2 внутривенно в течение 46 часов каждые 2 недели; Gem+NabP: Nab-паклитаксел 125 мг/м2 внутривенно в течение 35 минут с последующим гемцитабином 1000 мг/м2 внутривенно в течение 30 минут в 1, 8 и 15 дни каждого 28-дневного цикла. [14] Заявке был присвоен статус орфанного препарата . [14]
Общество и культура
[ редактировать ]Юридический статус
[ редактировать ]США Иринотекан получил ускоренное одобрение Управления по контролю за продуктами и лекарствами (FDA) в 1996 году. [25] и полное одобрение в 1998 году. [26] [27] [28]
Инкапсулированная в липосомы версия иринотекана, продаваемая под торговой маркой Onivyde, была одобрена FDA в октябре 2015 года для лечения метастатического рака поджелудочной железы . [29] [30] Он был одобрен для медицинского использования в Европейском Союзе в октябре 2016 года. [7]
Имена
[ редактировать ]Во время разработки он был известен как CPT-11. [ нужна медицинская ссылка ]
Ссылки
[ редактировать ]- ^ «Лекарства, отпускаемые по рецепту: регистрация новых химических веществ в Австралии, 2016» . Управление терапевтических товаров (TGA) . 21 июня 2022 г. Проверено 10 апреля 2023 г.
- ^ «Обновления о безопасности бренда в монографии о продукции» . Здоровье Канады . 7 июля 2016 года . Проверено 3 апреля 2024 г.
- ^ «Лечение рака» . Здоровье Канады . 8 мая 2018 года . Проверено 13 апреля 2024 г.
- ^ «Концентрат пегилированных липосомальных онивида 4,3 мг/мл для приготовления раствора для инфузий – Краткое описание характеристик продукта (SmPC)» . (эмс) . 18 февраля 2020 г. Проверено 25 мая 2020 г.
- ^ Jump up to: а б с «Камптосар-иринотекана гидрохлорид для инъекций, раствор» . ДейлиМед . 10 февраля 2020 г. Проверено 25 мая 2020 г.
- ^ Jump up to: а б с «Онивиде-иринотекана гидрохлорид для инъекций, порошок, для приготовления раствора» . ДейлиМед . 20 октября 2017 г. Проверено 25 мая 2020 г.
- ^ Jump up to: а б с «Онивид пегилированный липосомальный ЭПАР» . Европейское агентство лекарственных средств (EMA) . 17 сентября 2018 года . Проверено 25 мая 2020 г. Текст скопирован из источника, права на который принадлежат Европейскому агентству по лекарственным средствам. Воспроизведение разрешено при условии указания источника.
- ^ Jump up to: а б с д и ж г час я дж к «Иринотекана гидрохлорид» . Американское общество фармацевтов системы здравоохранения. Архивировано из оригинала 22 декабря 2016 года . Проверено 8 декабря 2016 г.
- ^ Британский национальный формуляр: BNF 69 (69-е изд.). Британская медицинская ассоциация. 2015. с. 624. ИСБН 9780857111562 .
- ^ Всемирная организация здравоохранения (2023 г.). Выбор и использование основных лекарств до 2023 г.: веб-приложение A: Типовой список основных лекарств Всемирной организации здравоохранения: 23-й список (2023 г.) . Женева: Всемирная организация здравоохранения. hdl : 10665/371090 . ВОЗ/MHP/HPS/EML/2023.02.
- ^ Генрих М., Барнс Дж., Гиббонс С., Уильямсон Э.М. (2012). Основы фармакогнозии и фитотерапии (2-е изд.). Эдинбург: Эльзевир. п. 130. ИСБН 978-0-7020-5231-6 . OCLC 802051297 .
- ^ Го Ю, Ши М, Шэнь Х, Ян С, Ян Л, Чжан Дж (июнь 2014 г.). «Капецитабин плюс иринотекан по сравнению с 5-ФУ / лейковорином плюс иринотекан в лечении колоректального рака: метаанализ». Клинический колоректальный рак . 13 (2): 110–118. дои : 10.1016/j.clcc.2013.12.004 . ПМИД 24461997 .
- ^ Котака М., Сюй Р., Муро К., Пак Ю.С., Морита С., Иваса С. и др. (декабрь 2016 г.). «Протокол исследования азиатского проекта XELIRI Project (AXEPT): многонациональное рандомизированное исследование III фазы не меньшей эффективности химиотерапии второй линии при метастатическом колоректальном раке, сравнение эффективности и безопасности XELIRI с бевацизумабом или без него по сравнению с FOLFIRI с или без него. бевацизумаб» . Китайский журнал рака . 35 (1): 102. дои : 10.1186/s40880-016-0166-3 . ПМК 5178089 . ПМИД 28007025 .
- ^ Jump up to: а б с д и ж «FDA одобрило липосому иринотекана в качестве терапии первой линии метастатической аденокарциномы поджелудочной железы» . США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) . 13 февраля 2024 г. Проверено 19 февраля 2024 г.
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе . - ^ Jump up to: а б «Onivyde: EPAR – Информация о продукте» (PDF) . Европейское агентство по лекарственным средствам . 25 октября 2016 г. Архивировано (PDF) из оригинала 16 января 2017 г.
- ^ Jump up to: а б Хаберфельд Х, изд. Австрийский кодекс (на немецком языке). Вена: Издательство австрийского фармацевта. Иринотекан Каби 20 мг/мл концентрат для приготовления раствора для инфузий.
- ^ Jump up to: а б Иринотеканская монография . По состоянию на 18 сентября 2021 г.
- ^ «Нирмала, М. Джойс, А. Самундисвари и П. Дипа Санкар. 2011. «Природные растительные ресурсы в противораковой терапии. Обзор». Исследования в области биологии растений 1 (3): 1–14» .
- ^ Jump up to: а б Помье Ю. (январь 2013 г.). «Лекарственное воздействие топоизомераз: уроки и проблемы» . АКС Химическая биология . 8 (1): 82–95. дои : 10.1021/cb300648v . ПМЦ 3549721 . ПМИД 23259582 .
- ^ Jump up to: а б Рейханоглу Г., Смит Т. (2021). «Иринотекан» . СтатПерлс . Остров сокровищ (Флорида): StatPearls Publishing. ПМИД 32119328 . Проверено 14 июня 2021 г.
- ^ Jump up to: а б с д и ж г час я дж к л м н тот п д р де Ман ФМ, Гой А.К., ван Шайк Р.Х., Матийссен Р.Х., Бинс С. (октябрь 2018 г.). «Индивидуализация лечения иринотеканом: обзор фармакокинетики, фармакодинамики и фармакогенетики» . Клиническая фармакокинетика . 57 (10): 1229–1254. дои : 10.1007/s40262-018-0644-7 . ПМК 6132501 . ПМИД 29520731 .
- ^ Jump up to: а б с д и ж г час Кцюк М., Марчиняк Б., Контек Р. (июль 2020 г.). «Иринотекан — по-прежнему важный игрок в химиотерапии рака: всесторонний обзор» . Международный журнал молекулярных наук . 21 (14): 4919. doi : 10.3390/ijms21144919 . ПМК 7404108 . ПМИД 32664667 .
- ^ Jump up to: а б Инноченти Ф., Ундевиа С.Д., Айер Л., Чен П.С., Дас С., Кочергинский М. и др. (апрель 2004 г.). «Генетические варианты гена УДФ-глюкуронозилтрансферазы 1А1 предсказывают риск тяжелой нейтропении иринотекана» . Журнал клинической онкологии . 22 (8): 1382–1388. дои : 10.1200/JCO.2004.07.173 . ПМИД 15007088 .
- ^ О'Дуайер П.Дж., Каталано РБ (октябрь 2006 г.). «Уридиндифосфатглюкуронозилтрансфераза (UGT) 1A1 и иринотекан: практическая фармакогеномика приходит в терапию рака» . Журнал клинической онкологии . 24 (28): 4534–4538. дои : 10.1200/JCO.2006.07.3031 . ПМИД 17008691 .
- ^ «Камптосар: препараты, одобренные FDA» . США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) . Проверено 25 мая 2020 г.
- ^ «Пакет одобрения лекарственного средства: камптосар (иринотекана гидрохлорид) NDA № 20-571/S-008» . США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) . Проверено 25 мая 2020 г.
- ^ «Новое одобренное лекарство от рака» . Нью-Йорк Таймс . 18 июня 1996 года. Архивировано из оригинала 31 мая 2016 года . Проверено 1 сентября 2017 г.
- ^ Темпл Р. (22 октября 1998 г.). «Заявка на новый препарат» (PDF) . США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) . Письмо Уокеру Дж.С. Архивировано (PDF) из оригинала 30 января 2012 года . Проверено 26 июля 2011 г.
- ^ «Онивид» . США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) . 29 сентября 2016 года . Проверено 25 мая 2020 г.
- ^ Пресс-релиз (22 октября 2015 г.). «FDA одобряет новый метод лечения распространенного рака поджелудочной железы» (пресс-релиз). США Управление по контролю за продуктами и лекарствами (FDA). Архивировано из оригинала 24 октября 2015 года.
Дальнейшее чтение
[ редактировать ]- Дин Л. (2015). «Иринотекановая терапия и генотип UGT1A1» . В Пратт В.М., МакЛеод Х.Л., Рубинштейн В.С. и др. (ред.). Краткое изложение медицинской генетики . Национальный центр биотехнологической информации (NCBI). ПМИД 28520360 . Идентификатор книжной полки: NBK294473.
