Иксазомиб
 | |
| Клинические данные | |
|---|---|
| Торговые названия | Нинларо |
| Другие имена | МЛН2238 |
| AHFS / Drugs.com | Монография |
| Медлайн Плюс | а616008 |
| Беременность категория |
|
| Маршруты администрация | Внутрь ( капсулы ) |
| код АТС | |
| Юридический статус | |
| Юридический статус | |
| Фармакокинетические данные | |
| Биодоступность | 58% [ 4 ] |
| Связывание с белками | 99% |
| Метаболизм | Печеночные ( CYP : 3А4 (42%), 1А2 (26%), 2В6 (16%) и другие) |
| Период полувыведения | 9,5 дней |
| Экскреция | Моча (62%), фекалии (22%) |
| Идентификаторы | |
| Номер CAS | |
| ПабХим CID | |
| Лекарственный Банк | |
| ХимическийПаук | |
| НЕКОТОРЫЙ | |
| КЕГГ | |
| КЭБ | |
| Панель управления CompTox ( EPA ) | |
| Информационная карта ECHA | 100.238.319 |
| Химические и физические данные | |
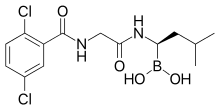
| Формула | С 14 Н 19 Б Cl 2 Н 2 О 4 |
| Молярная масса | 361.03 g·mol −1 |
| 3D model ( JSmol ) | |
Иксазомиб (торговое название Нинларо ) — препарат для лечения множественной миеломы . [ 5 ] тип рака лейкоцитов , [ 6 ] в сочетании с другими препаратами. Его принимают внутрь в виде капсул.
Общие побочные эффекты включают диарею, запор и низкое количество тромбоцитов . Как и более старый бортезомиб (который можно вводить только инъекционно), он действует как ингибитор протеасом , имеет статус орфанного препарата в США и Европе и является производным бороновой кислоты .
Препарат разработан компанией Takeda . В США он одобрен с ноября 2015 года, а в ЕС — с ноября 2016 года.
Медицинское использование
[ редактировать ]Иксазомиб используется в сочетании с леналидомидом и дексаметазоном для лечения множественной миеломы у взрослых после как минимум одной предшествующей терапии. Опыта работы с детьми и подростками до 18 лет нет. [ 7 ] [ 8 ]
В исследование, соответствующее одобрению, были включены 722 человека. В этом исследовании иксазомиб увеличивал медиану времени выживаемости без прогрессирования заболевания с 14,7 месяцев (в группе плацебо + леналидомид + дексаметазон, включая 362 человека) до 20,6 месяцев (в группе иксазомиб + леналидомид + дексаметазон, 360 человек), что было статистически значительный эффект ( р = 0,012). Полный ответ на лечение наблюдался у 11,7% пациентов в группе иксазомиба по сравнению с 6,6% в группе плацебо. Общий процент ответов (полный плюс частичный) составил 78,3% против 71,5%. [ 8 ] [ 9 ]
Исследование фазы 3 продемонстрировало значительное улучшение выживаемости без прогрессирования (ВБП) при применении иксазомиба-леналидомида-дексаметазона (IRd) по сравнению с плацебо. Цитогенетические нарушения высокого риска определялись как del(17p), t(4;14) и/или t(14;16); кроме того, у пациентов оценивалась амплификация 1q21. Из 722 рандомизированных пациентов у 552 были получены цитогенетические результаты; У 137 (25%) были цитогенетические нарушения высокого риска, а у 172 (32%) была только амплификация 1q21. ВБП была улучшена при применении ИРД по сравнению с плацебо в цитогенетических подгруппах как высокого, так и стандартного риска: у пациентов с высоким риском медиана ВБП составила 21,4 против 9,7 месяцев; у пациентов стандартного риска со средней ВБП 20,6 против 15,6 месяцев. Это преимущество PFS было постоянным во всех подгруппах с отдельными цитогенетическими нарушениями высокого риска, включая пациентов с del(17p). ВБП также была дольше при IRd по сравнению с плацебо у пациентов с амплификацией 1q21 и в группе «расширенного высокого риска», определяемой как пациенты с цитогенетическими нарушениями высокого риска и/или амплификацией 1q21. IRd продемонстрировал существенное преимущество по сравнению с плацебо у пациентов с рецидивирующей/рефрактерной множественной миеломой с цитогенетикой высокого и стандартного риска, а также улучшает плохую ВБП, связанную с цитогенетическими нарушениями высокого риска. [ 10 ]
Беременность и кормление грудью
[ редактировать ]иксазомиб и леналидомид оказывали тератогенное действие В исследованиях на животных . Последний противопоказан беременным, что делает данную схему терапии непригодной для этой группы. Неизвестно, проникают ли иксазомиб или его метаболиты в грудное молоко. [ 8 ] [ 11 ]
Побочные эффекты
[ редактировать ]Общие побочные эффекты исследуемой терапии иксазомиб+леналидомид+дексаметазон включали диарею (42% против 36% в группе плацебо+леналидомид+дексаметазон), запор (34% против 25%), тромбоцитопению (низкое количество тромбоцитов ; 28% против 14%), периферическая нейропатия (28% против 21%), тошнота (26% против 21%), периферические отеки (отек; 25% против 18%), рвота (22% против 11%) и боль в спине (21% против 16%) . Серьезная диарея или тромбоцитопения наблюдались у 2% пациентов соответственно. [ 8 ] [ 11 ]
Побочные эффекты только иксазомиба оценивались лишь у небольшого числа людей. Диарея 2-й степени и выше была обнаружена у 24% этих пациентов, тромбоцитопения 3-й степени и выше - у 28%, утомляемость 2-й степени и выше - у 26%. [ 12 ]
Взаимодействия
[ редактировать ]Препарат имеет низкий потенциал взаимодействия через ферменты печени цитохрома P450 (CYP) и белки-транспортеры . Единственным значимым результатом исследований было снижение уровня иксазомиба в крови при сочетании с сильным CYP3A4 индуктором рифампицином . Cmax под площадь снизилась на 54%, а кривой - на 74%. В этом исследовании [ 8 ] [ 11 ]
Фармакология
[ редактировать ]Механизм действия
[ редактировать ]В терапевтических концентрациях иксазомиб избирательно и обратимо ингибирует субъединицу бета-5 типа протеасомы белка (PSMB5). [ 11 ] с диссоциации периодом полураспада 18 минут. Этот механизм такой же, как и у бортезомиба , у которого период полувыведения диссоциации гораздо больше - 110 минут; родственный препарат карфилзомиб , напротив, необратимо блокирует PSMB5. Субъединицы протеасом бета-типа-1 и типа-2 ингибируются только при высоких концентрациях, достигаемых на моделях клеточных культур. [ 13 ]
PSMB5 является частью 20S протеасомного комплекса и обладает ферментативной активностью, сходной с химотрипсином . Он индуцирует апоптоз , тип запрограммированной гибели клеток , в различных линиях раковых клеток. Синергический эффект иксазомиба и леналидомида обнаружен на большом количестве клеточных линий миеломы. [ 11 ] [ 14 ]
Фармакокинетика
[ редактировать ]
Лекарство принимают перорально в виде пролекарства цитрата иксазомиба, который представляет собой сложный эфир бороновой кислоты ; этот сложный эфир быстро гидролизуется в физиологических условиях до его биологически активной формы, иксазомиба, бороновой кислоты. [ 4 ] Абсолютная биодоступность составляет 58%, а наивысшие концентрации иксазомиба в плазме крови достигаются через час. Связывание с белками плазмы составляет 99%. [ 8 ] [ 11 ]
Вещество метаболизируется многими ферментами CYP (в процентах in vitro , в концентрациях, превышающих клинические: CYP3A4 42,3%, CYP1A2 26,1%, CYP2B6 16,0%, CYP2C8 6,0%, CYP2D6 4,8%, CYP2C9 4,8%, CYP2C9 <1%), а также как ферменты, не относящиеся к CYP, [ 8 ] что могло бы объяснить низкий потенциал взаимодействия. Клиренс составляет около 1,86 литров в час с широкой вариабельностью 44% между отдельными людьми, а период полувыведения из плазмы составляет 9,5 дней. 62% иксазомиба и его метаболитов выводится с мочой (из них менее 3,5% в неизмененном виде) и 22% — с калом. [ 8 ] [ 11 ]
Химия
[ редактировать ]Иксазомиб — бороновой кислоты и пептида. аналог [ 14 ] как старый бортезомиб. Он содержит производное аминокислоты лейцина с карбоновой заменой группы на бороновую кислоту; а оставшуюся часть молекулы сравнивают с фенилаланином . [ 13 ] Структура была обнаружена посредством крупномасштабного скрининга борсодержащих молекул. [ 13 ]
История
[ редактировать ]Препарат разработан компанией Takeda. В 2011 году он получил статус орфанного препарата в США и Европе для лечения множественной миеломы, а в 2012 году — для AL-амилоидоза. В июле 2015 года компания Takeda подала в США заявку на новый препарат для лечения множественной миеломы. [ 15 ] США В сентябре 2015 года Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) предоставило иксазомибу в сочетании с леналидомидом и дексаметазоном статус приоритетного рассмотрения для лечения множественной миеломы. [ 16 ] 20 ноября 2015 года FDA одобрило эту комбинацию для лечения второй линии. [ 7 ]
Запрос на получение разрешения на продажу в Европе был первоначально отклонен Европейским агентством по лекарственным средствам (EMA) в мае 2016 года из-за недостаточности данных, подтверждающих пользу лечения. [ 17 ] После того, как компания Takeda запросила повторную экспертизу, 21 ноября 2016 года EMA выдало регистрационное удостоверение при условии проведения дальнейших исследований эффективности. Индикация одобрения такая же, как и в США. [ 8 ]
Исследовать
[ редактировать ]Этот раздел необходимо обновить . ( октябрь 2020 г. ) |
По состоянию на январь 2017 г. [update]иксазомиб также находится на стадии III клинических испытаний для лечения AL-амилоидоза. [ 18 ] и плазмоцитома костей, [ 19 ] и в исследованиях фазы I/II для различных других состояний. [ 20 ] [ 21 ]
Ссылки
[ редактировать ]- ^ «Лекарства, отпускаемые по рецепту: регистрация новых химических веществ в Австралии, 2016» . Управление терапевтических товаров (TGA) . 21 июня 2022 г. Проверено 10 апреля 2023 г.
- ^ «Обновления о безопасности бренда в монографии о продукции» . Здоровье Канады . Февраль 2024 года . Проверено 24 марта 2024 г.
- ^ «Разрешения на новые лекарства Министерства здравоохранения Канады: основные события 2016 г.» . Здоровье Канады . 14 марта 2017 года . Проверено 7 апреля 2024 г.
- ^ Jump up to: а б «Нинларо-иксазомиб капсула» . ДейлиМед . 24 марта 2020 г. Проверено 19 августа 2020 г.
- ^ Мина Р., Фальконе А.П., Бринген С., Либерати А.М., Пекоста Н., Петруччи М.Т. и др. (декабрь 2021 г.). «Схемы индукции на основе иксазомиба плюс поддерживающая поддержка иксазомиба при впервые диагностированной множественной миеломе, не подходящей для трансплантации: фаза II, многогрупповое, рандомизированное исследование UNITO-EMN10» . Журнал рака крови . 11 (12): 197. дои : 10.1038/s41408-021-00590-5 . ПМЦ 8651653 . ПМИД 34876566 .
- ^ Рааб М.С., Подар К., Брейткройц И., Ричардсон П.Г., Андерсон К.К. (июль 2009 г.). "Множественная миелома". Ланцет . 374 (9686): 324–339. дои : 10.1016/S0140-6736(09)60221-X . ПМИД 19541364 . S2CID 12906881 .
- ^ Jump up to: а б «Сообщения для прессы — FDA одобряет Нинларо, новый пероральный препарат для лечения множественной миеломы» . Управление по контролю за продуктами и лекарствами США. 20 ноября 2015 г.
- ^ Jump up to: а б с д и ж г час я «Нинларо: EPAR – Информация о продукте» (PDF) . Европейское агентство по лекарственным средствам . 21 ноября 2016 г. Архивировано из оригинала (PDF) 17 марта 2018 г. . Проверено 4 января 2017 г.
- ^ Моро П., Масси Т., Грзаско Н., Бахлис Н.Дж., Ханссон М., Поур Л. и др. (апрель 2016 г.). «Оральный иксазомиб, леналидомид и дексаметазон при множественной миеломе» . Медицинский журнал Новой Англии . 374 (17): 1621–34. дои : 10.1056/NEJMoa1516282 . ПМИД 27119237 .
- ^ Авет-Луазо Х., Бахлис Н.Дж., Чнг В.Дж., Масси Т., Витербо Л., Поур Л. и др. (декабрь 2017 г.). «Иксазомиб значительно продлевает выживаемость без прогрессирования у пациентов с рецидивирующей/рефрактерной миеломой высокого риска» . Кровь . 130 (24): 2610–2618. дои : 10.1182/blood-2017-06-791228 . ПМИД 29054911 .
- ^ Jump up to: а б с д и ж г Хаберфельд Х, изд. Австрийский кодекс (на немецком языке). Вена: Издательство австрийского фармацевта.
- ^ Гупта Н., Лаботка Р., Лю Г., Хуэй А.М., Венкатакришнан К. (июнь 2016 г.). «Анализ воздействия-безопасности-эффективности монотерапии иксазомибом, пероральным ингибитором протеасом, при рецидивирующей/рефрактерной множественной миеломе: выбор дозы для поддерживающего исследования фазы 3» . Исследуемые новые лекарства . 34 (3): 338–46. дои : 10.1007/s10637-016-0346-7 . ПМЦ 4859859 . ПМИД 27039387 .
- ^ Jump up to: а б с Муз Б, Газарян Р.Н., Оу М, Людерер М.Дж., Кусдоно Х.Д., Азаб АК (2016). «В центре внимания иксазомиб: потенциал в лечении множественной миеломы» . Дизайн, разработка и терапия лекарств . 10 : 217–26. дои : 10.2147/DDDT.S93602 . ПМЦ 4714737 . ПМИД 26811670 .
- ^ Jump up to: а б КЕГГ : Иксазомиб
- ^ «Такеда подает новую заявку на препарат иксазомиб для пациентов с рецидивирующей/рефрактерной множественной миеломой» . Такеда. 14 июля 2015 г.
- ^ «Иксазомиб получил приоритетное рассмотрение FDA для лечения множественной миеломы» . Таргетная онкология. 9 сентября 2015 года. Архивировано из оригинала 20 октября 2017 года . Проверено 23 января 2017 г.
- ^ «Вопросы и ответы об отказе в выдаче регистрационного удостоверения Нинларо» (PDF) . Европейское агентство по лекарственным средствам . 27 мая 2016 г. Архивировано из оригинала (PDF) 17 марта 2018 г. . Проверено 5 января 2017 г.
- ^ Номер клинического исследования NCT01659658 для «Исследование дексаметазона плюс иксазомиба (MLN9708) или лечения по выбору врачей при рецидивирующем или рефрактерном системном амилоидозе легкой цепи (AL)» на ClinicalTrials.gov
- ^ Номер клинического исследования NCT02516423 «Иксазомиб цитрат, леналидомид, дексаметазон и золедроновая кислота или только золедроновая кислота после лучевой терапии при лечении пациентов с одиночной плазмацитомой кости» на сайте ClinicalTrials.gov.
- ^ Номер клинического исследования NCT02420847 «Двумерное исследование по подбору дозы иксазомиба в комбинации с гемцитабином и доксорубицином с последующим продлением фазы II для оценки эффективности этой комбинации при метастатическом, хирургически неоперабельном раке уротелия» на сайте ClinicalTrials.gov
- ^ Номер клинического исследования NCT02250300 для «MLN9708 для профилактики хронической реакции трансплантат против хозяина у пациентов, перенесших аллогенную трансплантацию» на сайте ClinicalTrials.gov.