Клиническое исследование

Клинические испытания — это проспективные биомедицинские или поведенческие исследования на людях, призванные ответить на конкретные вопросы о биомедицинских или поведенческих вмешательствах, включая новые методы лечения (такие как новые вакцины , лекарства , выбор диеты , пищевые добавки и медицинские устройства ) и известные вмешательства, которые требуют дальнейшего изучение и сравнение. Клинические испытания собирают данные о дозировке, безопасности и эффективности. [1] [2] Они проводятся только после получения одобрения органа здравоохранения/комитета по этике в стране, где запрашивается одобрение терапии. Эти органы несут ответственность за проверку соотношения риска и пользы в исследовании — их одобрение не означает, что терапия «безопасна» или эффективна, а означает только то, что исследование может быть проведено.
В зависимости от типа продукта и стадии разработки исследователи сначала привлекают добровольцев или пациентов к небольшим пилотным исследованиям , а затем проводят сравнительные исследования все большего масштаба. Клинические испытания могут различаться по размеру и стоимости и могут включать в себя один исследовательский центр или несколько центров в одной стране или в нескольких странах. Дизайн клинического исследования направлен на обеспечение научной достоверности и воспроизводимости результатов.
Затраты на клинические испытания могут достигать миллиардов долларов на каждый одобренный препарат. [3] а полный процесс испытаний до утверждения может занять 7–15 лет. [4] [5] Спонсором может быть государственная организация или фармацевтическая , биотехнологическая компания или компания, производящая медицинское оборудование. Определенные функции, необходимые для исследования, такие как мониторинг и лабораторная работа, могут выполняться внешним партнером, например, контрактной исследовательской организацией или центральной лабораторией. Только 10 процентов всех лекарств, начатых в клинических испытаниях на людях, становятся одобренными лекарствами . [6]
Обзор [ править ]
Испытания лекарств [ править ]
В некоторых клинических испытаниях участвуют здоровые субъекты без каких -либо заболеваний . Другие клинические испытания касаются людей с особыми заболеваниями, которые готовы попробовать экспериментальное лечение. Пилотные эксперименты проводятся для получения информации о планировании последующего клинического исследования.
Тестирование медицинских методов лечения преследует две цели: выяснить, работают ли они достаточно хорошо, что называется «эффективностью» или «эффективностью»; и узнать, достаточно ли они безопасны, что называется «безопасность». [1] Ни один из них не является абсолютным критерием; как безопасность, так и эффективность оцениваются с учетом того, как предполагается использовать лечение, какие другие методы лечения доступны, а также тяжести заболевания или состояния. Выгоды должны перевешивать риски. [7] [8] : 8 Например, многие лекарства для лечения рака имеют серьезные побочные эффекты, которые неприемлемы для безрецептурных обезболивающих, однако лекарства от рака одобрены, поскольку они используются под наблюдением врача и применяются при опасных для жизни состояниях. состояние. [9]
В США пожилые люди составляют 14% населения, при этом они потребляют более трети наркотиков. [10] Людей старше 55 лет (или аналогичного предельного возраста) часто исключают из испытаний, поскольку их более серьезные проблемы со здоровьем и употребление наркотиков усложняют интерпретацию данных, а также потому, что у них другие физиологические возможности, чем у более молодых людей. Дети и люди с несвязанными заболеваниями также часто исключаются из исследования. [11] Беременные женщины часто исключаются из-за потенциального риска для плода .
Спонсор разрабатывает исследование совместно с группой экспертов-клиницистов, в том числе определяет, какие альтернативные или существующие методы лечения следует сравнивать с новым препаратом и какие типы пациентов могут получить от него пользу. Если спонсор не может получить достаточное количество испытуемых в одном месте, для участия в исследовании привлекаются исследователи из других мест.
В ходе исследования исследователи набирают субъектов с заранее определенными характеристиками, назначают лечение(я) и собирают данные о здоровье субъектов за определенный период времени. Данные включают такие измерения, как показатели жизненно важных функций , концентрацию исследуемого препарата в крови или тканях, изменения симптомов, а также то, происходит ли улучшение или ухудшение состояния, на которое направлено исследуемое лекарство. Исследователи отправляют данные спонсору исследования, который затем анализирует объединенные данные с помощью статистических тестов .
Примеры целей клинических испытаний включают оценку безопасности и относительной эффективности лекарства или устройства:
- О конкретном пациенте
- В разных дозировках
- По новому показанию
- Оценка повышения эффективности лечения заболевания по сравнению со стандартной терапией для этого состояния.
- Оценка исследуемого препарата или устройства по сравнению с двумя или более уже одобренными/распространенными вмешательствами для этого состояния.
В то время как большинство клинических испытаний проверяют одну альтернативу новому вмешательству, некоторые расширяются до трех или четырех и могут включать плацебо .
За исключением небольших исследований, проводимых в одном месте, дизайн и цели указаны в документе, называемом протоколом клинического исследования . Протокол представляет собой «руководство по эксплуатации» исследования и гарантирует, что все исследователи проводят исследование одинаково на аналогичных субъектах и что данные сопоставимы по всем субъектам.
Поскольку исследование предназначено для проверки гипотез , а также строгого мониторинга и оценки результатов, его можно рассматривать как применение научного метода , в частности, экспериментального этапа.
Наиболее распространенные клинические испытания оценивают новые фармацевтические продукты, медицинские устройства, биологические препараты , диагностические тесты , психологические методы лечения или другие вмешательства. [12] Клинические испытания могут потребоваться перед национальным регулирующим органом. [13] утверждает маркетинг инновации.
Испытания устройств [ править ]
Как и в случае с лекарствами, производители медицинского оборудования в США обязаны проводить клинические испытания для получения предпродажного одобрения . [14] Испытания устройств могут сравнивать новое устройство с уже существующим лечением или сравнивать аналогичные устройства друг с другом. Примером первого в области сосудистой хирургии является исследование «Открытое и эндоваскулярное восстановление» (OVER) для лечения аневризмы брюшной аорты , в котором сравнивали старый метод открытого восстановления аорты с новым эндоваскулярным устройством для восстановления аневризмы . [15] Примером последнего являются клинические испытания механических устройств, используемых при лечении недержания мочи у взрослых женщин . [16]
Испытания процедур [ править ]
Подобно лекарствам, медицинские или хирургические процедуры могут подвергаться клиническим испытаниям. [17] например, сравнение различных хирургических подходов в лечении миомы матки при бесплодии . [18] Однако, когда клинические испытания в хирургических условиях неэтичны или логистически невозможны, исследования «случай-контроль» будут заменены. [19]
и Участие общественности пациентов
Помимо участия в клинических испытаниях, представители общественности могут активно сотрудничать с исследователями в разработке и проведении клинических исследований . Это известно как участие пациентов и общественности (PPI). Участие общественности предполагает рабочее партнерство между пациентами, лицами, осуществляющими уход, людьми с жизненным опытом и исследователями, чтобы формировать и влиять на то, что такое исследователь и как. [20] PPI может улучшить качество исследований и сделать их более актуальными и доступными. Люди с нынешним или прошлым опытом заболевания могут представить точку зрения, отличную от профессионалов, и похвалить их знания. Благодаря своим личным знаниям они могут определить темы исследований, которые актуальны и важны для тех, кто живет с заболеванием или пользуется услугами. Они также могут помочь сделать исследования более ориентированными на потребности конкретных сообществ, частью которых они являются. Общественные участники могут также обеспечить, чтобы исследование было представлено простым языком , понятным широкому обществу и конкретным группам, для которых оно наиболее актуально. [21]
История [ править ]
Развитие [ править ]
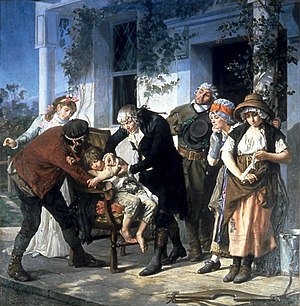
Хотя ранние медицинские эксперименты проводились часто, использование контрольной группы для точного сравнения и демонстрации эффективности вмешательства, как правило, отсутствовало. Например, леди Мэри Уортли Монтегю , которая выступала за введение прививки (тогда называемой вариоляцией) для предотвращения оспы , организовала для семи заключенных, приговоренных к смертной казни, пройти вариоляцию в обмен на их жизнь. Хотя они выжили и не заразились оспой, не было контрольной группы, которая могла бы оценить, был ли этот результат обусловлен прививкой или каким-то другим фактором. Подобные эксперименты, проведенные Эдвардом Дженнером над его вакциной от оспы, были столь же концептуально ошибочными. [22]
Первое полноценное клиническое испытание провел шотландский врач Джеймс Линд . [23] Болезнь цинга , которая, как теперь известно, вызвана дефицитом витамина С , часто имела ужасные последствия для благополучия экипажа дальних океанских путешествий. В 1740 году катастрофический результат привлек Ансона кругосветного плавания большое внимание в Европе; из 1900 мужчин 1400 умерли, большинство из них предположительно от цинги. [24] Джон Вудалл , английский военный хирург Британской Ост-Индской компании , рекомендовал употребление цитрусовых (они обладают противоцинготным действием) еще с 17 века, но их использование не получило широкого распространения. [25]
Линд провел первое систематическое клиническое исследование в 1747 году. [26] Он включил в эксперимент пищевую добавку кислого качества после двух месяцев плавания, когда корабль уже был поражен цингой. Он разделил двенадцать моряков, больных цингой, на шесть групп по два человека. Все они получали одинаковую диету, но, кроме того, первая группа ежедневно получала литр сидра , вторая группа - двадцать пять капель купоросного эликсира ( серной кислоты ), третья группа - шесть ложек уксуса , четвертая группа - полпинты морской воды. Пятая группа получила два апельсина и один лимон , а последняя группа - острую пасту и напиток из ячменного отвара . Лечение пятой группы прекратилось через шесть дней, когда у них закончились фрукты, но к тому времени один моряк был готов к службе, а другой почти выздоровел. Кроме того, только первая группа также показала некоторый эффект от лечения. [27] Каждый год 20 мая отмечается как День клинических испытаний в честь исследований Линда. [28]
После 1750 года дисциплина начала принимать современную форму. [29] [30] Английский врач Джон Хейгарт продемонстрировал важность контрольной группы для правильной идентификации эффекта плацебо в своем знаменитом исследовании неэффективного лекарства под названием « тракторы Перкина» . Дальнейшую работу в этом направлении провел выдающийся врач сэр Уильям Галл, 1-й баронет в 1860-х годах. [22]
Фредерик Акбар Магомед (ум. 1884), работавший в больнице Гая в Лондоне , внес существенный вклад в процесс клинических испытаний, где «он отделил хронический нефрит с вторичной гипертензией от того, что мы теперь называем эссенциальной гипертензией . Он также основал Коллективное исследование Рекорд Британской медицинской ассоциации ; эта организация собирала данные от врачей, практикующих за пределами больниц, и была предшественником современных совместных клинических испытаний». [31]
Современные испытания [ править ]

Сэр Рональд А. Фишер , работая на экспериментальной станции Ротамстеда в области сельского хозяйства, в 1920-х годах разработал свои «Принципы планирования экспериментов» как точную методологию правильного планирования экспериментов. Среди его основных идей была важность рандомизации — случайного распределения людей в разные группы для эксперимента; [32] репликация — для уменьшения неопределенности измерения следует повторять, а эксперименты повторять для выявления источников отклонений; [33] блокирование — для объединения экспериментальных единиц в группы единиц, похожих друг на друга, и таким образом уменьшая нерелевантные источники вариаций; использование факторных экспериментов — эффективно при оценке эффектов и возможных взаимодействий нескольких независимых факторов. [22]
Британский совет медицинских исследований официально признал важность клинических исследований 1930-х годов. Совет учредил Комитет терапевтических испытаний для консультирования и оказания помощи в организации должным образом контролируемых клинических испытаний новых продуктов, которые, по экспериментальным данным, могут иметь ценность при лечении заболеваний. [22]
Первое рандомизированное лечебное исследование было проведено в Исследовательском отделе туберкулеза MRC сэром Джеффри Маршаллом (1887–1982). Испытание, проведенное между 1946 и 1947 годами, было направлено на проверку эффективности химического вещества стрептомицина для лечения туберкулеза легких . Исследование было двойным слепым и плацебо-контролируемым . [34]
Методология клинических испытаний была далее развита сэром Остином Брэдфордом Хиллом , который принимал участие в испытаниях стрептомицина. С 1920-х годов Хилл применял статистику в медицине, посещая, среди прочего, лекции известного математика Карла Пирсона . Он прославился благодаря знаковому исследованию, проведенному в сотрудничестве с Ричардом Доллом, о корреляции между курением и раком легких . В 1950 году они провели исследование «случай-контроль» , в котором сравнивали пациентов с раком легких с соответствующими контрольными группами, а также начали длительное долгосрочное проспективное исследование более широкой проблемы курения и здоровья, которое включало изучение привычек курения и здоровья более 30 000 человек. врачей в течение нескольких лет. В его свидетельстве об избрании в Королевское общество он назван «... лидером в разработке в медицине точных экспериментальных методов, которые сейчас используются на национальном и международном уровне для оценки новых терапевтических и профилактических средств ».
Международный день клинических исследований отмечается 20 мая. [35]
Аббревиатуры, используемые в названиях клинических исследований , часто являются надуманными и становятся предметом насмешек. [36]
Типы [ править ]
Клинические испытания классифицируются по целям исследования, поставленным исследователями. [12]
- В наблюдательном исследовании исследователи наблюдают за субъектами и оценивают их результаты. Исследователи не активно руководят исследованием. [37]
- В интервенционном исследовании исследователи дают субъектам исследования экспериментальный препарат, хирургическую процедуру, использование медицинского устройства, диагностическое или другое вмешательство, чтобы сравнить пролеченных субъектов с субъектами, не получающими лечения или стандартным лечением. Затем исследователи оценивают, как меняется здоровье испытуемых. [37]
Испытания классифицируются по их цели. После того, как спонсору исследования будет предоставлено одобрение на исследование на людях, Управление по контролю за продуктами и лекарствами США (FDA) организует и контролирует результаты исследований в зависимости от типа: [12]
- В исследованиях по профилактике ищут способы предотвратить заболевание у людей, которые никогда не болели этим заболеванием, или предотвратить возвращение заболевания. Эти подходы могут включать лекарства , витамины или другие микроэлементы , вакцины или изменение образа жизни .
- Скрининговые испытания проверяют способы выявления определенных заболеваний или состояний здоровья.
- Диагностические испытания проводятся с целью найти более эффективные тесты или процедуры для диагностики конкретного заболевания или состояния.
- В ходе клинических испытаний проверяются экспериментальные лекарства, новые комбинации лекарств или новые подходы к хирургии или лучевой терапии .
- Испытания качества жизни (испытания поддерживающей терапии) оценивают, как улучшить комфорт и качество ухода за людьми с хроническими заболеваниями .
- Генетические исследования проводятся для оценки точности прогнозирования генетических нарушений, повышающих или снижающих вероятность развития заболевания у человека.
- эпидемиологических исследований является выявление общих причин, закономерностей или контроля заболеваний у большого числа людей. Целью
- Испытания сострадательного использования или испытания с расширенным доступом предоставляют частично проверенные, неутвержденные методы лечения небольшому числу пациентов, у которых нет других реалистичных вариантов. Обычно это касается заболевания, для которого не одобрено эффективное лечение, или пациента, которому уже не удалось пройти все стандартные методы лечения и чье здоровье слишком подорвано, чтобы претендовать на участие в рандомизированных клинических исследованиях. [38] Обычно для таких исключений в каждом конкретном случае должно быть одобрено как FDA, так и фармацевтическая компания.
- Фиксированные испытания учитывают существующие данные только во время разработки исследования, не изменяют исследование после его начала и не оценивают результаты до завершения исследования.
- Адаптивные клинические испытания используют существующие данные для разработки исследования, а затем используют промежуточные результаты для модификации исследования по мере его проведения. Модификации включают дозировку, размер выборки, препарат, проходящий испытания, критерии отбора пациентов и смесь «коктейлей». [39] Адаптивные испытания часто используют байесовский экспериментальный план для оценки прогресса исследования. В некоторых случаях испытания превратились в непрерывный процесс, в ходе которого по мере получения дополнительной информации регулярно добавляются и исчезают методы лечения и группы пациентов. [40] Цель состоит в том, чтобы быстрее идентифицировать лекарства, оказывающие терапевтический эффект, и сосредоточить внимание на группах пациентов, для которых препарат подходит. [41] [42]
Клинические испытания обычно проводятся в четыре этапа, причем на каждом этапе используется разное количество субъектов и преследуются разные цели, направленные на выявление конкретного эффекта. [12]
Фазы [ править ]
Клинические испытания новых лекарств обычно делятся на пять этапов. Каждый этап процесса утверждения препарата рассматривается как отдельное клиническое исследование. Процесс разработки лекарств обычно проходит этапы I–IV в течение многих лет, часто на протяжении десятилетия или дольше. Если препарат успешно проходит фазы I, II и III, национальный регулирующий орган обычно одобряет его для использования среди населения в целом. [12] Испытания фазы IV проводятся после выхода на рынок нового одобренного препарата, средства диагностики или устройства, обеспечивая оценку рисков, преимуществ или наилучшего использования. [12]
Фаза Цель Примечания Фаза 0 Фармакодинамика и фармакокинетика у человека Испытания фазы 0 — это необязательные первые испытания на людях. Разовые субтерапевтические дозы исследуемого препарата или лечения вводятся небольшому числу субъектов (обычно от 10 до 15) для сбора предварительных данных о фармакодинамике препарата (как препарат действует на организм) и фармакокинетике (как организм влияет на препараты). ). [43] Для тестируемого препарата исследование документирует всасывание, распределение, метаболизм и клиренс (выведение) препарата, а также взаимодействие препарата в организме, чтобы подтвердить, что они соответствуют ожиданиям. Фаза I Проверка на безопасность Часто это первые испытания на личном опыте. Тестирование на небольшой группе людей (обычно 20–80 человек) для оценки безопасности, определения безопасных диапазонов доз и выявления побочных эффектов . [12] Фаза II Установление предварительной эффективности препарата в «терапевтической группе» , обычно по сравнению с плацебо . контрольной группой Фаза II-а специально разработана для оценки требований к дозировке (сколько препарата следует ввести). [12] [44] в то время как исследование фазы II-b предназначено для определения эффективности (100–300 человек), [1] оценка того, насколько хорошо препарат действует в назначенной дозе(ах), для установления диапазона терапевтических доз и мониторинга возможных побочных эффектов. [44] Фаза III Окончательное подтверждение безопасности и эффективности Тестирование на больших группах людей (обычно 1000–3000) для подтверждения эффективности препарата, оценки его эффективности, мониторинга побочных эффектов, сравнения его с обычно используемыми методами лечения и сбора информации, которая позволит его безопасно использовать. [12] Фаза IV Исследования безопасности во время продаж Постмаркетинговые исследования определяют риски, преимущества и оптимальное использование. Таким образом, они продолжаются в течение всего срока активного медицинского применения препарата. [12]
Пробный дизайн [ править ]
Фундаментальное различие в доказательной практике заключается между обсервационными исследованиями и рандомизированными контролируемыми исследованиями . [45] Типы обсервационных исследований в эпидемиологии , такие как когортное исследование и исследование «случай-контроль» , предоставляют менее убедительные доказательства, чем рандомизированное контролируемое исследование. [45] В обсервационных исследованиях исследователи ретроспективно оценивают связь между лечением, назначенным участникам, и состоянием их здоровья, что может привести к значительным ошибкам в планировании и интерпретации. [46]
Рандомизированное контролируемое исследование может предоставить убедительные доказательства того, что исследуемый препарат оказывает влияние на здоровье человека. [45]
Некоторые исследования лекарств фазы II и большинство исследований лекарств фазы III проводятся как рандомизированные, двойные слепые и плацебо -контролируемые.
- Рандомизированный: каждому субъекту исследования случайным образом назначают либо исследуемое лечение, либо плацебо.
- Слепой: субъекты, участвующие в исследовании, не знают, какое исследуемое лечение они получают. Если исследование является двойным слепым, исследователи также не знают, какое лечение получает субъект. Цель состоит в том, чтобы помешать исследователям относиться к этим двум группам по-разному. Форма двойного слепого исследования, называемая «двойной макет», обеспечивает дополнительную страховку от предвзятости. В такого рода исследованиях всем пациентам в чередующиеся периоды назначаются как плацебо, так и активные дозы.
- Плацебо-контролируемый: использование плацебо (фальшивого лечения) позволяет исследователям изолировать эффект исследуемого лечения от эффекта плацебо .
Клинические исследования с небольшим количеством участников могут «спонсироваться» отдельными исследователями или небольшой группой исследователей и предназначены для проверки простых вопросов или возможности расширения исследования для более полного рандомизированного контролируемого исследования. [47]
Клинические исследования могут «спонсироваться» (финансироваться и организовываться) академическими учреждениями, фармацевтическими компаниями, государственными учреждениями и даже частными группами. Для новых лекарств, биотехнологий, диагностических тестов или медицинских устройств проводятся испытания с целью определить их безопасность и эффективность, прежде чем они будут представлены на рассмотрение регулирующих органов, которые определят одобрение на рынке.
активного Исследования контроля
Во многих случаях давать плацебо человеку, страдающему от заболевания, может быть неэтично. [48] Чтобы решить эту проблему, стало обычной практикой проводить испытания «активного сравнения» (также известного как «активный контроль»). В исследованиях с активной контрольной группой субъектам назначают либо экспериментальное лечение, либо ранее одобренное лечение с известной эффективностью.
Главный протокол [ править ]
В таких исследованиях в рамках одного испытания тестируются несколько экспериментальных методов лечения. Генетическое тестирование позволяет исследователям группировать пациентов в соответствии с их генетическим профилем, доставлять лекарства на основе этого профиля этой группе и сравнивать результаты. В проекте могут участвовать несколько компаний, каждая из которых предлагает свой препарат. Первый такой подход нацелен на плоскоклеточный рак , который включает в себя различные генетические нарушения у разных пациентов. В проекте участвуют компании Amgen, AstraZeneca и Pfizer. Они впервые работали вместе на поздней стадии исследования. Пациенты, чьи геномные профили не совпадают ни с одним из исследуемых препаратов, получают препарат, предназначенный для стимуляции иммунной системы для борьбы с раком. [49]
Протокол клинических испытаний [ править ]
Протокол клинического исследования — это документ, используемый для определения и управления исследованием. Его готовит группа экспертов. Ожидается, что все исследователи исследования будут строго соблюдать протокол.
Протокол описывает научное обоснование, цель(и), дизайн, методологию, статистические соображения и организацию запланированного исследования. Подробности судебного разбирательства представлены в документах, упомянутых в протоколе, например в брошюре исследователя .
Протокол содержит точный план исследования, призванный обеспечить безопасность и здоровье участников исследования, а также предоставить точный шаблон для проведения исследования исследователями. Это позволяет объединять данные всех следователей/объектов. Протокол также информирует администраторов исследования (часто контрактную исследовательскую организацию ).
Формат и содержание протоколов клинических исследований, спонсируемых фармацевтическими, биотехнологическими компаниями или компаниями по производству медицинского оборудования в США, Европейском Союзе или Японии, стандартизированы в соответствии с рекомендациями надлежащей клинической практики. [50] выпущен Международной конференцией по гармонизации технических требований для регистрации фармацевтических препаратов для использования человеком (ICH). [51] Регулирующие органы в Канаде и Австралии также следуют рекомендациям ICH. Такие журналы, как Trials , поощряют следователей публиковать свои протоколы.
Особенности конструкции [ править ]
Информированное согласие [ править ]

В клинических испытаниях испытуемые набираются для подписания документа, подтверждающего их « информированное согласие ». [52] Документ включает такие детали, как его цель, продолжительность, необходимые процедуры, риски, потенциальные выгоды, ключевые контакты и институциональные требования. [53] Затем участник решает, подписывать ли документ. Документ не является договором, так как участник может выйти в любой момент без штрафных санкций.
Информированное согласие — это юридический процесс, в ходе которого новобранец информируется о ключевых фактах, прежде чем принять решение об участии. [52] Исследователи объясняют детали исследования понятным для субъекта языком. Информация представлена на родном языке испытуемого. Как правило, дети не могут самостоятельно предоставить информированное согласие, но в зависимости от их возраста и других факторов от них может потребоваться предоставление информированного согласия.
мощность Статистическая
В любом клиническом исследовании количество участников, также называемое размером выборки, оказывает большое влияние на способность надежно выявлять и измерять эффекты вмешательства. Эта способность описывается как его « сила », которую необходимо рассчитать перед началом исследования, чтобы выяснить, стоит ли исследование затраченных средств. [54] В целом, больший размер выборки увеличивает статистическую мощность, а также стоимость.
Статистическая мощность оценивает способность исследования обнаружить разницу определенного размера (или большего) между экспериментальной и контрольной группами. Например, исследование гиполипидемического препарата по сравнению с плацебо с участием 100 пациентов в каждой группе может иметь мощность 0,90 для обнаружения разницы между плацебо и экспериментальными группами, получающими дозу 10 мг/дл или более, но только 0,70 для выявления разница 6 мг/дл.
Группы плацебо
Простое лечение может иметь неспецифические эффекты. Это контролируется путем включения пациентов, получающих только плацебо. Субъектов распределяют случайным образом, не сообщая им, к какой группе они принадлежат. Многие исследования являются двойными слепыми, поэтому исследователи не знают, к какой группе относят испытуемого.
Назначение субъекта в группу плацебо может создать этическую проблему, если оно нарушает его или ее право на получение наилучшего доступного лечения. содержит Хельсинкская декларация руководящие принципы по этому вопросу.
Продолжительность [ править ]

Клинические испытания — это лишь малая часть исследований, направленных на разработку нового метода лечения. Например, потенциальные лекарства сначала должны быть обнаружены, очищены, охарактеризованы и протестированы в лабораториях (в исследованиях на клетках и животных), прежде чем они начнут проходить клинические испытания. В общей сложности около 1000 потенциальных лекарств тестируются, прежде чем хотя бы один из них достигнет стадии клинического испытания. [55] Например, новое лекарство от рака в среднем проходит шесть лет исследований, прежде чем оно дойдет до клинических испытаний. Но основная проблема в создании новых лекарств от рака — это время, необходимое для завершения самих клинических испытаний. В среднем проходит около восьми лет с момента, когда лекарство от рака проходит клинические испытания, до того, как оно получит одобрение регулирующих органов для продажи населению. [56] Лекарства от других заболеваний имеют схожие сроки.
Некоторые причины, по которым клинические испытания могут длиться несколько лет:
- В случае хронических заболеваний, таких как рак, требуются месяцы, если не годы, чтобы увидеть, оказывает ли лечение рака влияние на пациента.
- Для лекарств, от которых не ожидается сильного эффекта (это означает, что для наблюдения «любого» эффекта необходимо набрать большое количество пациентов), набор достаточного количества пациентов для проверки эффективности препарата (т. е. получения статистической достоверности) может занять несколько лет.
- Только определенные люди, у которых есть целевое заболевание, имеют право принимать участие в каждом клиническом исследовании. В исследовании должны участвовать исследователи, которые лечат этих конкретных пациентов. Затем они должны определить желаемых пациентов и получить согласие от них или их семей на участие в исследовании.
Клиническое исследование может также включать расширенный период наблюдения после исследования от месяцев до лет для людей, принимавших участие в исследовании, так называемую «фазу продления», целью которой является определение долгосрочного воздействия лечения. [57]
Самым большим препятствием для завершения обучения является нехватка людей, которые принимают в нем участие. Все испытания лекарств и многих устройств нацелены на определенную часть населения, а это означает, что не каждый может принять в них участие. Некоторые испытания лекарств требуют, чтобы у пациентов были необычные комбинации характеристик заболевания. Найти подходящих пациентов и получить их согласие непросто, особенно если они не могут получить прямой выгоды (поскольку им не платят, эффективность исследуемого препарата еще не доказана или пациент может получать плацебо). Что касается больных раком, менее 5% взрослых больных раком будут участвовать в испытаниях лекарств. По данным Американского агентства фармацевтических исследований и производителей (PhRMA), в 2005 году в клинических испытаниях проходило около 400 противораковых лекарств. участников настолько мало. [58]
Для клинических испытаний, включающих потенциал сезонных влияний (таких как аллергия, передающаяся воздушно-капельным путем , сезонное аффективное расстройство , грипп и кожные заболевания ), исследование может проводиться в течение ограниченной части года (например, весной при аллергии на пыльцу), когда препарат может быть протестирован. [59] [60]
Клинические испытания, в которых не используется новый препарат, обычно имеют гораздо более короткую продолжительность. (Исключением являются эпидемиологические исследования, такие как исследование здоровья медсестер ).
Администрация [ править ]
Клинические испытания, разработанные местным исследователем, и (в США) клинические испытания, финансируемые из федерального бюджета, почти всегда проводятся исследователем, который разработал исследование и подал заявку на грант. Небольшие исследования устройств могут проводиться компанией-спонсором. Клинические испытания новых лекарств обычно проводятся контрактной исследовательской организацией (CRO), нанятой компанией-спонсором. Спонсор обеспечивает препарат и медицинский надзор. С CRO заключен контракт на выполнение всей административной работы по клиническому исследованию. На этапах II–IV CRO набирает участвующих исследователей, обучает их, обеспечивает их расходными материалами, координирует администрирование исследования и сбор данных , назначает встречи, контролирует учреждения на предмет соблюдения клинического протокола и обеспечивает спонсору получение данных из каждого учреждения. Также можно нанять специализированные организации по управлению объектами для координации действий с CRO, чтобы обеспечить быстрое одобрение IRB/IEC, а также более быстрое открытие объекта и набор пациентов. Фаза Клинические испытания новых лекарств часто проводятся в специализированной клинике клинических исследований под руководством специализированных фармакологов, где за пациентами может наблюдать штатный персонал. Этими клиниками часто управляет CRO, специализирующийся на этих исследованиях.
В участвующем учреждении большую часть работы по проведению клинического исследования выполняют один или несколько научных сотрудников (часто медсестер). Работа ассистента-исследователя может включать некоторые или все из следующих действий: предоставление местному институциональному наблюдательному совету (IRB) документации, необходимой для получения разрешения на проведение исследования, помощь в запуске исследования, выявление подходящих пациентов, получение от них согласия. или их семьям, назначением исследуемого лечения, сбором и статистическим анализом данных, ведением и обновлением файлов данных во время последующего наблюдения и общением с IRB, а также со спонсором и CRO.
Качество [ править ]
В контексте клинического исследования качество обычно означает отсутствие ошибок, которые могут повлиять на принятие решений как во время проведения исследования, так и при использовании его результатов. [61]
Маркетинг [ править ]
Модель интерактивного правосудия можно использовать для проверки последствий готовности поговорить с врачом о наборе пациентов в клинические исследования. [62] Результаты показали, что потенциальные кандидаты на клинические испытания с меньшей вероятностью будут участвовать в клинических испытаниях, если пациент с большей готовностью разговаривает со своим врачом. Причиной этого открытия может быть то, что пациенты довольны своим нынешним лечением. Еще одной причиной отрицательной связи между воспринимаемой справедливостью и участием в клинических исследованиях является отсутствие независимости от поставщика медицинских услуг. Результаты показали, что существует положительная связь между отсутствием желания поговорить со своим врачом и участием в клинических исследованиях. Отсутствие желания обсуждать клинические испытания с нынешними поставщиками медицинских услуг может быть связано с независимостью пациентов от врача. Пациенты, которые реже рассказывают о клинических исследованиях, более охотно используют другие источники информации, чтобы лучше понять альтернативные методы лечения. Набор участников клинических исследований должен быть мотивирован на использование веб-сайтов и телевизионной рекламы для информирования общественности о наборе участников на клинические исследования.
Информационные технологии [ править ]
За последнее десятилетие наблюдалось распространение использования информационных технологий при планировании и проведении клинических исследований. Системы управления клиническими исследованиями часто используются спонсорами исследований или CRO, чтобы помочь планировать и управлять операционными аспектами клинического исследования, особенно в отношении исследовательских центров. Расширенная аналитика для выявления исследователей и исследовательских центров, обладающих опытом в определенной области, использует общедоступную и частную информацию о текущих исследованиях. [63] управления клиническими данными через Интернет. электронного сбора данных (EDC) и системы В большинстве клинических исследований используются [64] для сбора данных о случаях заболевания с сайтов, управления их качеством и подготовки к анализу. Интерактивные системы голосового ответа используются сайтами для регистрации регистрации пациентов с помощью телефона и распределения пациентов по определенному направлению лечения (хотя телефоны все чаще заменяются веб-инструментами (IWRS), которые иногда являются частью системы EDC). . Хотя в прошлом результаты, сообщаемые пациентами, часто основывались на бумажных носителях, измерения все чаще собираются с использованием веб-порталов или портативных устройств ePRO (или eDiary), иногда беспроводных. [65] Статистическое программное обеспечение используется для анализа собранных данных и подготовки их для подачи в регулирующие органы. Доступ ко многим из этих приложений все чаще агрегируется на веб- порталах клинических исследований . В 2011 году FDA одобрило исследование фазы I, в котором использовался телемониторинг, также известный как удаленный мониторинг пациентов, для сбора биометрических данных в домах пациентов и передачи их в электронном виде в базу данных исследования. Эта технология предоставляет гораздо больше данных и гораздо более удобна для пациентов, поскольку они реже посещают центры испытаний.
Анализ [ править ]
Клиническое исследование дает данные, которые могут выявить количественные различия между двумя или более вмешательствами; Статистический анализ используется для определения того, являются ли такие различия правдивыми, случайными или они аналогичны отсутствию лечения (плацебо). [66] [67] Данные клинического исследования накапливаются постепенно в течение всего периода исследования, от месяцев до лет. [52] Соответственно, результаты участников, набранных на ранних стадиях исследования, становятся доступными для анализа, пока субъектов все еще распределяют по группам лечения в исследовании. Ранний анализ может позволить появляющимся доказательствам помочь принять решение о прекращении исследования или переводе участников в более успешный сегмент исследования. [66] Исследователи также могут захотеть остановить исследование, если анализ данных не показывает эффекта лечения. [67]
аспекты Этические
Клинические испытания тщательно контролируются соответствующими регулирующими органами. Все исследования, включающие медицинское или терапевтическое вмешательство на пациентах, должны быть одобрены комитетом по надзору за этикой, прежде чем будет дано разрешение на проведение исследования. Местный комитет по этике имеет право по своему усмотрению контролировать неинтервенционные исследования (наблюдательные исследования или исследования, использующие уже собранные данные). В США этот орган называется Институциональным наблюдательным советом (IRB); в ЕС их называют комитетами по этике . Большинство IRB расположены в больнице или учреждении местного исследователя, но некоторые спонсоры разрешают использовать центральный (независимый/коммерческий) IRB для исследователей, которые работают в небольших учреждениях.
Чтобы быть этичными, исследователи должны получить полное и информированное согласие участвующих людей. (Одна из основных функций IRB — обеспечить адекватное информирование потенциальных пациентов о клиническом исследовании.) Если пациент не может дать согласие от себя, исследователи могут запросить согласие у законного представителя пациента. Кроме того, участники клинического исследования должны быть проинформированы о том, что они могут выйти из клинического исследования в любое время без каких-либо неблагоприятных действий против них. [68] В Калифорнии штат отдает приоритет лицам, которые могут выступать в качестве законных представителей. [69]
В некоторых регионах США местный IRB должен сертифицировать исследователей и их сотрудников, прежде чем они смогут проводить клинические испытания. Они должны понимать федеральный закон о конфиденциальности пациентов ( HIPAA ) и надлежащую клиническую практику. Международная конференция по гармонизации руководящих принципов надлежащей клинической практики представляет собой набор стандартов, используемых на международном уровне для проведения клинических исследований. Руководящие принципы направлены на обеспечение «защиты прав, безопасности и благополучия субъектов испытаний».
Понятие информированного согласия участвующих людей существует во многих странах, но его точное определение может различаться.
Информированное согласие, очевидно, является «необходимым» условием этического поведения, но не «обеспечивает» этическое поведение. В ходе испытаний сострадательного использования последнее становится особенно сложной проблемой. Конечная цель — служить сообществу пациентов или будущих пациентов наилучшим и наиболее ответственным образом. См. также Расширенный доступ . Однако может быть сложно превратить эту цель в четко определенную, количественную целевую функцию. Однако в некоторых случаях это можно сделать, например, для вопросов о том, когда прекратить последовательные обработки (см. Алгоритм шансов ), и тогда количественные методы могут сыграть важную роль.
Дополнительные этические проблемы возникают при проведении клинических исследований на детях ( педиатрия ), а также в чрезвычайных или эпидемических ситуациях. [70] [71]
Этический баланс прав нескольких заинтересованных сторон может быть трудным. Например, если испытания лекарства терпят неудачу, спонсоры могут быть обязаны немедленно сообщить об этом нынешним и потенциальным инвесторам, а это означает, что и исследовательский персонал, и зарегистрированные участники могут сначала узнать об окончании испытания из публичных деловых новостей . [72]
интересов и неблагоприятные Конфликты исследования
В ответ на конкретные случаи, когда неблагоприятные данные исследований, спонсируемых фармацевтическими компаниями, не публиковались, Фармацевтические исследования и производители Америки опубликовали новые рекомендации, призывающие компании сообщать обо всех результатах и ограничивать финансовое участие исследователей в фармацевтических компаниях. [73] Конгресс США подписал закон, который требует, чтобы клинические испытания фазы II и III регистрировались спонсором на веб-сайте Clinicaltrials.gov, созданном Национальными институтами здравоохранения . [74]
Исследователи лекарств, не работающие напрямую в фармацевтических компаниях, часто ищут гранты у производителей, а производители часто обращаются к академическим исследователям для проведения исследований в сетях университетов и их больниц, например, для трансляционных исследований рака. Аналогичным образом, конкуренция за постоянные академические должности, государственные гранты и престиж создают конфликты интересов среди ученых-академиков. [75] Согласно одному исследованию, примерно 75% статей, отозванных по причинам, связанным с неправомерным поведением, не имеют заявленной финансовой поддержки со стороны отрасли. [76] испытания посева . Особые споры вызывают [77]
В Соединенных Штатах все клинические испытания, представленные в FDA в рамках процесса утверждения лекарств, проходят независимую оценку клинических экспертов Управления по контролю за продуктами и лекарствами. [78] включая проверки сбора первичных данных в отдельных центрах клинических исследований. [79]
В 2001 году редакторы 12 крупных журналов опубликовали совместную редакционную статью, опубликованную в каждом журнале, о контроле за клиническими исследованиями, проводимыми спонсорами, в частности, касаясь использования контрактов, которые позволяют спонсорам просматривать исследования до публикации и воздерживаться от публикации. Они усилили редакционные ограничения, чтобы противостоять этому эффекту. В редакционной статье отмечалось, что к 2000 году контрактные исследовательские организации получили 60% грантов от фармацевтических компаний США. Исследователям может быть запрещено участвовать в разработке дизайна исследования, получать доступ к необработанным данным и интерпретировать результаты. [80]
Несмотря на явные рекомендации заинтересованных сторон о мерах по улучшению стандартов медицинских исследований, спонсируемых промышленностью, [81] В 2013 году Тоэн предупредил о сохранении пробела в достоверности выводов, вытекающих из клинических испытаний, финансируемых промышленностью, и призвал обеспечить строгое соблюдение этических стандартов в промышленном сотрудничестве с научными кругами, чтобы избежать дальнейшей эрозии доверия общественности. [82] Вопросы, требующие внимания в этом отношении, включают потенциальную систематическую ошибку наблюдения, продолжительность времени наблюдения для поддерживающих исследований, выбор популяции пациентов, факторы, влияющие на реакцию плацебо, и источники финансирования. [83] [84] [85]
здравоохранения кризиса Во время общественного
Проведение клинических испытаний вакцин во время эпидемий и пандемий сопряжено с этическими проблемами. Для болезней с высоким уровнем смертности, таких как Эбола, отнесение людей к группе плацебо или контрольной группе может рассматриваться как смертный приговор. В ответ на этические проблемы, связанные с клиническими исследованиями во время эпидемий, Национальная академия медицины подготовила отчет, в котором указаны семь этических и научных соображений. Эти соображения таковы: [86]
- Научная ценность
- Социальная ценность
- Уважение к личности
- Участие сообщества
- Забота о благополучии и интересах участников
- Баланс между выгодой и риском
- Пост-испытательный доступ к проверенным методам лечения, которые были закрыты во время исследования
Беременные женщины и дети [ править ]
Беременных женщин и детей обычно исключают из клинических исследований как уязвимые группы населения, хотя данные, подтверждающие их исключение, не являются надежными. Исключая их из клинических испытаний, информация о безопасности и эффективности терапии для этих групп населения часто отсутствует. На заре эпидемии ВИЧ/СПИДа один ученый заметил, что, исключая эти группы из потенциально жизненно важного лечения, они были «защищены до смерти». Такие проекты, как «Этика исследований вакцин, эпидемий и новых технологий» (ПРЕВЕНТ), выступают за этическое включение беременных женщин в испытания вакцин. Включение детей в клинические испытания имеет дополнительные моральные соображения, поскольку детям не хватает самостоятельности в принятии решений. В прошлом испытания подвергались критике за использование госпитализированных детей или сирот; эти этические проблемы фактически остановили будущие исследования. Стремясь поддерживать эффективную педиатрическую помощь, некоторые европейские страны и США проводят политику, направленную на то, чтобы побудить или заставить фармацевтические компании проводить педиатрические исследования. Международные руководства рекомендуют проводить этические педиатрические исследования, ограничивая вред, учитывая различные риски и принимая во внимание сложности педиатрической помощи. [86]
Безопасность [ править ]
Ответственность за безопасность субъектов в клиническом исследовании распределяется между спонсором, местными исследователями (если они отличаются от спонсора), различными IRB, которые контролируют исследование, и (в некоторых случаях, если в исследовании используется коммерческий препарат) или устройство), регулирующий орган страны, где будет продаваться препарат или устройство.
Для обеспечения безопасности участников исследования часто используется систематический одновременный анализ безопасности. Проведение и текущий обзор должны быть пропорциональны риску, связанному с испытанием. Обычно эту роль выполняет Комитет по данным и безопасности , назначенный извне наблюдатель за медицинской безопасностью. [87] Независимый специалист по безопасности или, в случае небольших исследований или исследований с низким уровнем риска, главный исследователь. [88]
Из соображений безопасности многие клинические испытания лекарств [89] предназначены для исключения женщин детородного возраста, беременных женщин или женщин, которые забеременели во время исследования. В некоторых случаях партнеры-мужчины этих женщин также исключаются или обязаны принимать меры контроля над рождаемостью.
Спонсор [ править ]
На протяжении всего клинического исследования спонсор несет ответственность за точное информирование местных исследователей об истинных исторических данных о безопасности препарата, устройства или других медицинских методов лечения, подлежащих тестированию, а также о любых потенциальных взаимодействиях исследуемого препарата(ов) с уже одобренными препаратами. методы лечения. Это позволяет местным исследователям принять обоснованное решение о том, участвовать ли в исследовании или нет. Спонсор также несет ответственность за мониторинг результатов исследования по мере их поступления из различных учреждений по мере проведения исследования. В более крупных клинических исследованиях спонсор будет пользоваться услугами комитета по мониторингу данных (DMC, известного в США как совет по мониторингу безопасности данных). Эта независимая группа клиницистов и статистиков периодически встречается для рассмотрения открытых данных, полученных спонсором на данный момент. DMC имеет право рекомендовать прекращение исследования на основании своего обзора, например, если исследуемый препарат вызывает больше смертей, чем стандартное лечение, или кажется, что он вызывает неожиданные и серьезные последствия, связанные с исследованием. неблагоприятные события . Спонсор несет ответственность за сбор отчетов о нежелательных явлениях от всех исследователей, участвующих в исследовании, а также за информирование всех исследователей о заключении спонсора относительно того, были ли эти нежелательные явления связаны или не связаны с исследуемым лечением.
Спонсор и местные исследователи несут совместную ответственность за составление информированного согласия для конкретного участка , которое точно информирует потенциальных субъектов об истинных рисках и потенциальных преимуществах участия в исследовании, в то же время представляя материал как можно более кратко и на обычном языке. В правилах FDA говорится, что участие в клинических исследованиях является добровольным, при этом субъект имеет право не участвовать или прекратить участие в любое время. [90]
Местные следователи [ править ]
В исследовании используется этический принцип primum non-nocere («прежде всего, не навреди»), и если исследователь считает, что исследуемое лечение может причинить вред субъектам исследования, он может прекратить участие в исследовании в любое время. С другой стороны, следователи часто имеют финансовую заинтересованность в привлечении субъектов и могут действовать неэтично, чтобы добиться и сохранить их участие.
Местные исследователи несут ответственность за проведение исследования в соответствии с протоколом исследования и контроль за персоналом, проводящим исследование, на протяжении всего исследования. Местный исследователь или его/ее исследовательский персонал также несут ответственность за обеспечение понимания потенциальными участниками исследования рисков и потенциальных преимуществ участия в исследовании. Другими словами, они (или их законные представители) должны дать действительно осознанное согласие.
Местные исследователи несут ответственность за рассмотрение всех отчетов о нежелательных явлениях, отправленных спонсором. Эти отчеты о нежелательных явлениях содержат мнения как исследователя (в месте, где произошло нежелательное явление), так и спонсора относительно связи нежелательного явления с исследуемым лечением. Местные исследователи также несут ответственность за вынесение независимого заключения по этим отчетам и оперативное информирование местного IRB обо всех серьезных и связанных с исследуемым лечением нежелательных явлениях.
Если спонсором является местный исследователь, формальных отчетов о нежелательных явлениях может не быть, но персонал исследования во всех местах несет ответственность за информирование исследователя-координатора о любых неожиданных событиях. Местный исследователь несет ответственность за предоставление правдивой информации местному IRB во всех сообщениях, касающихся исследования.
Институциональные наблюдательные советы (IRB) [ править ]
одобрение Институционального наблюдательного совета (IRB) или Независимого комитета по этике Прежде чем начать любое исследование, кроме самого неформального, необходимо (IEC). В коммерческих клинических исследованиях протокол исследования не утверждается IRB до того, как спонсор наберет места для проведения исследования. Однако протокол и процедуры исследования были адаптированы в соответствии с общими требованиями к подаче заявок в IRB. В этом случае и при отсутствии независимого спонсора каждый местный исследователь представляет протокол исследования, согласие(я), формы сбора данных и подтверждающую документацию в местный ЭСО. Университеты и большинство больниц имеют собственные IRB. Другие исследователи (например, в поликлиниках) используют независимые IRB.
IRB тщательно проверяет исследование как на предмет медицинской безопасности, так и на предмет защиты пациентов, участвующих в исследовании, прежде чем разрешить исследователю начать исследование. Это может потребовать внесения изменений в процедуры исследования или в объяснения, данные пациенту. Требуемый ежегодный отчет о «постоянном обзоре» исследователя информирует IRB о ходе исследования и любой новой информации о безопасности, связанной с исследованием.
Регулирующие органы [ править ]
В США FDA может проверять файлы местных исследователей после того, как они завершили участие в исследовании, чтобы проверить, правильно ли они следовали процедурам исследования. Такая проверка может быть выборочной или поводовой (поскольку следователь подозревается в подтасовке данных). Уклонение от проверки является для следователей стимулом следовать процедурам исследования. «Покрываемое клиническое исследование» относится к исследованию, поданному в FDA как часть маркетинговой заявки (например, как часть NDA или 510 (k) ), в отношении которого FDA может потребовать раскрытия финансового интереса клинического исследователя. в результате исследования. Например, заявитель должен раскрыть, владеет ли исследователь долей в спонсоре или имущественной долей в исследуемом продукте. FDA определяет контролируемое исследование как «... любое исследование лекарственного средства, биологического продукта или устройства на людях, представленное в маркетинговой заявке или петиции о реклассификации, на которое заявитель или FDA опирается для установления эффективности продукта (включая исследования, которые показывают эквивалентность эффективного продукта) или любое исследование, в котором один исследователь вносит значительный вклад в демонстрацию безопасности». [91]
Альтернативно, многие американские фармацевтические компании перенесли некоторые клинические испытания за границу. Преимущества проведения исследований за рубежом включают более низкие затраты (в некоторых странах) и возможность проводить более крупные исследования в более короткие сроки, тогда как потенциальный недостаток заключается в более низком качестве управления исследованиями. [92] В разных странах действуют разные нормативные требования и возможности правоприменения. По оценкам, 40% всех клинических испытаний сейчас проводятся в Азии, Восточной Европе, Центральной и Южной Америке. «В этих странах нет системы обязательной регистрации клинических испытаний, и многие из них не следуют европейским директивам в своей деятельности», — говорит Джейкоб Сийтсма из нидерландской WEMOS, правозащитной медицинской организации, отслеживающей клинические испытания в развивающихся странах. [93]
Начиная с 1980-х годов, гармонизация протоколов клинических испытаний оказалась осуществимой во всех странах Европейского Союза. В то же время координация между Европой, Японией и Соединенными Штатами привела к совместной инициативе регуляторной отрасли по международной гармонизации, названной в честь 1990 года Международной конференцией по гармонизации технических требований к регистрации фармацевтических препаратов для использования человеком (ICH). [94] В настоящее время большинство программ клинических исследований следуют рекомендациям ICH, направленным на «обеспечение того, чтобы качественные, безопасные и эффективные лекарства разрабатывались и регистрировались наиболее эффективным и экономически выгодным способом. Эта деятельность осуществляется в интересах потребителей и общественного здравоохранения». предотвратить ненужное дублирование клинических испытаний на людях и свести к минимуму использование испытаний на животных без ущерба для нормативных обязательств по безопасности и эффективности». [95]
Агрегация данных по безопасности в ходе клинической разработки [ править ]
Обобщение данных о безопасности клинических испытаний во время разработки лекарств важно, поскольку исследования обычно проводятся с целью определить, насколько хорошо действует препарат. Данные о безопасности, собранные и обобщенные в ходе многочисленных исследований по мере разработки препарата, позволяют спонсору, исследователям и регулирующим органам отслеживать совокупный профиль безопасности экспериментальных лекарств по мере их разработки. Ценность оценки совокупных данных о безопасности заключается в том, что: а) решения, основанные на совокупной оценке безопасности во время разработки лекарственного средства, могут быть приняты на протяжении всей разработки лекарственного средства и б) это дает спонсору и регулирующим органам хорошую подготовку для оценки безопасности лекарственного средства после его утверждения. . [96] [97] [98] [99] [100]
Экономика [ править ]
Стоимость клинических исследований варьируется в зависимости от фазы исследования, типа исследования и изучаемого заболевания. Исследование клинических испытаний, проведенных в США с 2004 по 2012 год, показало, что средняя стоимость исследований фазы I составляет от 1,4 до 6,6 миллионов долларов, в зависимости от типа заболевания. Стоимость испытаний фазы II варьировалась от 7 до 20 миллионов долларов, а испытаний фазы III — от 11 до 53 миллионов долларов. [101]
Спонсор [ править ]
Стоимость исследования зависит от многих факторов, особенно от количества центров, проводящих исследование, количества участвующих пациентов и того, одобрено ли уже исследуемое лечение для медицинского использования.
Расходы, понесенные фармацевтической компанией при проведении клинических исследований фазы III или IV, могут включать, среди прочего:
- производство оцениваемого препарата(ов) или устройства(ий)
- зарплата дизайнеров и администраторов исследования
- выплаты контрактной исследовательской организации, организации по управлению объектом (если она используется) и любым внешним консультантам
- выплаты местным исследователям и их сотрудникам за время и усилия по набору испытуемых и сбору данных для спонсора
- стоимость учебных материалов и расходы на их доставку
- общение с местными исследователями, включая мониторинг на месте со стороны CRO до и (в некоторых случаях) несколько раз во время исследования
- одно или несколько учебных совещаний для следователей
- расходы, понесенные местными исследователями, такие как сборы за аптеку, сборы IRB и почтовые расходы.
- любые выплаты субъектам, участвующим в исследовании
- расходы на лечение испытуемого, у которого развилось заболевание, вызванное исследуемым препаратом
Эти расходы производятся в течение нескольких лет.
В США спонсоры могут получить 50-процентную налоговую льготу за клинические испытания лекарств, разрабатываемых для лечения орфанных заболеваний . [102] Национальные агентства здравоохранения, такие как Национальные институты здравоохранения США , предлагают гранты исследователям, которые разрабатывают клинические испытания, которые пытаются ответить на исследовательские вопросы, интересующие агентство. В этих случаях исследователь, который выдает грант и проводит исследование, выступает в качестве спонсора и координирует сбор данных с любых других сайтов. Этим другим сайтам может быть оплачено или не оплачено участие в исследовании, в зависимости от суммы гранта и ожидаемых от них усилий. Использование интернет-ресурсов может в некоторых случаях снизить экономическое бремя. [103]
Следователи [ править ]
Исследователи часто получают вознаграждение за свою работу в клинических исследованиях. Эти суммы могут быть небольшими, покрывая лишь частичную зарплату ассистентов и стоимость любых расходных материалов (обычно в случае исследований национальных агентств здравоохранения), или быть значительными и включать «накладные расходы», которые позволяют исследователю платить исследовательскому персоналу в периоды времени. между клиническими испытаниями. [ нужна ссылка ]
Предметы [ править ]
Участники I фазы испытаний лекарств не получают от участия никакой прямой пользы для здоровья. Обычно им платят за потраченное время, причем выплаты регулируются и не связаны с каким-либо риском. Мотивация здоровых добровольцев не ограничивается финансовым вознаграждением и может включать в себя и другие мотивы, такие как вклад в науку и другие. [104] На более поздних стадиях испытаний испытуемым могут не платить за обеспечение их мотивации к участию с потенциальной пользой для здоровья или вкладом в медицинские знания. Небольшие выплаты могут быть произведены для покрытия расходов, связанных с исследованием, таких как транспортные расходы, или в качестве компенсации за время, потраченное на предоставление последующей информации о своем здоровье после окончания пробного лечения.
Набор участников и участие [ править ]

Для испытаний лекарств фазы 0 и фазы I требуются здоровые добровольцы. В большинстве других клинических испытаний участвуют пациенты, страдающие определенным заболеванием или состоянием здоровья. Разнообразие, наблюдаемое в обществе, должно быть отражено в клинических исследованиях посредством надлежащего включения этнических меньшинств . [105] Набор пациентов или набор участников играет значительную роль в деятельности и обязанностях центров, проводящих клинические исследования. [106]
Все добровольцы, рассматриваемые для участия в исследовании, обязаны пройти медицинский осмотр. Требования различаются в зависимости от потребностей исследования, но обычно добровольцев проверяют в медицинской лаборатории на: [107]
- Измерение электрической активности сердца (ЭКГ)
- Измерение артериального давления, частоты сердечных сокращений и температуры тела
- Забор крови
- Забор мочи
- Измерение веса и роста
- Тестирование на злоупотребление наркотиками
- Тест на беременность
Было замечено, что участники клинических испытаний непропорционально белые. [108] [109] Зачастую меньшинства не информируют о клинических испытаниях. [110] Один недавний систематический обзор литературы показал, что раса/этническая принадлежность, а также пол не были широко представлены и иногда даже не отслеживались в качестве участников в большом количестве клинических исследований по лечению потери слуха у взрослых. [111] Это может снизить достоверность результатов в отношении небелых пациентов. [112] не представляя адекватно большую часть населения .
Поиск испытаний [ править ]
В зависимости от требуемого типа участников спонсоры клинических исследований или контрактные исследовательские организации, работающие от их имени, стараются найти места с квалифицированным персоналом, а также доступ к пациентам, которые могли бы принять участие в исследовании. Работая с этими сайтами, они могут использовать различные стратегии набора персонала, включая базы данных пациентов, рекламу в газетах и радио, листовки, плакаты в местах, куда пациенты могут пойти (например, в кабинеты врачей), а также личный набор пациентов исследователями.
Добровольцы с особыми заболеваниями или заболеваниями имеют дополнительные онлайн-ресурсы, которые помогут им найти клинические испытания. Например, Fox Trial Finder объединяет исследования болезни Паркинсона по всему миру с добровольцами, имеющими определенный набор критериев, таких как местоположение, возраст и симптомы. [113] Существуют и другие службы, специализирующиеся на конкретных заболеваниях, позволяющие добровольцам найти исследования, связанные с их состоянием. [114] Добровольцы могут осуществлять поиск клинических испытаний непосредственно на сайте ClinicalTrials.gov, используя реестр, который ведется Национальными институтами здравоохранения США и Национальной медицинской библиотекой . Существует также программное обеспечение, которое позволяет клиницистам находить варианты испытаний для отдельного пациента на основе таких данных, как геномные данные. [115]
Исследования [ править ]

Модель поиска и обработки информации о рисках (RISP) анализирует социальные последствия, которые влияют на отношение и принятие решений, касающихся клинических испытаний. [116] Люди, которые более заинтересованы в лечении, проводимом в рамках клинических исследований, с большей вероятностью будут искать информацию о клинических исследованиях. Больные раком сообщали о более оптимистичном отношении к клиническим испытаниям, чем население в целом. Более оптимистичный взгляд на клинические испытания также приводит к большей вероятности участия в них. [116]
Соответствие [ править ]
Сопоставление включает систематическое сравнение клинической и демографической информации пациента с критериями отбора различных исследований. Методы включают в себя:
- Руководство: Медицинские работники или координаторы клинических исследований вручную просматривают записи пациентов и доступные критерии исследования, чтобы выявить потенциальные совпадения. [117] Это также может включать ручной поиск в базах данных клинических исследований. [118]
- Электронные медицинские карты (ЭМК). Некоторые системы интегрируются с электронными медицинскими документами, чтобы автоматически отмечать пациентов, которые могут иметь право на участие в исследованиях, на основе их медицинских данных. Эти системы могут использовать методы машинного обучения , искусственного интеллекта или точной медицины для более эффективного подбора пациентов для участия в исследованиях. [119] Эти методы сталкиваются с проблемой преодоления ограничений записей EHR, таких как пропуски и ошибки регистрации.
- Услуги, ориентированные непосредственно на пациентов. Ресурсы специализируются на оказании помощи пациентам в поиске клинических испытаний через онлайн-платформы, горячие линии и персонализированную поддержку. [117] [118] [120]
Децентрализованные испытания [ править ]
Хотя исследования обычно проводятся в крупных медицинских центрах, некоторые участники исключаются из них из-за расстояния и расходов, необходимых для поездки, что приводит к трудностям, невыгодному состоянию и неравенству для участников, особенно тех, кто проживает в сельских и недостаточно обслуживаемых общинах. В 21 веке предпринимаются усилия по сбору информации в доме участника, и эта возможность улучшается благодаря телемедицине и портативным технологиям . [121]
См. также [ править ]
Ссылки [ править ]
- ↑ Перейти обратно: Перейти обратно: а б с «Клинические исследования НИЗ и вы: основы» . Национальные институты здравоохранения США. 3 октября 2022 года. Архивировано из оригинала 22 апреля 2020 года . Проверено 7 ноября 2022 г.
- ^ «Клинические испытания» (PDF) . Фонд Билла и Мелинды Гейтс. Архивировано (PDF) из оригинала 12 января 2017 года . Проверено 1 января 2014 г.
- ^ Димаси, Джозеф А; Грабовски, Генри Дж.; Хансен, Рональд В. (2016). «Инновации в фармацевтической промышленности: новые оценки затрат на НИОКР». Журнал экономики здравоохранения . 47 : 20–33. дои : 10.1016/j.jhealeco.2016.01.012 . hdl : 10161/12742 . ПМИД 26928437 .
- ^ «Процесс разработки лекарств. Шаг 3: Клинические исследования» . Управление по контролю за продуктами и лекарствами США. 4 января 2018 года . Проверено 9 марта 2024 г.
- ^ «Сколько времени нужно новому лекарству, чтобы пройти клинические испытания» . Исследования рака, Великобритания. 1 февраля 2022 г. Проверено 9 марта 2024 г.
- ^ Эмануэль Э.Дж. (9 сентября 2015 г.). «Решение проблемы цен на лекарства» . Нью-Йорк Таймс . Архивировано из оригинала 5 декабря 2022 года . Проверено 26 февраля 2017 г.
Из лекарств, начатых в клинических испытаниях на людях, только 10 процентов получили одобрение FDA. ...
- ^ Страница FDA последнее обновление 25 апреля 2014 г. Процесс проверки лекарств FDA: продолжение. Архивировано 23 апреля 2019 г. на Wayback Machine.
- ^ ФРМА. , февраль 2007 г. Открытие и разработка лекарств Архивировано 10 апреля 2023 г. в Wayback Machine.
- ^ Руководство Merck. Последний полный обзор/пересмотр, октябрь 2013 г., автор Дэниел А. Хусар, доктор философии. Обзор лекарств, отпускаемых без рецепта. Архивировано 4 февраля 2015 г. в Wayback Machine.
- ^ Аворн Дж. (2004). Мощные лекарства , стр. 129–33. Альфред А. Кнопф.
- ^ Ван Сполл Х.Г., Торен А., Кисс А., Фаулер Р.А. (март 2007 г.). «Критерии отбора рандомизированных контролируемых исследований, опубликованных в влиятельных общемедицинских журналах: систематический выборочный обзор». ДЖАМА . 297 (11): 1233–40. дои : 10.1001/jama.297.11.1233 . ПМИД 17374817 .
- ↑ Перейти обратно: Перейти обратно: а б с д и ж г час я дж «Каковы различные типы клинических исследований?» . Управление по контролю за продуктами и лекарствами США. 2019. Архивировано из оригинала 12 июня 2019 года . Проверено 24 мая 2019 г.
- ^ Регулирующим органом в США является Управление по контролю за продуктами и лекарствами ; в Канаде – Министерство здравоохранения Канады ; в Европейском Союзе – Европейское агентство по лекарственным средствам ; а в Японии – Министерство здравоохранения, труда и социального обеспечения.
- ^ «Медицинские изделия, предпродажные клинические исследования для исключения исследуемых устройств» . Управление по контролю за продуктами и лекарствами США. 17 марта 2017 г. Архивировано из оригинала 1 ноября 2017 г. Проверено 2 октября 2017 г.
- ^ Ледерле Ф.А., Фрейшлаг Х.А., Кириакидес Т.К., Падберг Ф.Т., Мацумура Дж.С., Колер Т.Р., Лин П.Х., Жан-Клод Ж.М., Цикрит Д.Ф., Суонсон К.М., Педуцци П.Н. (октябрь 2009 г.). «Результаты эндоваскулярного и открытого лечения аневризмы брюшной аорты: рандомизированное исследование» . ДЖАМА . 302 (14): 1535–42. дои : 10.1001/jama.2009.1426 . ПМИД 19826022 .
- ^ Липп А., Шоу С., Главинд К. (декабрь 2014 г.). «Механические устройства для лечения недержания мочи у женщин» . Кокрановская база данных систематических обзоров . 2014 (12): CD001756. дои : 10.1002/14651858.CD001756.pub6 . ПМК 7061494 . ПМИД 25517397 .
- ^ Фаррохьяр Ф., Караниколас П.Дж., Тома А., Симунович М., Бхандари М., Деверо П.Дж., Анвари М., Адили А., Гаятт Г. (март 2010 г.). «Рандомизированные контролируемые исследования хирургических вмешательств». Анналы хирургии . 251 (3): 409–16. дои : 10.1097/SLA.0b013e3181cf863d . ПМИД 20142732 . S2CID 17084906 .
- ^ Метвалли, Мостафа; Рэйбоулд, Грейс; Чеонг, Ин С; Хорн, Эндрю В. (29 января 2020 г.). Кокрейновская группа по гинекологии и фертильности (ред.). «Хирургическое лечение миомы матки при бесплодии» . Кокрейновская база данных систематических обзоров . 2020 (1): CD003857. дои : 10.1002/14651858.CD003857.pub4 . ПМК 6989141 . ПМИД 31995657 .
- ^ Цао А.М., Кокс М.Р., Эслик Г.Д. (март 2016 г.). «План исследования в доказательной хирургии: какова роль исследований случай-контроль?» . Всемирный методологический журнал . 6 (1): 101–4. дои : 10.5662/wjm.v6.i1.101 . ПМЦ 4804244 . ПМИД 27019801 .
- ^ «Пакет общественной информации (PIP): Как принять участие в исследованиях Национальной службы здравоохранения, общественного здравоохранения и социальной помощи» . Национальный институт исследований в области здравоохранения и ухода . Проверено 3 января 2024 г.
- ^ «Информационные заметки для исследователей – участие общественности в исследованиях Национальной службы здравоохранения, здравоохранения и социальной помощи» . Национальный институт исследований в области здравоохранения и ухода . Проверено 3 января 2024 г.
- ↑ Перейти обратно: Перейти обратно: а б с д Мейнерт КЛ, Тонасия С (1986). Клинические исследования: дизайн, проведение и анализ . Издательство Оксфордского университета, США. п. 3. ISBN 978-0-19-503568-1 . Архивировано из оригинала 15 апреля 2023 года . Проверено 5 июня 2020 г.
- ^ Саймон, Харви Б. (2002). Руководство Гарвардской медицинской школы по мужскому здоровью . Нью-Йорк: Свободная пресса . п. 31 . ISBN 978-0-684-87181-3 .
- ^ Браун, Стивен Р. (2003). Цинга: как хирург, моряк и джентльмен разгадали величайшую медицинскую загадку эпохи парусного спорта . Нью-Йорк, штат Нью-Йорк: Пресса Св. Мартина. ISBN 0-312-31391-8
- ^ Роджерс, Эверетт М. (1995). Распространение инноваций . Нью-Йорк, штат Нью-Йорк: Свободная пресса. ISBN 0-7432-2209-1 . п. 7.
- ^ Карлайл, Родни (2004). Scientific American Inventions and Discoveries , John Wiley & Songs, Inc., Нью-Джерси. п. 393. ISBN 0-471-24410-4 .
- ^ «Джеймс Линд: Трактат о цинге (1754 г.)» . 2001. Архивировано из оригинала 1 октября 2018 года . Проверено 9 сентября 2007 г.
- ^ «О Дне клинических исследований» . День клинических испытаний . Архивировано из оригинала 5 февраля 2023 года . Проверено 7 апреля 2023 г.
- ^ Грин С., Кроули Дж., Бенедетти Дж., Смит А. (30 июля 2002 г.). Клинические исследования в онкологии, второе издание . ЦРК Пресс. стр. 1–. ISBN 978-1-4200-3530-8 .
- ^ Гад СК (17 июня 2009 г.). Справочник по клиническим исследованиям . Джон Уайли и сыновья. стр. 118–. ISBN 978-0-470-46635-3 .
- ^ О'Рурк МФ (февраль 1992 г.). «Фредерик Акбар Магомед» . Гипертония . 19 (2): 212–7. дои : 10.1161/01.HYP.19.2.212 . ПМИД 1737655 .
- ^ Кресвелл, JW (2008). Образовательные исследования: планирование, проведение и оценка количественных и качественных исследований (3-е). Река Аппер-Сэдл, Нью-Джерси: Прентис-Холл. 2008, с. 300. ISBN 0-13-613550-1
- ^ Хани (2009). «Исследование репликации» . Архивировано из оригинала 2 июня 2012 года . Проверено 27 октября 2011 г.
- ^ Меткалф, Нью-Хэмпшир (февраль 2011 г.). «Сэр Джеффри Маршалл (1887–1982): врач-респиратор, катализатор развития анестезии, врач премьер-министра и короля, а также командир баржи времен Первой мировой войны». Журнал медицинской биографии . 19 (1): 10–4. дои : 10.1258/jmb.2010.010019 . ПМИД 21350072 . S2CID 39878743 .
- ↑ Pharmabiz.com, 19 мая 2014 г., Мумбаи ISCR выпускает Руководство для участников клинических исследований в Международный день клинических испытаний. Архивировано 7 апреля 2023 г. в Wayback Machine (по состоянию на 20 мая 2014 г.).
- ^ Поттегорд, Антон; Хааструп, Майя Бруун; Сцена, Торе Бьеррегард; Хансен, Мортен Рикс; и др. (16 декабря 2014 г.). «Поиск юмористических и экстравагантных акронимов и совершенно неподходящих названий для важных клинических исследований (НАУЧНЫХ): качественное и количественное систематическое исследование» . БМЖ . 349 : g7092. дои : 10.1136/bmj.g7092 . ПМК 4267482 . ПМИД 25516539 .
- ↑ Перейти обратно: Перейти обратно: а б «Что такое клиническое исследование?» . Национальная медицинская библиотека, Национальные институты здравоохранения США. 1 марта 2019 г. Архивировано из оригинала 19 мая 2019 г. . Проверено 24 мая 2019 г.
- ^ Хелен С (2010). «Программы сострадательного использования ЕС (CUP): нормативно-правовая база и моменты, которые следует учитывать перед внедрением CUP» . Фарм Мед . 24 (4): 223–229. дои : 10.1007/BF03256820 . S2CID 31439802 .
- ^ Бреннан З. (5 июня 2013 г.). «CRO медленно переходят к адаптивному дизайну клинических исследований» . Аутсорсинг-pharma.com. Архивировано из оригинала 27 августа 2017 года . Проверено 5 января 2014 г.
- ^ «Адаптивные клинические испытания для преодоления исследовательских проблем» . Новости-medical.net. 17 сентября 2013 г. Архивировано из оригинала 11 августа 2020 г. . Проверено 4 января 2014 г.
- ^ Ван, Ширли С. (30 декабря 2013 г.). «Здоровье: ученые стремятся снизить стоимость и время испытаний лекарств - WSJ.com» . Онлайн.wsj.com. Архивировано из оригинала 14 марта 2016 года . Проверено 4 января 2014 г.
- ^ Хубер П.В. (12 ноября 2013 г.). Лекарство в кодексе: как закон 20-го века подрывает медицину 21-го века . Основные книги. ISBN 978-0-465-06981-1 .
- ^ Ланцет (июль 2009 г.). «Испытания фазы 0: платформа для разработки лекарств?» . Ланцет . 374 (9685): 176. doi : 10.1016/S0140-6736(09)61309-X . ПМИД 19616703 . S2CID 30939770 .
- ↑ Перейти обратно: Перейти обратно: а б «Клиническое исследование фазы IIa и фазы IIb» . www.musculardystrophyuk.org . Архивировано из оригинала 9 августа 2020 года . Проверено 10 августа 2020 г.
- ↑ Перейти обратно: Перейти обратно: а б с Ханнан Э.Л. (июнь 2008 г.). «Рандомизированные клинические испытания и наблюдательные исследования: рекомендации по оценке соответствующих сильных сторон и ограничений» . JACC. Сердечно-сосудистые вмешательства . 1 (3): 211–7. дои : 10.1016/j.jcin.2008.01.008 . ПМИД 19463302 .
- ^ Сесслер Д.И., Имри П.Б. (октябрь 2015 г.). «Методология клинических исследований 2: Наблюдательные клинические исследования» . Анестезия и анальгезия . 121 (4): 1043–51. doi : 10.1213/ANE.0000000000000861 . ПМИД 26378704 . S2CID 19333613 .
- ^ Элдридж С.М., Ланкастер Г.А., Кэмпбелл М.Дж., Табейн Л., Хоупвелл С., Коулман К.Л., Бонд К.М. (2016). «Определение технико-экономического обоснования и пилотных исследований при подготовке к рандомизированным контролируемым исследованиям: разработка концептуальной основы» . ПЛОС ОДИН . 11 (3): e0150205. Бибкод : 2016PLoSO..1150205E . дои : 10.1371/journal.pone.0150205 . ПМЦ 4792418 . ПМИД 26978655 .
- ^ «Активное управление/Активный компаратор» . 3 марта 2017 года. Архивировано из оригинала 8 апреля 2023 года . Проверено 31 октября 2017 г.
- ^ Янг, Сьюзен. «Foundation Medicine присоединяется к коалиции, стремящейся встряхнуть испытания лекарств от рака | Обзор технологий MIT» . Technologyreview.com. Архивировано из оригинала 13 ноября 2013 года . Проверено 14 ноября 2013 г.
- ^ «Официальный веб-сайт ICH» (PDF) . www.ich.org . Архивировано из оригинала (PDF) 21 сентября 2008 года.
- ^ «Официальный веб-сайт ICH: ICH» . ich.org . Архивировано из оригинала 25 мая 2011 года . Проверено 5 октября 2008 г.
- ↑ Перейти обратно: Перейти обратно: а б с «Узнайте о клинических исследованиях» . www.clinicaltrials.gov . Архивировано из оригинала 10 апреля 2012 года.
- ^ Мэлони, Деннис М (1984). Защита объектов исследований на людях: Практическое руководство по федеральным законам и постановлениям . Бостон, Массачусетс: Springer US. п. 151. ИСБН 9781461327035 .
- ^ Дори, Фредерик (2011). «Кратко о статистике: статистическая мощь: что это такое и когда ее следует использовать?» . Клиническая ортопедия и связанные с ней исследования . 469 (2): 619–620. дои : 10.1007/s11999-010-1435-0 . ПМК 3018227 . ПМИД 20585913 .
- ^ Норвиц Э.Р., Гринберг Дж.А. (2011). «Одобрение FDA на использование лекарств во время беременности: тяжелая битва» . Обзоры по акушерству и гинекологии . 4 (2): 39–41. ПМК 3218552 . ПМИД 22102925 .
- ^ «Часто задаваемые вопросы | Онкологический центр Университета Аризоны» . Azcc.arizona.edu. Архивировано из оригинала 2 декабря 2013 года . Проверено 14 ноября 2013 г.
- ^ Мисета, Эд (17 декабря 2019 г.). «Янссен использует геозоны для мониторинга пациентов, участвующих в клинических исследованиях» . Клинический руководитель . Пенсильвания, США: VertMarkets. Архивировано из оригинала 27 января 2020 года . Проверено 26 января 2020 г.
- ^ Унгер, Дж. М.; Кук, Э; Тай, Э; Блейер, А (2016). «Роль участия в клинических исследованиях рака: барьеры, доказательства и стратегии» . Учебная книга Американского общества клинической онкологии. Американское общество клинической онкологии. Ежегодное собрание . 35 (36). Американское общество клинической онкологии: 185–198. дои : 10.1200/EDBK_156686 . ПМЦ 5495113 . ПМИД 27249699 .
- ^ Вайс С.К., Роуэлл Р., Крохмаль Л. (2008). «Влияние сезонности на проведение клинических исследований в дерматологии». Клиники по дерматологии . 26 (5): 565–9. doi : 10.1016/j.clindermatol.2008.01.016 . ПМИД 18755376 .
- ^ Хан Ю, Тилли С. «Сезонность: логистическая проблема менеджера клинических исследований» (PDF) . Фарм-Олам Интернешнл. Архивировано из оригинала (PDF) 15 июля 2011 года . Проверено 26 апреля 2010 г.
- ^ Маршалл, Меган (19 декабря 2019 г.). «Внедрение QbD в ваше клиническое исследование? 4 вопроса, на которые нужно ответить в первую очередь» . Клинический руководитель . Пенсильвания: VertMarkets. Архивировано из оригинала 27 января 2020 года . Проверено 26 января 2020 г.
- ^ Ян, ZJ и др. (2010). «Мотивация для поиска и обработки медицинской информации о наборе участников в клинические исследования». Health Communication 25(5): 423–436.
- ^ «BIO будет использовать ViS Analytics для оптимизации педиатрических клинических исследований - WSJ.com» . Онлайн.wsj.com. 7 мая 2013 г. Архивировано из оригинала 4 февраля 2014 г. Проверено 14 ноября 2013 г.
- ^ Группа стратегии в области медико-биологических наук, Синдицированная публикация «Использование технологий клинических испытаний, предпочтения при покупке и перспективы роста», май 2009 г.
- ^ «Результаты электронных отчетов пациентов (ePRO) – изменение облика клинических исследований» . Med-Quest.org . Архивировано из оригинала 21 мая 2015 года . Проверено 20 мая 2015 г.
- ↑ Перейти обратно: Перейти обратно: а б Эванс, Скотт Р. (2010). «Общие статистические проблемы в клинических исследованиях» . Журнал экспериментального инсульта и трансляционной медицины . 3 (1): 1–7. doi : 10.6030/1939-067x-3.1.1 (неактивен 17 марта 2024 г.). ISSN 1939-067X . ПМК 3059317 . ПМИД 21423790 .
{{cite journal}}: CS1 maint: DOI неактивен по состоянию на март 2024 г. ( ссылка ) - ↑ Перейти обратно: Перейти обратно: а б Эванс-младший, Швейцария; Ильдстад, ST, ред. (2001). «Статистические подходы к анализу небольших клинических исследований». Проблемы и проблемы малых клинических исследований; В: Статистические подходы к анализу небольших клинических исследований . Издательство национальных академий (США). Архивировано из оригинала 15 апреля 2023 года . Проверено 7 ноября 2022 г.
- ^ Гордон, Э.Дж.; Прохаска, ТР (2006). «Этика отказа от участия в исследовании» . Ответственность в исследованиях . 13 (4): 285–309. дои : 10.1080/08989620600848645 . ПМЦ 9527709 . ПМИД 17849641 .
- ^ «Законопроект № 2328» (PDF) . Архивировано из оригинала (PDF) 2 декабря 2007 года . Проверено 19 ноября 2007 г.
- ^ Хайден ЕС (ноябрь 2014 г.). «Этическая дилемма испытаний лекарств от Эболы» . Природа . 515 (7526): 177–8. Бибкод : 2014Natur.515..177C . дои : 10.1038/515177a . ПМИД 25391940 .
- ^ Паттинсон, Шон Д. (2012). «Экстренные исследования и интересы участников» (PDF) . Международное медицинское право . 12 (2): 121–141. дои : 10.1177/0968533212465615 . S2CID 71853867 . Архивировано (PDF) из оригинала 9 апреля 2023 года . Проверено 13 июля 2019 г.
- ^ Спан, Паула (3 марта 2020 г.). «Когда исследование препарата внезапно заканчивается, добровольцам приходится справляться с ситуацией» . Нью-Йорк Таймс . ISSN 0362-4331 . Архивировано из оригинала 7 апреля 2023 года . Проверено 23 апреля 2020 г.
- ^ Мойнихан, Р. (2003). «Кто платит за пиццу? Переосмысление отношений между врачами и фармацевтическими компаниями. Часть 2: Распутывание» . Британский медицинский журнал . 326 (7400): 1193–1196. дои : 10.1136/bmj.326.7400.1193 . ПМК 1126054 . ПМИД 12775622 .
- ^ «Информация Hogan & Hartson о регистрации фармацевтических исследований» (PDF) . 3 марта 2008 г. Архивировано из оригинала (PDF) 25 июня 2008 г. . Проверено 2 июня 2008 г.
- ^ «Рост количества опровержений научных журналов побуждает к реформам» . Нью-Йорк Таймс . 16 апреля 2012 года. Архивировано из оригинала 18 июня 2018 года . Проверено 22 мая 2018 г.
- ^ Вулли К.Л., Лью Р.А., Стреттон С., Эли Дж.А., Брамич Н.Дж., Киз Дж.Р., Монк Дж.А., Вулли М.Дж. (июнь 2011 г.). «Отсутствие участия писателей-медиков и фармацевтической промышленности в публикациях, отозванных за неправомерное поведение: систематическое, контролируемое ретроспективное исследование». Текущие медицинские исследования и мнения . 27 (6): 1175–82. дои : 10.1185/03007995.2011.573546 . ПМИД 21473670 . S2CID 2583905 .
- ^ Сокс ХК, Ренни Д. (август 2008 г.). «Посевные испытания: просто скажи «нет» » . Анналы внутренней медицины . 149 (4): 279–80. дои : 10.7326/0003-4819-149-4-200808190-00012 . ПМИД 18711161 .
- ^ «Процесс разработки и утверждения (лекарственные препараты)» . Управление по контролю за продуктами и лекарствами США. Архивировано из оригинала 10 июня 2018 года . Проверено 22 мая 2018 г.
- ^ «Информационный листок-руководство для IRB, клинических исследователей и спонсоров: проверки FDA клинических исследователей» (PDF) . Управление по контролю за продуктами и лекарствами . Июнь 2010 г. Архивировано (PDF) из оригинала 11 июня 2014 г. Проверено 16 октября 2014 г.
- ^ Давидофф Ф., ДеАнджелис С.Д., Дразен Дж.М., Николлс М.Г., Хоуи Дж., Хойгаард Л., Хортон Р., Котцин С., Найленна М., Овербеке А.Дж., Сокс ХК, Ван дер Вейден М.Б., Уилкс М.С. (сентябрь 2001 г.). «Спонсорство, авторство и ответственность» . CMAJ . 165 (6): 786–8. ПМК 81460 . ПМИД 11584570 . Архивировано из оригинала 15 апреля 2023 года . Проверено 27 февраля 2011 г.
- ^ Манси, Бернадетт А.; Кларк, Джули; Дэвид, Фрэнк С.; Гезелл, Томас М.; Глассер, Сьюзен; Гонсалес, Джон; Халлер, Дэниел Г.; Лейн, Кристина; Миллер, Чарльз Л.; Муни, ЛаВерн А.; Зечевич, Майя (май 2012 г.). «Десять рекомендаций по устранению разрыва в доверии к отчетности о клинических исследованиях, спонсируемых промышленностью: совместный взгляд журнала и фармацевтической промышленности» . Труды клиники Мэйо . 87 (5): 424–429. дои : 10.1016/j.mayocp.2012.02.009 . ISSN 1942-5546 . ПМЦ 3538468 . ПМИД 22560521 .
- ^ Тоэн, Маурисио (сентябрь 2013 г.). «Доверие к клиническим исследованиям, финансируемым промышленностью» . Международный журнал нейропсихофармакологии . 16 (8): 1879–1884. дои : 10.1017/S1461145713000461 . ISSN 1469-5111 . ПМИД 23672957 .
- ^ Тоэн, Маурисио (1 февраля 2017 г.). «Руководство по лечению биполярных расстройств и важность правильного дизайна клинических исследований» . Международный журнал нейропсихофармакологии . 20 (2): 95–97. дои : 10.1093/ijnp/pyx002 . ISSN 1469-5111 . ПМК 5356994 . ПМИД 28927197 .
- ^ Тоэн, Маурисио (2018). «Тяжесть симптомов в клинических рекомендациях по мании и последствия дизайна исследования» . Биполярные расстройства . 20 (2): 171–172. дои : 10.1111/bdi.12598 . ISSN 1399-5618 . ПМИД 29327798 . Архивировано из оригинала 8 апреля 2023 года . Проверено 27 мая 2021 г.
- ^ Тоэн, Маурисио (2013). «Доверие к клиническим исследованиям, финансируемым промышленностью» . Международный журнал нейропсихофармакологии . 16 (8): 1879–1884. дои : 10.1017/S1461145713000461 . ISSN 1469-5111 . ПМИД 23672957 .
- ↑ Перейти обратно: Перейти обратно: а б Эдвардс, Кэтрин М.; Кочхар, Сонали (2020). «Этика проведения клинических исследований в условиях вспышки» . Ежегодный обзор вирусологии . 7 (1): 475–494. doi : 10.1146/annurev-virology-013120-013123 . ПМИД 32212920 .
- ^ «Руководство NINDS по мониторингу в клинических исследованиях | Национальный институт неврологических расстройств и инсульта» . ninds.nih.gov . Архивировано из оригинала 9 января 2020 года . Проверено 25 ноября 2019 г.
- ^ «Руководство по обучению Совета по мониторингу данных и безопасности для исследований, инициированных следователями - Тафтс CTSI» . tuftsctsi.wpengine.com . 15 мая 2018 года. Архивировано из оригинала 7 апреля 2023 года . Проверено 25 ноября 2019 г.
- ^ Планирование и проведение клинических исследований – обзор . Международный журнал статистики и медицинской информатики. 2019. ISBN 9781096489085 .
- ^ «Для пациентов: информированное согласие на участие в клинических исследованиях» . Управление по контролю за продуктами и лекарствами США. 25 февраля 2016 года. Архивировано из оригинала 22 июля 2017 года . Проверено 9 августа 2017 г.
- ^ Руководство для промышленности: раскрытие финансовой информации клиническими исследователями , Управление по санитарному надзору за качеством пищевых продуктов и медикаментов , 20 марта 2001 г., заархивировано из оригинала 11 мая 2009 г. , получено 16 декабря 2019 г.
- ^ Ланг Т., Сирибаддана С. (2012). «Клинические испытания стали глобальными: хорошо ли это?» . ПЛОС Медицина . 9 (6): e1001228. дои : 10.1371/journal.pmed.1001228 . ПМЦ 3373653 . ПМИД 22719228 .
- ^ «Индия: главное место для неэтичных клинических испытаний» . Общие мечты . Архивировано из оригинала 15 декабря 2007 года . Проверено 16 декабря 2007 г.
- ^ «Агентство фармацевтических препаратов и медицинского оборудования Pmda.go.jp» (PDF) Архивировано из оригинала (PDF) 17 декабря 2008 г.
- ^ «Официальный веб-сайт ICH: ICH» . www.ich.org . Архивировано из оригинала 30 июня 2007 года.
- ^ «Управление информацией о безопасности клинических исследований: отчет Рабочей группы VI CIOMS» . Публикации ЦИОМС . 2005. Архивировано из оригинала 15 августа 2019 года . Проверено 11 ноября 2017 г.
- ^ «Заявка на новое исследовательское лекарство (IND) – Окончательное правило: Требования к отчетности о безопасности новых лекарств для человека и биологических продуктов, а также Требования к отчетности о безопасности для исследований биодоступности и биоэквивалентности на людях» . FDA.gov . Центр оценки и исследования лекарств. 29 сентября 2010 г. Архивировано из оригинала 23 апреля 2019 г. . Проверено 11 ноября 2017 г.
- ^ «Руководство для промышленности и следователей. Требования к отчетности по безопасности для исследований IND и BA/BE. Руководство по соблюдению требований для малых предприятий» (PDF) . Управление по контролю за продуктами и лекарствами =. Декабрь 2012 г. Архивировано (PDF) из оригинала 16 января 2019 г. . Проверено 11 ноября 2017 г.
- ^ «Оценка безопасности для руководства по отчетности о безопасности IND для промышленности» (PDF) . Управление по контролю за продуктами и лекарствами. Декабрь 2015 г. Архивировано (PDF) из оригинала 4 мая 2017 г. Проверено 11 ноября 2017 г.
- ^ «Синтез фактических данных и метаанализ: отчет рабочей группы X CIOMS» . Публикации ЦИОМС. 2016. Архивировано из оригинала 15 августа 2019 года . Проверено 11 ноября 2017 г.
- ^ Серткая, Айлин; Вонг, Хуэй-Синг; Джессап, Эмбер; Белече, Тринидад (2016). «Основные факторы затрат на фармацевтические клинические испытания в США» . Клинические испытания . 13 (2): 117–126. дои : 10.1177/1740774515625964 . ПМИД 26908540 . S2CID 24308679 .
- ^ «Налоговый кредит на расходы на тестирование лекарств от редких заболеваний или состояний» . Управление по контролю за продуктами и лекарствами . 17 апреля 2001 года. Архивировано из оригинала 6 апреля 2007 года . Проверено 27 марта 2007 г.
- ^ Пол Дж., Сейб Р., Прескотт Т. (март 2005 г.). «Интернет и клинические испытания: предыстория, онлайн-ресурсы, примеры и проблемы» . Журнал медицинских интернет-исследований . 7 (1): e5. дои : 10.2196/jmir.7.1.e5 . ПМК 1550630 . ПМИД 15829477 .
- ^ Станкель, Лиэнн; Грейди, Кристина (май 2011 г.). «Больше, чем деньги: обзор литературы, исследующей здоровую мотивацию волонтеров» . Современные клинические исследования . 32 (3): 342–352. дои : 10.1016/j.cct.2010.12.003 . ПМЦ 4943215 . ПМИД 21146635 .
- ^ Лю Джей Джей, Дэвидсон Э, Шейх А (2011). «Достижение этнического разнообразия при наборе в суд» . Фарм Мед . 25 (4): 215–222. дои : 10.1007/BF03256863 . S2CID 19557355 . Архивировано из оригинала 14 ноября 2011 года.
- ^ Макдональд А.М., Найт Р.С., Кэмпбелл М.К., Энтвистл В.А., Грант А.М., Кук Дж.А., Эльбурн Д.Р., Фрэнсис Д., Гарсия Дж., Робертс И., Сноудон С. (апрель 2006 г.). «Что влияет на набор участников в рандомизированные контролируемые исследования? Обзор исследований, финансируемых двумя финансирующими агентствами Великобритании» . Испытания . 7 :9. дои : 10.1186/1745-6215-7-9 . ПМЦ 1475627 . ПМИД 16603070 .
- ^ «Волонтерство в клинических исследованиях» . Бостон, Массачусетс: CenterWatch. 2016. Архивировано из оригинала 25 ноября 2016 года . Проверено 26 ноября 2016 г.
- ^ «Разнообразие и инклюзивность в клинических исследованиях» . НИМГД . Архивировано из оригинала 18 марта 2023 года . Проверено 9 декабря 2022 г.
- ^ Конкель, Линдси (2015). «Расовые и этнические различия в научных исследованиях: проблема создания более разнообразных когорт» . Перспективы гигиены окружающей среды . 123 (12): А297–А302. дои : 10.1289/ehp.123-A297 . ISSN 0091-6765 . ПМК 4670264 . ПМИД 26625444 .
- ^ «Почти половина чернокожих пациентов с метастатическим раком молочной железы не информированы о клинических испытаниях» . 6 августа 2022 года. Архивировано из оригинала 7 апреля 2023 года . Проверено 7 апреля 2023 г.
- ^ Питтман, Корин А.; Рура, Рауль; Прайс, Кэрри; Лин, Фрэнк Р.; Марроне, Николь; Ниман, Кэрри Л. (1 июля 2021 г.). «Расовая/этническая и половая репрезентация в американских клинических исследованиях по лечению потери слуха у взрослых: систематический обзор» . JAMA Отоларингология – хирургия головы и шеи . 147 (7): 656–662. дои : 10.1001/jamaoto.2021.0550 . ISSN 2168-6181 . ПМИД 33885733 . S2CID 233351877 .
- ^ «Как остановить отсутствие разнообразия, подрывающее данные клинических испытаний» . Файнэншл Таймс . 18 января 2019 года. Архивировано из оригинала 10 декабря 2022 года . Проверено 26 февраля 2019 г.
- ^ «Клинические исследования болезни Паркинсона» . Искатель проб Fox . Проверено 14 ноября 2013 г.
- ^ «Медицинская информация в Интернете» . Мланет.орг. Архивировано из оригинала 3 октября 2013 года . Проверено 14 ноября 2013 г.
- ^ Кляйн, Гарри; Мазор, Тали; Сигел, Итан; Труханов Павел; Овалье, Андреа; Веккио Фитц, Кэтрин Дель; Цвислер, Закари; Кумари, Прити; Ван дер Вин, Бернд; Марриотт, Эрик; Гензель, Джейсон; Ю, Джойс; Албайрак, Адем; Барри, Сьюзен; Келлер, Рэйчел Б.; МакКонейл, Лаура Э.; Линдеман, Нил; Джонсон, Брюс Э.; Роллинз, Барретт Дж.; До, Хан Т.; Бердсли, Брайан; Шапиро, Джеффри; Гектор-Барри, Сюзанна; Митот, Джон; Шолл, Линетт; Линдси, Джеймс; Хассетт, Майкл Дж.; Черами, Итан (6 октября 2022 г.). «MatchMiner: платформа с открытым исходным кодом для точной медицины рака» . npj Прецизионная онкология . 6 (1): 69. дои : 10.1038/s41698-022-00312-5 . ISSN 2397-768X . ПМЦ 9537311 . ПМИД 36202909 .
- ↑ Перейти обратно: Перейти обратно: а б Ян З.Дж., МакКомас К.А., Гей Г.К., Леонард Дж.П., Данненберг А.Дж., Диллон Х. (2012). «Сравнение принятия решений больными раком и населением в целом: мысли, эмоции или социальное влияние?». Журнал медицинских коммуникаций . 17 (4): 477–94. дои : 10.1080/10810730.2011.635774 . ПМИД 22376222 . S2CID 1344880 .
- ↑ Перейти обратно: Перейти обратно: а б «Что нужно знать о программах сопоставления клинических исследований рака» . Рак.Нет . 14 марта 2023 года. Архивировано из оригинала 28 сентября 2023 года . Проверено 26 декабря 2023 г.
- ↑ Перейти обратно: Перейти обратно: а б «Как искать клинические исследования» . ClinicalTrials.gov, Национальная медицинская библиотека США. 2023. Архивировано из оригинала 26 декабря 2023 года . Проверено 26 декабря 2023 г.
- ^ Фунцилас Э., Цимбериду А.М., Во Х.Х., Курцрок Р. (август 2022 г.). «Дизайн клинических исследований в эпоху точной медицины» . Геномная медицина . 14 (1): 101. дои : 10.1186/s13073-022-01102-1 . ПМЦ 9428375 . ПМИД 36045401 .
- ^ Флери МЭ (2023). «Консенсусные рекомендации по улучшению условий проведения клинических исследований рака» . Рак . 130 (1): 11–15. дои : 10.1002/cncr.35034 . ПМИД 37851508 .
- ^ Ван Норман, Джорджия (27 апреля 2021 г.). «Децентрализованные клинические исследования» . JACC: Основы трансляционной науки . 6 (4): 384–387. дои : 10.1016/j.jacbts.2021.01.011 . ПМК 8093545 . ПМИД 33997523 .
Внешние ссылки [ править ]
- Международная конференция по гармонизации технических требований к регистрации лекарственных средств для человеческого применения , руководство по регулированию клинических исследований
- ClinicalTrials.gov, всемирная база данных зарегистрированных клинических исследований ; Национальная медицинская библиотека США
- Кокрейновский центральный регистр контролируемых исследований (CENTRAL) ; концентрированный источник библиографических отчетов о рандомизированных контролируемых исследованиях
- ClinicalTrials.eu, Европейская информационная сеть по клиническим исследованиям ; Клинические испытания легко понять.