Субъединичная вакцина
Субъединичная вакцина — это вакцина , которая содержит очищенные части возбудителя , которые являются антигенными или необходимы для индукции защитного иммунного ответа . [1] [2] Субъединичная вакцина может быть изготовлена из разобранных вирусных частиц в клеточной культуре или рекомбинантной ДНК . экспрессии [3] в этом случае это рекомбинантная субъединичная вакцина .
«Субъединичная» вакцина не содержит весь возбудитель, в отличие от живой аттенуированной или инактивированной вакцины , а содержит только антигенные части, такие как белки , полисахариды. [1] [2] или пептиды . [4] Поскольку вакцина не содержит «живых» компонентов возбудителя, отсутствует риск заражения, она более безопасна и стабильна, чем вакцины, содержащие целые возбудители. [1] Другие преимущества включают в себя хорошо отработанную технологию и возможность использования для людей с ослабленным иммунитетом . [2] К недостаткам можно отнести относительно сложную разработку по сравнению с некоторыми вакцинами, возможно, необходимость использования адъювантов и повторных прививок , а также необходимость времени для изучения того, какие антигенные комбинации могут работать лучше всего. [2]
Первая рекомбинантная субъединичная вакцина была произведена в середине 1980-х годов для защиты людей от гепатита В. Другие лицензированные рекомбинантные субъединичные вакцины включают Энгерикс-В ( гепатит В ), Гардасил 9. [5] ( Вирус папилломы человека ), Флублок [6] ( грипп ), Шингрикс [7] ( Опоясывающий герпес ) и Нуваксовид [8] ( Коронавирус заболевание 2019 ).
После инъекции антигены запускают выработку антигенспецифических антител , которые отвечают за распознавание и нейтрализацию чужеродных веществ. Основные компоненты рекомбинантных субъединичных вакцин включают рекомбинантные субъединицы, адъюванты и носители. Кроме того, рекомбинантные субъединичные вакцины являются популярными кандидатами для разработки вакцин против инфекционных заболеваний (например, туберкулеза , [9] денге [10] )
Рекомбинантные субъединичные вакцины считаются безопасными для инъекций. Вероятность побочных эффектов варьируется в зависимости от конкретного типа вакцины вводимой . Незначительные побочные эффекты включают боль в месте инъекции, лихорадку и усталость , а серьезные побочные эффекты включают анафилаксию и потенциально смертельную аллергическую реакцию . Противопоказания ; также зависят от вакцины их, как правило, не рекомендуют людям, у которых в анамнезе была анафилаксия на какой-либо компонент вакцин. Перед получением какой-либо вакцинации следует проконсультироваться с медицинскими работниками.
Открытие [ править ]
Первой сертифицированной субъединичной вакциной, прошедшей клинические испытания на людях, является вакцина против гепатита В, содержащая поверхностные антигены самого вируса гепатита В, полученные от инфицированных пациентов и адаптированная с помощью недавно разработанной технологии, направленной на повышение безопасности вакцины и устранение возможного заражения через плазму человека. [11]
Механизм [ править ]
Субъединичные вакцины содержат фрагменты возбудителя, такие как белок или полисахарид, комбинации которых тщательно подбираются, чтобы вызвать сильный и эффективный иммунный ответ.Поскольку иммунная система взаимодействует с возбудителем ограниченно, риск побочных эффектов минимален. [2] Эффективная вакцина вызовет иммунный ответ на антигены и сформирует иммунологическую память , которая позволит быстро распознавать возбудители и быстро реагировать на будущие инфекции. [1]
Недостаток заключается в том, что специфические антигены, используемые в субъединичной вакцине, могут не иметь молекулярных структур, связанных с патогеном , которые являются общими для класса патогенов. Эти молекулярные структуры могут использоваться иммунными клетками для распознавания опасности, поэтому без них иммунный ответ может быть слабее. Еще одним недостатком является то, что антигены не заражают клетки , поэтому иммунный ответ на субъединичные вакцины может быть только антитело-опосредованным , а не клеточно-опосредованным , и, как следствие, он слабее, чем те, которые вызываются другими типами вакцин.Для усиления иммунного ответа с субъединичными вакцинами можно использовать адъюванты или могут потребоваться бустерные дозы. [2]
Типы [ править ]
| Типы | Описание | Примеры |
|---|---|---|
| Белковая субъединица | содержит изолированные патогенов вирусов ( белки или бактерий ) | гепатит В , бесклеточные коклюшные вакцины |
| Полисахарид | содержит цепочки полисахаридов (молекул сахара), обнаруженных в капсуле возбудителя, например, в клеточных стенках некоторых бактерий. | пневмококковая полисахаридная вакцина , менингококковая вакцина, предотвращающая заболевания, вызванные Neisseria meningitidis группы A, C, W-135 и Y |
| Сопряженный | содержит полисахаридные цепи, связанные с белками-переносчиками , такими как дифтерийный и столбнячный анатоксин , для усиления иммунного ответа. | пневмококковая конъюгированная вакцина , конъюгированная вакцина против гемофильной инфекции типа b , менингококковая конъюгированная вакцина |
Белковая субъединица [ править ]
Белковая субъединица — это полипептидная цепь или белковая молекула, которая собирается (или « совмещается ») с другими белковыми молекулами с образованием белкового комплекса . [12] [13] [14] Большие сборки белков, такие как вирусы, часто используют небольшое количество типов белковых субъединиц в качестве строительных блоков. [15] Ключевым шагом в создании рекомбинантной белковой вакцины является идентификация и выделение белковой субъединицы из возбудителя, которая может вызвать сильный и эффективный иммунный ответ, без включения частей вируса или бактерии, которые позволяют возбудителю размножаться. Часто подходят части белковой оболочки или капсида вируса. Цель состоит в том, чтобы субъединица белка инициировала реакцию иммунной системы, имитируя внешний вид, но не действие патогена. [16] Другой подход, основанный на белках, включает самосборку нескольких субъединиц белка в вирусоподобную частицу (VLP) или наночастицу. Цель увеличения поверхностного сходства вакцины с целой вирусной частицей (но не ее способности распространяться) состоит в том, чтобы вызвать более сильный иммунный ответ. [17] [16] [18]
Белковые субъединичные вакцины обычно производятся путем производства белка , манипулируя экспрессией генов организма так, что он экспрессирует большие количества рекомбинантных генов . [16] [19] Для разработки могут быть использованы различные подходы в зависимости от используемой вакцины. [17] Культуры клеток дрожжей , бакуловирусов или млекопитающих можно использовать для производства больших количеств белков in vitro. [16] [19] [20]
Белковые вакцины используются против гепатита В и вируса папилломы человека (ВПЧ). [17] [16] Этот подход используется для разработки вакцин против трудно поддающихся вакцинации вирусов, таких как эболавирус и ВИЧ . [21] Белковые вакцины против COVID-19, как правило, нацелены либо на его шиповый белок, либо на его рецептор-связывающий домен. [17] Сообщалось, что по состоянию на 2021 год наиболее исследованной платформой вакцин против COVID-19 в мире были вакцины на основе рекомбинантных белковых субъединиц. [16] [22]
Полисахаридная субъединица [ править ]
Капсульная полисахаридная вакцина Vi (ViCPS) против брюшного тифа, вызываемого серотипом Typhi Salmonella enterica . [23] Антиген Vi представляет собой не белок, а полисахид бактериальной капсулы , состоящий из длинной сахарной цепи, связанной с липидом. [24] Капсульные вакцины, такие как ViCPS, как правило, слабо вызывают иммунные реакции у детей. Создание конъюгированной вакцины путем связывания полисахида с анатоксином повышает эффективность. [25]
Конъюгированная вакцина [ править ]
Конъюгированная вакцина — это тип вакцины , в которой слабый антиген сочетается с сильным антигеном в качестве носителя, поэтому иммунная система имеет более сильный ответ на слабый антиген. [26]
Пептидная субъединица [ править ]
Субъединичная вакцина на основе пептидов использует пептид вместо полноценного белка . [27] Субъединичная вакцина на основе пептидов чаще всего используется по многим причинам, например, из-за того, что она проста и доступна для массового производства. Добавьте к этому его высочайшую стабильность, чистоту и открытый состав. [28] Происходят три шага, ведущие к созданию пептидной субъединичной вакцины; [29]
- Распознавание эпитопа
- Оптимизация эпитопа
- Пептидное улучшение иммунитета
Особенности [ править ]
По сравнению с обычными аттенуированными вакцинами и инактивированными вакцинами рекомбинантные субъединичные вакцины обладают следующими особыми характеристиками:
- Они содержат четко идентифицированные композиции, что значительно снижает вероятность присутствия нежелательных материалов в вакцине . [ нужна ссылка ]
- присутствуют только фрагменты возбудителя Их патогенность сведена к минимуму, поскольку в вакцине , которые не могут проникать и размножаться в организме человека. [30]
- У них лучший профиль безопасности. [31] и подходят для введения пациентам с ослабленным иммунитетом . [32]
- Они пригодны для массового производства благодаря использованию рекомбинантных технологий. [ нужна ссылка ]
- Они обладают высокой стабильностью, поэтому могут противостоять изменениям окружающей среды и более удобны для использования в общественных местах. [30]
Однако рекомбинантные субъединичные вакцины имеют и некоторые недостатки:
- Добавление адъювантов необходимо во время производства для повышения эффективности этих вакцин. [33]
- Пациентам придется получать бустерные дозы для поддержания долговременного иммунитета . [33] [34]
- Выбор подходящих клеточных линий для культивирования субъединиц требует много времени, поскольку микробные белки могут быть несовместимы с определенными системами экспрессии . [34]
Фармакология [ править ]

Вакцинация является мощным способом защиты людей от инфекционных заболеваний . [35]
Активный иммунитет можно приобрести искусственно путем вакцинации в результате запуска собственного защитного механизма организма под воздействием небольшого, контролируемого количества патогенных веществ для выработки собственных антител и клеток памяти без заражения реальным возбудителем. [36]
Процессы, участвующие в первичном иммунном ответе, следующие:
- Предварительное воздействие антигенов, присутствующих в вакцинах, вызывает первичный ответ. После инъекции антигены будут поглощаться , антигенпрезентирующими клетками (АПК) такими как дендритные клетки и макрофаги , посредством фагоцитоза . [36] [37]
- АПК Т - отправятся в лимфатические узлы , где незрелые В-клетки и клетки . присутствуют [38]
- После антигенных процессов с помощью APC антигены будут связываться либо с рецепторами MHC класса I , либо с рецепторами MHC класса II на клеточной поверхности клеток в зависимости от их композиционных и структурных особенностей, образуя комплексы. [36]
- Происходит презентация антигена , при которой рецепторы Т-клеток прикрепляются к комплексам антиген-MHC, инициируя клональную экспансию и дифференцировку и, следовательно, превращение наивных Т-клеток в цитотоксические Т-клетки (CD8+) или Т-хелперы (CD4+) . [39] [40]
- Цитотоксические клетки CD8+ могут напрямую разрушать инфицированные клетки, содержащие антигены , презентированные им АПК, путем высвобождения литических молекул, тогда как хелперные клетки CD4+ ответственны за секрецию цитокинов , которые активируют В-клетки и цитотоксические Т-клетки . [37] [41]
- В-клетки могут подвергаться активации в отсутствие Т-клеток через сигнальный путь рецептора В-клеток . [37]
- После того, как дендритные клетки захватывают иммуноген , присутствующий в вакцине , они могут представить эти вещества наивным В-клеткам , вызывая пролиферацию плазматических клеток для производства антител . [42] Переключение изотипа может происходить во время развития В-клеток для образования различных антител, включая IgG , IgE и IgA . [37]
- памяти В-клетки и Т-клетки образуются после инфекции. [36] Антигены воспроизводится запоминаются этими клетками, так что последующее воздействие того же типа антигенов будет стимулировать вторичный ответ , при котором более высокая концентрация антител, специфичных для антигенов, быстро и эффективно за короткое время для элиминации возбудителя . [38]
При определенных обстоятельствах низкие дозы вакцины первоначально вводятся , за которыми следуют дополнительные дозы, называемые бустерными дозами . Бустеры способны эффективно поддерживать уровень клеток памяти человека в организме человека, тем самым продлевая иммунитет . [33] [34] [43]
Производство [ править ]
Процесс производства рекомбинантных субъединичных вакцин следующий: [ нужна ссылка ]
- Идентификация иммуногенной субъединицы
- субъединиц Экспрессия и синтез
- Экстракция и очистка
- Добавление адъювантов или включение в векторы
- Оформление и доставка.
Идентификация иммуногенной субъединицы
Субъединицы-кандидаты будут выбираться в первую очередь по их иммуногенности . [44] Чтобы быть иммуногенными , они должны иметь чужеродную природу и достаточную сложность, чтобы могла произойти реакция между различными компонентами иммунной системы и кандидатами. [45] Кандидаты также отбираются на основе размера, характера функции (например, передачи сигналов ) и клеточного местоположения (например, трансмембранного ). [44]
Экспрессия и синтез субъединиц [ править ]
После идентификации целевой субъединицы и ее кодирующего гена ген будет выделен и перенесен во второй, непатогенный организм, и культивирован для массового производства . [46] Этот процесс также известен как гетерологичная экспрессия . [ нужна ссылка ]
Подходящую систему экспрессии выбирают на основе требований посттрансляционных модификаций , затрат, простоты экстракции продукта и эффективности производства. Обычно используемые системы как для лицензированных, так и для разрабатываемых рекомбинантных субъединичных вакцин включают бактерии , дрожжи , клетки млекопитающих , клетки насекомых . [47]
Бактериальные клетки [ править ]

Бактериальные клетки широко используются для процессов клонирования , генетической модификации и мелкомасштабного производства. [48] Escherichia coli (E. Coli) широко используется благодаря ее хорошо изученной генетике , широко доступным генетическим инструментам для экспрессии генов , точному профилированию и ее способности расти в недорогих средах при высокой плотности клеток. [49]
E. Coli в основном подходит для структурно простых белков из-за ее неспособности осуществлять посттрансляционные модификации , отсутствия белковой секреторной системы и возможности образования телец включения , требующих дополнительной солюбилизации. [48] [49] [50] Что касается применения, E.Coli используется в качестве системы экспрессии вакцины против денге . [10]
Дрожжи [ править ]
Дрожжи соответствуют экономической эффективности, эффективности и технической осуществимости бактериальных клеток . [48] Более того, дрожжи секретируют растворимые белки и обладают способностью осуществлять посттрансляционные модификации, подобно клеткам млекопитающих . [50]

Примечательно, что дрожжи включают больше маннозы молекул во время N-гликозилирования по сравнению с другими эукариотами . [51] которые могут вызвать клеточные конформационные стрессовые реакции . Такие реакции могут привести к невозможности достижения конформации нативного белка, что подразумевает потенциальное снижение периода полувыведения из сыворотки и иммуногенности . [48] Что касается применения, то как поверхностный антиген вируса гепатита В ( HBsAg ), так и вирусоподобные частицы ( VLP ) основного капсидного белка L1 вируса папилломы человека типов 6, 11, 16, 18 производятся Saccharomyces cerevisiae . [ нужна ссылка ]
Клетки млекопитающих [ править ]
Клетки млекопитающих хорошо известны своей способностью осуществлять терапевтически важные посттрансляционные модификации и экспрессировать правильно свернутые, гликозилированные и функционально активные белки. [49] [52] [53] Однако эффективность клеток млекопитающих может быть ограничена эпигенетическим подавлением генов и образованием агресом (агрегацией рекомбинантных белков). [49] Сообщалось, что в клетках млекопитающих синтезированные белки секретируются в химически определенные среды, что потенциально упрощает экстракцию и очистку белков. [48]
Наиболее ярким примером этого класса являются клетки яичника китайского хомячка (CHO), используемые для синтеза рекомбинантного вируса ветряной оспы антигена поверхностного гликопротеина (gE) для SHINGRIX . [7] Клетки CHO известны своим быстрым ростом и способностью обеспечивать универсальность процесса. Их также можно культивировать в адаптированной к суспензии культуре в безбелковой среде, что снижает риск загрязнения, вызванного прионами . [48] [49]
Клетки бакуловируса насекомого ) (

- фосфорилирование клетка обладает насекомого Система экспрессии способностью экспрессировать различные рекомбинантные белки на высоких уровнях и обеспечивает значительные возможности обработки эукариотических белков, включая гликозилирование , . , миристоилирование и пальмитоилирование бакуловирус [54] Подобно клеткам млекопитающих , экспрессируемые белки в основном растворимы , точно свернуты и биологически активны. [55] Однако он имеет более медленную скорость роста и требует более высокой стоимости питательной среды, чем бактерии и дрожжи , а также создает токсикологический риск. [48] Примечательной особенностью является существование элементов контроля, которые обеспечивают экспрессию секретируемых и мембраносвязанных белков в клетках бакуловирусных насекомых. [48] [54]
Лицензированные рекомбинантные субъединичные вакцины , в которых используются бакуловирусы - клетки насекомых включают Церварикс (C-концевой усеченный основной капсидный белок L1 папилломавируса типов 16 и 18). [48] [56] и Флублок Четырехвалентный ( белки гемагглютинина ( НА ) из четырех штаммов вирусов гриппа ). [6]
Добыча и очистка [ править ]
На протяжении всей истории методы экстракции и очистки развивались от стандартных хроматографических методов до использования аффинных меток . [57] Однако окончательный процесс экстракции и очистки во многом зависит от выбранной системы экспрессии . Пожалуйста, обратитесь к выражению и синтезу субъединиц для получения дополнительной информации. [ нужна ссылка ]
Добавление адъювантов [ править ]
Адъюванты — это материалы, добавляемые для улучшения иммуногенности рекомбинантных субъединичных вакцин . [58]
Адъюванты увеличивают степень адаптивного ответа на вакцину и направляют активацию наиболее эффективных форм иммунитета к каждому конкретному патогену (например, усиление генерации Т-клеточной памяти). [58] [59] [60] [61] Добавление адъювантов может дать преимущества, включая экономию дозы и стабилизацию конечного состава вакцины. [58] [61]
Соответствующие адъюванты выбирают на основе безопасности, переносимости, совместимости антигена и производственных соображений. [58] Обычно используемыми адъювантами для рекомбинантных субъединичных вакцин являются квасцовые адъюванты (например, гидроксид алюминия ), эмульсии (например, MF59 ) и липосомы в сочетании с иммуностимулирующими молекулами (например, AS01 B ). [58] [60]
и Формулировка доставка
Системы доставки в основном делятся на системы доставки на основе полимеров ( микросферы и липосомы ) и живые системы доставки ( грамположительные бактерии , грамотрицательные бактерии и вирусы ). [ нужна ссылка ]
Системы доставки на основе полимеров [ править ]
Вакцинные антигены часто инкапсулированы в микросферы или липосомы . Обычные микросферы, изготовленные из полимолочной кислоты (PLA). [62] и полимолочная гликолевая кислота (PLGA) [62] обеспечивают контролируемое высвобождение антигена путем разложения in vivo, в то время как липосомы, включающие многоламеллярные или одноламеллярные везикулы, обеспечивают пролонгированное высвобождение. [60]
на основе полимеров Системы доставки обладают такими преимуществами, как повышенная устойчивость к деградации в желудочно-кишечном тракте , контролируемое высвобождение антигена , повышенное поглощение частиц иммунными клетками и повышенная способность индуцировать цитотоксические реакции Т-клеток. [60] Примером лицензированной рекомбинантной вакцины, использующей липосомальную доставку, является Шрингрикс .
Системы живой доставки [ править ]
Живые системы доставки , также известные как векторы , представляют собой клетки, модифицированные лигандами или антигенами для улучшения иммуногенности рекомбинантных субъединиц посредством изменения презентации антигена , биораспределения и транспортировки. [63] Субъединицы могут быть либо встроены в носитель, либо генетически модифицированы для экспрессии на поверхности векторов для эффективной презентации иммунной системе слизистой оболочки . [46]
Преимущества и недостатки [ править ]
Преимущества [ править ]
- Не могут вернуться к вирулентности , что означает, что они не могут вызвать заболевание, от которого стремятся защитить. [64] [65]
- Безопасен для с ослабленным иммунитетом . пациентов [66]
- Может выдерживать изменения условий (например, температуры, освещенности, влажности) [64]
Недостатки [ править ]
- Сниженная иммуногенность по сравнению с аттенуированными вакцинами. [65] [66]
- Может быть трудно выделить специфический антиген(ы) , который вызовет необходимый иммунный ответ. [66]
- Нелегко контролировать химию сопряжения, которая приводит к прерывистым изменениям. [66]
Побочные эффекты и противопоказания [ править ]
Рекомбинантные субъединичные вакцины безопасны для введения. [67] [68] Однако легкие местные реакции, включая уплотнение и отек места инъекции, а также лихорадку , утомляемость и головную боль . после вакцинации могут наблюдаться [67] [69] [70] встречаются Тяжелые реакции гиперчувствительности и анафилаксия редко. [71] но может привести к гибели людей. Неблагоприятные последствия могут различаться среди групп населения в зависимости от их физического состояния здоровья, возраста, пола и генетической предрасположенности. [72] [73]
Рекомбинантные субъединичные вакцины противопоказаны аллергические людям, у которых ранее наблюдались реакции и анафилаксия на антигены или другие компоненты вакцин . [74] [75] Кроме того, следует соблюдать меры предосторожности при введении вакцин людям, находящимся в болезненном состоянии и во время беременности . [74] при этом их инъекции следует отложить до тех пор, пока их состояние не станет стабильным, и после родов соответственно.
Лицензированные вакцины [ править ]
Гепатит В [ править ]
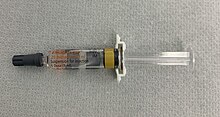
ENGERIX-B (производство GSK) и RECOMBIVAX HB (производство Merck) представляют собой две рекомбинантные субъединичные вакцины , лицензированные для защиты от гепатита B. Оба содержат HBsAg , выделенный и очищенный из Saccharomyces cerevisiae , и представляют собой суспензию антигена с адъювантом квасцов . [76] [77]
Концентрация антител против HBsAg ≥10 мМЕ/мл считается обеспечивающей защиту от инфекции гепатита В. [76] [77]
Было показано, что первичная трехдозовая вакцинация здоровых людей связана с уровнем серопротекции для ENGERIX-B ≥90% , несмотря на снижение с возрастом. Более низкие показатели серопротекции также связаны с наличием хронических заболеваний и иммунодефицита . Тем не менее, GSK HepB по-прежнему имеет клинически приемлемый профиль безопасности во всех изученных популяциях. [78]
Вирус папилломы человека (ВПЧ) [ править ]

Церварикс , ГАРДАСИЛ и ГАРДАСИЛ9 — три рекомбинантные субъединичные вакцины, лицензированные для защиты от инфекции ВПЧ . Они различаются штаммами , от которых они защищают пациентов, поскольку Церварикс обеспечивает защиту от типов 16 и 18. [56] Гардасил обеспечивает защиту от типов 6, 11, 16 и 18. [79] а Гардасил 9 обеспечивает защиту от типов 6, 11, 16, 18, 31, 33, 45, 52, 58. [5] соответственно. Вакцины VLP содержат очищенную Saccharomyces главного капсидного белка L1, продуцируемого рекомбинантными cerevisiae . [ нужна ссылка ]
В систематическом количественном обзоре 2014 года было показано, что бивалентная вакцина против ВПЧ ( Церварикс ) связана с болью (ОШ 3,29; 95% ДИ: 3,00–3,60), отеком (ОШ 3,14; 95% ДИ: 2,79–3,53) и покраснением. (ОШ 2,41; 95% ДИ: 2,17–2,68), что является наиболее частым побочным эффектом. При применении Гардасила наиболее частыми явлениями были боль (ОШ 2,88; 95% ДИ: 2,42–3,43) и отек (ОШ 2,65; 95% ДИ: 2,0–3,44). [80]
Гардасил был прекращен в США 8 мая 2017 года после появления на рынке Гардасила 9. [81] и Церварикс также был добровольно снят с производства в США 8 августа 2016 г. [82]
Influenza[editГрипп
Флублок Квадривалент — лицензированная рекомбинантная субъединичная вакцина для активной иммунизации против гриппа . Он содержит белки НА четырех штаммов вируса гриппа , очищенные и экстрагированные с использованием бакуловирус - насекомое системы экспрессии . Четыре вирусных штамма ежегодно стандартизируются в соответствии с требованиями Службы общественного здравоохранения США (USPHS) . [6]
Флублок Четырехвалентный имеет профиль безопасности, сравнимый с традиционными эквивалентами трехвалентной и четырехвалентной вакцины. Флублок также связан с меньшим количеством местных реакций (ОР = 0,94, 95% ДИ 0,90–0,98, три РКИ, МКЭ, I2 = 0%, доказательства низкой достоверности) и более высоким риском озноба (ОР = 1,33, 95% ДИ 1,03–0,98). 1,72, три РКИ, МКЭ, I2 = 14%, доказательства низкой определенности). [83]
Опоясывающий герпес [ править ]
ШИНГРИКС — лицензированная рекомбинантная субъединичная вакцина для защиты от опоясывающего герпеса , риск развития которого увеличивается по мере снижения к вирусу ветряной оспы (VZV) специфического иммунитета . Вакцина содержит VZV антигенный компонент gE, экстрагированный из клеток CHO , который необходимо восстановить с помощью адъювантной суспензии B. AS01 [7]
Были проведены систематические обзоры и метаанализы эффективности, результативности и безопасности ШИНГРИКСА у пациентов с ослабленным иммунитетом в возрасте 18–49 лет и здоровых взрослых в возрасте 50 лет и старше. В этих исследованиях сообщалось, что уровень гуморального и клеточно-опосредованного иммунитета колебался от 65,4 до 96,2% и от 50,0% до 93,0%, тогда как эффективность у пациентов (18-49 лет) с гематологическими злокачественными новообразованиями оценивалась в 87,2% (95% ДИ, 44,3–98,6%). до 13 месяцев после вакцинации с приемлемым профилем безопасности . [84] [85]
- КОВИД 19
НУВАКСОВИД — рекомбинантная субъединичная вакцина, лицензированная для профилактики инфекции SARS-CoV-2 . Разрешение на продажу было выдано 20 декабря 2021 года. [86] Вакцина содержит шиповый белок SARS-CoV-2, полученный с использованием бакуловируса системы экспрессии , который в конечном итоге адъювантируется Matrix M. адъювантом [8]
История [ править ]
Хотя практика иммунизации восходит к XII веку , когда древние китайцы того времени использовали технику вариоляции для придания иммунитета к инфекции оспы . [ нужна ссылка ] Современная эра вакцинации имеет короткую историю, насчитывающую около 200 лет. Все началось с изобретения Эдвардом Дженнером в 1798 году вакцины для искоренения оспы путем введения коровьей оспы . в организм человека относительно более слабого вируса [ нужна ссылка ]
Середина 20 века ознаменовала золотой век науки о вакцинах. [ нужна ссылка ] Быстрый технологический прогресс в этот период времени позволил ученым культивировать клеточную культуру в контролируемых условиях в лабораториях. [87] впоследствии это привело к производству вакцин против полиомиелита , кори и различных инфекционных заболеваний . [ нужна ссылка ] Конъюгированные вакцины были также разработаны с использованием иммунологических маркеров, включая капсульный полисахарид и белки . [87] от инфекций Создание продуктов, направленных на борьбу с распространенными заболеваниями, успешно снизило смертность и снизило нагрузку на общественное здравоохранение .
Появление методов генной инженерии произвело революцию в создании вакцин. К концу 20-го века у исследователей появилась возможность создавать рекомбинантные вакцины помимо традиционной цельноклеточной вакцины , например вакцину против гепатита B , которая использует вирусные антигены для инициации иммунных ответов . [87]
Поскольку методы производства продолжают развиваться, в будущем неизбежно будут создаваться вакцины с более сложным составом, которые расширят их терапевтическое применение как при инфекционных, так и при неинфекционных заболеваниях . [ нужна ссылка ] чтобы защитить здоровье большего числа людей.
Будущие направления [ править ]
Рекомбинантные субъединичные вакцины используются в разработке для лечения туберкулеза . [9] лихорадка денге , [10] гельминты, передающиеся через почву , [88] кошачий лейкоз [89] и COVID-19 . [90]
Субъединичные вакцины считаются эффективными не только против SARS-COV-2, но и в качестве кандидатов для разработки иммунизации против малярии, столбняка, сальмонеллы и других заболеваний. [11]
- КОВИД 19
Было проведено исследование с целью изучения возможности разработки гетерологичного SARS-CoV рекомбинантного белка, связывающего рецептор (RBD), в качестве вакцины для человека против COVID-19 . Теория подтверждается доказательствами того, что выздоравливающих сыворотка пациентов с SARS-CoV обладает способностью нейтрализовать SARS-CoV-2 (вирус, соответствующий Covid-19 ) и что аминокислотное сходство между SARS-CoV и пиком SARS-CoV-2 и RBD белок высокий (82%). [90]
Ссылки [ править ]
- ↑ Перейти обратно: Перейти обратно: а б с д и «Модуль 2 – Субъединичные вакцины» . Курс электронного обучения ВОЗ «Основы безопасности вакцин» . Архивировано из оригинала 8 августа 2021 г.
- ↑ Перейти обратно: Перейти обратно: а б с д и ж г «Что такое белковые субъединичные вакцины и как их можно использовать против COVID-19?» . ГАВИ . Архивировано из оригинала 17 августа 2021 г.
- ^ Фрэнсис MJ (март 2018 г.). «Последние достижения в области вакцинных технологий» . Ветеринарные клиники Северной Америки. Практика с мелкими животными . Вакцины и иммунология. 48 (2): 231–241. дои : 10.1016/j.cvsm.2017.10.002 . ПМЦ 7132473 . ПМИД 29217317 .
- ^ Лиддер П., Соннино А (2012). Биотехнологии для управления генетическими ресурсами для производства продовольствия и ведения сельского хозяйства . Достижения генетики. Том. 78. Эльзевир. стр. 1–167. дои : 10.1016/B978-0-12-394394-1.00001-8 . ISBN 9780123943941 . ПМИД 22980921 .
- ↑ Перейти обратно: Перейти обратно: а б «Гардасил 9 (9-валентная вакцина против вируса папилломы человека, рекомбинантная)» . Управление по контролю за продуктами и лекарствами . Архивировано из оригинала 29 августа 2023 г. Проверено 2 апреля 2023 г.
- ↑ Перейти обратно: Перейти обратно: а б с «Флублок Четырехвалентный (Вакцина против гриппа)» . Управление по контролю за продуктами и лекарствами . Архивировано из оригинала 26 марта 2023 г. Проверено 2 апреля 2023 г.
- ↑ Перейти обратно: Перейти обратно: а б с «Шингрикс (рекомбинантная вакцина против зостера с адъювантом)» . Управление по контролю за продуктами и лекарствами . Архивировано из оригинала 2 июля 2023 г. Проверено 2 апреля 2023 г.
- ↑ Перейти обратно: Перейти обратно: а б «Дисперсия Нуваксовида для инъекций, вакцина против COVID-19 (рекомбинантная, адъювантная)» (PDF) . Архивировано (PDF) из оригинала 17 августа 2022 г. Проверено 2 апреля 2023 г.
- ↑ Перейти обратно: Перейти обратно: а б Маскола-младший, Фаучи А.С. (февраль 2020 г.). «Новые вакцинные технологии XXI века» . Обзоры природы. Иммунология . 20 (2): 87–88. дои : 10.1038/s41577-019-0243-3 . ПМЦ 7222935 . ПМИД 31712767 .
- ↑ Перейти обратно: Перейти обратно: а б с Трипати Н.К., Шривастава А (23 августа 2018 г.). «Последние разработки в области вакцин против денге на основе рекомбинантных белков» . Границы в иммунологии . 9 : 1919. дои : 10.3389/fimmu.2018.01919 . ПМК 6115509 . ПМИД 30190720 .
- ↑ Перейти обратно: Перейти обратно: а б Куффари Б (2022). «Что такое субъединичная вакцина?» . Новости медицинских наук о жизни. Архивировано из оригинала 25 мая 2022 г. Проверено 12 января 2023 г.
- ^ Альбертс Б., Джонсон А., Льюис Дж., Рафф М., Робертс К., Уолтер П. (2002). Форма и структура белков . Нью-Йорк: Garland Science. Архивировано из оригинала 26 марта 2020 года . Проверено 15 апреля 2022 г.
- ^ Стокер HS (1 января 2015 г.). Общая, органическая и биологическая химия (7-е изд.). Бостон, Массачусетс: Cengage Learning. стр. 709–710. ISBN 978-1-305-68618-2 . Архивировано из оригинала 5 сентября 2023 года . Проверено 15 апреля 2022 г.
- ^ Смит МБ (27 апреля 2020 г.). Биохимия: подход органической химии . Бока-Ратон: CRC Press. п. 269-270. ISBN 978-1-351-25807-4 . Архивировано из оригинала 5 сентября 2023 года . Проверено 15 апреля 2022 г.
- ^ Виджаян М., Ятиндра Н., Коласкар А.С. (1999). «Мультибелковые сборки с симметрией точечной группы» . Виджаян М., Ятиндра Н., Коласкар А.С. (ред.). Перспективы структурной биологии: Том в честь Г. Н. Рамачандрана . Хайдарабад, Индия: Universities Press. стр. 449–466. ISBN 978-81-7371-254-8 . Архивировано из оригинала 8 ноября 2023 года . Проверено 15 апреля 2022 г.
- ↑ Перейти обратно: Перейти обратно: а б с д и ж Пламмер Э.М., Манчестер М. (2011). «Вирусные наночастицы и вирусоподобные частицы: платформы для разработки современных вакцин» . Междисциплинарные обзоры Wiley. Наномедицина и нанобиотехнологии . 3 (2): 174–196. дои : 10.1002/wnan.119 . ПМК 7169818 . ПМИД 20872839 .
- ↑ Перейти обратно: Перейти обратно: а б с д Хотез П.Дж., Боттацци М.Э. (январь 2022 г.). «Цельноинактивированные вирусные и белковые вакцины против COVID-19» . Ежегодный обзор медицины . 73 (1): 55–64. doi : 10.1146/annurev-med-042420-113212 . ПМИД 34637324 . S2CID 238747462 .
- ^ Ноад Р., Рой П. (сентябрь 2003 г.). «Вирусоподобные частицы как иммуногены». Тенденции в микробиологии . 11 (9): 438–444. дои : 10.1016/S0966-842X(03)00208-7 . PMID 13678860 .
- ↑ Перейти обратно: Перейти обратно: а б Ван М., Цзян С., Ван Ю (апрель 2016 г.). «Последние достижения в производстве рекомбинантных субъединичных вакцин против Pichia Pastoris» . Биоинженерия . 7 (3): 155–165. дои : 10.1080/21655979.2016.1191707 . ПМЦ 4927204 . ПМИД 27246656 .
- ^ Билл РМ (март 2015 г.). «Синтез вакцины на основе рекомбинантных белковых субъединиц у микробов: роль дрожжей?» . Журнал фармации и фармакологии . 67 (3): 319–328. дои : 10.1111/jphp.12353 . ПМИД 25556638 . S2CID 22339760 .
- ^ Декер Дж.М. "Вакцина" . Курс иммунологии 419 . Кафедра ветеринарных наук и микробиологии Университета Аризоны. Архивировано из оригинала 10 июня 2003 г.
- ^ Баяни Ф., Хашкаваи Н.С., Арджманд С., Резаи С., Ускокович В., Алиджанианзаде М. и др. (март 2023 г.). «Обзор вакцинных платформ для борьбы с COVID-19 с акцентом на субъединичные вакцины» . Прогресс биофизики и молекулярной биологии . 178 : 32–49. doi : 10.1016/j.pbiomolbio.2023.02.004 . ПМЦ 9938630 . ПМИД 36801471 .
- ^ Раффателлу М., Чесса Д., Уилсон Р.П., Дюсолд Р., Рубино С., Боймлер А.Дж. (июнь 2005 г.). «Капсульный антиген Vi Salmonella enterica серотипа Typhi снижает экспрессию интерлейкина-8, зависимую от Toll-подобного рецептора, в слизистой оболочке кишечника» . Инфекция и иммунитет . 73 (6): 3367–3374. дои : 10.1128/IAI.73.6.3367-3374.2005 . ПМЦ 1111811 . ПМИД 15908363 .
- ^ Ху X, Чен Z, Сюн К., Ван Дж, Рао X, Конг Ю (август 2017 г.). «Капсулярный полисахарид Vi: синтез, вирулентность и применение». Критические обзоры по микробиологии . 43 (4): 440–452. дои : 10.1080/1040841X.2016.1249335 . ПМИД 27869515 . S2CID 205694206 .
- ^ Лин Ф.Ю., Хо В.А., Кхием Х.Б., Трач Д.Д., Бэй П.В., Тхань Т.С. и др. (апрель 2001 г.). «Эффективность конъюгированной вакцины против Salmonella typhi Vi у детей в возрасте от двух до пяти лет» . Медицинский журнал Новой Англии . 344 (17): 1263–1269. дои : 10.1056/nejm200104263441701 . ПМИД 11320385 .
- ^ Поллард А. «Виды вакцин» . Оксфордская группа по вакцинам 2020 . Оксфордский университет. Архивировано из оригинала 16 ноября 2021 г. Проверено 12 января 2023 г.
- ^ Малонис Р.Дж., Лай Дж.Р., Верньолл О. (март 2020 г.). «Вакцины на основе пептидов: текущий прогресс и будущие проблемы» . Химические обзоры . 120 (6): 3210–3229. doi : 10.1021/acs.chemrev.9b00472 . ПМЦ 7094793 . ПМИД 31804810 .
- ^ Скварчинский М., Тот I (май 2011 г.). «Субъединичные нановакцины на основе пептидов». Текущая доставка лекарств . 8 (3): 282–289. дои : 10.2174/156720111795256192 . ПМИД 21291373 .
- ^ Калита П., Трипати Т. (май 2022 г.). «Методические достижения в разработке вакцин на основе пептидов». Открытие наркотиков сегодня . 27 (5). Эльзевир: 1367–1380. дои : 10.1016/j.drudis.2022.03.004 . ПМИД 35278703 . S2CID 247399368 .
- ↑ Перейти обратно: Перейти обратно: а б Бакстер Д. (декабрь 2007 г.). «Активный и пассивный иммунитет, типы вакцин, вспомогательные вещества и лицензирование» . Профессиональная медицина . 57 (8): 552–556. doi : 10.1093/ocmed/kqm110 . ПМИД 18045976 .
- ^ Насименто ИП, Лейте LC (декабрь 2012 г.). «Рекомбинантные вакцины и разработка новых стратегий вакцинации» . Бразильский журнал медицинских и биологических исследований . 45 (12): 1102–1111. дои : 10.1590/S0100-879X2012007500142 . ПМЦ 3854212 . ПМИД 22948379 .
- ^ Ван М., Цзян С., Ван Ю (апрель 2016 г.). «Последние достижения в производстве рекомбинантных субъединичных вакцин против Pichia Pastoris» . Биоинженерия . 7 (3): 155–165. дои : 10.1080/21655979.2016.1191707 . ПМЦ 4927204 . ПМИД 27246656 .
- ↑ Перейти обратно: Перейти обратно: а б с Седова Е.С., Щербинин Д.Н., Мигунов А.И., Смирнов И., Логунов Д.И., Шмаров М.М. и др. (октябрь 2012 г.). «Рекомбинантные вакцины против гриппа» . Акта Натурае . 4 (4): 17–27. дои : 10.32607/20758251-2012-4-4-17-27 . ПМЦ 3548171 . ПМИД 23346377 .
- ↑ Перейти обратно: Перейти обратно: а б с Андерссон К. Производство и доставка рекомбинантных субъединичных вакцин . OCLC 1301470908 .
- ^ Родригес СМ, Плоткин С.А. (14 июля 2020 г.). «Воздействие вакцин; здравоохранение, экономические и социальные перспективы» . Границы микробиологии . 11 : 1526. дои : 10.3389/fmicb.2020.01526 . ПМК 7371956 . ПМИД 32760367 .
- ↑ Перейти обратно: Перейти обратно: а б с д Клем А.С. (январь 2011 г.). «Основы вакцинной иммунологии» . Журнал глобальных инфекционных заболеваний . 3 (1): 73–78. дои : 10.4103/0974-777X.77299 . ПМК 3068582 . ПМИД 21572612 .
- ↑ Перейти обратно: Перейти обратно: а б с д Сэйлор К., Гиллам Ф., Лонейс Т., Чжан С. (24 февраля 2020 г.). «Разработка структуры и состава антигена для повышения эффективности белковых вакцин» . Границы в иммунологии . 11 (283): 283. дои : 10.3389/fimmu.2020.00283 . ПМК 7050619 . ПМИД 32153587 .
- ↑ Перейти обратно: Перейти обратно: а б ЛеБьен Т.В., Теддер Т.Ф. (сентябрь 2008 г.). «В-лимфоциты: как они развиваются и функционируют» . Кровь . 112 (5): 1570–1580. doi : 10.1182/blood-2008-02-078071 . ПМК 2518873 . ПМИД 18725575 .
- ^ Каллон С., Самир С., Гунетиллеке Н. (апрель 2021 г.). «Вакцины: основные принципы разработки и тестирования» . Клиническая фармакология и терапия . 109 (4): 987–999. дои : 10.1002/cpt.2207 . ПМК 8048882 . ПМИД 33705574 .
- ^ Куртсингер Дж. М., Джонсон К. М., Мешер М. Ф. (ноябрь 2003 г.). «Клональная экспансия CD8 Т-клеток и развитие эффекторной функции требуют длительного воздействия антигена, костимуляции и сигнального цитокина 3» . Журнал иммунологии . 171 (10): 5165–5171. дои : 10.4049/jimmunol.171.10.5165 . ПМИД 14607916 . S2CID 24326081 .
- ^ Кларквист Дж., Кросс Э.В., Томпсон С.Б., Уиллетт Б., Олдридж Д.Л., Кэффри-Карр А.К. и др. (август 2021 г.). «В-клетки стимулируют первичную реакцию Т-клеток CD8 и реакцию памяти на субъединичные вакцины» . Отчеты по ячейкам . 36 (8): 109591. doi : 10.1016/j.celrep.2021.109591 . ПМЦ 8456706 . ПМИД 34433030 .
- ^ Уайкс М., Макферсон Дж. (май 2000 г.). «Взаимодействие дендритных клеток и B-клеток: дендритные клетки обеспечивают B-клетки CD40-независимыми сигналами пролиферации и CD40-зависимыми сигналами выживания» . Иммунология . 100 (1): 1–3. дои : 10.1046/j.1365-2567.2000.00044.x . ПМК 2326988 . ПМИД 10809952 .
- ^ Мэн Х., Мао Дж., Е Ц. (июнь 2022 г.). «Стратегия ревакцинации: необходимость, цели иммунизации, стратегия иммунизации и безопасность». Журнал медицинской вирусологии . 94 (6): 2369–2375. дои : 10.1002/jmv.27590 . ПМИД 35028946 . S2CID 245933504 .
- ↑ Перейти обратно: Перейти обратно: а б Линдског М., Рокберг Дж., Улен М., Стерки Ф. (май 2005 г.). «Выбор белковых эпитопов для продукции антител» . БиоТехники . 38 (5): 723–727. дои : 10.2144/05385ST02 . ПМИД 15945371 .
- ^ Тейссен П., изд. (1 января 1985 г.). «Глава 4. Природа иммуногенов, антигенов и гаптенов». Лабораторные методы в биохимии и молекулярной биологии . Практика и теория иммуноферментных анализов. Том. 15. Эльзевир. стр. 39–41. дои : 10.1016/S0075-7535(08)70134-7 . ISBN 9780444806345 .
- ↑ Перейти обратно: Перейти обратно: а б Лильеквист С., Столь С. (июль 1999 г.). «Производство рекомбинантных субъединичных вакцин: белковые иммуногены, живые системы доставки и вакцины на основе нуклеиновых кислот». Журнал биотехнологии . 73 (1): 1–33. дои : 10.1016/s0168-1656(99)00107-8 . ПМИД 10483112 .
- ^ Фрэнсис MJ (март 2018 г.). «Последние достижения в области вакцинных технологий» . Ветеринарные клиники Северной Америки. Практика с мелкими животными . 48 (2): 231–241. дои : 10.1016/j.cvsm.2017.10.002 . ПМЦ 7132473 . ПМИД 29217317 .
- ↑ Перейти обратно: Перейти обратно: а б с д и ж г час я Феррер-Миральес Н., Доминго-Эспин Х., Корчеро Х.Л., Васкес Э., Вильяверде А. (март 2009 г.). «Микробные фабрики по производству рекомбинантных фармацевтических препаратов» . Заводы по производству микробных клеток . 8 (1): 17. дои : 10.1186/1475-2859-8-17 . ПМК 2669800 . ПМИД 19317892 .
- ↑ Перейти обратно: Перейти обратно: а б с д и Корчеро Дж.Л., Гассер Б., Ресина Д., Смит В., Паррилли Е., Васкес Ф. и др. (2013). «Нетрадиционные микробные системы для экономичного производства высококачественных белковых терапевтических средств». Достижения биотехнологии . 31 (2): 140–153. doi : 10.1016/j.biotechadv.2012.09.001 . ПМИД 22985698 .
- ↑ Перейти обратно: Перейти обратно: а б Тагучи С., Оой Т., Мизуно К., Мацусаки Х. (ноябрь 2015 г.). «Достижения и потребности в производстве штаммов, не содержащих эндотоксинов». Прикладная микробиология и биотехнология . 99 (22): 9349–9360. дои : 10.1007/s00253-015-6947-9 . ПМИД 26362682 . S2CID 8308134 .
- ^ Гернгросс ТУ (ноябрь 2004 г.). «Достижения в производстве человеческих терапевтических белков дрожжами и мицелиальными грибами». Природная биотехнология . 22 (11): 1409–1414. дои : 10.1038/nbt1028 . ПМИД 15529166 . S2CID 22230030 .
- ^ Чжу Дж (2012). «Экспрессия белков клеток млекопитающих для биофармацевтического производства». Достижения биотехнологии . 30 (5): 1158–1170. doi : 10.1016/j.biotechadv.2011.08.022 . ПМИД 21968146 .
- ^ Баешен Н.А., Баешен М.Н., Шейх А., Бора Р.С., Ахмед М.М., Рамадан Х.А. и др. (октябрь 2014 г.). «Клеточные заводы по производству инсулина» . Заводы по производству микробных клеток . 13 (1): 141. дои : 10.1186/s12934-014-0141-0 . ПМК 4203937 . ПМИД 25270715 .
- ↑ Перейти обратно: Перейти обратно: а б Джарвис Д.Л. (2009). «Глава 14 Системы экспрессии бакуловируса в клетках насекомых». Руководство по очистке белков, 2-е издание . Методы энзимологии. Том. 463. Эльзевир. стр. 191–222. дои : 10.1016/s0076-6879(09)63014-7 . ISBN 9780123745361 . ПМИД 19892174 .
- ^ Галлено М., Больной Эй.Дж. (1999). «Векторная система экспрессии бакуловируса». Системы экспрессии генов . Эльзевир. стр. 331–363.
- ↑ Перейти обратно: Перейти обратно: а б «ЦЕРВАРИКС [двухвалентная вакцина против вируса папилломы человека (типы 16 и 18), рекомбинантная)» . Управление по контролю за продуктами и лекарствами . Архивировано из оригинала 29 августа 2023 г. Проверено 2 апреля 2023 г.
- ^ Wingfield PT (апрель 2015 г.). «Обзор очистки рекомбинантных белков» . Современные протоколы в науке о белках . 80 (1): 6.1.1–6.1.35. дои : 10.1002/0471140864.ps0601s80 . ПМЦ 4410719 . ПМИД 25829302 .
- ↑ Перейти обратно: Перейти обратно: а б с д и Шах Р.Р. (2017). «Обзор вакцинных адъювантов: введение, история и текущий статус». В Fox CB, Хассетт К.Дж., Брито Л.А. (ред.). Адъюванты для вакцин . Методы молекулярной биологии. Том. 1494. Нью-Йорк, штат Нью-Йорк: Спрингер Нью-Йорк. стр. 1–13. дои : 10.1007/978-1-4939-6445-1_1 . ISBN 978-1-4939-6443-7 . ПМИД 27718182 .
- ^ Коффман Р.Л., Шер А., Седер Р.А. (октябрь 2010 г.). «Вакцинальные адъюванты: задействуем врожденный иммунитет» . Иммунитет . 33 (4): 492–503. doi : 10.1016/j.immuni.2010.10.002 . ПМК 3420356 . ПМИД 21029960 .
- ↑ Перейти обратно: Перейти обратно: а б с д Солер Э., Удебин Л.М. (2007). «Приготовление рекомбинантных вакцин» . Ежегодный обзор биотехнологии . 13 . Эльзевир: 65–94. дои : 10.1016/s1387-2656(07)13004-0 . ISBN 978-0-444-53032-5 . ПМК 7106376 . ПМИД 17875474 .
- ↑ Перейти обратно: Перейти обратно: а б Рамбе Д.С., Дель Джудиче Дж., Росси С., Саникас М. (6 июля 2015 г.). «Безопасность и механизм действия лицензированных адъювантов вакцин» . Международный текущий фармацевтический журнал . 4 (8): 420–431. дои : 10.3329/icpj.v4i8.24024 . ISSN 2224-9486 .
- ↑ Перейти обратно: Перейти обратно: а б Ци Ф, Ву Дж, Ли Х, Ма Г (09 июня 2018 г.). «Последние исследования и разработки микросфер/наночастиц PLGA/PLA: обзор научных и промышленных аспектов». Границы химической науки и техники . 13 (1): 14–27. дои : 10.1007/s11705-018-1729-4 . ISSN 2095-0179 . S2CID 103993541 .
- ^ Вартак А., Сучек С.Дж. (апрель 2016 г.). «Последние достижения в области субъединичных носителей вакцин» . Вакцина . 4 (2): 12. doi : 10.3390/vaccines4020012 . ПМЦ 4931629 . ПМИД 27104575 .
- ↑ Перейти обратно: Перейти обратно: а б с д Бакстер Д. (декабрь 2007 г.). «Активный и пассивный иммунитет, типы вакцин, вспомогательные вещества и лицензирование» . Профессиональная медицина . 57 (8): 552–556. doi : 10.1093/ocmed/kqm110 . ПМИД 18045976 .
- ↑ Перейти обратно: Перейти обратно: а б с д Мойл П.М., Тот I (март 2013 г.). «Современные субъединичные вакцины: разработка, компоненты и возможности исследований». ХимМедХим . 8 (3): 360–376. дои : 10.1002/cmdc.201200487 . ПМИД 23316023 . S2CID 205647062 .
- ↑ Перейти обратно: Перейти обратно: а б с д Вартак А., Сучек С.Дж. (апрель 2016 г.). «Последние достижения в области субъединичных носителей вакцин» . Вакцина . 4 (2): 12. doi : 10.3390/vaccines4020012 . ПМЦ 4931629 . ПМИД 27104575 .
- ↑ Перейти обратно: Перейти обратно: а б Коста АП, Кобуччи РН, да Силва ЖМ, да Коста Лима ПХ, Хиральдо ПК, Гонсалвеш АК (2017). «Безопасность 9-валентной вакцины против вируса папилломы человека: метаанализ рандомизированных исследований» . Журнал иммунологических исследований . 2017 : 3736201. doi : 10.1155/2017/3736201 . ПМК 5546048 . ПМИД 28812030 .
- ^ Кокс М.М., Изиксон Р., Пост П., Данкл Л. (июль 2015 г.). «Безопасность, эффективность и иммуногенность Флублока в профилактике сезонного гриппа у взрослых» . Терапевтические достижения в области вакцин . 3 (4): 97–108. дои : 10.1177/2051013615595595 . ПМЦ 4591523 . ПМИД 26478817 .
- ^ Джеймс С.Ф., Шахин Э.Б., Сучер А.Дж., Ханна С. (июль 2018 г.). «Шингрикс: новая рекомбинантная вакцина против опоясывающего герпеса с адъювантом». Анналы фармакотерапии . 52 (7): 673–680. дои : 10.1177/1060028018758431 . ПМИД 29457489 . S2CID 206644211 .
- ^ «Возможные побочные эффекты от вакцин» . Центры США по контролю и профилактике заболеваний (CDC) . 06 апреля 2022 г. Архивировано из оригинала 17 марта 2017 г. Проверено 13 апреля 2022 г.
- ^ МакНил М.М., ДеСтефано Ф. (февраль 2018 г.). «Вакцино-ассоциированная гиперчувствительность» . Журнал аллергии и клинической иммунологии . 141 (2): 463–472. дои : 10.1016/j.jaci.2017.12.971 . ПМК 6602527 . ПМИД 29413255 .
- ^ Финк А.Л., Кляйн С.Л. (ноябрь 2015 г.). «Секс и гендерное влияние на иммунную реакцию на вакцины среди пожилых людей» . Физиология . 30 (6): 408–416. дои : 10.1152/физиол.00035.2015 . ПМК 4630198 . ПМИД 26525340 .
- ^ Кроу Дж. Э. (июль 2007 г.). «Генетическая предрасположенность к нежелательным явлениям после вакцинации». Журнал инфекционных болезней . 196 (2): 176–177. дои : 10.1086/518800 . ПМИД 17570102 . S2CID 14121320 .
- ↑ Перейти обратно: Перейти обратно: а б «Руководство ACIP по противопоказаниям для иммунизации» . Центры США по контролю и профилактике заболеваний (CDC) . 2022-03-22. Архивировано из оригинала 01 мая 2019 г. Проверено 14 апреля 2022 г.
- ^ Агентство общественного здравоохранения Канады (18 июля 2007 г.). «Противопоказания и меры предосторожности: Канадское руководство по иммунизации» . www.canada.ca . Архивировано из оригинала 25 мая 2023 г. Проверено 14 апреля 2022 г.
- ↑ Перейти обратно: Перейти обратно: а б «РЕКОМБИВАКС HB Вакцина против гепатита В (рекомбинантная)» (PDF) . Управление по контролю за продуктами и лекарствами . Архивировано (PDF) из оригинала 19 мая 2023 г. Проверено 2 апреля 2023 г.
- ↑ Перейти обратно: Перейти обратно: а б «ENGERIX-B [Вакцина против гепатита B (рекомбинантная)]» (PDF) . Управление по контролю за продуктами и лекарствами . Архивировано (PDF) из оригинала 8 апреля 2022 г. Проверено 2 апреля 2023 г.
- ^ Ван Ден Энде К., Марано К., Ван Ахи А., Бунге Э.М., Де Мурлуз Л. (август 2017 г.). «Иммуногенность и безопасность рекомбинантной вакцины против гепатита B компании GSK у взрослых: систематический обзор 30-летнего опыта» . Экспертная оценка вакцин . 16 (8): 811–832. дои : 10.1080/14760584.2017.1338568 . ПМИД 28573913 . S2CID 4721288 .
- ^ «Гардасил [четырехвалентная вакцина против вируса папилломы человека (типы 6, 11, 16 и 18), рекомбинантная)» (PDF) . Управление по контролю за продуктами и лекарствами . Архивировано (PDF) из оригинала 16 июня 2023 г.
- ^ Гонсалвеш АК, Кобуччи РН, Родригес ХМ, де Мело АГ, Хиральдо ПК (2014). «Безопасность, переносимость и побочные эффекты вакцин против вируса папилломы человека: систематический количественный обзор» . Бразильский журнал инфекционных заболеваний . 18 (6): 651–659. дои : 10.1016/j.bjid.2014.02.005 . ПМЦ 9425215 . ПМИД 24780368 .
- ^ «Гардасил-4 больше не доступен» . Центры США по контролю и профилактике заболеваний (CDC). 23 мая 2022 года. Архивировано из оригинала 15 октября 2019 года . Проверено 2 апреля 2023 г.
- ^ Сагоновский Э (21 октября 2016 г.). «GSK уходит с рынка США со своей вакциной против ВПЧ Cervarix» . Жесткая Фарма . Архивировано из оригинала 9 июля 2021 г. Проверено 15 марта 2022 г.
- ^ О Мурчу Э., Комбер Л., Джордан К., Хокшоу С., Маршалл Л., О'Нил М. и др. (февраль 2022 г.). «Систематический обзор эффективности, результативности и безопасности рекомбинантных гемагглютининовых вакцин против сезонного гриппа для профилактики лабораторно подтвержденного гриппа у лиц в возрасте ≥18 лет». Обзоры по медицинской вирусологии . 33 (3): e2331. дои : 10.1002/rmv.2331 . ПМИД 35106885 . S2CID 246475234 .
- ^ Расин Э, Гилка В, Амини Р, Тунис М, Исмаил С, Соважо С (сентябрь 2020 г.). «Систематический обзор литературы по использованию рекомбинантной субъединичной вакцины против опоясывающего герпеса у пациентов в возрасте 18–49 лет с ослабленным иммунитетом». Вакцина . 38 (40): 6205–6214. doi : 10.1016/j.vaccine.2020.07.049 . ПМИД 32788132 . S2CID 221123883 .
- ^ Трикко А.С., Зарин В., Кардозо Р., Вероники А.А., Хан П.А., Нинчич В. и др. (октябрь 2018 г.). «Эффективность, результативность и безопасность вакцин против опоясывающего герпеса у взрослых в возрасте 50 лет и старше: систематический обзор и сетевой метаанализ» . БМЖ . 363 :к4029. дои : 10.1136/bmj.k4029 . ПМК 6201212 . ПМИД 30361202 .
- ^ «Нуваксовид Вакцина против COVID-19 (рекомбинантная, адъювантная)» . 17 декабря 2021 года. Архивировано из оригинала 23 декабря 2021 года . Проверено 2 апреля 2023 г.
- ↑ Перейти обратно: Перейти обратно: а б с Плоткин С. (август 2014 г.). «История вакцинации» . Труды Национальной академии наук Соединенных Штатов Америки . 111 (34): 12283–12287. Бибкод : 2014PNAS..11112283P . дои : 10.1073/pnas.1400472111 . ПМЦ 4151719 . ПМИД 25136134 .
- ^ Полдень Дж.Б., Ароян Р.В. (декабрь 2017 г.). «Рекомбинантные субъединичные вакцины против почвенных гельминтов» . Паразитология . 144 (14): 1845–1870. дои : 10.1017/S003118201700138X . ПМЦ 5729844 . ПМИД 28770689 .
- ^ Марчиани DJ, Кенсил ЧР, Бельц Г.А., Хунг CH, Кронье Дж., Обер А. (февраль 1991 г.). «Генетически-инженерная субъединичная вакцина против вируса лейкоза кошек: защитный иммунный ответ у кошек». Вакцина . 9 (2): 89–96. дои : 10.1016/0264-410x(91)90262-5 . ПМИД 1647576 .
- ↑ Перейти обратно: Перейти обратно: а б Чен В.Х., Хотез П.Дж., Боттацци М.Э. (июнь 2020 г.). «Возможность разработки рекомбинантного белка рецептор-связывающего домена SARS-CoV (RBD) в качестве гетерологичной человеческой вакцины против коронавирусного инфекционного заболевания (COVID)-19» . Человеческие вакцины и иммунотерапия . 16 (6): 1239–1242. дои : 10.1080/21645515.2020.1740560 . ПМЦ 7482854 . ПМИД 32298218 .