Гликозилирование
Гликозилирование — это реакция, в которой углевод (или « гликан »), то есть гликозильный донор , присоединяется к гидроксильной или другой функциональной группе другой молекулы ( гликозильный акцептор ) с целью образования гликоконъюгата . В биологии (но не всегда в химии) гликозилирование обычно относится к реакции, катализируемой ферментами, тогда как гликирование (также «неферментативное гликирование» и «неферментативное гликозилирование») может относиться к неферментативной реакции. [ 1 ]
Гликозилирование — это форма котрансляционной и посттрансляционной модификации . Гликаны выполняют разнообразные структурные и функциональные роли в мембранных и секретируемых белках. [ 2 ] Большинство белков, синтезируемых в шероховатой эндоплазматической сети, подвергаются гликозилированию. Гликозилирование также присутствует в цитоплазме и ядре в виде модификации O -GlcNAc . Агликозилирование — это особенность сконструированных антител, позволяющая обходить гликозилирование. [ 3 ] [ 4 ] Производятся пять классов гликанов:
- N присоединенные к азоту аспарагина -связанные гликаны , или аргинина боковых цепей . N -связанное гликозилирование требует участия специального липида, называемого долихолфосфатом .
- О связанные гликаны присоединены к гидроксильному кислороду серина - , треонина , тирозина , гидроксилизина или гидроксипролина боковых цепей или к атомам кислорода на липидах, таких как церамиды .
- Фосфогликаны связаны через фосфат фосфосерина.
- С -связанные гликаны, редкая форма гликозилирования, при которой сахар добавляется к углероду на триптофана боковой цепи . Алоин – одно из немногих веществ природного происхождения.
- Глипирование , которое представляет собой добавление якоря GPI, который связывает белки с липидами посредством гликановых связей.
Цель
[ редактировать ]Гликозилирование – это процесс, посредством которого углевод присоединяется ковалентно к целевой макромолекуле , обычно белкам и липидам . Эта модификация выполняет различные функции. [ 5 ] Например, некоторые белки не сворачиваются правильно, если они не гликозилированы. [ 2 ] В других случаях белки нестабильны, если они не содержат олигосахариды, связанные по амидному азоту определенных аспарагина остатков . Влияние гликозилирования на сворачивание и стабильность гликопротеина двоякое. Во-первых, хорошо растворимые гликаны могут оказывать прямое физико-химическое стабилизирующее действие. Во-вторых, N -связанные гликаны опосредуют критическую контрольную точку контроля качества сворачивания гликопротеинов в эндоплазматическом ретикулуме. [ 6 ] Гликозилирование также играет роль в межклеточной адгезии (механизм, используемый клетками иммунной системы ) посредством сахаросвязывающих белков, называемых лектинами , которые распознают определенные углеводные фрагменты. [ 2 ] Гликозилирование является важным параметром оптимизации многих препаратов на основе гликопротеинов, таких как моноклональные антитела . [ 6 ] Гликозилирование также лежит в основе системы групп крови АВО . Именно наличие или отсутствие гликозилтрансфераз определяет, какие антигены группы крови представлены и, следовательно, какая специфичность антител проявляется. Эта иммунологическая роль вполне могла способствовать диверсификации гетерогенности гликанов и создавать барьер для зоонозной передачи вирусов. [ 7 ] Кроме того, гликозилирование часто используется вирусами для защиты основного вирусного белка от иммунного распознавания. Ярким примером является плотный гликановый щит оболочки вируса иммунодефицита человека . [ 8 ]
В целом, гликозилирование необходимо понимать с учетом вероятного давления эволюционного отбора, которое его сформировало. В одной модели диверсификацию можно рассматривать исключительно как результат эндогенной функциональности (например, торговли клетками ). Однако более вероятно, что диверсификация обусловлена уклонением от механизма заражения патогеном (например, прикреплением Helicobacter к терминальным остаткам сахарида) и что разнообразие внутри многоклеточного организма затем используется эндогенно.
Гликозилирование также может модулировать термодинамическую и кинетическую стабильность белков. [ 9 ]
Разнообразие гликопротеинов
[ редактировать ]Гликозилирование увеличивает разнообразие протеома , поскольку почти каждый аспект гликозилирования может быть изменен, в том числе:
- Гликозидная связь — место гликановой связи.
- Гликановый состав — типы сахаров, связанных с данным белком.
- Гликановая структура — может представлять собой неразветвленные или разветвленные цепи сахаров.
- Длина гликана — могут представлять собой олигосахариды с короткой или длинной цепью.
Механизмы
[ редактировать ]Существуют различные механизмы гликозилирования, хотя большинство из них имеют несколько общих черт: [ 2 ]
- Гликозилирование, в отличие от гликирования , представляет собой ферментативный процесс. Действительно, гликозилирование считается наиболее сложной посттрансляционной модификацией из-за большого количества задействованных ферментативных стадий. [ 10 ]
- Молекула-донор часто представляет собой активированный нуклеотидный сахар .
- Этот процесс не является шаблонным (в отличие от транскрипции белков ДНК или трансляции ); вместо этого клетка полагается на разделение ферментов по различным клеточным компартментам (например, эндоплазматическая сеть , цистерны в аппарате Гольджи ). Следовательно, гликозилирование представляет собой сайт-специфическую модификацию.
Типы
[ редактировать ]N- связанное гликозилирование
[ редактировать ]N -связанное гликозилирование является очень распространенной формой гликозилирования и важно для сворачивания многих эукариотических гликопротеинов, а также для прикрепления клетка-клетка и клетка- внеклеточный матрикс . Процесс N -связанного гликозилирования происходит у эукариот в просвете эндоплазматической сети и широко у архей , но очень редко у бактерий . В дополнение к своей функции по сворачиванию белка и прикреплению к клеткам, N -связанные гликаны белка могут модулировать функцию белка, в некоторых случаях действуя как переключатель включения/выключения.
О- связанное гликозилирование
[ редактировать ]О -связанное гликозилирование — это форма гликозилирования, которая происходит у эукариот в аппарате Гольджи . [ 11 ] но также встречается у архей и бактерий .
Гликозилирование фосфосерина
[ редактировать ]ксилозе , фукозе , маннозе и GlcNAc фосфосерингликанах о В литературе сообщалось . Фукоза и GlcNAc обнаружены только у Dictyostelium discoideum , манноза у Leishmania mexicana и ксилоза у Trypanosoma cruzi . Недавно сообщалось о маннозе у позвоночных, мышей Mus musculus , на альфа-дистрогликане рецептора ламинина на клеточной поверхности. 4 . Было высказано предположение, что это редкое открытие может быть связано с тем фактом, что альфа-дистрогликан высоко консервативен от низших позвоночных до млекопитающих. [ 12 ]
C -маннозилирование
[ редактировать ]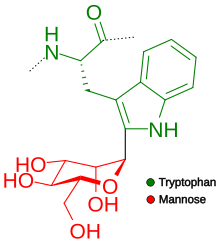
( в последовательности W –X–X–W добавляется маннозный сахар К первому остатку триптофана W обозначает триптофан; X – любая аминокислота). Связь CC образуется между первым углеродом альфа-маннозы и вторым углеродом триптофана. [ 13 ] Однако не все последовательности, имеющие этот паттерн, являются маннозилированными. Установлено, что на самом деле их только две трети и что существует явное предпочтение, чтобы вторая аминокислота была одной из полярных (Ser, Ala , Gly для того, чтобы произошло маннозилирование, и Thr). Недавно произошел прорыв в технике прогнозирования того, будет ли последовательность иметь сайт маннозилирования, что обеспечивает точность 93% по сравнению с точностью 67%, если мы просто рассмотрим мотив WXXW. [ 14 ]
Тромбоспондины являются одними из белков, наиболее часто модифицируемых таким образом. Однако существует еще одна группа белков, подвергающихся C -маннозилированию, — рецепторы цитокинов I типа . [ 15 ] C- маннозилирование необычно, поскольку сахар связан с углеродом, а не с химически активным атомом, таким как азот или кислород . В 2011 году была определена первая кристаллическая структура белка, содержащего этот тип гликозилирования, — 8-го компонента комплемента человека. [ 16 ] В настоящее время установлено, что 18% белков человека , секретируемых и трансмембранных, подвергаются процессу С-маннозилирования. [ 14 ] Многочисленные исследования показали, что этот процесс играет важную роль в секреции белков, содержащих тромбоспондин типа 1 , которые сохраняются в эндоплазматическом ретикулуме , если они не подвергаются С-маннозилированию. [ 14 ] Это объясняет, почему тип цитокиновых рецепторов , рецептор эритропоэтина, остался в эндоплазматическом ретикулуме , если в нем отсутствовали сайты C-маннозилирования. [ 17 ]
Формирование якорей GPI (глипиирование)
[ редактировать ]Глипирование — это особая форма гликозилирования, характеризующаяся образованием якоря GPI . При этом виде гликозилирования белок прикрепляется к липидному якорю через гликановую цепь. (См. также пренилирование .)
Химическое гликозилирование
[ редактировать ]Гликозилирование можно также осуществлять с помощью средств синтетической органической химии . В отличие от биохимических процессов, синтетическая гликохимия в значительной степени опирается на защитные группы. [ 18 ] (например, 4,6- O -бензилиден) для достижения желаемой региоселективности. Другой проблемой химического гликозилирования является стереоселективность, заключающаяся в том, что каждая гликозидная связь имеет два стереорезультата: α/β или цис / транс . Обычно α- или цис- гликозиды синтезировать сложнее. [ 19 ] Разработаны новые методы, основанные на участии растворителя или образовании бициклических ионов сульфония в качестве хирально-вспомогательных групп. [ 20 ]
Неферментативное гликозилирование
[ редактировать ]Неферментативное гликозилирование также известно как гликирование или неферментативное гликирование. Это спонтанная реакция и тип посттрансляционной модификации белков, означающий изменение их структуры и биологической активности. Это ковалентное соединение между карбонильной группой редуцирующего сахара (в основном глюкозы и фруктозы) и боковой цепью аминокислоты белка. В этом процессе вмешательство фермента не требуется. Это происходит поперек и вблизи водных каналов и выступающих канальцев. [ 21 ]
Сначала в результате реакции образуются временные молекулы, которые позже подвергаются различным реакциям ( перегруппировки Амадори , реакции основания Шиффа , реакции Майяра , сшивания ...) и образуют постоянные остатки, известные как конечные продукты продвинутого гликирования (AGE).
КПГ накапливаются в долгоживущих внеклеточных белках, таких как коллаген. [ 22 ] который является наиболее гликированным и структурно распространенным белком, особенно у человека. Кроме того, некоторые исследования показали, что лизин может вызывать спонтанное неферментативное гликозилирование. [ 23 ]
Роль AGE
[ редактировать ]AGE несут ответственность за многие вещи. Эти молекулы играют важную роль, особенно в питании, они отвечают за коричневатый цвет, а также аромат и вкус некоторых продуктов. Показано, что приготовление при высокой температуре приводит к получению различных пищевых продуктов с высоким уровнем КПГ. [ 24 ]
Повышенный уровень КПГ в организме оказывает прямое влияние на развитие многих заболеваний. Он имеет прямое отношение к сахарному диабету 2 типа , который может привести ко многим осложнениям, таким как: катаракта , почечная недостаточность , повреждение сердца... [ 25 ] А если они присутствуют на пониженном уровне, снижается эластичность кожи, что является важным признаком старения. [ 22 ]
Они также являются предшественниками многих гормонов и регулируют и модифицируют механизмы их рецепторов на уровне ДНК . [ 22 ]
Дегликозилирование
[ редактировать ]Существуют разные ферменты , удаляющие гликаны из белков или удаляющие часть сахарной цепи.
- α2-3,6,8,9-нейраминидаза (из Arthrobacter ureafaciens ): расщепляет все невосстанавливающие концевые разветвленные и неразветвленные сиаловые кислоты .
- β1,4-галактозидаза (из Streptococcus pneumoniae ): высвобождает только β1,4-связанную невосстанавливающую концевую галактозу из сложных углеводов и гликопротеинов .
- β- N -ацетилглюкозаминидаза (из Streptococcus pneumoniae): расщепляет все невосстанавливающие концевые β-связанные остатки N-ацетилглюкозамина из сложных углеводов и гликопротеинов.
- эндо -α- N -ацетилгалактозаминидаза ( О -гликозидаза из Streptococcus pneumoniae ): удаляет O -гликозилирование. Этот фермент расщепляет связанную с серином или треонином незамещенную Galβ1,3GalNAc.
- PNGаза F : расщепляет аспарагин -связанные олигосахариды, если ядро α1,3 не фукозилировано.
Регуляция передачи сигналов Notch
[ редактировать ]Передача сигналов Notch представляет собой клеточный сигнальный путь, роль которого, среди многих других, заключается в контроле процесса клеточной дифференцировки в эквивалентных клетках-предшественниках . [ 26 ] Это означает, что он имеет решающее значение для эмбрионального развития, вплоть до того, что на мышах было проверено, что удаление гликанов в белках Notch может привести к эмбриональной гибели или порокам развития жизненно важных органов, таких как сердце. [ 27 ]
Некоторыми специфическими модуляторами, контролирующими этот процесс, являются гликозилтрансферазы, локализованные в эндоплазматическом ретикулуме и аппарате Гольджи . [ 28 ] Белки Notch проходят через эти органеллы в процессе созревания и могут подвергаться различным типам гликозилирования: N-связанному гликозилированию и O-связанному гликозилированию (более конкретно: O-связанной глюкозе и O-связанной фукозе). [ 26 ]
Все белки Notch модифицируются O-фукозой, поскольку они имеют общую черту: консенсусные последовательности O-фукозилирования . [ 26 ] Одним из модуляторов, которые вмешиваются в этот процесс, является Fringe, гликозилтрансфераза, которая модифицирует О-фукозу, активируя или деактивируя части передачи сигналов, действуя как положительный или отрицательный регулятор соответственно. [ 28 ]
Клинический
[ редактировать ]Существует три типа нарушений гликозилирования, классифицированных по типу изменений, вносимых в процесс гликозилирования: врожденные изменения, приобретенные изменения и неферментативные приобретенные изменения.
- Врожденные изменения: более 40 врожденных нарушений гликозилирования (CGD). у людей зарегистрировано [ 29 ] Их можно разделить на четыре группы: нарушения белка N гликозилирования , нарушения гликозилирования белка O , нарушения гликозилирования липидов и нарушения других путей гликозилирования и множественных путей гликозилирования. Эффективное лечение любого из этих расстройств не известно. 80% из них поражают нервную систему. [ нужна ссылка ]
- Приобретенные изменения: во второй группе основными заболеваниями являются инфекционные заболевания, аутоиммунные заболевания или рак . В этих случаях изменения гликозилирования являются причиной определенных биологических событий. Например, при ревматоидном артрите (РА) организм пациента вырабатывает антитела против фермента галактозилтрансферазы лимфоцитов, который ингибирует гликозилирование IgG. Следовательно, изменения в N-гликозилировании вызывают иммунодефицит, связанный с этим заболеванием. В этой второй группе мы также можем найти расстройства, вызванные мутациями ферментов, которые контролируют гликозилирование белков Notch, такие как синдром Алажилля . [ 28 ]
- Неферментативные приобретенные изменения. Неферментативные нарушения также бывают приобретенными, но они обусловлены отсутствием ферментов, присоединяющих олигосахариды к белку. В этой группе выделяются болезнь Альцгеймера и диабет . [ 30 ]
Все эти заболевания трудно диагностировать, поскольку они поражают не только один орган, но и многие из них и по-разному. Как следствие, их также трудно лечить. Однако благодаря многочисленным достижениям, достигнутым в секвенировании следующего поколения , ученые теперь могут лучше понять эти нарушения и открыть новые CDG. [ 31 ]
Влияние на терапевтическую эффективность
[ редактировать ]Сообщалось, что гликозилирование млекопитающих может повысить терапевтическую эффективность биотерапевтических препаратов . Например, терапевтическая эффективность рекомбинантного человеческого интерферона гамма , экспрессированного на платформе HEK 293 , была улучшена в отношении устойчивых к лекарственным средствам рака яичников . клеточных линий [ 32 ]
См. также
[ редактировать ]- Конечный продукт расширенного гликирования — белки или липиды, которые гликируются в результате воздействия сахаров.
- Химическое гликозилирование - реакция донора и акцептора гликозила.
- Фукозилирование – ковалентное присоединение фукозильной группы к молекуле-акцептору.
- Гликирование – присоединение сахара к белку или липиду.
- Гликорандомизация – технология, обеспечивающая быструю диверсификацию молекул.
Ссылки
[ редактировать ]- ^ Лима, М.; Бэйнс, JW (2013). «Гликация». В Леннарце, Уильям Дж.; Лейн, М. Дэниел (ред.). Энциклопедия биологической химии (второе изд.). Академическая пресса. стр. 405–411. дои : 10.1016/B978-0-12-378630-2.00120-1 . ISBN 9780123786319 .
- ^ Jump up to: а б с д Варки А., Каммингс Р.Д., Эско Дж.Д., Фриз Х.Х., Стэнли П., Бертоцци Ч.Р., Харт Г.В., Эцлер М.Э. (2009). Варки А (ред.). Основы гликобиологии (2-е изд.). Издательство Колд-Спринг-Харбор Лабораториз. ISBN 978-0-87969-770-9 . ПМИД 20301239 .
- ^ Юнг С.Т., Канг Т.Х., Келтон В., Георгиу Г. (декабрь 2011 г.). «Обход гликозилирования: разработка агликозилированных полноразмерных антител IgG для терапии человека». Современное мнение в области биотехнологии . 22 (6): 858–67. дои : 10.1016/j.copbio.2011.03.002 . ПМИД 21420850 .
- ^ «Трансгенные растения Nicotiana tabacum L. экспрессируют агликозилированные моноклональные антитела с противоопухолевой активностью» . Биотехнология Апликада . 2013.
- ^ Дрикамер К., Тейлор М.Е. (2006). Введение в гликобиологию (2-е изд.). Издательство Оксфордского университета, США. ISBN 978-0-19-928278-4 .
- ^ Jump up to: а б Далзиел М., Криспин М., Сканлан К.Н., Зитцманн Н., Двек Р.А. (январь 2014 г.). «Новые принципы терапевтического использования гликозилирования». Наука . 343 (6166): 1235681. doi : 10.1126/science.1235681 . ПМИД 24385630 . S2CID 206548002 .
- ^ Криспин М., Харви DJ, Битто Д., Бономелли С., Эджворт М., Скривенс Дж.Х., Хуисконен Дж.Т., Боуден Т.А. (март 2014 г.). «Структурная пластичность гликома вируса леса Семлики при межвидовой передаче» . Журнал исследований протеома . 13 (3): 1702–12. дои : 10.1021/pr401162k . ПМЦ 4428802 . ПМИД 24467287 .
- ^ Криспин М., Дорес К.Дж. (апрель 2015 г.). «Нацеливание гликанов, полученных от хозяина, на вирусы с оболочкой для разработки вакцин на основе антител» . Современное мнение в вирусологии . Вирусный патогенез • Профилактические и лечебные вакцины. 11 : 63–9. дои : 10.1016/j.coviro.2015.02.002 . ПМЦ 4827424 . ПМИД 25747313 .
- ^ Ардеяни, Мазиар С.; Нудлман, Луи; Пауэрс, Эван Т.; Келли, Джеффри В. (15 марта 2021 г.). «Стереоэлектронные эффекты в стабилизации взаимодействий белок-N-гликан, выявленные экспериментом и машинным обучением» . Природная химия . 13 (5): 480–487. Бибкод : 2021НатЧ..13..480А . дои : 10.1038/s41557-021-00646-w . ISSN 1755-4349 . ПМК 8102341 . ПМИД 33723379 .
- ^ Уолш С. (2006). Посттрансляционная модификация белков: расширение запасов природы . Издательство Roberts and Co., Энглвуд, Колорадо, ISBN 978-0974707730 .
- ^ Флинн В.Г. (2008). Биотехнология и биоинженерия . Издательство Нова. стр. 45 и далее. ISBN 978-1-60456-067-1 .
- ^ Йошида-Моригучи Т, Ю Л, Сталнакер С.Х., Дэвис С., Кунц С., Мэдсон М., Олдстоун М.Б., Шахтер Х., Уэллс Л., Кэмпбелл К.П. (январь 2010 г.). « О -маннозильное фосфорилирование альфа-дистрогликана необходимо для связывания ламинина» . Наука . 327 (5961): 88–92. Бибкод : 2010Sci...327...88Y . дои : 10.1126/science.1180512 . ПМК 2978000 . ПМИД 20044576 .
- ^ Ихара, Ёсито. «C-маннозилирование: модификация триптофана в клеточных белках». Гликосаука: биология и медицина .
- ^ Jump up to: а б с Юлениус, Карин (май 2007 г.). «NetCGlyc 1.0: предсказание сайтов C-маннозилирования млекопитающих, К. Юлениус (2007)» . Гликобиология . 17 (8): 868–876. дои : 10.1093/гликоб/cwm050 . ПМИД 17494086 .
- ^ Александра, Щербакова (2019). «С-маннозилирование поддерживает сворачивание и повышает стабильность повторов тромбоспондина» . электронная жизнь . 8 . doi : 10.7554/eLife.52978 . ПМК 6954052 . ПМИД 31868591 .
- ^ Лавлейс Л.Л., Купер К.Л., Содец Дж.М., Лебиода Л. (2011). «Структура человеческого белка C8 дает представление о механизме образования мембранных пор комплементом» . J Биол Хим . 286 (20): 17585–17592. дои : 10.1074/jbc.M111.219766 . ПМК 3093833 . ПМИД 21454577 .
- ^ Ёсимура (июнь 1992 г.). «Мутации в мотиве Trp-Ser-X-Trp-Ser рецептора эритропоэтина отменяют процессинг, связывание лиганда и активацию рецептора» . Журнал биологической химии . 267 (16): 11619–25. дои : 10.1016/S0021-9258(19)49956-0 . ПМИД 1317872 .
- ^ Крич Д. (август 2010 г.). «Механизм химической реакции гликозилирования». Отчеты о химических исследованиях . 43 (8): 1144–53. дои : 10.1021/ar100035r . ПМИД 20496888 .
- ^ Нигудкар С.С., Демченко А.В. (май 2015 г.). « Цисс -гликозилирование как движущая сила прогресса в химии синтетических углеводов» . Химическая наука . 6 (5): 2687–2704. дои : 10.1039/c5sc00280j . ПМЦ 4465199 . ПМИД 26078847 .
- ^ Фанг Т., Гу Ю, Хуан В., Бунс Г.Дж. (март 2016 г.). «Механизм гликозилирования аномерных ионов сульфония» . Журнал Американского химического общества . 138 (9): 3002–11. дои : 10.1021/jacs.5b08436 . ПМК 5078750 . ПМИД 26878147 .
- ^ Хенле, Томас; Дюраш, Аня; Вейц, Александр; Рак, Майкл; Мёкель, Ульрике (1 ноября 2020 г.). «Реакции гликирования мицелл казеина». Журнал сельскохозяйственной и пищевой химии . 64 (14): 2953–2961. doi : 10.1021/acs.jafc.6b00472 . ПМИД 27018258 .
- ^ Jump up to: а б с Бэйнс, JW; Лима, М. (2013). Энциклопедия биологической химии . стр. 405–411. ISBN 978-0-12-378631-9 .
- ^ Святецкая, Д.; Костыра, Х.; Святецкий, А. (2010). «Влияние гликированных белков гороха на активность свободноплавающих и иммобилизованных бактерий». Дж. Наук. Продовольственное сельское хозяйство . 90 (11): 1837–1845. дои : 10.1002/jsfa.4022 . ПМИД 20549652 .
- ^ Гилл, Видху; Кумар, Виджай; Сингх, Кританджали; Кумар, Ашок; Ким, Чон Чжу (17 декабря 2019 г.). «Конечные продукты гликации (AGE) могут быть поразительным связующим звеном между современной диетой и здоровьем» . Биомолекулы . 9 (12): 888. doi : 10.3390/biom9120888 . ПМК 6995512 . ПМИД 31861217 .
- ^ Ansari, N.A.; Rasheed, Z. (March 2010). "НЕФЕРМЕНТАТИВНОЕ ГЛИКИРОВАНИЕ БЕЛКОВ: ОТ ДИАБЕТА ДО РАКА" [Non-enzymatic glycation of proteins: from diabetes to cancer]. Biomeditsinskaya Khimiya (in Russian). 56 (2): 168–178. doi : 10.18097/pbmc20105602168 . ISSN 2310-6905 . PMID 21341505 .
- ^ Jump up to: а б с Хейнс, Николь (октябрь 2003 г.). «Гликозилирование регулирует передачу сигналов Notch» . Обзоры природы. Молекулярно-клеточная биология . 4 (10): 786–797. дои : 10.1038/nrm1228 . ПМИД 14570055 . S2CID 22917106 . Проверено 1 ноября 2020 г.
- ^ Стэнли, Памела; Окадзима, Тэцуя (2010). «Роль гликозилирования в передаче сигналов Notch» . Актуальные темы биологии развития . 92 : 131–164. дои : 10.1016/S0070-2153(10)92004-8 . ISBN 9780123809148 . ПМИД 20816394 . Проверено 2 ноября 2020 г.
- ^ Jump up to: а б с Хидеюки, Такеучи (17 октября 2014 г.). «Значение гликозилирования в передаче сигналов Notch» . Связь с биохимическими и биофизическими исследованиями . 453 (2): 235–42. дои : 10.1016/j.bbrc.2014.05.115 . ПМЦ 4254162 . ПМИД 24909690 .
- ^ Джейкен Дж (2013). «Врожденные нарушения гликозилирования». Детская неврология Часть III . Справочник по клинической неврологии. Том. 113. стр. 1737–43. дои : 10.1016/B978-0-444-59565-2.00044-7 . ISBN 9780444595652 . ПМИД 23622397 .
- ^ Хименес Мартинес, Мария дель Кармен (январь – март 2002 г.). «Изменения гликозилирования при заболеваниях человека» . Rev Inst Nal Enf Resp Mex . 15 :39–47 . Проверено 2 ноября 2020 г.
- ^ С. Кейн, Меган (4 февраля 2016 г.). «Митотическая внутригенная рекомбинация: механизм выживания при некоторых врожденных нарушениях гликозилирования» . Американский журнал генетики человека . 98 (2): 339–46. дои : 10.1016/j.ajhg.2015.12.007 . ПМЦ 4746335 . ПМИД 26805780 .
- ^ Разаги А., Вильякрес К., Юнг В., Машкур Н., Батлер М., Оуэнс Л., Хейманн К. (октябрь 2017 г.). «Повышение терапевтической эффективности экспрессированного рекомбинантного гамма-интерферона млекопитающих против клеток рака яичников». Экспериментальные исследования клеток . 359 (1): 20–29. дои : 10.1016/j.yexcr.2017.08.014 . ПМИД 28803068 . S2CID 12800448 .
Внешние ссылки
[ редактировать ]- гликоЭП Чаухан Дж.С., Рао А., Рагхава Г.П. (2013). « Платформа In silico для предсказания N-, O- и C-гликозитов в последовательностях эукариотических белков» . ПЛОС ОДИН . 8 (6): e67008. Бибкод : 2013PLoSO...867008C . дои : 10.1371/journal.pone.0067008 . ПМЦ 3695939 . ПМИД 23840574 .
- Варки А., Каммингс Р., Эско Дж., Фриз Х., Харт Г., Март Дж., ред. (1999). Основы гликобиологии . Лабораторный пресс Колд-Спринг-Харбор. ISBN 0-87969-559-5 . НБК20709.
- in-silico GlyProt: N- гликозилирование белков в сети [ постоянная мертвая ссылка ]
- NetNGlyc: Сервер NetNglic предсказывает сайты N -гликозилирования в белках человека, используя искусственные нейронные сети, которые исследуют контекст последовательности последовательностей Asn-Xaa-Ser/Thr.
- Дополнительные материалы к книге «Сахарный кодекс»
- Дополнительная информация о гликозилировании и цифрах
- Эмануал Маверакис; и др. (2015). «Гликаны в иммунной системе и теория аутоиммунитета с измененными гликанами» . Журнал аутоиммунитета . 57 : 1–13. дои : 10.1016/j.jaut.2014.12.002 . ПМЦ 4340844 . ПМИД 25578468 .