Катаболизм белков
В молекулярной биологии катаболизм белков – это распад белков на более мелкие пептиды и, в конечном счете, на аминокислоты . Катаболизм белка является ключевой функцией процесса пищеварения . Катаболизм белков часто начинается с пепсина , который превращает белки в полипептиды. Эти полипептиды затем подвергаются дальнейшей деградации. У человека протеазы поджелудочной железы включают трипсин , химотрипсин и другие ферменты. В кишечнике небольшие пептиды расщепляются на аминокислоты, которые могут всасываться в кровоток. Эти поглощенные аминокислоты затем могут подвергаться аминокислотному катаболизму , где они используются в качестве источника энергии или предшественников новых белков. [1]
Аминокислоты, полученные в результате катаболизма, могут быть напрямую переработаны для образования новых белков, преобразованы в другие аминокислоты или могут подвергнуться катаболизму аминокислот для преобразования в другие соединения посредством цикла Кребса . [2]
Взаимодействие с другими метаболическими путями и путями спасения
[ редактировать ]Катаболизм белков производит аминокислоты, которые используются для образования других белков или окисляются для удовлетворения энергетических потребностей клетки. Аминокислоты, образующиеся в результате катаболизма белков, затем могут подвергаться дальнейшему катаболизму при катаболизме аминокислот. Среди нескольких процессов разложения аминокислот выделяют дезаминирование (удаление аминогруппы), трансаминирование (перенос аминогруппы), декарбоксилирование (удаление карбоксильной группы) и дегидрирование (удаление водорода). Деградация аминокислот может функционировать как часть пути спасения, при котором части деградированных аминокислот используются для создания новых аминокислот, или как часть метаболического пути, при котором аминокислота расщепляется с высвобождением или повторным захватом химической энергии. Например, химическая энергия, выделяющаяся при окислении в реакции дегидрирования, может быть использована для восстановления НАД. + до НАДН , который затем можно подавать непосредственно в цикл Кребса/лимонной кислоты (ТСА) . [2]
Деградация белка
[ редактировать ]Деградация белка отличается от катаболизма белка. Белки производятся и разрушаются регулярно в рамках нормальной деятельности клетки. Факторы транскрипции , белки, которые помогают регулировать синтез белка, являются мишенью такой деградации. Их деградация не вносит существенного вклада в энергетические потребности клетки. [3] Добавление убиквитина (убиквитилирование) отмечает деградацию белка через протеасому . [4]
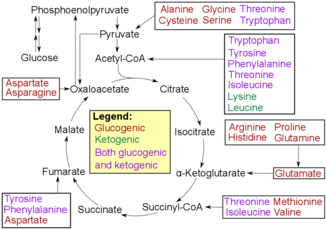
Деградация аминокислот
[ редактировать ]Окислительное дезаминирование — это первый шаг к расщеплению аминокислот с целью их превращения в сахара. Процесс начинается с удаления аминогруппы аминокислот. Аминогруппа превращается в аммоний по мере ее потери, а затем подвергается циклу мочевины в печени , превращаясь в мочевину. Затем он попадает в кровоток, где переносится в почки, которые выделяют мочевину в виде мочи. [5] [6] Оставшаяся часть аминокислоты окисляется, образуя α- кетокислоту . Затем альфа-кетокислота переходит в цикл ТСА для производства энергии. Кислота также может участвовать в гликолизе , где она в конечном итоге преобразуется в пируват . Затем пируват превращается в ацетил-КоА , чтобы он мог войти в цикл ТСА и преобразовать исходные молекулы пирувата в АТФ или полезную энергию для организма. [7]
Трансаминирование приводит к тому же результату, что и дезаминирование: оставшаяся кислота подвергается либо гликолизу, либо циклу ТСА с получением энергии, которую организм организма будет использовать для различных целей. Этот процесс переносит аминогруппу вместо потери аминогруппы для преобразования в аммоний. Аминогруппа переносится на α-кетоглутарат , благодаря чему ее можно превратить в глутамат . Затем глутамат переносит аминогруппу на оксалоацетат . Этот перенос заключается в том, что оксалоацетат может быть преобразован в аспартат или другие аминокислоты. В конце концов, этот продукт также подвергнется окислительному дезаминированию с образованием альфа-кетоглутарата, альфа-кетокислоты, которая пройдет цикл ТСА, и аммоний, который в конечном итоге пройдет цикл мочевины. [8]
Трансаминазы — это ферменты, которые помогают катализировать реакции, происходящие при трансаминировании. Они помогают катализировать реакцию в тот момент, когда аминогруппа переносится от исходной аминокислоты, например глутамата, к α-кетоглутарату, и удерживают ее, передавая ее на другую α-кетокислоту. [8]
Факторы, определяющие период полувыведения белка
[ редактировать ]Некоторые ключевые факторы, определяющие общую скорость, включают период полураспада белка, pH и температуру.
Период полураспада белка помогает определить общую скорость, поскольку он обозначает первый этап катаболизма белка. В зависимости от того, короткий или длинный этот шаг, это повлияет на остальную часть метаболического процесса. Один из ключевых компонентов определения периода полураспада белка основан на правиле N-конца . Это означает, что аминокислота, присутствующая на N-конце белка, помогает определить период полураспада белка. [9]
Дальнейшее чтение
[ редактировать ]- Бойковска, Каролина; Сантони де Сио, Франческа; Бард, Изабель; Оффнер, Сандра; Верп, Соня; Хейнис, Кристиан; Джонсон, Кай; Троно, Дидье (24 июня 2011 г.). «Измерение периода полураспада белка in vivo» . Химия и биология . 18 (6): 805–815. doi : 10.1016/j.chembiol.2011.03.014 . ПМИД 21700215 .
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Гурина Татьяна С.; Мохиуддин, Шамим С. (2023). «Биохимия, катаболизм белков» . СтатПерлз. ПМИД 32310507 .
- ^ Jump up to: а б Бауман, Роберт В.; Мачунис-Масуока, Элизабет; Тизард, Ян Р. (1 января 2004 г.). Микробиология . Пирсон/Адитья поют Каммингса. ISBN 9780805376524 .
- ^ Купер, генеральный менеджер; Сандерленд, Массачусетс (2000). Деградация белка . Синауэр Ассошиэйтс.
- ^ Кимура Ю, Танака К (июнь 2010 г.). «Регуляторные механизмы, участвующие в контроле гомеостаза убиквитина» . Журнал биохимии . 147 (6): 793–8. дои : 10.1093/jb/mvq044 . ПМИД 20418328 .
- ^ «26.9: Катаболизм белков» . Химия LibreTexts . 19 июня 2014 г. Проверено 25 октября 2016 г.
- ^ «Окислительное дезаминирование» . chemistry.elmhurst.edu . Проверено 25 октября 2016 г.
- ^ «ГЛИКОЛИЗ И ЦИКЛ КРЕБСА» . домашняя страница.smc.edu . Проверено 8 ноября 2016 г.
- ^ Jump up to: а б Майлз, Брайант (9 апреля 2003 г.). «Катаболизм белков» (PDF) . Архивировано из оригинала (PDF) 12 августа 2014 г.
- ^ Тасаки, Такафуми; Шрирам, Шашикант М.; Пак, Кён Су; Квон, Ён Тэ (4 июня 2012 г.). «Путь правила N-конца» . Ежегодный обзор биохимии . 81 (1): 261–289. doi : 10.1146/annurev-biochem-051710-093308 . ISSN 0066-4154 . ПМК 3610525 . ПМИД 22524314 .