Стероидный препарат

Стероид — это органическое соединение с четырьмя слитыми кольцами (обозначенными A, B, C и D), расположенными в определенной молекулярной конфигурации .
Стероиды выполняют две основные биологические функции: являются важными компонентами клеточных мембран , изменяющими текучесть мембран ; и как сигнальные молекулы . Примеры включают липидный холестерин , половые гормоны эстрадиол и тестостерон . [2] : 10–19 анаболические стероиды и противовоспалительный кортикостероидный препарат дексаметазон . [3] Сотни стероидов обнаружены в грибах , растениях и животных . Все стероиды производятся в клетках из стеринов ланостерина ( опистоконты ) или циклоартенола (растения). Ланостерол и циклоартенол образуются в циклизации тритерпенового результате сквалена . [4]
Стероиды названы в честь стероида холестерина. [5] который был впервые описан в желчных камнях от древнегреческих слов chole- « bile » и «stereos» «твердый». [6] [7] [8]
Стероидное ядро ( коровая структура ) называется гонаном (циклопентанпергидрофенантрен). [9] Обычно он состоит из семнадцати атомов углерода , связанных в четыре конденсированных кольца: три шестичленных циклогексановых кольца (кольца A, B и C на первой иллюстрации) и одно пятичленное циклопентановое кольцо (кольцо D). Стероиды различаются по функциональным группам , прикрепленным к этому четырехкольцевому ядру, и по степени окисления колец. Стеролы представляют собой формы стероидов с гидроксильной группой в третьем положении и скелетом, полученным из холестана . [1] : 1785f [10] Стероиды также могут быть модифицированы более радикально, например, путем изменения кольцевой структуры, например, путем разрезания одного из колец. Режущее кольцо B производит секостероиды , одним из которых является витамин D3 .
Номенклатура [ править ]
Кольца и функциональные группы [ править ]


Гонан , также известный как стеран или циклопентанпергидрофенантрен, простейший стероид и ядро всех стероидов и стеролов. [11] [12] состоит из семнадцати атомов углерода в углерод-углеродных связях, образующих четыре сросшихся кольца трехмерной формы . Три циклогексановых B и C на первой иллюстрации) образуют скелет пергидропроизводного фенантрена кольца (A , . Кольцо D имеет циклопентановую структуру. Когда присутствуют две метильные группы и восемь боковых углеродных цепей (в положении C-17, как показано для холестерина), говорят, что стероид имеет холестановый каркас. Две распространенные стереоизомерные формы стероидов 5α и 5β существуют из-за различий в стороне преимущественно плоской кольцевой системы, к которой присоединен атом водорода (H) при углероде-5, что приводит к изменению конформации A-кольца стероида. Изомеризация боковой цепи C-21 приводит к образованию параллельного ряда соединений, называемых изостероидами. [13]
Примеры стероидных структур:
- Холевая кислота , желчная кислота , с карбоновой кислотой дополнительными гидроксильными группами . и часто присутствующими
- Дексаметазон , синтетический кортикостероидный препарат.
- Ланостерол , биосинтетический предшественник животных стероидов. Количество атомов углерода (30) указывает на его тритерпеноидную классификацию.
- Прогестерон , стероидный гормон, участвующий в женском менструальном цикле, беременности и эмбриогенезе.
- Медрогестон — синтетический препарат, действие которого аналогично прогестерону.
- β-ситостерин , растение или фитостерин , с полностью разветвленной углеводородной боковой цепью у С-17 и гидроксильной группой у С-3.
Помимо разрывов колец (расщеплений), расширений и сжатий (расщепления и повторного замыкания в более крупные или меньшие кольца) — всех вариаций структуры углерод-углеродных связей — стероиды также могут различаться:
- в заказах облигаций внутри колец,
- по количеству метильных групп, присоединенных к кольцу (и, если они присутствуют, к заметной боковой цепи у C17),
- в функциональных группах, прикрепленных к кольцам и боковой цепи, и
- в конфигурации групп, прикрепленных к кольцам и цепочке. [2] : 2–9
Например, стерины, такие как холестерин и ланостерин, имеют гидроксильную группу , присоединенную в положении С-3, тогда как тестостерон и прогестерон имеют карбонильную группу (оксозаместитель) в положении С-3. Среди этих соединений только ланостерин имеет две метильные группы при С-4. Холестерин, имеющий двойную связь от C-5 до C-6, отличается от тестостерона и прогестерона, которые имеют двойную связь от C-4 до C-5.
 |  |
Соглашение об именах [ править ]
Почти все биологически значимые стероиды можно представить как производные исходной холестериноподобной структуры , углеводородной служащей скелетом . [14] [15] Эти родительские структуры имеют конкретные названия, такие как прегнан , андростан и т. д. Производные несут различные функциональные группы , называемые суффиксами или префиксами, после соответствующих цифр, указывающих их положение в стероидном ядре. [16] Широко используются тривиальные названия стероидов природного происхождения со значительной биологической активностью, такие как прогестерон , тестостерон или кортизол . Некоторые из этих названий определены в «Номенклатуре стероидов». [17] Эти тривиальные имена также можно использовать в качестве основы для получения новых названий, однако путем добавления только префиксов, а не суффиксов, например, стероид 17α-гидроксипрогестерон имеет гидроксильную группу (-ОН) в положении 17 стероидного ядра по сравнению с прогестероном. .
Буквы α и β [18] обозначают абсолютную стереохимию в хиральных центрах - особую номенклатуру, отличную от соглашения R/S. [19] органической химии для обозначения абсолютной конфигурации функциональных групп, известных как правила приоритета Кана-Ингольда-Прелога . Соглашение R/S назначает приоритеты заместителям в хиральном центре на основе их атомного номера. Группа с высшим приоритетом назначается атому с самым высоким атомным номером, а группа с самым низким приоритетом назначается атому с наименьшим атомным номером. Затем молекулу ориентируют так, чтобы группа с наименьшим приоритетом была направлена в сторону от зрителя, а остальные три группы располагались в порядке убывания приоритета вокруг хирального центра. Если это расположение по часовой стрелке, ему присваивается конфигурация R; если против часовой стрелки, ему присваивается конфигурация S. [20] Напротив, в номенклатуре стероидов используются α и β для обозначения стереохимии в хиральных центрах. Обозначения α и β основаны на ориентации заместителей относительно друг друга в конкретной кольцевой системе. В общем, α относится к заместителю, который ориентирован к плоскости кольцевой системы, тогда как β относится к заместителю, который ориентирован от плоскости кольцевой системы. В стероидах, нарисованных со стандартной точки зрения, используемой в этой статье, α-связи изображены на рисунках пунктирными клиньями, а β-связи — сплошными клиньями. [14]
Название « 11-дезоксикортизол » является примером производного названия, в котором кортизол используется в качестве исходной структуры без кислорода атома (отсюда «дезокси»), присоединенного к положению 11 (как часть гидроксигруппы). [14] [21] Нумерация положений атомов углерода в стероидном ядре задается по шаблону, найденному в Номенклатуре стероидов. [22] который используется независимо от того, присутствует ли атом в рассматриваемом стероиде. [14]
Ненасыщенные атомы углерода (как правило, входящие в двойную связь) в стероидном ядре обозначаются заменой -ана на -ен. [23] Это изменение традиционно делалось в родительском названии с добавлением префикса для обозначения положения с Δ (греческая заглавная дельта) или без него, который обозначает ненасыщенность, например, 4-прегнен-11β,17α-диол-3,20-дион ( также Δ 4 -прегнен-11β,17α-диол-3,20-дион) или 4-андростен-3,11,17-трион (также Δ 4 -андростен-3,11,17-трион). Однако Номенклатура стероидов рекомендует всегда располагать местонахождение двойной связи рядом со слогом, обозначающим ненасыщенность, поэтому использовать его в качестве суффикса, а не префикса, и без использования символа Δ, т.е. прегн-4-. ен-11β,17α-диол-3,20-дион или андрост-4-ен-3,11,17-трион . Двойная связь обозначается атомом углерода с меньшим номером, т.е. «Δ 4 -» или «4-ен» означает двойную связь между положениями 4 и 5. Насыщение атомами углерода исходного стероида можно осуществить путем добавления префикса «дигидро-», [24] т.е. насыщение атомов углерода 4 и 5 тестостерона двумя атомами водорода представляет собой 4,5α-дигидротестостерон или 4,5β-дигидротестостерон. Обычно, когда нет двусмысленности, один номер положения водорода стероида с насыщенной связью можно опустить, оставив только положение второго атома водорода, например, 5α-дигидротестостерона или 5β-дигидротестостерона . Δ 5 -стероиды – это те, у которых двойная связь между атомами углерода 5 и 6 и Δ 4 стероиды – это те, у которых двойная связь между атомами углерода 4 и 5. [25] [23]
Такие сокращения, как « P4 » для прогестерона и « A4 » для андростендиона, относятся к Δ. 4 -стероиды, тогда как « P5 » для прегненолона и « A5 » для андростендиола относятся к Δ 5 -стероиды. [14]
Суффикс -ол обозначает гидроксильную группу , а суффикс -он обозначает оксогруппу. Когда две или три одинаковые группы присоединены к основной структуре в разных положениях, суффикс обозначается как -диол или -триол для гидроксильных групп и -дион или -трион для оксогрупп соответственно. Например, 5α-прегнан-3α,17α-диол-20-он имеет атом водорода в положении 5α (отсюда и приставка «5α-»), две гидроксигруппы (-ОН) в положениях 3α и 17α (отсюда « суффикс «3α,17α-диол») и оксогруппу (=O) в положении 20 (отсюда и суффикс «20-один»). Однако можно встретить ошибочное использование суффиксов, например, «5α-прегнан-17α-диол-3,11,20-трион». [26] [ sic ] — поскольку у него только одна гидроксигруппа (в 17α), а не две, то суффикс должен быть -ол, а не -диол, чтобы правильное название было «5α-прегнан-17α-ол-3, 11,20-трион».
Согласно правилу, установленному в Номенклатуре стероидов, окончание «е» в названии родительской структуры должно быть опущено перед гласной (наличие или отсутствие цифры не влияет на такое опущение). [14] [16] Это означает, например, что если суффикс, добавленный непосредственно к имени родительской структуры, начинается с гласной, конечная буква «е» удаляется из этого имени. Примером такого удаления является « 5α-прегнан-17α-ол-3,20-дион », где последняя «е» в слове « прегнан » опускается из-за гласной («о») в начале суффикса — ол. Некоторые авторы неправильно используют это правило, пропуская терминал «е» там, где его следует оставить, или наоборот. [27]
Термин «11-оксигенированный» относится к присутствию атома кислорода в качестве оксо (=O) или гидрокси (-OH) заместителя у углерода 11. «Оксигенированный» постоянно используется в химии стероидов. [28] с 1950-х годов. [29] В некоторых исследованиях используется термин «11-оксиандрогены». [30] [31] как аббревиатура для 11-оксигенированных андрогенов, чтобы подчеркнуть, что все они имеют атом кислорода, присоединенный к углероду в положении 11. [32] [33] Однако в химической номенклатуре приставка «окси» связана с эфирными функциональными группами, т. е. соединением , у которого атом кислорода связан с двумя алкильными или арильными группами (ROR), [34] поэтому использование слова «окси» в названии класса стероидов может ввести в заблуждение. Яркие примеры слова «оксигенированный» для обозначения широкого класса органических молекул, содержащих множество кислородсодержащих функциональных групп, можно найти и в других областях органической химии. [35] и уместно использовать это соглашение. [14]
Несмотря на то, что «кето» является стандартным префиксом в органической химии, рекомендации Объединенной комиссии по биохимической номенклатуре 1989 года не рекомендуют использовать префикс «кето» для названий стероидов и отдают предпочтение префиксу «оксо» (например, 11-оксостероиды). а не 11-кетостероиды), поскольку «кето» включает углерод, входящий в состав стероидного ядра, и один и тот же атом углерода не следует указывать дважды. [36] [14]
видов Распространение
Этот раздел требует внимания эксперта в области фармакологии . Конкретная проблема заключается в следующем: изучить этот и следующий раздел (и далее), удалить избыточность перечисленного контента и обеспечить источник перечисленного контента, который остается в любом разделе. ( март 2017 г. ) |
Стероиды встречаются во всех сферах жизни, включая бактерии , археи и эукариоты . У эукариот стероиды встречаются в грибах, растениях и животных. [37] [38]
Эукариотические и прокариотические [ править ]
В этом разделе отсутствует информация о стероловом каркасе неэукариотического типа – см. PMID 27446030, рис. 4/5, оксидоскваленциклаза группы 1 . ( ноябрь 2021 г. ) |
Эукариотические клетки, к которым относятся животные, растения, грибы и протисты, имеют сложную клеточную структуру с настоящим ядром и мембраносвязанными органеллами. [39]
Стероиды являются неотъемлемой частью клеточных мембран эукариот, где они помогают поддерживать целостность и функцию мембраны. [40]
Во время эукариогенеза (появление современных эукариотических клеток) стероиды, вероятно, играли роль в приобретении митохондрий посредством эндоцитоза. [41]
У прокариот существуют пути биосинтеза тетрациклического стероидного каркаса (например, у миксобактерий ). [42] – где его происхождение от эукариот предполагается [43] - и более распространенный пентациклический тритерпиноид- гопаноидный каркас. [44]
Грибковый [ править ]
Грибковые стероиды включают эргостерины , которые участвуют в поддержании целостности клеточной мембраны грибов. Различные противогрибковые препараты , такие как амфотерицин B и азоловые противогрибковые средства , используют эту информацию для уничтожения патогенных грибков. [45] Грибы могут изменять содержание эргостерина (например, за счет мутаций с потерей функции ферментов ERG3 или ERG6 , вызывающих истощение запасов эргостерина, или мутаций, снижающих содержание эргостерина) для развития устойчивости к препаратам, нацеленным на эргостерин. [46]
Эргостерин аналогичен холестерину , обнаруженному в клеточных мембранах животных (включая человека), или фитостеринам, содержащимся в клеточных мембранах растений. [46] Все грибы содержат большое количество эргостерина, от десятков до сотен миллиграммов на 100 граммов сухого веса. [46] Кислород необходим для синтеза эргостерина у грибов. [46]
Эргостерин отвечает за содержание витамина D в грибах; Эргостерин химически превращается в провитамин D2 под воздействием ультрафиолетового света . [46] Провитамин D2 спонтанно образует витамин D2. [46] Однако не все грибы используют эргостерин в своих клеточных мембранах; например, патогенный вид грибов Pneumocystis jirovecii этого не делает, что имеет важные клинические последствия (учитывая механизм действия многих противогрибковых препаратов). гриба Saccharomyces cerevisiae На примере другие основные стероиды включают эргоста-5,7,22,24(28)-тетраен-3β-ол , зимостерин и ланостерин . S. cerevisiae использует 5,6-дигидроэргостерин вместо эргостерина в своей клеточной мембране. [46]
Растение [ править ]
Растительные стероиды включают стероидные алкалоиды , обнаруженные в пасленовых. [47] и Melanthiaceae (особенно род Veratrum ), [48] сердечные гликозиды , [49] фитостеролы ( которые и брассиностероиды включают несколько растительных гормонов).
Животное [ править ]
Животные стероиды включают соединения позвоночного и насекомого происхождения, причем последние включают экдистероиды, такие как экдистерон (контролирующий линьку у некоторых видов). Примеры позвоночных включают стероидные гормоны и холестерин; последний является структурным компонентом клеточных мембран , который помогает определять текучесть клеточных мембран и является основным компонентом бляшек (участвующих в атеросклерозе ). К стероидным гормонам относятся:
- Половые гормоны , которые влияют на половые различия и поддерживают воспроизводство . К ним относятся андрогены , эстрогены и прогестагены .
- Кортикостероиды , включая большинство синтетических стероидных препаратов, с натуральными классами глюкокортикоидов (которые регулируют многие аспекты метаболизма и иммунной функции ) и минералокортикоидов (которые помогают поддерживать объем крови и контролировать почечную экскрецию электролитов ).
- Анаболические стероиды , натуральные и синтетические, которые взаимодействуют с рецепторами андрогенов для увеличения синтеза мышц и костей. В популярном использовании термин «стероиды» часто относится к анаболическим стероидам.
Типы [ править ]
По функциям [ править ]
Этот раздел нуждается в расширении : Более подробное объяснение функций также было бы полезно. Вы можете помочь, добавив к нему . ( январь 2019 г. ) |
Основными классами стероидных гормонов с известными членами и примерами связанных функций являются: [50] [51]
- Кортикостероиды :
- Глюкокортикоиды :
- Кортизол , глюкокортикоид , функции которого включают иммуносупрессию.
- Минералокортикоиды :
- Альдостерон , минералокортикоид , который помогает регулировать кровяное давление посредством водно-электролитного баланса.
- Глюкокортикоиды :
- Секс-стероиды :
- Прогестагены :
- Прогестерон , регулирующий циклические изменения эндометрия матки и . поддерживающий беременность
- Андрогены :
- Тестостерон , который способствует развитию и поддержанию мужских вторичных половых признаков.
- Эстрогены :
- Эстрадиол , который способствует развитию и поддержанию женских вторичных половых признаков.
- Прогестагены :
Дополнительные классы стероидов включают:
- Нейростероиды, такие как ДГЭА и аллопрегнанолон.
- Желчные кислоты, такие как таурохолевая кислота
- Аминостероидные нервно-мышечные блокаторы (в основном синтетические), такие как бромид панкурония.
- Стероидные антиандрогены (в основном синтетические), такие как ципротерона ацетат.
- Ингибиторы стероидогенеза (в основном экзогенные), такие как альфарадиол.
- Мембранные стерины, такие как холестерин , эргостерин и различные фитостерины.
- Токсины, такие как стероидные сапонины и карденолиды / сердечные гликозиды.
А также следующий класс секостероидов (стероиды с открытым кольцом):
- Формы витамина D , такие как эргокальциферол , холекальциферол и кальцитриол.
По структуре [ править ]
Неповрежденная система колец [ править ]
Этот раздел нуждается в расширении: более полным обсуждением этого наиболее известного структурного типа. Вы можете помочь, добавив к нему . ( март 2017 г. ) |
Стероиды можно классифицировать по их химическому составу. [52] Один из примеров того, как MeSH выполняет эту классификацию, доступен в каталоге MeSH в Википедии. Примеры этой классификации включают в себя:


| Сорт | Пример | Количество атомов углерода |
|---|---|---|
| Холестаны | Холестерин | 27 |
| Холаны | Холевая кислота | 24 |
| Преньянес | Прогестерон | 21 |
| Андростаны | Тестостерон | 19 |
| Стране | Эстрадиол | 18 |
В биологии принято называть вышеуказанные классы стероидов по количеству присутствующих атомов углерода, когда речь идет о гормонах: C 18 -стероиды для эстранов (в основном эстрогены), C 19 19 -стероиды для андростанов (в основном андрогенов) и C -стероиды для эстранов (в основном эстрогенов). 21- стероиды для прегнанов (в основном кортикостероиды). [53] Классификация « 17-кетостероид » также важна в медицине.
Гонан (стероидное ядро) представляет собой родительскую молекулу тетрациклического углеводорода с 17 атомами углерода без алкильных боковых цепей. [54]
, суженные и расширенные кольца Расколотые
Секостероиды (лат. seco , «разрезать») представляют собой подкласс стероидных соединений, образующихся биосинтетически или концептуально в результате расщепления (расщепления) родительских стероидных колец (обычно одного из четырех). Основные подклассы секостероидов определяются атомами углерода стероидов, в которых произошло это расщепление. Например, прототип секостероида холекальциферола , витамина D3 ( показан), относится к подклассу 9,10-секостероидов и образуется в результате расщепления атомов углерода C-9 и C-10 стероидного B-кольца; 5,6-секостероиды и 13,14-стероиды схожи. [55]
Норстероиды ( нор- , L.norma ; «нормальный» в химии, указывающий на удаление углерода) [56] и гомостероиды (гомо-, греческий homos ; «тот же», что указывает на присоединение углерода) представляют собой структурные подклассы стероидов, образующихся на этапах биосинтеза. Первое включает ферментативные реакции расширения-сокращения кольца , а второе осуществляется ( биомиметически ) или (чаще) посредством замыкания кольца ациклических предшественников с большим (или меньшим) количеством атомов кольца, чем исходный стероидный каркас. [57]
Комбинации этих изменений колец известны в природе. Например, овцы , пасущиеся на кукурузной лилии, потребляют циклопамин (на фото) и вератрамин , два из подсемейства стероидов, у которых C- и D-кольца сжимаются и расширяются соответственно за счет биосинтетической миграции исходного атома C-13. Прием внутрь этих C-nor-D-гомостероидов приводит к врожденным дефектам у ягнят: циклопии из-за циклопамина и деформации ног из-за вератрамина. [58] Еще один C-nor-D-гомостероид (накитерпиозин) выделяется окинавскими цианобактериальными губками . например, Terpios hoshinota , приводящая к гибели кораллов от болезни черных кораллов. [59] Стероиды типа накитерпиозина активны в отношении сигнального пути, включающего белки сглаживания и hedgehog , пути, который гиперактивен при ряде видов рака. [ нужна ссылка ]
значение Биологическое
Стероиды и их метаболиты часто функционируют как сигнальные молекулы (наиболее яркими примерами являются стероидные гормоны), а стероиды и фосфолипиды являются компонентами клеточных мембран . [60] Стероиды, такие как холестерин, снижают текучесть мембран . [61] Подобно липидам , стероиды представляют собой высококонцентрированные хранилища энергии. Однако обычно они не являются источниками энергии; у млекопитающих они обычно метаболизируются и выводятся из организма.
Стероиды играют решающую роль в ряде заболеваний, включая злокачественные новообразования, такие как рак простаты , при котором выработка стероидов внутри и снаружи опухоли способствует агрессивности раковых клеток. [62]
Биосинтез и обмен веществ [ править ]
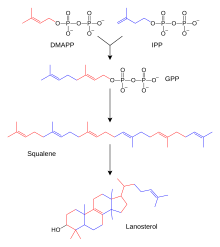
Сотни стероидов, обнаруженных у животных, грибов и растений, состоят из ланостерола (у животных и грибов; см. примеры выше) или циклоартенола (у других эукариот). И ланостерол, и циклоартенол образуются в циклизации тритерпеноида результате сквалена . [4] Ланостерол и циклоартенол иногда называют протостеринами, поскольку они служат исходными соединениями для всех других стероидов.
Биосинтез стероидов — это анаболический путь, при котором стероиды производятся из простых предшественников. У животных наблюдается уникальный путь биосинтеза (по сравнению со многими другими организмами ), что делает этот путь общей мишенью для антибиотиков и других противоинфекционных препаратов. Метаболизм стероидов у человека также является целью препаратов, снижающих уровень холестерина, таких как статины . У людей и других животных биосинтез стероидов происходит по мевалонатному пути, в котором ацетил-КоА используется в качестве строительных блоков для диметилаллилдифосфата (DMAPP) и изопентенилдифосфата (IPP). [63] [ нужен лучший источник ]
На последующих стадиях DMAPP и IPP конъюгируются с образованием фарнезилдифосфата (FPP), который в дальнейшем конъюгируется друг с другом с образованием линейного тритерпеноида сквалена. Биосинтез сквалена катализируется скваленсинтазой , которая принадлежит к семейству сквален/фитоенсинтаз . Последующее эпоксидирование и циклизация сквалена приводят к образованию ланостерола, который является отправной точкой для дополнительных модификаций других стероидов (стероидогенеза). [64] У других эукариот продуктом циклизации эпоксидированного сквалена (оксидосквалена) является циклоартенол.
Мевалонатный путь [ править ]

Мевалонатный путь (также называемый путем ГМГ-КоА-редуктазы) начинается с ацетил-КоА и заканчивается диметилаллилдифосфатом (DMAPP) и изопентенилдифосфатом (IPP).
DMAPP и IPP отдают изопреновые единицы, которые собираются и модифицируются с образованием терпенов и изопреноидов. [65] (большой класс липидов, в состав которого входят каротиноиды и образуют самый большой класс растительных натуральных продуктов ). [66] Здесь единицы изопрена соединяются, образуя сквален , и сворачиваются в набор колец, образуя ланостерин . [67] Ланостерин затем может быть преобразован в другие стероиды, такие как холестерин и эргостерин . [67] [68]
Два класса препаратов нацелены на путь мевалоната : статины (например, розувастатин ), которые используются для снижения повышенного уровня холестерина , [69] и бисфосфонаты (например, золедронат ), которые используются для лечения ряда дегенеративных заболеваний костей. [70]
Стероидогенез [ править ]

Стероидогенез — это биологический процесс, в ходе которого стероиды образуются из холестерина и превращаются в другие стероиды. [72] Пути . стероидогенеза различаются у разных видов Как отмечалось выше, основными классами стероидных гормонов (с их основными членами и функциями) являются прогестагены , кортикостероиды (кортикоиды), андрогены и эстрогены . [25] [73] Человеческий стероидогенез этих классов происходит в ряде мест:
- Прогестагены являются предшественниками всех других человеческих стероидов, и все ткани человека, которые производят стероиды, должны сначала преобразовать холестерин в прегненолон . Это преобразование является лимитирующей стадией синтеза стероидов, которая происходит внутри митохондрий соответствующей ткани. [74] [25] [ нужен лучший источник ]
- Кортизол, кортикостерон , альдостерон вырабатываются в коре надпочечников . [25] [73]
- Эстрадиол, эстрон и прогестерон вырабатываются преимущественно в яичниках , эстриол — в плаценте во время беременности, а тестостерон — преимущественно в семенниках. [25] [75] [76] [77] (некоторое количество тестостерона также может вырабатываться в коре надпочечников). [25] [73]
- Эстрадиол преобразуется из тестостерона напрямую (у мужчин) или по первичному пути ДГЭА – андростендион – эстрон и вторично через тестостерон (у женщин). [25]
- стромальные клетки Было показано, что производят стероиды в ответ на передачу сигналов, вырабатываемых клетками рака предстательной железы, испытывающими андрогенное голодание . [62] [ нужен неосновной источник ] [ нужен лучший источник ]
- Некоторые нейроны и глия в центральной нервной системе (ЦНС) экспрессируют ферменты, необходимые для местного синтеза прегненолона, прогестерона, ДГЭА и ДГЭАС, de novo или из периферических источников. [25] [ нужна ссылка ]
Альтернативные пути [ править ]
У растений и бактерий немевалонатный путь (путь MEP) использует пируват и глицеральдегид-3-фосфат в качестве субстратов для производства IPP и DMAPP. [65] [78]
Во время заболеваний могут использоваться пути, которые в противном случае не имели бы существенного значения для здоровых людей. Например, при одной из форм врожденной гиперплазии надпочечников дефицит ферментативного пути 21-гидроксилазы приводит к избытку 17α-гидроксипрогестерона (17-ОНР) – этот патологический избыток 17-ОНР, в свою очередь, может превращаться в дигидротестостерон (ДГТ, мощный андроген), среди прочего, через 17,20 лиазу (член семейства ферментов цитохрома P450 ), 5α-редуктазу и 3α-гидроксистероиддегидрогеназу . [79]
Катаболизм и выведение [ править ]
Стероиды в первую очередь окисляются ферментами оксидазы цитохрома P450 , такими как CYP3A4 . Эти реакции вводят кислород в стероидное кольцо, позволяя другим ферментам расщеплять холестерин на желчные кислоты. [80] Эти кислоты затем могут быть выведены из печени с желчью . [81] Экспрессия гена оксидазы может усиливаться с помощью стероидного датчика PXR при высокой концентрации стероидов в крови. [82] Стероидные гормоны, лишенные боковой цепи холестерина и желчных кислот, обычно гидроксилируются в различных положениях кольца или окисляются в положении 17 , конъюгируются с сульфатом или глюкуроновой кислотой и выводятся с мочой. [83]
, определение структуры и анализа методы Выделение
стероидов Выделение , в зависимости от контекста, представляет собой выделение химического вещества, необходимого для выяснения химической структуры , химической деривитации или деградации, биологических испытаний и других исследовательских нужд (обычно от миллиграммов до граммов, но часто и больше). [84] или выделение «аналитических количеств» интересующего вещества (когда основное внимание уделяется идентификации и количественному определению вещества (например, в биологической ткани или жидкости). Выделенное количество зависит от аналитического метода, но обычно меньше единицы. микрограмм. [85] [ нужна страница ]
Методы выделения для получения продукта двух масштабов различны, но включают экстракцию , осаждение, адсорбцию , хроматографию и кристаллизацию . В обоих случаях выделенное вещество очищают до химической однородности; комбинированные методы разделения и анализа, такие как ЖХ-МС , выбраны как «ортогональные» — их разделение основано на различных способах взаимодействия между веществом и изолирующей матрицей — для обнаружения одного вида в чистом образце.
Определение структуры относится к методам определения химической структуры изолированного чистого стероида с использованием развивающегося набора химических и физических методов, которые включают ЯМР малых молекул и кристаллографию . [2] : 10–19 Методы анализа перекрывают обе вышеуказанные области, уделяя особое внимание аналитическим методам определения присутствия стероида в смеси и определению его количества. [85]
Химический синтез [ править ]
Микробный катаболизм фитостеринов приводит к образованию стероидов C-19, стероидов C - боковых цепей 22 и 17-кетостероидов (т.е. предшественников адренокортикальных гормонов и противозачаточных средств ). [86] [87] [88] Добавление и модификация функциональных групп является ключевым моментом при производстве широкого спектра лекарств, доступных в рамках этой химической классификации. Эти модификации осуществляют с использованием традиционных методов органического синтеза и/или биотрансформации . [89] [90]
Прекурсоры [ править ]
Полусинтез [ править ]
Полусинтез стероидов часто начинается с таких предшественников, как холестерин , [88] фитостеролы , [87] или сапогенины . [91] Усилиями компании Syntex , занимающейся мексиканской торговлей барбаско использовалась , Dioscorea mexicana для производства сапогенина диосгенина на заре фармацевтической промышленности синтетических стероидов . [84]
Полный синтез [ править ]
Некоторые стероидные гормоны экономически выгодно получать только путем полного синтеза из продуктов нефтехимии (например, 13- алкилстероиды ). [88] Например, фармацевтический препарат Норгестрел начинается с метокси - 1-тетралона , нефтехимического продукта, полученного из фенола .
Награды за исследования [ править ]
ряд Нобелевских премий За исследования стероидов был присужден , в том числе:
- 1927 ( Химия ) Генрих Отто Виланд — Состав желчных кислот и стеринов и их связь с витаминами. [92]
- 1928 (Химия) Адольф Отто Рейнхольд Виндаус — Состав стеринов и их связь с витаминами. [93]
- 1939 (Химия) Адольф Бутенандт и Леопольд Ружичка - Выделение и структурные исследования стероидных половых гормонов и связанные с ними исследования высших терпенов. [94]
- 1950 ( физиология и медицина ) Эдвард Кэлвин Кендалл , Тадеус Райхштейн и Филип Хенч - Структура и биологические эффекты гормонов надпочечников. [95]
- 1965 (Химия) Роберт Бернс Вудворд — Частично за синтез холестерина, кортизона и ланостерола. [96]
- 1969 (Химия) Дерек Бартон и Одд Хассель - Разработка концепции конформации в химии с упором на стероидное ядро. [97]
- 1975 (Химия) Владимир Прелог — В частности, за разработку методов определения стереохимического хода биосинтеза холестерина из мевалоновой кислоты через сквален. [98]
См. также [ править ]
Ссылки [ править ]
- ↑ Перейти обратно: Перейти обратно: а б с д Мосс Г.П., Рабочая группа Объединенной комиссии IUPAC-IUB по биохимической номенклатуре (1989). «Номенклатура стероидов, рекомендации 1989 г.» (PDF) . Чистое приложение. хим. 61 (10): 1783–1822. дои : 10.1351/pac198961101783 . S2CID 97612891 . Архивировано (PDF) из оригинала 30 ноября 2012 года . Проверено 21 февраля 2012 г. Также доступно у тех же авторов по адресу «Объединенная комиссия IUPAC-IUB по биохимической номенклатуре (JCBN). Номенклатура стероидов. Рекомендации 1989 г.». Европейский журнал биохимии . 186 (3): 429–458. Декабрь 1989 г. doi : 10.1111/j.1432-1033.1989.tb15228.x . ПМИД 2606099 . ; Также доступно онлайн по адресу «Номенклатура стероидов» . Лондон, Великобритания: Лондонский университет Королевы Марии. п. 3С-1,4. Архивировано из оригинала 10 сентября 2017 года . Проверено 10 мая 2014 г.
- ↑ Перейти обратно: Перейти обратно: а б с Ледницер Д. (2011). Краткие сведения о химии стероидов . Хобокен: Уайли. ISBN 978-0-470-66084-3 .
- ^ Рен Т., Цидловски Дж. А. (октябрь 2005 г.). «Противовоспалительное действие глюкокортикоидов - новые механизмы старых лекарств». Медицинский журнал Новой Англии . 353 (16): 1711–1723. дои : 10.1056/NEJMra050541 . ПМИД 16236742 . S2CID 5744727 .
- ↑ Перейти обратно: Перейти обратно: а б «Биосинтез ланостерола» . Рекомендации по биохимической и органической номенклатуре, символам и терминологии . Международный союз биохимии и молекулярной биологии. Архивировано из оригинала 8 марта 2011 года . Проверено 28 ноября 2006 г.
- ^ Харпер Д. «Стерол | Этимология, происхождение и значение стерола по этимонлину» . Интернет-словарь этимологии . Архивировано из оригинала 19 марта 2023 года . Проверено 19 марта 2023 г.
- ^ Шеврёль М.Е. (8 мая 1815 г.). «Химические исследования жировых веществ, и в частности их соединений со щелочами. Шестая диссертация. Исследование жиров человека, овцы, говядины, ягуара и гуся» [Химические исследования жировых веществ, и особенно их соединений со щелочами. Шестые воспоминания. Исследование человеческого, овечьего, говяжьего, ягуарового и гусиного жиров. Анналы химии и физики (на французском языке). 2 : 339–372. Архивировано из оригинала 4 октября 2023 года . Проверено 11 сентября 2023 г. - через Deutsche Digitale Bibliothek.
- ^ Араго Ф., Гей-Люссак Ж.Л. (1816). Анналы химии и физики (на французском языке). У Крочарда. п. 346.
«Назову холестерин – кристаллизованное вещество из желчных камней человека...) – от χολη (желчь) и στερεος (твердое)
- ^ «Р-2.4.1 Номенклатура Fusion» . Архивировано из оригинала 22 ноября 2023 года . Проверено 22 ноября 2023 г.
- ^ Ян Ю, Крин А, Цай Х, Пупари М.Р., Чжан Ю, Чизмэн-младший, Сюй Ю (январь 2023 г.). «Конформации стероидных гормонов: инфракрасная и колебательная спектроскопия кругового дихроизма» . Молекулы . 28 (2): 771. doi : 10,3390/molecules28020771 . ПМЦ 9864676 . PMID 36677830 .
- ^ Также доступно в печатном виде на сайте Хилл Р.А., Макин Х.Л., Кирк Д.Н., Мерфи Г.М. (1991). Словарь стероидов . Лондон, Великобритания: Чепмен и Холл. стр. xxx – lix. ISBN 978-0-412-27060-4 . Проверено 20 июня 2015 г.
- ^ Рогозкин В.А. (14 июня 1991 г.). «Анаболические андрогенные стероиды: структура, номенклатура и классификация, биологические свойства» . Метаболизм анаболически-андрогенных стероидов . ЦРК Пресс. стр. 1–. ISBN 978-0-8493-6415-0 .
Структурной основой стероида является стерановое ядро, полициклический стерановый скелет С17, состоящий из трех конденсированных циклогексановых колец в нелинейном или фенантреновом соединении (А, Б и С), и циклопентанового кольца (Г).1,2
[ постоянная мертвая ссылка ] - ^ Урих К. (16 сентября 1994 г.). «Стерины и стероиды» . Сравнительная биохимия животных . Springer Science & Business Media. стр. 624–. ISBN 978-3-540-57420-0 .
- ^ Захват 2013 г.
- ↑ Перейти обратно: Перейти обратно: а б с д и ж г час Масютин М.М., Ядав МК (3 апреля 2023 г.). «Альтернативные пути андрогенов» (PDF) . Викижурнал медицины . 10:29 . дои : 10.15347/WJM/2023.003 . S2CID 257943362 .
 В эту статью включен текст из этого источника, доступного по лицензии CC BY 4.0 .
В эту статью включен текст из этого источника, доступного по лицензии CC BY 4.0 . - ^ «Объединенная комиссия IUPAC-IUB по биохимической номенклатуре (JCBN). Номенклатура стероидов. Рекомендации 1989 г.». Eur J Biochem . 186 (3): 430. 1989. doi : 10.1111/j.1432-1033.1989.tb15228.x . ПМИД 2606099 . п. 430:
3S-1,0. Определение стероидов и стеролов. Стероиды представляют собой соединения, имеющие скелет циклопента[а]фенантрена или скелет, полученный из него в результате одного или нескольких разрывов связей или расширения или сжатия кольца. Метильные группы обычно присутствуют при C-10 и C-13. Алкильная боковая цепь также может присутствовать у C-17. Стеролы — это стероиды, несущие гидроксильную группу в положении С-3 и большую часть скелета холестана.
- ↑ Перейти обратно: Перейти обратно: а б «Объединенная комиссия IUPAC-IUB по биохимической номенклатуре (JCBN). Номенклатура стероидов. Рекомендации 1989 г.». Eur J Biochem . 186 (3): 429–458. 1989. doi : 10.1111/j.1432-1033.1989.tb15228.x . ПМИД 2606099 . п. 441:
3С-4. ФУНКЦИОНАЛЬНЫЕ ГРУППЫ. 3С-4.0. Общий. Почти все биологически важные стероиды являются производными исходных углеводородов (см. табл. 1), несущими различные функциональные группы. [...] К названию насыщенной или ненасыщенной родительской системы добавляются суффиксы (см. 33-2.5), при этом окончание e в -ane, -ene, -yne, -adiene и т. д. опускается перед гласной (наличие или отсутствие цифр не влияет на такие исключения).
- ^ «Объединенная комиссия IUPAC-IUB по биохимической номенклатуре (JCBN). Номенклатура стероидов. Рекомендации 1989 г., глава 3S-4.9» . Европейский журнал биохимии . 186 (3): 429–458. Декабрь 1989 г. doi : 10.1111/j.1432-1033.1989.tb15228.x . ПМИД 2606099 . Архивировано из оригинала 19 февраля 2024 года . Проверено 19 февраля 2024 г.
3S-4.9. Тривиальные названия важных стероидов. Примеры тривиальных названий, сохранившихся для важных производных стероидов, которые в основном представляют собой природные соединения, обладающие значительной биологической активностью, приведены в таблице 2.
- ^ «Объединенная комиссия IUPAC-IUB по биохимической номенклатуре (JCBN). Номенклатура стероидов. Рекомендации 1989 г., глава 3S-1.4». Европейский журнал биохимии . 186 (3): 429–458. Декабрь 1989 г. doi : 10.1111/j.1432-1033.1989.tb15228.x . ПМИД 2606099 . п. 431:
3S-1.4. Ориентация формул проекции. Когда кольца стероида обозначаются как проекции на плоскость бумаги, формулу обычно следует ориентировать, как в пункте 2а. Атом или группа, прикрепленная к кольцу, изображенному в ориентации 2а, называется α (альфа), если он находится ниже плоскости бумаги, или β (бета), если он лежит над плоскостью бумаги.
- ^ Фавр Х.А., Пауэлл WH (2014). «П-91». Номенклатура органической химии – Рекомендации ИЮПАК и предпочтительные названия 2013 . Королевское химическое общество. дои : 10.1039/9781849733069 . ISBN 978-0-85404-182-4 . п. 868:
P-91.2.1.1 Стереодескрипторы Кана-Ингольда-Прелога (CIP). Некоторые стереодескрипторы, описанные в системе приоритетов Кана-Ингольда-Прелога (CIP), называемые «стереодескрипторы CIP», рекомендуются для определения конфигурации органических соединений, как описано и показано на примерах в этой главе и применяется в главах с P-1 по P-8. и в номенклатуре натуральных продуктов в главе П-10. Следующие стереодескрипторы используются в качестве предпочтительных стереодескрипторов (см. P-92.1.2): (a) «R» и «S» для обозначения абсолютной конфигурации тетракоординатных (квадрилигантных) центров хиральности;
- ^ «3.5: Именование хиральных центров - система R и S» . 11 августа 2018 года. Архивировано из оригинала 1 ноября 2023 года . Проверено 16 октября 2023 г.
- ^ Фавр Х.А., Пауэлл WH (2014). «П-13.8.1.1». Номенклатура органической химии – Рекомендации ИЮПАК и предпочтительные названия 2013 г. Королевское химическое общество. дои : 10.1039/9781849733069 . ISBN 978-0-85404-182-4 . п. 66:
P-13.8.1.1 Префикс «de» (не «des»), за которым следует название группы или атома (кроме водорода), означает удаление (или потерю) этой группы и добавление необходимых атомов водорода. , т. е. обмен этой группы на атомы водорода. В виде исключения, «дезокси» применительно к гидроксисоединениям означает удаление атома кислорода из группы –OH с повторным присоединением атома водорода. «Дезокси» широко используется в качестве субтрактивного префикса в номенклатуре углеводов (см. P-102.5.3).
- ^ «Объединенная комиссия IUPAC-IUB по биохимической номенклатуре (JCBN). Номенклатура стероидов. Рекомендации 1989 г.». Eur J Biochem . 186 (3): 430. 1989. doi : 10.1111/j.1432-1033.1989.tb15228.x . ПМИД 2606099 . п. 430:
3С-1.1. Нумерация и кольцевые буквы. Стероиды пронумерованы, а кольца обозначены буквами, как в формуле 1.
- ↑ Перейти обратно: Перейти обратно: а б «Объединенная комиссия IUPAC-IUB по биохимической номенклатуре (JCBN). Номенклатура стероидов. Рекомендации 1989 г.». Eur J Biochem . 186 (3): 436–437. 1989. doi : 10.1111/j.1432-1033.1989.tb15228.x . ПМИД 2606099 . п. 436-437:
3S-2,5 Ненасыщенность. Ненасыщенность обозначается заменой -ана на -ен, -адиен, -ин и т. д. или -ан- на -ен-, -адиен-, -ин- и т. д. Примеры: Андрост-5-ен, а не 5-андростен; 5α-холест-6-ен; 5β-холеста-7,9(11)-диен; 5α-холест-6-ен-3β-ол. Примечания. 1) Теперь рекомендуется, чтобы место двойной связи всегда располагалось рядом со слогом, обозначающим ненасыщенность.[...] 3) Не рекомендуется использовать символ Δ (греческая заглавная дельта) для обозначения ненасыщенности в отдельных именах. Однако его можно использовать и в общих терминах, например, «Δ 5 -стероиды'
- ^ Фавр Х.А., Пауэлл WH (2014). «П-3». Номенклатура органической химии – Рекомендации ИЮПАК и предпочтительные названия 2013 . Королевское химическое общество. дои : 10.1039/9781849733069 . ISBN 978-0-85404-182-4 .
П-31.2.2 Общая методология. Префиксы «гидро» и «дегидро» связаны с гидрированием и дегидрированием двойной связи соответственно; таким образом, умножающие префиксы четных значений, такие как «ди», «тетра» и т. д., используются для обозначения насыщения двойной связи (связей), например «дигидро», «тетрагидро»; или создание двойных (или тройных) связей, как «дидегидро» и т. д. В названиях они ставятся непосредственно перед названием родительского гидрида и перед любыми неотделяемыми префиксами. Указанные атомы водорода имеют приоритет над префиксами «гидро» для низких локантов. Если в названии присутствуют указанные атомы водорода, перед ними ставится префикс «гидро».
- ↑ Перейти обратно: Перейти обратно: а б с д и ж г час Миллер В.Л., Охус Р.Дж. (февраль 2011 г.). «Молекулярная биология, биохимия и физиология стероидогенеза человека и его нарушений» . Эндокр преп . 32 (1): 81–151. дои : 10.1210/er.2010-0013 . ПМЦ 3365799 . ПМИД 21051590 .
- ^ «Результаты поиска в Google Scholar для «5α-прегнан-17α-диол-3,11,20-трион» — это неправильное имя» . 2022. Архивировано из оригинала 6 октября 2023 года . Проверено 1 октября 2023 г.
- ^ «Результаты поиска в Google Scholar для «5α-прегнан-17α-ол-3,20-диона» — это неправильное название» . 2022. Архивировано из оригинала 7 октября 2023 года . Проверено 1 октября 2023 г.
- ^ Макин Х.Л., Траффордский диджей (1972). «Химия стероидов». Клиники эндокринологии и обмена веществ . 1 (2): 333–360. дои : 10.1016/S0300-595X(72)80024-0 .
- ^ Бонджованни А.М., Клейтон Г.В. (март 1954 г.). «Упрощенный метод оценки содержания 11-оксигенированных нейтральных 17-кетостероидов в моче лиц с гиперплазией коры надпочечников». Труды Общества экспериментальной биологии и медицины . 85 (3): 428–429. дои : 10.3181/00379727-85-20905 . ПМИД 13167092 . S2CID 8408420 .
- ^ Слонуайт-младший WR, Нили Л., Сэндберг А.А. (1964). «Метаболизм 11-оксиандрогенов у человека». Стероиды . 3 (4): 391–416. дои : 10.1016/0039-128X(64)90003-0 .
- ^ Тейлор А.Э., Уэр М.А., Бреслоу Э., Пайл Л., Северн С., Надо К.Дж. и др. (июль 2022 г.). «11-Оксиандрогены у подростков с синдромом поликистозных яичников» . Журнал Эндокринного общества . 6 (7): bvac037. дои : 10.1210/jendso/bvac037 . ПМЦ 9123281 . ПМИД 35611324 .
- ^ Турку А.Ф., Реге Дж., Охус Р.Дж., Рейни В.Е. (май 2020 г.). «11-Оксигенированные андрогены в здоровье и болезни» . Обзоры природы. Эндокринология . 16 (5): 284–296. дои : 10.1038/s41574-020-0336-x . ПМЦ 7881526 . ПМИД 32203405 .
- ^ Барнард Л., Дю Туа Т., Сварт AC (апрель 2021 г.). «Вернемся туда, где ему место: 11β-гидроксиандростендион требует переоценки C11-оксиандрогенов в стероидогенезе». Молекулярная и клеточная эндокринология . 525 : 111189. doi : 10.1016/j.mce.2021.111189 . ПМИД 33539964 . S2CID 231776716 .
- ^ Фавр Х., Пауэлл В. (2014). «Приложение 2». Номенклатура органической химии – Рекомендации ИЮПАК и предпочтительные названия 2013 г. Королевское химическое общество. дои : 10.1039/9781849733069 . ISBN 978-0-85404-182-4 . п. 1112:
окси* –О– П-15.3.1.2.1.1; П-63.2.2.1.1
- ^ Барриентос Э.Дж., Лапуэрта М., Боеман А.Л. (август 2013 г.). «Групповая аддитивность при образовании сажи на примере кислородсодержащих углеводородных топлив C-5». Горение и пламя . 160 (8): 1484–1498. Бибкод : 2013CoFl..160.1484B . doi : 10.1016/j.combustflame.2013.02.024 .
- ^ «Объединенная комиссия IUPAC-IUB по биохимической номенклатуре (JCBN). Номенклатура стероидов. Рекомендации 1989 г.». Eur J Biochem . 186 (3): 429–58. 1989. doi : 10.1111/j.1432-1033.1989.tb15228.x . ПМИД 2606099 . п. 430:
Префикс оксо- также следует использовать в сочетании с общими терминами, например, 17-оксостероиды. Термин «17-кетостероиды», часто используемый в медицинской литературе, неверен, поскольку C-17 указывается дважды, поскольку термин «кето» обозначает C=O.
- ^ Биологическое значение стероидов . Архивировано из оригинала 12 февраля 2024 года . Проверено 12 февраля 2024 г.
- ^ «17.2С: Стероиды» . Либретексты по биологии . 3 июля 2018 года. Архивировано из оригинала 12 февраля 2024 года . Проверено 12 февраля 2024 г.
- ^ Хосино Ю., Гоше Э.А. (2021). «Распространение стероидов» . Труды Национальной академии наук Соединенных Штатов Америки . 118 (25). дои : 10.1073/pnas.2101276118 . ПМЦ 8237579 . ПМИД 34131078 .
- ^ «Распространение стероидов» . Архивировано из оригинала 18 января 2017 года . Проверено 17 мая 2024 г.
{{cite web}}: CS1 maint: bot: исходный статус URL неизвестен ( ссылка ) - ^ «Распространение видов» . дои : 10.1073/pnas.2101276118 . ПМИД 34131078 .
- ^ Боде Х.Б., Зеггель Б., Силаковски Б., Венцель С.К., Райхенбах Х., Мюллер Р. (январь 2003 г.). «Биосинтез стероидов у прокариот: идентификация миксобактериальных стероидов и клонирование первой бактериальной 2,3 (S)-оксидоскваленциклазы из миксобактерии Stigmatella aurantiaca». Молекулярная микробиология . 47 (2): 471–81. дои : 10.1046/j.1365-2958.2003.03309.x . ПМИД 12519197 . S2CID 37959511 .
- ^ Десмонд Э., Грибальдо С. (2009). «Филогеномика синтеза стеринов: понимание происхождения, эволюции и разнообразия ключевых особенностей эукариот» . Геномная биология и эволюция . 1 : 364–81. дои : 10.1093/gbe/evp036 . ПМК 2817430 . ПМИД 20333205 .
- ^ Зиденбург Г., Йендроссек Д. (июнь 2011 г.). «Сквален-гопенциклазы» . Прикладная и экологическая микробиология . 77 (12): 3905–15. Бибкод : 2011ApEnM..77.3905S . дои : 10.1128/AEM.00300-11 . ПМК 3131620 . ПМИД 21531832 .
- ^ Бхетария П.Дж., Шарма Н., Сингх П., Трипати П., Упадхьяй С.К., Гаутам П. (21 марта 2017 г.). «Грибковые патогены человека и лекарственная устойчивость к азоловым препаратам». В Арора С., Саджид А., Калия В. (ред.). Лекарственная устойчивость бактерий, грибов, малярии и рака . Спрингер. ISBN 978-3-319-48683-3 .
- ↑ Перейти обратно: Перейти обратно: а б с д и ж г Кавана К., изд. (8 сентября 2017 г.). Грибы: биология и применение . Джон Уайли и сыновья, Inc. ISBN 978-1-119-37431-2 .
- ^ Винк М (сентябрь 2003 г.). «Эволюция вторичных метаболитов с экологической и молекулярно-филогенетической точки зрения». Фитохимия . 64 (1): 3–19. Бибкод : 2003PChem..64....3W . дои : 10.1016/S0031-9422(03)00300-5 . ПМИД 12946402 .
- ^ Винк М., Ван Вик Б.Е. (2008). Меняющие сознание и ядовитые растения мира . Портленд (Орегон, США) и Солсбери (Лондон, Англия): Timber Press Inc. стр. 252, 253 и 254. ISBN. 978-0-88192-952-2 .
- ^ Винк М., ван Вик Б.Е. (2008). Меняющие сознание и ядовитые растения мира . Портленд (Орегон, США) и Солсбери (Лондон, Англия): Timber Press Inc. стр. 324, 325 и 326. ISBN. 978-0-88192-952-2 .
- ^ Эриксон-Нилсен В., Кэй А.Д. (2014). «Стероиды: фармакология, осложнения и вопросы практического применения» . Окснер Дж . 14 (2): 203–7. ПМЦ 4052587 . ПМИД 24940130 .
- ^ «Международный журнал молекулярных наук» . Архивировано из оригинала 12 февраля 2024 года . Проверено 12 февраля 2024 г.
- ^ Зорея А (2014). Стероиды (проблемы здравоохранения и медицины сегодня) . Вестпорт, Коннектикут: Greenwood Press. стр. 10–12. ISBN 978-1-4408-0299-7 .
- ^ «Путь биосинтеза стероидного гормона C19 - Браузер онтологии - База данных генома крысы» . rgd.mcw.edu . Архивировано из оригинала 12 мая 2023 года . Проверено 11 апреля 2022 г.
- ^ Эдгрен Р.А., Станчик ФЗ (декабрь 1999 г.). «Номенклатура гонановых прогестинов». Контрацепция . 60 (6): 313. doi : 10.1016/S0010-7824(99)00101-8 . ПМИД 10715364 .
- ^ Хэнсон-младший (июнь 2010 г.). «Стероиды: частичный синтез в медицинской химии». Отчеты о натуральных продуктах . 27 (6): 887–99. дои : 10.1039/c001262a . ПМИД 20424788 .
- ^ «Рекомендации ИЮПАК: Модификация скелета в пересмотренном разделе F: Натуральные продукты и родственные соединения (Рекомендации ИЮПАК, 1999 г.)» . Международный союз теоретической и прикладной химии (ИЮПАК). 1999. Архивировано из оригинала 4 марта 2016 года . Проверено 20 мая 2014 г.
- ^ Вольфинг Дж (2007). «Последние разработки в области выделения и синтеза D-гомостероидов и родственных соединений» . Аркивок . 2007 (5): 210–230. дои : 10.3998/ark.5550190.0008.517 . hdl : 2027/spo.5550190.0008.517 . Архивировано из оригинала 1 февраля 2013 года . Проверено 20 мая 2014 г.
- ^ Гао Г, Чен С (2012). «Накитерпиозин» . В Кори Э.Дж., Ли Дж.Дж. (ред.). Тотальный синтез натуральных продуктов: на переднем крае органической химии . Берлин: Шпрингер. дои : 10.1007/978-3-642-34065-9 . ISBN 978-3-642-34064-2 . S2CID 92690863 .
- ^ Уэмура Э., Кита М., Аримото Х., Китамура М. (2009). «Последние аспекты химической экологии: природные токсины, коралловые сообщества и симбиотические отношения» . Чистое приложение. Хим . 81 (6): 1093–1111. doi : 10.1351/PAC-CON-08-08-12 .
- ^ Сильверторн ДУ, Джонсон БР, Обер ВК, Обер CE, Сильверторн AC (2016). Физиология человека: комплексный подход (Седьмое изд.). [Сан-Франциско]: Sinauer Associates; WH Freeman & Co. ISBN 978-0-321-98122-6 . ОСЛК 890107246 .
- ^ Садава Д., Хиллис Д.М., Хеллер Х.К., Беренбаум М.Р. (2011). Жизнь: наука биологии (9-е изд.). Сан-Франциско: Фриман. стр. 105–114. ISBN 978-1-4292-4646-0 .
- ↑ Перейти обратно: Перейти обратно: а б Любик А.А., Нури М., Труонг С., Гаффари М., Адомат Х.Х., Кори Э., Кокс М.Э., Ли Н., Ганс Э.С., Йенки П., Фам С., Буттян Р. (2016). «Паракринная передача сигналов Sonic Hedgehog вносит значительный вклад в приобретенный стероидогенез в микроокружении опухоли простаты» . Межд. Дж. Рак . 140 (2): 358–369. дои : 10.1002/ijc.30450 . ПМИД 27672740 . S2CID 2354209 .
- ^ Гроховски Л.Л., Сюй Х., Уайт Р.Х. (май 2006 г.). «Methanocaldococcus jannaschii использует модифицированный мевалонатный путь для биосинтеза изопентенилдифосфата» . Журнал бактериологии . 188 (9): 3192–8. дои : 10.1128/JB.188.9.3192-3198.2006 . ПМЦ 1447442 . ПМИД 16621811 .
- ^ Чатуфонпрасерт В., Ярукамджорн К., Эллингер И. (12 сентября 2018 г.). «Физиология и патофизиология биосинтеза, транспорта и метаболизма стероидов в плаценте человека» . Границы в фармакологии . 9 : 1027. дои : 10.3389/fphar.2018.01027 . ISSN 1663-9812 . ПМК 6144938 . ПМИД 30258364 .
- ↑ Перейти обратно: Перейти обратно: а б Кузуяма Т., Сето Х (апрель 2003 г.). «Разнообразие биосинтеза изопреновых единиц». Отчеты о натуральных продуктах . 20 (2): 171–83. дои : 10.1039/b109860h . ПМИД 12735695 .
- ^ Дубей В.С., Бхалла Р., Лутра Р. (сентябрь 2003 г.). «Обзор немевалонатного пути биосинтеза терпеноидов в растениях» (PDF) . Журнал биологических наук . 28 (5): 637–46. дои : 10.1007/BF02703339 . ПМИД 14517367 . S2CID 27523830 . Архивировано из оригинала (PDF) 15 апреля 2007 года.
- ↑ Перейти обратно: Перейти обратно: а б Шрёпфер Г.Дж. (1981). «Биосинтез стерола». Ежегодный обзор биохимии . 50 : 585–621. дои : 10.1146/annurev.bi.50.070181.003101 . ПМИД 7023367 .
- ^ Лиз Н.Д., Скэггс Б., Кирш Д.Р., Бард М. (март 1995 г.). «Клонирование поздних генов пути биосинтеза эргостерола Saccharomyces cerevisiae - обзор». Липиды . 30 (3): 221–6. дои : 10.1007/BF02537824 . ПМИД 7791529 . S2CID 4019443 .
- ^ Конес Р. (декабрь 2010 г.). «Розувастатин, воспаление, С-реактивный белок, ЮПИТЕР и первичная профилактика сердечно-сосудистых заболеваний — перспектива» . Дизайн, разработка и терапия лекарств . 4 : 383–413. дои : 10.2147/DDDT.S10812 . ПМК 3023269 . ПМИД 21267417 .
- ^ Рулофс А.Дж., Томпсон К., Гордон С., Роджерс М.Дж. (октябрь 2006 г.). «Молекулярные механизмы действия бисфосфонатов: современное состояние». Клинические исследования рака . 12 (20, часть 2): 6222–6230 гг. дои : 10.1158/1078-0432.CCR-06-0843 . ПМИД 17062705 . S2CID 9734002 .
- ^ Хэггстрем М., Ричфилд Д. (2014). «Схема путей стероидогенеза человека» . Викижурнал медицины . 1 (1). дои : 10.15347/wjm/2014.005 . ISSN 2002-4436 .
- ^ Ханукоглу I (декабрь 1992 г.). «Стероидогенные ферменты: структура, функции и роль в регуляции биосинтеза стероидных гормонов» . Журнал биохимии стероидов и молекулярной биологии . 43 (8): 779–804. дои : 10.1016/0960-0760(92)90307-5 . ПМИД 22217824 . S2CID 112729 . Архивировано из оригинала 26 апреля 2021 года . Проверено 20 апреля 2018 г.
- ↑ Перейти обратно: Перейти обратно: а б с Эстлунд И., Сноп Дж., Шиффер Л., Вабич М., Арльт В., Сторбек К.Х. (февраль 2024 г.). «Фермент 11β-гидроксистероиддегидрогеназа типа 1, активирующий глюкокортикоиды, катализирует активацию тестостерона» . J Стероид Биохим Мол Биол . 236 : 106436. дои : 10.1016/j.jsbmb.2023.106436 . ПМИД 38035948 .
- ^ Россье МФ (август 2006 г.). «Т-каналы и биосинтез стероидов: в поисках связи с митохондриями». Клеточный кальций . 40 (2): 155–64. дои : 10.1016/j.ceca.2006.04.020 . ПМИД 16759697 .
- ^ «Репродуктивные гормоны» . 24 января 2022 года. Архивировано из оригинала 10 февраля 2024 года . Проверено 12 февраля 2024 г.
- ^ Дэвис ХК, Хакни AC (2017). «Ось гипоталамо-гипофиз-яичников и пероральные контрацептивы: регуляция и функция» . Половые гормоны, физические упражнения и женщины . стр. 1–17. дои : 10.1007/978-3-319-44558-8_1 . ISBN 978-3-319-44557-1 .
- ^ андроген . 19 января 2024 года. Архивировано из оригинала 29 января 2024 года . Проверено 12 февраля 2024 г.
- ^ Лихтенталер Гонконг (июнь 1999 г.). «1-дезокси-d-ксилулозо-5-фосфатный путь биосинтеза изопреноидов в растениях». Ежегодный обзор физиологии растений и молекулярной биологии растений . 50 : 47–65. doi : 10.1146/annurev.arplant.50.1.47 . ПМИД 15012203 .
- ^ Витчел С.Ф., Аззиз Р. (2010). «Неклассическая врожденная гиперплазия надпочечников» . Международный журнал детской эндокринологии . 2010 : 1–11. дои : 10.1155/2010/625105 . ПМК 2910408 . ПМИД 20671993 .
- ^ Пикулева И.А. (декабрь 2006 г.). «Цитохром P450 и гомеостаз холестерина». Фармакология и терапия . 112 (3): 761–73. doi : 10.1016/j.pharmthera.2006.05.014 . ПМИД 16872679 .
- ^ Золлнер Г., Маршалл Х.У., Вагнер М., Траунер М. (2006). «Роль ядерных рецепторов в адаптивном ответе на желчные кислоты и холестаз: патогенетические и терапевтические соображения». Молекулярная фармацевтика . 3 (3): 231–51. дои : 10.1021/mp060010s . ПМИД 16749856 .
- ^ Кливер С.А., Гудвин Б., Уилсон Т.М. (октябрь 2002 г.). «Ядерный рецептор прегнана X: ключевой регулятор метаболизма ксенобиотиков» . Эндокринные обзоры . 23 (5): 687–702. дои : 10.1210/er.2001-0038 . ПМИД 12372848 .
- ^ Стеймер Т. «Метаболизм стероидных гормонов» . Сотрудничающий центр ВОЗ по образованию и исследованиям в области репродукции человека . Женевский фонд медицинского образования и исследований. Архивировано из оригинала 17 февраля 2015 года . Проверено 27 марта 2015 г.
- ↑ Перейти обратно: Перейти обратно: а б «Создание Рассела Маркера в мексиканской индустрии стероидных гормонов» . Международная историческая химическая достопримечательность . Американское химическое общество. Архивировано из оригинала 12 февраля 2020 года . Проверено 10 мая 2014 г.
- ↑ Перейти обратно: Перейти обратно: а б Макин Х.Л., Хонор Дж.В., Шеклтон CH, Гриффитс WJ (2010). «Общие методы экстракции, очистки и измерения стероидов методами хроматографии и масс-спектрометрии». Макин Х.Л., Гауэр Д.Б. (ред.). Стероидный анализ . Дордрехт; Нью-Йорк: Спрингер. стр. 163–282. ISBN 978-1-4020-9774-4 .
- ^ Коннер А.Х., Нагаока М., Роу Дж.В., Перлман Д. (август 1976 г.). «Микробная конверсия стеринов таллового масла в стероиды C19» . Прикладная и экологическая микробиология . 32 (2): 310–1. Бибкод : 1976ApEnM..32..310C . дои : 10.1128/АЕМ.32.2.310-311.1976 . ПМК 170056 . ПМИД 987752 .
- ↑ Перейти обратно: Перейти обратно: а б Хесселинк П.Г., ван Влит С., де Врис Х., Витолт Б. (1989). «Оптимизация расщепления боковой цепи стероида Mycobacterium sp. в присутствии циклодекстринов». Ферментные и микробные технологии . 11 (7): 398–404. дои : 10.1016/0141-0229(89)90133-6 .
- ↑ Перейти обратно: Перейти обратно: а б с Сандов Дж., Юрген Э., Харинг М., Ниф Г., Прежевовски К., Сташ У. (2000). «Гормоны». Энциклопедия промышленной химии Ульмана . Wiley-VCH Verlag GmbH & Co. KGaA. дои : 10.1002/14356007.a13_089 . ISBN 978-3-527-30673-2 .
- ^ Фрид Дж., Тома Р.В., Герке Дж.Р., Герц Дж.Э., Донин М.Н., Перлман Д. (1952). «Микробиологические трансформации стероидов.1 I. Введение кислорода в углерод-11 прогестерона». Журнал Американского химического общества . 73 (23): 5933–5936. дои : 10.1021/ja01143a033 .
- ^ Чапек М., Олдрич Х., Алоис С. (1966). Микробные трансформации стероидов . Прага: Издательство «Академия» Чехословацкой академии наук. дои : 10.1007/978-94-011-7603-3 . ISBN 978-94-011-7605-7 . S2CID 13411462 .
- ^ Маркер РЭ, Рорманн Э (1939). «Стерины. LXXXI. Превращение сарсаса-погенина в прегнанедиал - 3 (α), 20 (α)». Журнал Американского химического общества . 61 (12): 3592–3593. дои : 10.1021/ja01267a513 .
- ^ «Нобелевская премия по химии 1927 года» . Нобелевский фонд. Архивировано из оригинала 20 октября 2012 года . Проверено 27 ноября 2013 г.
- ^ «Нобелевская премия по химии 1928 года» . Нобелевский фонд. Архивировано из оригинала 17 октября 2012 года . Проверено 27 ноября 2013 г.
- ^ «Нобелевская премия по химии 1939 года» . Нобелевский фонд. Архивировано из оригинала 20 октября 2012 года . Проверено 27 ноября 2013 г.
- ^ «Нобелевская премия по физиологии и медицине 1950 года» . Нобелевский фонд. Архивировано из оригинала 19 октября 2012 года . Проверено 27 ноября 2013 г.
- ^ «Нобелевская премия по химии 1965 года» . Нобелевский фонд. Архивировано из оригинала 6 ноября 2012 года . Проверено 1 декабря 2013 г.
- ^ «Нобелевская премия по химии 1969 года» . Нобелевский фонд. Архивировано из оригинала 22 октября 2012 года . Проверено 27 ноября 2013 г.
- ^ «Нобелевская премия по химии 1975 года» . Нобелевский фонд. Архивировано из оригинала 20 октября 2012 года . Проверено 1 декабря 2013 г.
Библиография [ править ]
- Рассел, Калифорния (2005). «Органическая химия: натуральные продукты, стероиды». В Расселе, Калифорния, Робертсе Г.К. (ред.). Химическая история: обзоры новейшей литературы . Кембридж: RSC Publ. ISBN 978-0-85404-464-1 .
- «Создание Рассела Маркера в мексиканской индустрии стероидных гормонов - ориентир -» . Американское химическое общество. 1999. Архивировано из оригинала 12 февраля 2020 года . Проверено 10 мая 2014 г.
- Ледницер Д. (2011). Краткие сведения о химии стероидов . Хобокен: Уайли. дои : 10.1002/9780470973639 . ISBN 978-0-470-66085-0 . Краткая история изучения стероидов.
- Йодер Р.А., Джонстон Дж.Н. (декабрь 2005 г.). «Пример биомиметического полного синтеза: карбоциклизация полиолефинов в терпены и стероиды» . Химические обзоры . 105 (12): 4730–56. дои : 10.1021/cr040623l . ПМЦ 2575671 . ПМИД 16351060 . Обзор истории синтеза стероидов, особенно биомиметических .
- Хан Т.С., Уокер Б.Р., Арлт В., Росс Р.Дж. (февраль 2014 г.). «Лечение и результаты лечения взрослых с врожденной гиперплазией надпочечников». Обзоры природы. Эндокринология . 10 (2): 115–24. дои : 10.1038/nrendo.2013.239 . ПМИД 24342885 . S2CID 6090764 . Путь стероидогенеза надпочечников.
- Греп Р.О., изд. (22 октября 2013 г.). «Кортоиновые кислоты» . Недавний прогресс в исследованиях гормонов: материалы Лаврентийской конференции по гормонам 1979 года . Эльзевир Наука . стр. 345–391. ISBN 978-1-4832-1956-1 .
- Боуэн Р.А. (20 октября 2001 г.). «Стероидогенез» . Патофизиология эндокринной системы . Государственный университет Колорадо. Архивировано из оригинала 28 февраля 2009 года.









