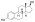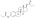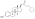Полиэстрадиола фосфат
 | |
 Скелетная структура полиэстрадиолфосфата (вверху) и шаростержневая модель эстрадиолфосфата ) (один мономер полиэстрадиолфосфата) (внизу | |
| Клинические данные | |
|---|---|
| Торговые названия | Эстрадурин, Эстрадурин |
| Другие имена | ПКП; Полимерный фосфат эстрадиола; Полимерный эстрадиол-17β-фосфат; Эстрадиолфосфатный полимер; полимер эстрадиола-17β-фосфата; Полимер эстрадиола с фосфорной кислотой; Лео-114 |
| AHFS / Drugs.com | Международные названия лекарств |
| Беременность категория |
|
| Маршруты администрация | Внутримышечная инъекция [ 1 ] [ 2 ] |
| Класс препарата | Эстроген ; Эстрогеновый эфир |
| код АТС | |
| Юридический статус | |
| Юридический статус |
|
| Фармакокинетические данные | |
| Биодоступность | ИМ : Высокий |
| Связывание с белками | Эстрадиол: ~98% (к альбумину и ГСПГ ) [ 3 ] [ 4 ] [ 1 ] |
| Метаболизм | Преимущественно в печени , в меньшей степени в почках , половых железах и мышцах (за счет фосфатаз ). [ 1 ] |
| Метаболиты | Эстрадиол , фосфорная кислота и метаболиты эстрадиола [ 5 ] [ 6 ] |
| Период полувыведения | ПКП: 70 дней (10 недель) [ 7 ] Эстрадиол: 1–2 часа. [ 8 ] |
| Экскреция | Моча (в виде конъюгатов ) [ 1 ] |
| Идентификаторы | |
| Номер CAS | |
| ПабХим SID | |
| Лекарственный Банк | |
| ХимическийПаук |
|
| НЕКОТОРЫЙ | |
| КЕГГ | |
| ХЭМБЛ | |
| Химические и физические данные | |
| Формула | (С 18 Н 23 О 4 Р) н (n = переменная; n = 13) |
| Молярная масса | Полимер : Переменная Повторяющаяся единица : 334,347 г/моль. |
| Температура плавления | От 195 до 202 ° C (от 383 до 396 ° F) |
| (проверять) | |
Полиэстрадиолфосфат ( ПЭП ), продаваемый под торговой маркой Эстрадурин , представляет собой препарат эстрогена , который используется в основном при лечении рака простаты у мужчин. [ 1 ] [ 9 ] [ 2 ] [ 10 ] Он также используется у женщин для лечения рака молочной железы , как компонент гормональной терапии для лечения низкого уровня эстрогена и менопаузы симптомов , а также как компонент феминизирующей гормональной терапии для трансгендерных женщин . [ 1 ] [ 11 ] Его вводят путем инъекции в мышцу один раз в четыре недели. [ 1 ] [ 2 ] [ 12 ]
Общие побочные эффекты ПКП включают головную боль , болезненность молочных желез , развитие молочных желез , феминизацию , сексуальную дисфункцию , бесплодие и вагинальные кровотечения . [ 1 ] [ 2 ] ПЭП является эстрогеном и, следовательно, является агонистом рецептора эстрогена , биологической мишени эстрогенов , таких как эстрадиол . [ 2 ] [ 6 ] [ 5 ] Это сложный эфир эстрогена в форме полимера , длительным действием который является пролекарством эстрадиола с чрезвычайно в организме. [ 2 ] [ 12 ] [ 5 ] [ 6 ] Биологический период полураспада ПКП составляет более двух месяцев. [ 7 ] Поскольку ПКП действует путем преобразования в эстрадиол, он считается естественной и биоидентичной формой эстрогена. [ 5 ] [ 2 ] Профиль безопасности парентеральных эфиров эстрадиола , таких как PEP, значительно улучшен по сравнению с синтетическими пероральными эстрогенами, такими как этинилэстрадиол и диэтилстильбестрол . [ 2 ]
ПЭП был открыт примерно в 1953 году и был введен для медицинского применения в США в 1957 году. [ 12 ] [ 13 ] [ 14 ] Наряду с ундецилатом эстрадиола и валератом эстрадиола он часто использовался в США и Европе в качестве парентеральной формы эстрогена для лечения мужчин с раком простаты. [ 15 ] Однако он больше не доступен в США. [ 13 ] [ 16 ]
Медицинское использование
[ редактировать ]ПКП используется в виде внутримышечных инъекций для эстрогенной терапии рака предстательной железы у мужчин. [ 1 ] [ 2 ] Он также используется для лечения рака молочной железы не менее 5 лет у женщин в постменопаузе . [ 1 ] [ 17 ] [ 18 ] Кроме того, ПКП используется в заместительной гормональной терапии при низком уровне эстрогена из-за гипогонадизма или менопаузы у женщин. [ 1 ] Он также используется в феминизирующей гормональной терапии для трансгендерных женщин . [ 11 ] [ 19 ] ПКП – это форма терапии высокими дозами эстрогенов . [ 2 ] После инъекции он очень медленно высвобождает активный агент эстрадиол в течение как минимум нескольких месяцев. [ 20 ] [ 7 ]
ПКП сравнивали с комбинированной андрогенной блокадой (КАБ; кастрация плюс флутамид ) при лечении рака простаты в крупном рандомизированном клиническом исследовании с участием 915 пациентов. [ 21 ] [ 22 ] Через 18,5 месяцев не было различий в выживаемости или сердечно-сосудистой токсичности между двумя методами лечения. [ 21 ] [ 22 ] Эти данные позволяют предположить, что парентеральные формы эстрадиола могут иметь аналогичную эффективность и безопасность по сравнению с андрогендепривационной терапией (АДТ) при лечении рака простаты. [ 21 ] [ 22 ] Кроме того, эстрогены могут иметь значительные преимущества по сравнению с АДТ с точки зрения потери костной массы и переломов , приливов , сексуальной функции и качества жизни , а также значительную экономию средств при парентеральных формах эстрадиола по сравнению с ГнРГ . аналогами терапией [ 21 ] [ 22 ] С другой стороны, болезненность молочных желез и гинекомастия очень часто наблюдаются при приеме эстрогенов, тогда как частота встречаемости низкая при кастрации и CAB. [ 23 ] Однако гинекомастия при приеме эстрогенов обычно имеет легкую или умеренную степень тяжести и обычно доставляет лишь умеренный дискомфорт. [ 2 ] Кроме того, гинекомастию, вызванную эстрогенами, можно предотвратить профилактическим облучением молочных желез или устранить мастэктомией . [ 2 ]
ПКП изучалась для лечения рака простаты в дозах 160 мг/месяц (три исследования) и 240 мг/месяц (четыре исследования). [ 24 ] В дозе 160 мг/мес ПКП не полностью подавляет уровень тестостерона , не достигая кастрационного уровня, и значительно уступает орхиэктомии в замедлении прогрессирования заболевания. [ 24 ] [ 2 ] И наоборот, ПКП в дозе 240 мг/месяц приводит к более сильному подавлению тестостерона в диапазоне кастрации, аналогично орхиэктомии, и по эффективности эквивалентен орхиэктомии. [ 24 ] [ 2 ]
При раке простаты у мужчин ПКП обычно назначают в дозе от 80 до 320 мг каждые 4 недели в течение первых 2–3 месяцев для быстрого повышения уровня эстрадиола. [ 1 ] После этого для поддержания уровня эстрадиола дозировку обычно снижают до 40–160 мг каждые 4 недели на основании клинических данных и лабораторных показателей. [ 1 ] При раке молочной железы и низком уровне эстрогена у женщин дозировка составляет от 40 до 80 мг каждые 4 недели. [ 1 ] Для трансгендерных женщин дозировка составляет от 80 до 160 мг каждые 4 недели. [ 11 ] [ 19 ] [ 25 ] [ 5 ]
Доступные формы
[ редактировать ]ПКП предоставляется в форме порошка или водного раствора во флаконах и ампулах отдельно или в сочетании с мепивакаином и/или никотинамидом ( витамином B3 ) для внутримышечного введения . [ 1 ] [ 26 ] [ 27 ] Мепивакаин является местным анестетиком и используется, чтобы избежать ощущения жжения во время инъекции ПКП. [ 1 ] Каждый флакон/ампула эстрадурина содержит 80 мг ПКП, 5 мг гидрохлорида мепивакаина, 40 мг никотинамида и 2 мл воды. [ 27 ]
Противопоказания
[ редактировать ]Противопоказания : ПКП во многом такие же, как и у эстрадиола, и включают [ 1 ] [ 28 ] [ 29 ] [ 30 ] [ 31 ]
- Повышенная чувствительность к ПКП, мепивакаину или другим ингредиентам.
- Известный, предшествующий или подозреваемый рак молочной железы или другие эстрогензависимые злокачественные опухоли (например, рак эндометрия )
- Вагинальное кровотечение неизвестной причины или нелеченая гиперплазия эндометрия.
- Тромбоз и связанные с ним заболевания, включая активный тромбофлебит , бывшую или текущую венозную тромбоэмболию ( тромбоз глубоких вен , тромбоэмболия легочной артерии ), активную или недавнюю артериальную тромбоэмболию (например, стенокардия , инфаркт миокарда ) или известную тромбофилию (например, дефицит белка C , дефицит белка S , дефицит антитромбина )
- Тяжелая аритмия , гипотония , гипертония или нарушения липидного обмена.
- Цереброваскулярные события (например, инсульт )
- Острое заболевание печени или ранее подтвержденное заболевание печени с отклонениями в показателях функции печени или желтухой (например, синдром Дубина-Джонсона , синдром Ротора )
- Тяжелая печеночная дисфункция
- Другие, включая порфирию , серповидноклеточную анемию , отосклероз или миастению.
- Беременность , лактация и грудное вскармливание
Побочные эффекты
[ редактировать ]Систематические исследования побочных эффектов ПКП отсутствуют. [ 1 ] Однако предполагается, что его побочные эффекты идентичны таковым у эстрадиола и других эфиров эстрадиола . [ 1 ] Побочные эффекты ПКП частично зависят от пола. [ 1 ] К частым или частым (>10%) побочным эффектам относят головную боль , боль в животе , тошноту , сыпь , зуд , потерю либидо , эректильную дисфункцию , болезненность молочных желез , гинекомастию , феминизацию , демаскулинизацию , бесплодие , а также вагинальные кровотечения или кровянистые выделения . [ 1 ] [ 32 ] Побочные эффекты, возникающие время от времени или нечасто (0,1–1%), включают задержку натрия и воды , отеки , гиперчувствительность , напряжение молочных желез , депрессию , головокружение , нарушения зрения , сердцебиение , диспепсию , узловатую эритему , крапивницу и боль в груди . [ 1 ] Все остальные побочные эффекты ПКП считаются редкими. [ 1 ]
К редким (<0,1%) побочным эффектам ПКП относят увеличение веса , нарушение толерантности к глюкозе , изменения настроения ( приподнятое настроение или депрессия ), нервозность , утомляемость , головная боль , мигрень , непереносимость контактных линз , гипертония , тромбоз , тромбофлебит , тромбоэмболия. , сердечная недостаточность , инфаркт миокарда , рвота , вздутие живота , холестатическая желтуха , желчнокаменная болезнь , преходящее повышение уровня трансаминаз и билирубина , мультиформная эритема , гиперпигментация , мышечные судороги , дисменорея , выделения из влагалища , предменструальноподобные симптомы , увеличение молочных желез , атрофия яичек , аллергические реакции ( например, крапивница , бронхиальная астма , анафилактический шок ) вследствие мепивакаина и реакции в месте инъекции (например, боль , стерильные абсцессы , воспалительные инфильтраты ). [ 1 ]
Поскольку тромбоэмболические и другие сердечно-сосудистые осложнения связаны главным образом с синтетическими пероральными эстрогенами, такими как этинилэстрадиол и диэтилстильбэстрол , они возникают гораздо реже с парентеральными биоидентичными формами эстрогенов, такими как ПКП. [ 1 ] [ 2 ]
Сердечно-сосудистые эффекты
[ редактировать ]ПКП оказывает минимальное нежелательное воздействие на факторы свертывания крови увеличивает риск образования тромбов . и, как полагают , незначительно или вообще не [ 33 ] [ 34 ] И это несмотря на то, что при применении высоких доз (320 мг/месяц) ПКП уровни эстрадиола могут достигать высоких концентраций (до 700 пг/мл). [ 35 ] Это также контрастирует с пероральными синтетическими эстрогенами, такими как диэтилстильбэстрол и этинилэстрадиол , которые вызывают заметное увеличение факторов свертывания крови и высокую скорость образования тромбов при высоких дозах, используемых для достижения кастрационного уровня тестостерона при раке простаты. [ 33 ] [ 34 ] [ 6 ] Разница между двумя типами терапии обусловлена биоидентичной и парентеральной природой ПКП и ее минимальным влиянием на синтез белка в печени . [ 33 ] [ 34 ] [ 6 ] ПКП может фактически снизить риск образования тромбов за счет снижения уровня определенных прокоагулянтных белков. [ 33 ] [ 34 ] Хотя ПКП не увеличивает выработку печенью или уровень прокоагулянтных факторов, было обнаружено, что она значительно снижает уровни антикоагулянтного антитромбина III , что может указывать на потенциальный риск тромбоэмболических и сердечно-сосудистых осложнений. [ 2 ] С другой стороны, ПКП значительно повышает уровень холестерина ЛПВП и значительно снижает уровень холестерина ЛПНП , изменения, которые, как считается, защищают от ишемической болезни сердца . [ 2 ] Похоже, что ПКП может оказывать благотворное влияние на здоровье сердечно-сосудистой системы при более низких дозах (например, 160 мг/день) из-за его положительного воздействия на уровни холестерина ЛПВП и ЛПНП, но эти эффекты затмеваются при более высоких дозах (например, 240 мг/день) из-за к неблагоприятному дозозависимому влиянию на гемостаз , а именно на уровень антитромбина III. [ 2 ]
Небольшие ранние пилотные исследования ПКП при раке простаты у мужчин не выявили сердечно-сосудистой токсичности этой терапии. [ 33 ] Доза ПКП 160 мг/мес, по-видимому, не увеличивает риск сердечно-сосудистых осложнений. [ 2 ] Фактически, при этой дозировке наблюдалось потенциальное положительное влияние на смертность от сердечно-сосудистых заболеваний. [ 2 ] Тем не менее, в крупных исследованиях впоследствии было обнаружено, что ПКП в более высокой дозе 240 мг/месяц значительно увеличивает сердечно-сосудистую заболеваемость по сравнению с модуляторами ГнРГ и орхиэктомией у мужчин, получавших ее по поводу рака простаты. [ 33 ] [ 34 ] [ 2 ] Увеличение сердечно-сосудистой заболеваемости на фоне ПКП-терапии связано с увеличением несмертельных сердечно-сосудистых событий, включая ишемическую болезнь сердца и декомпенсацию сердца , в частности сердечную недостаточность . [ 34 ] [ 36 ] [ 37 ] И наоборот, не было обнаружено значительного увеличения сердечно-сосудистой смертности при ПКП по сравнению с модуляторами ГнРГ и орхиэктомией. [ 33 ] [ 34 ] Более того, в одном крупном исследовании в группу ПКП было рандомизировано большее количество пациентов с ранее существовавшими сердечно-сосудистыми заболеваниями (17,1% против 14,5%; значимость не сообщается), и это могло способствовать увеличению частоты сердечно-сосудистых заболеваний, наблюдаемых при ПКП. [ 34 ] В любом случае, некоторые исследования показали, что увеличение сердечно-сосудистой заболеваемости при ПКП ограничивается главным образом первым годом или двумя годами терапии, тогда как одно исследование обнаружило постоянное увеличение сердечно-сосудистой заболеваемости в течение трех лет терапии. [ 33 ] Лонгитюдный анализ риска, рассчитанный на 10 лет, показал, что сердечно-сосудистые риски ПКП могут быть обращены вспять при длительном лечении и что терапия может в конечном итоге привести к значительному снижению сердечно-сосудистого риска по сравнению с модуляторами ГнРГ и орхиэктомией, хотя это не было подтверждено. [ 33 ]
Сердечно-сосудистая токсичность ПКП намного меньше, чем у пероральных синтетических эстрогенов, таких как диэтилстильбэстрол и этинилэстрадиол, которые повышают риск венозной и артериальной тромбоэмболии и, как следствие, увеличивают риск транзиторной ишемической атаки , нарушения мозгового кровообращения (инсульта) и инфаркта миокарда (инфаркта). ), и приводят к существенному увеличению смертности от сердечно-сосудистых заболеваний. [ 33 ] [ 34 ] Считается, что относительно минимальная сердечно-сосудистая токсичность парентеральных форм эстрадиола, таких как ПКП и трансдермальные пластыри с эстрадиолом в высоких дозах, [ 38 ] Это связано с отсутствием у них влияния на факторы свертывания печени. [ 33 ] [ 34 ]
Передозировка
[ редактировать ]Исследования острой токсичности не выявили риска острых побочных эффектов при передозировке ПКП. [ 1 ] Средняя летальная доза (LD 50 ) PEP для мышей составляет примерно 700 мг/кг. [ 39 ] ПКП назначалась в общих количествах от 2000 до 3000 мг в течение нескольких месяцев пациентам с раком без наблюдаемой токсичности . [ 39 ] Наиболее вероятным признаком передозировки является обратимая феминизация , а именно гинекомастия . [ 1 ] Другие симптомы эстрогена передозировки могут включать тошноту , рвоту , вздутие живота , увеличение веса , задержку жидкости , болезненность груди , выделения из влагалища , тяжесть в ногах и судороги ног . [ 28 ] Эти побочные эффекты можно уменьшить, уменьшив дозировку эстрогена. [ 28 ] не существует . Специфического антидота при передозировке ПКП [ 1 ] Лечение передозировки ПКП должно основываться на симптомах . [ 1 ]
Взаимодействия
[ редактировать ]Известные потенциальные взаимодействия ПКП в основном такие же, как и у эстрадиола, и включают: [ 1 ]
- цитохрома P450 Ингибиторы , особенно CYP3A4 , могут снижать метаболизм эстрадиола и тем самым повышать уровень эстрадиола; примеры включают противоинфекционные средства (например, эритромицин , кларитромицин , кетоконазол , итраконазол ), циметидин и грейпфрутовый сок . [ 1 ] [ 40 ]
- цитохрома P450 Индукторы , особенно CYP3A4, могут индуцировать метаболизм эстрадиола и тем самым снижать уровень эстрадиола; примеры включают противосудорожные средства (например, фенобарбитал , карбамазепин , фенитоин ), противоинфекционные средства ( рифампицин , рифабутин , невирапин и эфавиренз ) и зверобой ; кроме того, хотя ритонавир и нелфинавир известны как сильные ингибиторы, они оказывают индуцирующее действие в сочетании со стероидными гормонами. [ 1 ]
- Некоторые антибиотики (например, ампициллин , тетрациклины ) могут снижать уровень эстрадиола за счет ограничения энтерогепатической рециркуляции эстрадиола. [ 1 ]
- Парацетамол (ацетаминофен), некоторые бета-блокаторы (например, метопролол ) и некоторые бензодиазепины могут усиливать эффекты ПКП. [ 1 ]
- Эффекты коагуляции, ПКП, способствующие могут усиливать эффекты аминокапроновой кислоты. [ 1 ]
- Полистиролфосфат может снизить действие антикоагулянтов. [ 1 ]
- Эстрогены повышают уровень тироксинсвязывающего глобулина и могут привести к повышению общего уровня гормонов щитовидной железы (но не уровня свободных гормонов щитовидной железы у эутиреоидных лиц); [ 41 ] интерпретация функциональных тестов щитовидной железы должна учитывать это [ 1 ]
- Из-за снижения толерантности к глюкозе это может влиять на потребность в инсулине или пероральных противодиабетических препаратах. [ 1 ]
- ПКП может ослаблять действие фибратов (например, безафибрат ) и некоторых нестероидных противовоспалительных препаратов (например, феназон ). [ 1 ]
- Одновременное применение гепатотоксичных препаратов, особенно дантролена , может увеличить риск гепатотоксичности. [ 1 ]
- Ингибиторы фосфатазы, такие как левамизол, могут ингибировать расщепление PEP до эстрадиола.
Взаимодействие с ПКП может быть меньшим, чем с пероральными эстрогенами, из-за отсутствия первого прохождения через печень . [ 1 ]
Фармакология
[ редактировать ]Фармакодинамика
[ редактировать ]
ПЭП представляет собой сложный эфир эстрадиола в форме полимера и длительным действием является пролекарством эстрадиола с чрезвычайно . [ 2 ] [ 7 ] [ 5 ] [ 6 ] По сути, это эстроген или агонист рецепторов эстрогена . [ 2 ] [ 6 ] [ 5 ] ПЭП оказывает антигонадотропное и функциональное антиандрогенное действие благодаря своей эстрогенной активности. [ 35 ] Единственная повторяющаяся единица PEP, соответствующая фосфату эстрадиола (без OH 2 ), имеет молекулярную массу примерно на 23% выше , чем у эстрадиола, из-за присутствия его фосфатного эфира C17β. [ 42 ] [ 15 ] Поскольку ПКП является пролекарством эстрадиола, его считают естественной и биоидентичной формой эстрогена. [ 5 ]
PEP является сильным ингибитором нескольких ферментов , включая кислую фосфатазу , щелочную фосфатазу и гиалуронидазу , in vitro . [ 43 ] [ 44 ] [ 45 ] В свете того факта, что фосфатазы , расщепляющие ПЭП на эстрадиол и фосфорную кислоту, присутствуют в большинстве тканей организма, считается, что длительный период полувыведения и медленное высвобождение ПЭП вызывают некоторое удивление. [ 46 ] Считается, что ПКП может ингибировать собственный метаболизм . [ 46 ]
-
Уровни эстрадиола и тестостерона при однократной внутримышечной инъекции 320 мг полиэстрадиолфосфата у мужчин с раком простаты. [ 7 ]
-
Уровни эстрадиола и тестостерона при приеме полиэстрадиолфосфата 160, 240 или 320 мг один раз каждые 4 недели внутримышечными инъекциями у мужчин с раком простаты. [ 35 ]
Антигонадотропные эффекты
[ редактировать ]ПЭП оказывает антигонадотропное действие благодаря своей эстрогенной активности. [ 36 ] Было обнаружено, что он подавляет уровень тестостерона у мужчин на 55%, 75% и 85% при внутримышечных дозах 80, 160 и 240 мг каждые 4 недели соответственно. [ 46 ] Было обнаружено, что однократная внутримышечная инъекция 320 мг ПКП мужчинам подавляет уровень тестостерона до уровня кастрации (< 50 нг/дл) в течение 3 недель. [ 7 ] Это было связано с уровнем циркулирующего эстрадиола чуть более 200 пг/мл. [ 35 ] Подавление уровня тестостерона, которого можно достичь с помощью ПКП, такое же, как и при орхиэктомии . [ 47 ] Однако для достижения таких концентраций тестостерона, которые в среднем составляют около 15 нг/дл, были необходимы более высокие концентрации эстрадиола – около 500 пг/мл. [ 35 ] [ 47 ] [ 48 ] Это было связано с внутримышечным введением 320 мг ПКП каждые четыре недели и происходило к 90 дням лечения. [ 35 ] Однако сообщалось, что прием 240 мг ПКП каждые четыре недели в конечном итоге подавляет уровень тестостерона в диапазоне кастрации. [ 49 ] [ 50 ]
Механизм действия при раке простаты
[ редактировать ]Рост рака простаты обычно стимулируется дигидротестостероном (ДГТ), и если рак не устойчив к кастрации , его можно лечить, лишая его андрогенов . Эстрадиол оказывает свое терапевтическое воздействие главным образом за счет воздействия отрицательной обратной связи на ось гипоталамус-гипофиз-гонады . [ 36 ] [ 46 ] [ 7 ] Это блокирует секрецию лютеинизирующего гормона , снижает тестостерона выработку в клетках Лейдига яичек , что, в свою очередь . [ 36 ] [ 46 ] [ 7 ] Эстрадиол также снижает процент свободного тестостерона за счет повышения уровня глобулина, связывающего половые гормоны (ГСПГ). [ 7 ] Кроме того, он проявляет прямую цитотоксичность в отношении клеток рака простаты. [ 51 ] [ 20 ]
Отличия от других эстрогенов
[ редактировать ]
| Факторы | Пероральные эстрогены а | Парентеральные эстрогены б |
|---|---|---|
| Фактор VII | Увеличивает | Без изменений |
| фактора VIII Активность | Увеличивает | Без изменений |
| антитромбина III Активность | Уменьшается | Уменьшается |
| Фрагмент протромбина 1+2 | Увеличивает | Без изменений |
| Устойчивость к активированному протеину С | Увеличивает | Без изменений |
| Фибриноген | Уменьшается | Без изменений |
| Сноски: а = Например, DES , EE . б = ПЭП. Источники: [ 34 ] | ||
Эстрогены оказывают влияние на синтез белков печени , в том числе на синтез белков плазмы , факторов свертывания крови , липопротеинов и триглицеридов . [ 47 ] Эти эффекты могут привести к увеличению риска тромбоэмболических и сердечно-сосудистых осложнений, что, в свою очередь, может привести к увеличению смертности . [ 47 ] Исследования обнаружили заметно повышенный 5-летний риск сердечно-сосудистой смертности (от 14 до 26%) у мужчин, получавших пероральные синтетические эстрогены, такие как этинилэстрадиол и диэтилстильбэстрол, по поводу рака простаты. [ 47 ] Однако в то время как пероральные синтетические эстрогены оказывают сильное влияние на синтез белка в печени, влияние парентеральных биоидентичных эстрогенов, таких как ПЭП, на синтез белка в печени сравнительно очень слабое или даже полностью устраняется. [ 47 ] Это связано с тем, что при пероральном приеме избегают первого прохождения через печень и поскольку биоидентичные эстрогены эффективно инактивируются в печени. [ 47 ] Соответственно, ПКП оказывает минимальное влияние на печень в дозировке не менее 240 мг/мес. [ 52 ]
Исследование показало, что в то время как внутримышечная ПКП в дозе 320 мг/месяц повышала уровень ГСПГ до 166% у мужчин с раком простаты, комбинация 80 мг/месяц внутримышечного полиэстрадиолфосфата и 150 мкг/день перорального этинилэстрадиола повышала уровень ГСПГ до 617%, что почти 8-кратная разница в увеличении и почти 4-кратная разница в абсолютных уровнях между двумя схемами лечения. [ 35 ] [ 7 ] [ 53 ] Кроме того, хотя в группе, получавшей только ПКП, не было сердечно-сосудистых осложнений, в группе, которую также лечили этинилэстрадиолом, частота сердечно-сосудистых осложнений в течение года составила 25%. [ 7 ] Другое исследование не обнаружило никаких изменений в уровнях фактора свертывания крови VII , белка, имеющего особое значение в сердечно-сосудистых побочных эффектах эстрогенов, при внутримышечной ПКП в дозе 240 мг/месяц. [ 52 ] Эти результаты демонстрируют огромное влияние синтетических пероральных эстрогенов, таких как этинилэстрадиол, на выработку белка в печени по сравнению с парентеральными биоидентичными формами эстрогена, такими как ПКП. [ 7 ]
Первоначально ПКП обычно использовался в дозе 80 мг в месяц в сочетании с пероральным приемом 150 мкг в день этинилэстрадиола при лечении рака простаты. [ 46 ] [ 54 ] Было обнаружено, что эта комбинация вызывает значительную частоту сердечно-сосудистой токсичности, [ 47 ] и в некоторых публикациях эту токсичность ошибочно приписывали ПКП. [ 55 ] Последующие исследования показали, что токсичность обусловлена не ПКП, а компонентом этинилэстрадиола. [ 56 ] [ 46 ] [ 47 ]
Исследование показало, что терапия внутримышечной ПКП, приводящая к повышению уровня эстрадиола около 400 пг/мл у мужчин с раком простаты, не влияет на уровни гормона роста или инсулиноподобного фактора роста 1 , тогда как добавление перорального этинилэстрадиола значительно увеличивает уровни гормона роста и снижает Уровень инсулиноподобного фактора роста 1. [ 57 ] [ 58 ]
Фармакокинетика
[ редактировать ]ПКП имеет очень длительный срок действия и вводится внутримышечно один раз в 4 недели. [ 35 ] У мужчин первоначальная внутримышечная инъекция ПКП приводит к быстрому повышению уровня эстрадиола, измеряемому через 24 часа, с последующим медленным и постепенным дальнейшим увеличением уровня, по крайней мере, до 28-го дня (момента следующей инъекции). [ 35 ] Последующие инъекции приводят к прогрессирующему и значительному накоплению уровня эстрадиола в течение как минимум 6 месяцев. [ 35 ] Было обнаружено, что средний период полувыведения ПКП составляет 70 дней (10 недель) при однократном внутримышечном введении дозы 320 мг препарата. [ 7 ] T . max (время достижения максимальных концентраций) для эстрадиола составляло около 16 дней [ 7 ] ПКП составляет Продолжительность примерно 1 месяц при разовой дозе 40 мг, 2 месяца при дозе 80 мг и 4 месяца при дозе 160 мг. [ 59 ] [ 60 ] [ 61 ] [ 62 ] [ 39 ]
ПКП попадает в кровоток в течение нескольких часов после инъекции (90% через 24 часа), где циркулирует и накапливается в ретикулоэндотелиальной системе . [ 51 ] Затем эстрадиол отщепляется от полимера фосфатазами , хотя и очень медленно. [ 63 ] Уровни эстрадиола у мужчин, получавших внутримышечные инъекции ПКП один раз в 4 недели, составляли около 350 пг/мл при дозе 160 мг, 450 пг/мл при дозе 240 мг и почти 700 пг/мл при дозе 320 мг, все измеренные после 6 месяцев лечения. [ 35 ] При ежемесячных инъекциях стабильная концентрация эстрадиола достигается через 6–12 месяцев. [ 51 ] Эстрадиол метаболизируется преимущественно в печени под действием CYP3A4 и других цитохрома P450 ферментов и в меньшей степени метаболизируется во внепеченочных тканях. [ 20 ] [ 1 ] Метаболиты основном в выводятся с мочой через почки . [ 1 ]
Ранние исследования показали, что дозировка 80 мг ПКП каждые 4 недели быстро приводит к относительно высоким средним уровням эстрадиола, примерно от 400 до 800 пг/мл. [ 64 ] Эти уровни аналогичны уровням приема 100 мг ундецилата эстрадиола каждый месяц, который, как было обнаружено, обеспечивает уровни эстрадиола примерно от 500 до 600 пг/мл. [ 65 ] [ 66 ] В результате ранее говорилось, что 80 мг ПКП в месяц и 100 мг ундецилата эстрадиола в месяц примерно эквивалентны. [ 67 ] [ 68 ] [ 7 ] Однако последующие исследования показали, что такая дозировка ПКП на самом деле обеспечивает гораздо более низкие уровни эстрадиола, чем первоначально продемонстрировано. [ 35 ]
Химия
[ редактировать ]ПЭП представляет собой синтетический эстрана стероид и фосфорной кислоты (фосфата) эфир эстрадиола C17β ( эстрадиол-17β-фосфат ) в форме полимера . [ 69 ] [ 15 ] [ 46 ] [ 70 ] Он также известен как полимер эстрадиола с фосфорной кислотой или как полимер 17β-фосфата эстрадиола, а также полимер 17β-фосфата эстра-1,3,5(10)-триен-3,17β-диол. [ 15 ] [ 69 ] [ 46 ] [ 70 ] было установлено С помощью ультрацентрифугирования , что средняя молекулярная масса ПЭП соответствует длине цепи примерно 13 повторяющихся единиц 17β-фосфата эстрадиола. [ 46 ] ПЭП тесно связан с фосфатом полиэстриола (Гинасан, Климадурин, Триодурин) и фосфатом политестостерона флоретина (никогда не поступившим в продажу), которые представляют собой сложные эфиры эстриола и тестостерона в форме полимеров соответственно. [ 59 ] [ 71 ] Он также связан с фосфатом полидиэтилстильбестрола (никогда не поступившим в продажу), сложным эфиром диэтилстильбестрола в форме полимера . [ 72 ]
Растворимость
[ редактировать ]ПЭП очень плохо растворяется в воде , ацетоне , хлороформе , диоксане и этаноле , но легко растворяется в основаниях , особенно в водном пиридине . [ 51 ]
Синтез
[ редактировать ]Как и полифосфаты полифенолов , ПЭП можно получить из мономера (в данном случае эстрадиола) и фосфорилхлорида . Последний реагирует как с фенольной гидроксильной группой в положении 3, так и с алифатической в положении 17β. Молекулярную массу полученного полимера можно контролировать, прерывая реакцию через определенное время: чем дольше продолжается реакция, тем выше масса. [ 63 ] [ 73 ]
История
[ редактировать ]Фармакологические эксперименты с фосфатами эстрадиола, проведенные около 1950 года, дали начало гипотезе, что эстрадиол-3,17β-дифосфат действует как ингибитор почечной щелочной фосфатазы . [ 63 ] Когда те же учёные захотели синтезировать простые фосфаты флоретина , соединения, обнаруженного в листьях яблони, [ 74 ] вместо этого они случайно создали полимер. [ 73 ] Позже было показано, что он проявляет те же антифосфатазные свойства, что и дифосфат эстрадиола, и поэтому была выдвинута гипотеза, что первоначальное открытие было связано с загрязнением полимерами фосфата эстрадиола. [ 63 ] Следовательно, эти полимеры были изучены более детально, что привело к разработке ПЭП уже в 1953 году. [ 12 ] и его последующее внедрение для медицинского использования в 1957 году в США . [ 13 ] [ 14 ] [ 75 ] PEP оставался на рынке США как минимум до 2000 года, но в конечном итоге был прекращен как в этой стране, так и в большинстве или во всех других странах. [ 15 ] [ 13 ] [ 42 ] [ 76 ] [ 77 ]
Общество и культура
[ редактировать ]Общие имена
[ редактировать ]Полиэстрадиолфосфат — это непатентованное название препарата, а также его INN Tooltip и BAN Tooltip . [ 15 ] [ 69 ] [ 42 ] Он также известен под своим кодовым названием Leo-114 . [ 15 ] [ 42 ]
Названия брендов
[ редактировать ]ПКП продается исключительно под торговой маркой Эстрадурин или Эстрадурин. [ 15 ] [ 42 ]
Доступность
[ редактировать ]
ПЭП продается в США и во многих странах Европы , в том числе в Австрии , Бельгии , Чехии , Дании , Финляндии , Германии , Италии , Нидерландах , Норвегии , России , Испании , Швеции , Швейцарии , Украине и Великобритании. . [ 15 ] [ 26 ] [ 1 ] [ 76 ] [ 77 ] [ 14 ] Однако он больше не доступен в США, Швейцарии и некоторых других странах. [ 13 ] [ 16 ] но до сих пор известно, что он продается в Австрии, Бельгии, Дании, Финляндии, Нидерландах, Норвегии и Швеции. [ 42 ] [ 76 ] [ 77 ] [ 1 ]
Исследовать
[ редактировать ]ПКП изучалась как средство гормонального увеличения груди у женщин. [ 78 ]
Комбинация ПКП и медроксипрогестерона ацетата изучалась у женщин как комбинированный инъекционный контрацептив применения длительного действия для внутримышечного один раз в три месяца. [ 79 ] [ 80 ] [ 81 ]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Перейти обратно: а б с д и ж г час я дж к л м н тот п д р с т в v В х и С аа аб и объявление но из в ах есть также и аль являюсь а к ап ак с как в «Эстрадурин® – Фармановия» . Архивировано из оригинала 2 января 2018 года . Проверено 1 января 2018 г.
- ^ Перейти обратно: а б с д и ж г час я дж к л м н тот п д р с т в v В Миккола А., Рууту М., Аро Дж., Ранникко С., Сало Дж. (1999). «Роль парентерального полиэстрадиолфосфата в лечении распространенного рака предстательной железы на пороге нового тысячелетия». Annales Chirurgiae et Gynaecologiae . 88 (1): 18–21. ПМИД 10230677 .
Орхиэктомия и эстрогены используются более 50 лет при лечении распространенного рака предстательной железы. Хотя орхиэктомия — простая процедура, она может вызвать психологический стресс. Пероральная терапия эстрогенами так же эффективна, как и орхиэктомия, с точки зрения ингибирующего рака эффекта, но ее признание в качестве основного гормонального лечения омрачается повышенным риском сердечно-сосудистых осложнений. Парентеральный эстроген, полиэстрадиолфосфат (ПЭП), эффективен, но также связан с сердечно-сосудистыми осложнениями, хотя и в меньшей степени. В течение последних 20 лет хорошо переносимые аналоги рилизинг-гормона лютеинизирующего гормона (ЛГРГ) заменили орхиэктомию и эстрогены. Были предприняты попытки повысить эффективность лечения путем добавления антиандрогенов к аналогам ЛГРГ, а также к орхиэктомии (комбинированная андрогенная блокада, КАВ). Однако эффективность аналогов LHRH и CAB не превосходит эффективность простой орхиэктомии, и, более того, они являются дорогостоящими методами лечения. Орхиэктомия и аналоги ЛГРГ связаны с негативным воздействием на костную массу и могут вызывать остеопороз, тогда как лечение ПКП имеет противоположный эффект. Парентеральный полиэстрадиолфосфат по-прежнему является дешевым потенциальным средством лечения распространенного рака предстательной железы, но необходимо провести дальнейшие исследования, чтобы установить его будущую роль, например, сочетание ацетилсалициловой кислоты для предотвращения сердечно-сосудистых осложнений.
- ^ Станчик Ф.З., Арчер Д.Ф., Бхавнани Б.Р. (июнь 2013 г.). «Этинилэстрадиол и 17β-эстрадиол в комбинированных пероральных контрацептивах: фармакокинетика, фармакодинамика и оценка риска». Контрацепция . 87 (6): 706–727. doi : 10.1016/j.contraception.2012.12.011 . ПМИД 23375353 .
- ^ Гупта МК, Чиа С.Ю. (2007). «Гормоны яичников: структура, биосинтез, функции, механизм действия и лабораторная диагностика» . В Фальконе Т., Херд В.В. (ред.). Клиническая репродуктивная медицина и хирургия . Elsevier Науки о здоровье. стр. 22, 362, 388. ISBN. 978-0-323-03309-1 .
- ^ Перейти обратно: а б с д и ж г час Кунц В., Блоде Х., Циммерманн Х. (6 декабря 2012 г.). «Фармакокинетика экзогенных природных и синтетических эстрогенов» . В Эттель М., Шиллингер Э. (ред.). Эстрогены и антиэстрогены II: фармакология и клиническое применение эстрогенов и антиэстрогенов . Springer Science & Business Media. п. 261 544. ISBN 978-3-642-60107-1 .
Рассматриваемые здесь природные эстрогены включают: [...] Эфиры 17β-эстрадиола, такие как валерат эстрадиола, бензоат эстрадиола и ципионат эстрадиола. Целью этерификации является либо лучшее всасывание после перорального введения, либо замедленное высвобождение из депо после внутримышечного введения. При всасывании сложные эфиры расщепляются эндогенными эстеразами и высвобождается фармакологически активный 17β-эстрадиол; поэтому сложные эфиры считаются природными эстрогенами.
- ^ Перейти обратно: а б с д и ж г Куль Х. (август 2005 г.). «Фармакология эстрогенов и прогестагенов: влияние различных путей введения». Климактерический . 8 (Приложение 1): 3–63. дои : 10.1080/13697130500148875 . ПМИД 16112947 . S2CID 24616324 .
- ^ Перейти обратно: а б с д и ж г час я дж к л м н тот Стеге Р., Гуннарссон П.О., Йоханссон С.Дж., Олссон П., Пусетт А., Карлстрем К. (май 1996 г.). «Фармакокинетика и подавление тестостерона однократной дозой полиэстрадиолфосфата (эстрадурина) у больных раком предстательной железы». Простата . 28 (5): 307–310. doi : 10.1002/(SICI)1097-0045(199605)28:5<307::AID-PROS6>3.0.CO;2-8 . ПМИД 8610057 . S2CID 33548251 .
- ^ Дюстерберг Б., Нишино Ю (декабрь 1982 г.). «Фармакокинетика и фармакологические особенности валерата эстрадиола». Матуритас . 4 (4): 315–324. дои : 10.1016/0378-5122(82)90064-0 . ПМИД 7169965 .
- ^ Стеге Р., Карлстрем К., Хедлунд П.О., Пусетт А., фон Шульц Б., Хенрикссон П. (сентябрь 1995 г.). «[Внутримышечные депо-эстрогены (Эстрадурин) в лечении больных раком предстательной железы. Исторические аспекты, механизм действия, результаты и современное клиническое состояние]» [Внутримышечные депо-эстрогены (Эстрадурин) в лечении больных раком предстательной железы. Исторические аспекты, механизм действия, результаты и современное клиническое состояние. Дер Уролог. Аусг. А (на немецком языке). 34 (5): 398–403. ПМИД 7483157 .
Более 50 лет назад пероральный эстроген уже использовался для лечения рака простаты. Из-за сердечно-сосудистых побочных эффектов с высокой заболеваемостью (25%) это лечение не стало стандартным. Недавние исследования показывают, что парентеральное применение снижает риск побочных эффектов со стороны сердечно-сосудистой системы, поскольку позволяет избежать первого прохождения через печень высоких концентраций эстрогена, которое обычно происходит после перорального применения. Следовательно, можно избежать повышенного синтеза так называемых «стероидочувствительных» белков печени, таких как факторы свертывания крови (особенно фактор VII). Это новое парентеральное применение эстрогена показывает обнадеживающие результаты дешевой и эффективной гормональной терапии с низким уровнем побочных эффектов у пациентов с раком простаты.
- ^ Миккола А., Аро Дж., Ранникко С., Рууту М. (март 2007 г.). «Десятилетняя выживаемость и сердечно-сосудистая смертность у пациентов с распространенным раком простаты, которых лечили преимущественно внутримышечным введением полиэстрадиолфосфата или орхиэктомией». Простата . 67 (4): 447–455. дои : 10.1002/pros.20547 . ПМИД 17219379 . S2CID 20549248 .
- ^ Перейти обратно: а б с Урдл В. (2009). «Терапевтические принципы транссексуализма». Гинекологическая эндокринология (на немецком языке). 7 (3): 153–160. дои : 10.1007/s10304-009-0314-9 . ISSN 1610-2894 . S2CID 8001811 .
- ^ Перейти обратно: а б с д Штайнбах Т., Вурм, Франция (май 2015 г.). «Полифосфоэфиры: новая платформа для разлагаемых полимеров». Ангеванде Хеми . 54 (21): 6098–6108. дои : 10.1002/anie.201500147 . ПМИД 25951459 .
- ^ Перейти обратно: а б с д и «Drugs@FDA: Лекарственные препараты, одобренные FDA: Эстрадурин» . Управление по контролю за продуктами и лекарствами США . Проверено 24 июня 2018 г.
- ^ Перейти обратно: а б с Издательство Уильяма Эндрю (22 октября 2013 г.). Энциклопедия фармацевтического производства . Эльзевир. стр. 2934–2935. ISBN 978-0-8155-1856-3 .
- ^ Перейти обратно: а б с д и ж г час я Index Nominum 2000: Международный каталог лекарств . Тейлор и Фрэнсис. Январь 2000 г. стр. 1-1. 856–. ISBN 978-3-88763-075-1 .
- ^ Перейти обратно: а б Мосби (11 февраля 2009 г.). Карманный словарь Мосби по медицине, сестринскому делу и медицинским профессиям . Elsevier Науки о здоровье. стр. 3672–. ISBN 978-0-323-06604-4 .
- ^ Островский MJ, Джексон AW (1979). «Полиэстрадиолфосфат: предварительная оценка его влияния на рак молочной железы». Отчеты о лечении рака . 63 (11–12): 1803–1807. ПМИД 393380 .
- ^ Бруннер Н., Спанг-Томсен М., Каллен К. (1996). «Ксенотрансплантат рака молочной железы человека T61: экспериментальная модель эстрогенной терапии рака молочной железы». Исследование и лечение рака молочной железы . 39 (1): 87–92. дои : 10.1007/bf01806080 . ПМИД 8738608 . S2CID 27430232 .
[...] В исследовании парентеральной терапии эстрогенами пациентов с метастатическим раком молочной железы 14 из 24 пациентов получили объективный ответ (включая пациентов со стабильным заболеванием >6 месяцев) [13]. Единственным побочным эффектом, о котором сообщалось, было кровотечение из гиперпластического эндометрия.
- ^ Перейти обратно: а б Арвер Д.С. (2015). «Транссексуализм, könsdysfori» [Транссексуализм, гендерная дисфория] . Проверено 12 ноября 2018 г.
- ^ Перейти обратно: а б с Ясек В., изд. Австрийский кодекс (на немецком языке) (62-е изд.). Вена: Издательство австрийского фармацевта. стр. 2992–4. ISBN 978-3-85200-181-4 .
- ^ Перейти обратно: а б с д Сайед Ю., Таксел П. (декабрь 2003 г.). «Применение эстрогеновой терапии у мужчин». Современное мнение в фармакологии . 3 (6): 650–654. дои : 10.1016/j.coph.2003.07.004 . ПМИД 14644018 .
- ^ Перейти обратно: а б с д Хедлунд П.О., Хенрикссон П. (март 2000 г.). «Парентеральная эстрогеновая абляция по сравнению с полной андрогенной абляцией при лечении распространенной карциномы простаты: влияние на общую выживаемость и сердечно-сосудистую смертность. Скандинавское исследование рака простаты (SPCG)-5». Урология . 55 (3): 328–333. дои : 10.1016/s0090-4295(99)00580-4 . ПМИД 10699602 .
- ^ Дипиндер Ф., Браунштайн Г.Д. (сентябрь 2012 г.). «Лекарственная гинекомастия: обзор фактических данных». Экспертное заключение о безопасности лекарственных средств . 11 (5): 779–795. дои : 10.1517/14740338.2012.712109 . ПМИД 22862307 . S2CID 22938364 .
Лечение эстрогенами имеет самую высокую частоту гинекомастии (40–80%), на втором месте идут антиандрогены, включая флутамид, бикалутамид и нилутамид, с частотой 40–70%, за ними следуют аналоги ГнРГ (гозерелин, лейпрорелин) и комбинированные андрогены. депривации, оба с частотой 13% каждый.
- ^ Перейти обратно: а б с Норман Г., Дин М.Э., Лэнгли Р.Э., Ходжес З.К., Ричи Г., Пармар М.К. и др. (февраль 2008 г.). «Парентеральный эстроген в лечении рака простаты: систематический обзор» . Британский журнал рака . 98 (4): 697–707. дои : 10.1038/sj.bjc.6604230 . ПМК 2259178 . ПМИД 18268497 .
- ^ Шлаттерер К., фон Вердер К., Сталла ГК (1996). «Концепция многоступенчатого лечения пациентов-транссексуалов». Экспериментальная и клиническая эндокринология и диабет . 104 (6): 413–419. дои : 10.1055/s-0029-1211479 . ПМИД 9021341 . S2CID 25099676 .
- ^ Перейти обратно: а б Мюллер Н.Ф., Дессинг Р.П. (19 июня 1998 г.). Европейский индекс лекарств: европейские регистрации лекарств (Четвертое изд.). ЦРК Пресс. стр. 455–. ISBN 978-3-7692-2114-5 .
- ^ Перейти обратно: а б «Эстрадурин» (PDF) . Паспорт безопасности материала . Пфайзер. 2 января 2007 г. Архивировано из оригинала (PDF) 20 августа 2013 г.
- ^ Перейти обратно: а б с Лауритцен С. (сентябрь 1990 г.). «Клиническое применение эстрогенов и прогестагенов». Зрелость . 12 (3): 199–214. дои : 10.1016/0378-5122(90)90004-П . ПМИД 2215269 .
- ^ Лауритцен С. (22 июня 2005 г.). «Практика заместительной гормональной терапии» . В Лауритцене С., Стадде Дж.В. (ред.). Текущее управление менопаузой . ЦРК Пресс. стр. 95–98, 488. ISBN. 978-0-203-48612-2 .
- ^ Лауртизен С. (2001). «Гормональная замена до, во время и после менопаузы» (PDF) . В Fisch FH (ред.). Менопауза – Андропауза: заместительная гормональная терапия на протяжении веков . Краузе и Пачернегг: Габлиц. стр. 67–88. ISBN 978-3-901299-34-6 .
- ^ Середина зимы А (1976). «Противопоказания к терапии эстрогенами и лечение климактерического синдрома в этих случаях». В Кэмпбелле С. (ред.). Управление менопаузой и постменопаузальными годами: материалы международного симпозиума, состоявшегося в Лондоне 24–26 ноября 1975 г. Организовано Институтом акушерства и гинекологии Лондонского университета . МТП Пресс Лимитед. стр. 377–382. дои : 10.1007/978-94-011-6165-7_33 . ISBN 978-94-011-6167-1 .
- ^ Альтвейн Дж. Э. (12 марта 2013 г.). «Терапия девственного метастатического рака простаты» . В Helpap B, Руббен Х (ред.). Рак предстательной железы – патология, практика и клиника: Патология, практика и клиника . Издательство Спрингер. стр. 126–. ISBN 978-3-642-72110-6 .
- ^ Перейти обратно: а б с д и ж г час я дж к Окрим Дж., Лалани Э.Н., Абель П. (октябрь 2006 г.). «Therapy Insight: парентеральное лечение эстрогенами при раке простаты - новый рассвет старой терапии». Природная клиническая практика. Онкология . 3 (10): 552–563. дои : 10.1038/ncponc0602 . ПМИД 17019433 . S2CID 6847203 .
- ^ Перейти обратно: а б с д и ж г час я дж к Lycette JL, Bland LB, Garzotto M, Beer TM (декабрь 2006 г.). «Парентеральные эстрогены при раке простаты: может ли новый способ введения преодолеть старые токсичности?». Клинический рак мочеполовой системы . 5 (3): 198–205. дои : 10.3816/CGC.2006.n.037 . ПМИД 17239273 .
- ^ Перейти обратно: а б с д и ж г час я дж к л м Стеге Р., Карлстрем К., Коллсте Л., Эрикссон А., Хенрикссон П., Пусетт А. (1988). «Терапия одним препаратом полиэстрадиолфосфата при раке предстательной железы». Американский журнал клинической онкологии . 11 (Приложение 2): S101–S103. дои : 10.1097/00000421-198801102-00024 . ПМИД 3242384 . S2CID 32650111 .
- ^ Перейти обратно: а б с д Денмид С.Р. (2010). «Стратегии андрогенной депривации в лечении распространенного рака простаты» . В Hong WK, Holland JF (ред.). Холланд-Фрай онкологическая медицина 8 . PMPH-США. стр. 753–. ISBN 978-1-60795-014-1 .
- ^ Рассел Н., Чунг А., Гроссманн М. (август 2017 г.). «Эстрадиол для смягчения побочных эффектов андрогендепривационной терапии» . Эндокринный рак . 24 (8): Р297–Р313. дои : 10.1530/ERC-17-0153 . ПМИД 28667081 .
- ^ Лэнгли Р.Э., Кафферти Ф.Х., Альхассо А.А., Розен С.Д., Сундарам С.К., Фриман С.К. и др. (апрель 2013 г.). «Сердечно-сосудистые исходы у пациентов с местно-распространенным и метастатическим раком предстательной железы, получавших агонисты рилизинг-гормона лютеинизирующего гормона или трансдермальный эстроген: рандомизированное исследование 2 фазы MRC PATCH (PR09)» . «Ланцет». Онкология . 14 (4): 306–316. дои : 10.1016/S1470-2045(13)70025-1 . ПМЦ 3620898 . ПМИД 23465742 .
- ^ Перейти обратно: а б с Дичфалуси Э., Вестман А (апрель 1956 г.). «Выведение природных эстрогенов с мочой у женщин с удаленными яичниками, получавших полиэстрадиолфосфат (ПЭП)». Акта Эндокринологика . 21 (4): 321–336. дои : 10.1530/acta.0.0210321 . ПМИД 13312990 .
- ^ Ченг З.Н., Шу Ю, Лю ZQ, Ван Л.С., Оу-Ян Д.С., Чжоу Х.Х. (февраль 2001 г.). «Роль цитохрома P450 в метаболизме эстрадиола in vitro». Акта Фармакологика Синика . 22 (2): 148–154. ПМИД 11741520 .
- ^ Мазер Н.А. (2004). «Взаимодействие эстрогеновой терапии и заместительной терапии гормонами щитовидной железы у женщин в постменопаузе». Щитовидная железа . 14 (Приложение 1): С27–С34. дои : 10.1089/105072504323024561 . ПМИД 15142374 .
- ^ Перейти обратно: а б с д и ж «Полиэстрадиола фосфат – Drugs.com International» . Архивировано из оригинала 29 июня 2018 года.
- ^ Линдстедт Э (1980). «Полиэстрадиолфосфат и этинилэстрадиол в лечении рака предстательной железы». Скандинавский журнал урологии и нефрологии. Дополнение . 55 : 95–97. ПМИД 6938044 .
Полиэстрадиолфосфат представляет собой полимерный эфир бета-эстрадиола-17 и фосфорной кислоты. Большая молекула обладает очень слабыми эстрогенными свойствами, но является сильным ингибитором нескольких ферментов, например, кислой и щелочной фосфатаз и гиалуронидазы.
- ^ Стивен Ф.С., Гриффин М.М. (1982). «Ингибирование тромбинового расщепления фибриногена полиэстрадиолфосфатом; взаимодействие с важнейшими остатками аргинина в фибриногене, необходимыми для ферментативного расщепления». Международный журнал биохимии . 14 (8): 699–700. дои : 10.1016/0020-711X(82)90004-0 . ПМИД 7117668 .
Было продемонстрировано, что полиэстрадиолфосфат (ПЭП) обладает ингибирующей активностью в отношении гиалуронидазы, кислой фосфатазы и щелочной фосфатазы (Fernö et al., 1958).
- ^ Фернё О, Фекс Х, Хёгберг Б, Линдерот Т, Вейге С (1958). «Высокомолекулярные ингибиторы ферментов. 3. Полиэстрадиолфосфат (ПЭП), эстроген длительного действия» . Acta Chemica Scandinavica . 12 (8): 1675–1689. doi : 10.3891/acta.chem.scand.12-1675 .
- ^ Перейти обратно: а б с д и ж г час я дж Гуннарссон П.О., Норлен Б.Дж. (1988). «Клиническая фармакология полиэстрадиолфосфата». Простата . 13 (4): 299–304. дои : 10.1002/pros.2990130405 . ПМИД 3217277 . S2CID 33063805 .
- ^ Перейти обратно: а б с д и ж г час я фон Шульц Б, Карлстрем К, Коллсте Л, Эрикссон А, Хенрикссон П, Пусетт А, Стеге Р (1989). «Эстрогенная терапия и функция печени - метаболические эффекты перорального и парентерального введения». Простата . 14 (4): 389–395. дои : 10.1002/pros.2990140410 . ПМИД 2664738 . S2CID 21510744 .
- ^ Хурмуз П., Акёл Ф., Гюльтекин М., Язычи Г., Сари С.Ю., Озийгит Г. (1 августа 2017 г.). «Роль гормонального лечения при раке простаты» . В Озийгит Г., Селек У (ред.). Принципы и практика уроонкологии: лучевая терапия, хирургия и системная терапия . Спрингер. стр. 334–. ISBN 978-3-319-56114-1 .
Уровень кастрации был определен как уровень тестостерона менее 50 нг/дл (1,7 нмоль/л) много лет назад. Однако современные методы лабораторного тестирования показали, что среднее значение после хирургической кастрации составляет 15 нг/дл [1]. Так, в последнее время уровень определяется как менее 20 нг/дл (1 нмоль/л).
- ^ Миккола А.К., Рууту М.Л., Аро Дж.Л., Ранникко С.А., Сало Д.О. (июль 1998 г.). «Парентеральный полиэстрадиолфосфат по сравнению с орхидэктомией в лечении распространенного рака простаты. Эффективность и сердечно-сосудистые осложнения: двухлетний отчет о наблюдении за национальным проспективным исследованием рака простаты. Finnprostate Group». Британский журнал урологии . 82 (1): 63–68. дои : 10.1046/j.1464-410x.1998.00688.x . ПМИД 9698663 .
- ^ Стеге Р., Карлстрем К., Коллсте Л., Эрикссон А., Хенрикссон П. (1987). «Терапия одним препаратом полиэстрадиолфосфата (ПЭП) при раке предстательной железы (ВП)». Европейский журнал рака и клинической онкологии . 23 (8): 1249. doi : 10.1016/0277-5379(87)90236-7 . ISSN 0277-5379 .
- ^ Перейти обратно: а б с д Диннендал В., Фрике У., ред. (2010). Профили лекарств (на немецком языке). Том 4 (23-е изд.). Эшборн, Германия: Govi Pharmazeutischer Verlag. ISBN 978-3-7741-98-46-3 .
- ^ Перейти обратно: а б Хенрикссон П., Карлстрем К., Пусетт А., Гуннарссон П.О., Йоханссон С.Дж., Эрикссон Б. и др. (июль 1999 г.). «Время возрождения эстрогенов в лечении распространенной карциномы предстательной железы? Фармакокинетика, эндокринные и клинические эффекты парентерального режима эстрогена». Простата . 40 (2): 76–82. doi : 10.1002/(sici)1097-0045(19990701)40:2<76::aid-pros2>3.0.co;2-q . ПМИД 10386467 . S2CID 12240276 .
- ^ Карлстрем К., Коллсте Л., Эрикссон А., Хенрикссон П., Пусетт А., Стеге Р., фон Шульц Б (1989). «Сравнение андрогенного статуса у пациентов с раком предстательной железы, получавших пероральные и/или парентеральные эстрогены или орхидэктомию». Простата . 14 (2): 177–182. дои : 10.1002/pros.2990140210 . ПМИД 2523531 . S2CID 25516937 .
- ^ Кокс Р.Л., Кроуфорд Э.Д. (декабрь 1995 г.). «Эстрогены в лечении рака простаты». Журнал урологии . 154 (6): 1991–1998. дои : 10.1016/S0022-5347(01)66670-9 . ПМИД 7500443 .
- ^ Вендерот Великобритания, Якоби Г.Х. (1983). «Аналоги гонадотропин-рилизинг гормона для паллиативного лечения рака предстательной железы». Всемирный журнал урологии . 1 (1): 40–48. дои : 10.1007/BF00326861 . ISSN 0724-4983 . S2CID 23447326 .
- ^ Oh WK (сентябрь 2002 г.). «Развивающаяся роль эстрогеновой терапии при раке простаты». Клинический рак простаты . 1 (2): 81–89. дои : 10.3816/CGC.2002.n.009 . ПМИД 15046698 .
- ^ Стеге Р., Фреландер Н., Карлстрем К., Пусетт А., фон Шульц Б. (1987). «Стероид-чувствительные белки, гормон роста и соматомедин С при раке предстательной железы: эффекты парентеральной и пероральной терапии эстрогенами». Простата . 10 (4): 333–338. дои : 10.1002/pros.2990100407 . ПМИД 2440014 . S2CID 36814574 .
- ^ фон Шульц Б., Карлстрем К. (февраль 1989 г.). «О регуляции глобулина, связывающего половые гормоны, - вызов старой догме и наброски альтернативного механизма». Журнал биохимии стероидов . 32 (2): 327–334. дои : 10.1016/0022-4731(89)90272-0 . ПМИД 2646476 .
- ^ Перейти обратно: а б Шрайнер В.Е. (6 декабря 2012 г.). «Яичник» . В Лабхарте А. (ред.). Клиническая эндокринология: теория и практика . Springer Science & Business Media. стр. 551–. ISBN 978-3-642-96158-8 .
Полимер эстрадиола или эстриола и фосфорной кислоты обладает превосходным депо-действием при внутримышечном введении (полиэстриолфосфат или полиэстрадиолфосфат) (таблица 16). Фосфорная кислота соединяется с молекулой эстрогена по позициям C3 и C17, образуя макромолекулу. Соединение хранится в печени и селезенке, где эстроген постепенно высвобождается путем отщепления фосфатной части под действием щелочной фосфатазы. [...] Конъюгированные эстрогены, полиэстриол и фосфат эстрадиола также можно вводить внутривенно в водном растворе. Однако внутривенное введение гормонов яичников не дает преимуществ и, следовательно, не имеет практического значения. [...] Следующие сроки действия были получены при однократном введении (WlED, 1954; LAURITZEN, 1968): [...] 50 мг полиэстрадиолфосфата ~ 1 месяц; 50 мг полиэстриолфосфата ~ 1 месяц; 80 мг полиэстриолфосфата ~ 2 месяца.
- ^ Кнёрр К., Кнёрр-Гертнер Х., Беллер Ф.К., Лауритцен К. (8 марта 2013 г.). «Принципы гормональной терапии» . Учебник акушерства и гинекологии: физиология и патология репродукции . Издательство Спрингер. стр. 508–. ISBN 978-3-662-00526-2 .
- ^ Кнёрр К., Беллер ФК, Лауритцен С (17 апреля 2013 г.). «Принципы гормональной терапии» . Учебник гинекологии . Издательство Спрингер. п. 213. ИСБН 978-3-662-00942-0 .
- ^ Брамбилла Ф., Берчеллер П.Х., Эпштейн Дж.А., Блатт М.Х., Купперман Х.С. (1961). «Опыт использования полиэстрадиолфосфата, эстрогена длительного действия» . Акушерство и гинекология . 17 (1): 115–118.
- ^ Перейти обратно: а б с д Дичфалуси Э (апрель 1954 г.). «Полиэстрадиолфосфат (ПЭП); водорастворимый эстроген длительного действия». Эндокринология . 54 (4): 471–477. дои : 10.1210/endo-54-4-471 . ПМИД 13151143 .
- ^ Якоби Г.Р. (1 декабря 1982 г.). «Экспериментальное обоснование исследования антипролактинов в качестве паллиативного лечения рака простаты». В Якоби Г., Хоэнфелльнер Р. (ред.). Рак простаты . Уильямс и Уилкинс. п. 426. ИСБН 978-0-683-04354-9 .
- ^ Вермюлен А (1975). «Стероидные препараты пролонгированного действия». Акта Клиника Бельгика . 30 (1): 48–55. дои : 10.1080/17843286.1975.11716973 . ПМИД 1231448 .
- ^ Якоби Г.Х., Альтвейн Дж.Е. (1979). «[Бромокриптин для паллиативной терапии распространенной карциномы предстательной железы. Экспериментальный и клинический профиль препарата (перевод автора)]» [Бромокриптин как паллиативная терапия при распространенном раке предстательной железы: экспериментальный и клинический профиль лекарственного журнала = Urologia Internationalis]. Международная урология . 34 (4): 266–290. дои : 10.1159/000280272 . ПМИД 89747 .
- ^ Якоби Г.Х., Альтвейн Дж.Е., Курт К.Х., Бастинг Р., Хоэнфеллнер Р. (июнь 1980 г.). «Лечение распространенного рака предстательной железы парентеральным ацетатом ципротерона: рандомизированное исследование III фазы». Британский журнал урологии . 52 (3): 208–215. дои : 10.1111/j.1464-410x.1980.tb02961.x . ПМИД 7000222 .
- ^ Альтвейн Дж. (29 июня 2013 г.). «Спорные аспекты гормональных манипуляций при раке предстательной железы» . В Смите П.Х. (ред.). Рак простаты и почек . Springer Science & Business Media. стр. 307–. ISBN 978-1-4684-4349-3 .
- ^ Перейти обратно: а б с Ганголли С (1999). Словарь веществ и их действия: ОС . Королевское химическое общество. стр. 425–. ISBN 978-0-85404-833-5 .
- ^ Перейти обратно: а б Йоханссон CJ, Гуннарссон П.О. (июнь 2000 г.). «Фармакодинамическая модель подавления тестостерона после внутримышечной депо-терапии эстрогенами при раке простаты». Простата . 44 (1): 26–30. doi : 10.1002/1097-0045(20000615)44:1<26::AID-PROS4>3.0.CO;2-P . ПМИД 10861754 . S2CID 30678644 .
- ^ Патент США 2928849 , Бертил Х.К., Биргер Ф.О., Енок Л.Т., Якоб Ф.Х., Рихардт Д.Е., «Высокомолекулярные производные стероидов, содержащие гидроксильные группы, и способ их получения», опубликован 15 марта 1960 г., передан Лео А.Б.
- ^ Дичфалуси Э, Фернё Х, Фекс Б, Хёгберг Б, Кнайп П (1959). «Высокомолекулярные ингибиторы ферментов. IV. Полимерные фосфаты синтетических эстрогенов» (PDF) . Акта Хим. Скан . 13 (5): 1011–1018. doi : 10.3891/acta.chem.scand.13-1011 .
- ^ Перейти обратно: а б Дичфалуси Э., Ферно О., Фекс Х., Хогберг Б., Линдерот Т., Розенберг Т. (1953). «Синтетические высокомолекулярные ингибиторы ферментов. I. Полимерные фосфаты флоретина и родственных соединений» (PDF) . Acta Chem Scand . 7 (6): 921–7. doi : 10.3891/acta.chem.scand.07-0913 .
- ^ Пичинелли А., Дапена Э., Мангас Дж.Дж. (1995). «Полифенольная структура листьев яблони в зависимости от устойчивости к парше. Предварительное исследование» (PDF) . Журнал сельскохозяйственной и пищевой химии . 43 (8): 2273–78. дои : 10.1021/jf00056a057 . Проверено 23 апреля 2012 г.
- ^ Шведский фармацевтический журнал . Шведская ассоциация фармацевтов. 1973. стр. 728.
- ^ Перейти обратно: а б с «Продукты для здоровья IBM Watson» .
- ^ Перейти обратно: а б с Свитман С.С., изд. (2009). «Половые гормоны и их модуляторы» . Мартиндейл: Полный справочник лекарств (36-е изд.). Лондон: Фармацевтическая пресса. п. 2082. ИСБН 978-0-85369-840-1 .
- ^ Хартманн Б.В., Ламл Т., Кирхенгаст С., Альбрехт А.Е., Хубер Дж.К. (апрель 1998 г.). «Гормональное увеличение груди: прогностическая значимость инсулиноподобного фактора роста-I». Гинекологическая эндокринология . 12 (2): 123–127. дои : 10.3109/09513599809024960 . ПМИД 9610425 .
- ^ Гольдцихер Дж.В., Фотерби К. (1994). Фармакология противозачаточных стероидов . Рэйвен Пресс. п. 154. ИСБН 978-0-7817-0097-9 .
- ^ Заньярту Дж., Райс-Рэй Э., Гольдцихер Дж.В. (октябрь 1966 г.). «Контроль рождаемости с помощью инъекционных стероидов длительного действия. Предварительный отчет» . Акушерство и гинекология . 28 (4): 513–515. ПМИД 5925038 .
- ^ Бекман Х (1967). Ежегодник лекарственной терапии . Год книжного издательства.
Дальнейшее чтение
[ редактировать ]- Хенрикссон П. (1991). «Эстроген у больных раком предстательной железы. Оценка рисков и преимуществ». Безопасность лекарств . 6 (1): 47–53. дои : 10.2165/00002018-199106010-00005 . ПМИД 2029353 . S2CID 39861824 .
- Стеге Р., Сандер С. (март 1993 г.). «[Эндокринное лечение рака простаты. Возрождение парентерального эстрогена]» [Эндокринное лечение рака простаты. Возрождение парентерального эстрогена]. Tidsskrift для den Norske Laegeforening (на норвежском языке). 113 (7): 833–835. ПМИД 8480286 .
- Стеге Р., Карлстрем К., Хедлунд П.О., Пусетт А., фон Шульц Б., Хенрикссон П. (сентябрь 1995 г.). «[Внутримышечные депо-эстрогены (Эстрадурин) в лечении больных раком предстательной железы. Исторические аспекты, механизм действия, результаты и современное клиническое состояние]» [Внутримышечные депо-эстрогены (Эстрадурин) в лечении больных раком предстательной железы. Исторические аспекты, механизм действия, результаты и современное клиническое состояние. Дер Уролог. Аусг. А (на немецком языке). 34 (5): 398–403. ПМИД 7483157 .
- Смит П.Х., Робинсон М.Р. (сентябрь 1995 г.). «[Ренессанс эстрогеновой терапии при распространенной карциноме простаты?]» [Ренессанс эстрогеновой терапии при распространенной карциноме простаты?]. Дер Уролог. Аусг. А (на немецком языке). 34 (5): 393–397. ПМИД 7483156 .
- Окрим Дж., Абель П.Д. (2009). «Андрогендепривационная терапия рака простаты – потенциал парентерального эстрогена». Центральноевропейский журнал урологии . 62 (3): 132–140. doi : 10.5173/ceju.2009.03.art1 .
- Вибово Э., Шеллхаммер П., Вассерсуг Р.Дж. (январь 2011 г.). «Роль эстрогена в нормальной мужской функции: клинические последствия для пациентов с раком простаты, находящихся на андрогенной депривационной терапии». Журнал урологии . 185 (1): 17–23. дои : 10.1016/j.juro.2010.08.094 . ПМИД 21074215 .
- Вибово Э., Вассерсуг Р.Дж. (сентябрь 2013 г.). «Влияние эстрогена на сексуальный интерес кастрированных мужчин: последствия для больных раком простаты андроген-депривационной терапии». Критические обзоры по онкологии/гематологии . 87 (3): 224–238. дои : 10.1016/j.critrevonc.2013.01.006 . ПМИД 23484454 .
- Филлипс I, Шах С.И., Дуонг Т., Абель П., Лэнгли Р.Э. (2014). «Андрогендепривационная терапия и повторное появление парентерального эстрогена при раке простаты» . Обзор онкологии и гематологии . 10 (1): 42–47. дои : 10.17925/OHR.2014.10.1.42 . ПМК 4052190 . ПМИД 24932461 .
- Али Шах С.И. (2015). «Новый потенциал парентерального эстрогена в качестве андрогенной депривационной терапии рака простаты» . Южноазиатский журнал рака . 4 (2): 95–97. дои : 10.4103/2278-330X.155699 . ПМК 4418092 . ПМИД 25992351 .
![Уровни эстрадиола и тестостерона при однократной внутримышечной инъекции 320 мг полиэстрадиолфосфата у мужчин с раком простаты.[7]](http://upload.wikimedia.org/wikipedia/commons/thumb/7/7d/Estradiol_and_testosterone_levels_with_a_single_intramuscular_injection_of_320_mg_polyestradiol_phosphate_in_men.png/450px-Estradiol_and_testosterone_levels_with_a_single_intramuscular_injection_of_320_mg_polyestradiol_phosphate_in_men.png)
![Уровни эстрадиола и тестостерона при приеме полиэстрадиолфосфата в дозе 160, 240 или 320 мг один раз каждые 4 недели внутримышечными инъекциями у мужчин с раком простаты.[35]](http://upload.wikimedia.org/wikipedia/commons/thumb/4/41/Estradiol_and_testosterone_levels_with_polyestradiol_phosphate_in_men_with_prostate_cancer.png/216px-Estradiol_and_testosterone_levels_with_polyestradiol_phosphate_in_men_with_prostate_cancer.png)