Фибриноген
| Семейство альфа/бета-цепей фибриногена | |||
|---|---|---|---|
 кристаллическая структура нативного куриного фибриногена с двумя разными связанными лигандами | |||
| Идентификаторы | |||
| Символ | Фиб_альфа | ||
| Пфам | PF08702 | ||
| ИнтерПро | ИПР012290 | ||
| СКОП2 | 1м1дж / СКОПе / СУПФАМ | ||
| |||
| Домен фибриногена альфа C | |||
|---|---|---|---|
| Идентификаторы | |||
| Символ | Фибриноген_aC | ||
| Пфам | ПФ12160 | ||
| ИнтерПро | ИПР021996 | ||
| |||
| Идентификаторы | |||
|---|---|---|---|
| Символ | Фибриноген_С | ||
| Пфам | PF00147 | ||
| Пфам Клан | CL0422 | ||
| ИнтерПро | ИПР002181 | ||
| PROSITE | PDOC00445 | ||
| СКОП2 | 1фза / СКОПе / СУПФАМ | ||
| |||
Фибриноген ( фактор свертывания крови I ) представляет собой гликопротеиновый комплекс , вырабатываемый в печени. [1] циркулирует в крови всех позвоночных . [2] преобразуется При повреждении тканей и сосудов он ферментативно тромбином , а затем в в фибрин на основе фибрина сгусток крови . Сгустки фибрина в первую очередь выполняют функцию закупорки кровеносных сосудов и остановки кровотечения . Фибрин также связывает и снижает активность тромбина. Эта активность, иногда называемая антитромбином I , ограничивает свертывание крови. [1] Фибрин также опосредует распространение тромбоцитов и эндотелиальных клеток , тканевых фибробластов пролиферацию , образование капиллярных трубок и ангиогенез и тем самым способствует реваскуляризации и заживлению ран . [3]
Пониженный и/или дисфункциональный уровень фибриногена встречается при различных врожденных и приобретенных заболеваниях человека, связанных с фибриногеном . Эти расстройства представляют собой группу редких состояний, при которых у людей могут наблюдаться тяжелые эпизоды патологического кровотечения и тромбоза ; эти состояния лечатся путем повышения уровня фибриногена в крови и ингибирования свертывания крови соответственно. [4] [5] Эти расстройства также могут быть причиной некоторых заболеваний печени и почек. [1]
Фибриноген является «положительным» белком острой фазы , то есть его уровень в крови повышается в ответ на системное воспаление , повреждение тканей и некоторые другие события. Его уровень также повышается при различных видах рака . Было высказано предположение, что повышенные уровни фибриногена при воспалении , а также раке и других состояниях являются причиной тромбоза и повреждения сосудов, которые сопровождают эти состояния. [6] [7]
Гены
[ редактировать ]Фибриноген вырабатывается и секретируется в кровь преимущественно клетками гепатоцитов печени . Сообщается также, что клетки эндотелия производят небольшое количество фибриногена, но этот фибриноген полностью не охарактеризован; Тромбоциты , хотя когда-то считалось, что они производят фибриноген, теперь известно, что они поглощают и хранят костного мозга и их предшественники, мегакариоциты , но не производят гликопротеин. [4] [7] Последний секретируемый гликопротеин, полученный из гепатоцитов, состоит из двух тримеров , каждый из которых состоит из трех различных полипептидных цепей : альфа-цепи фибриногена (также называемой Aα или α-цепью), кодируемой геном FGA , бета-цепи фибриногена (также называемой цепь Bβ или β), кодируемая геном FGB , и гамма-цепь фибриногена (также называемая γ-цепью), кодируемая геном FGG . Все три гена расположены на длинном или «q» плече 4-й хромосомы человека (в позициях 4q31.3, 4q31.3 и 4q32.1 соответственно). [1]
|
|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Альтернативный сплайсинг гена FGA дает минорную расширенную изоформу Aα, называемую AαE, которая заменяет Aα в 1–3% циркулирующего фибриногена; альтернативный сплайсинг FGG дает минорную изоформу γ, называемую γ', которая заменяет γ в 8–10% циркулирующего фибриногена; FGB альтернативно не сращивается. Следовательно, конечный продукт фибриногена состоит в основном из цепей Aα, Bβ и γ, при этом небольшой процент его содержит цепи AαE и/или γ' вместо цепей Aα и/или γ соответственно. Три гена транскрибируются и транслируются с помощью механизма(ов), который остается не до конца понятным. координировано [8] [9] [10] [11] [12] Скоординированная транскрипция этих трех генов фибриногена быстро и значительно увеличивается при системных состояниях, таких как воспаление и повреждение тканей. Цитокины, вырабатываемые при этих системных состояниях, такие как интерлейкин 6 и интерлейкин 1β , по-видимому, ответственны за активацию этой транскрипции. [11]
Структура
[ редактировать ]
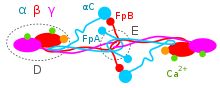

Цепи Aα, Bβ и γ координировано транскрибируются и транслируются в эндоплазматическом ретикулуме (ЭР), при этом их пептидные цепи передаются в ЭР, а их сигнальные пептидные части удаляются. Внутри ЭР три цепи сначала собираются в димеры Aαγ и Bβγ, затем в тримеры AαBβγ и, наконец, в гексимеры (AαBβγ) 2 , т.е. в два тримера AαBβγ, соединенные многочисленными дисульфидными связями . Гексимер переносится в аппарат Гольджи , где он гликозилируется , гидроксилируется , сульфатируется и фосфорилируется с образованием зрелого гликопротеина фибриногена, который секретируется в кровь. [10] [12] Зрелый фибриноген представляет собой длинный гибкий белковый массив из трех узелков, скрепленных вместе очень тонкой нитью, диаметр которой, по оценкам, составляет от 8 до 15 ангстрем (Å). Два концевых узелка (называемые D-областями или доменами) одинаково состоят из цепей Bβ и γ, тогда как центральный узелок немного меньшего размера (называемый областью или доменом E) состоит из двух переплетенных альфа-цепей Aα. Измерения длин теней показывают, что диаметр узелков находится в диапазоне от 50 до 70 Å. Длина высушенной молекулы составляет 475 ± 25 Å. [14]
Молекула фибриногена циркулирует как растворимый плазмы гликопротеин с типичной молекулярной массой ~340 – ~420 кДа (килодальтоны). [15] (в зависимости от содержания цепей Aα и AαE, γ и γ' и углеводов [~4 – ~10% масс.]). Он имеет стержнеобразную форму с размерами 9 × 47,5 × 6 нм и имеет отрицательный суммарный заряд при физиологическом pH (его изоэлектрическая точка ~5,5 – ~6,5, например pH 5,8). [16] [17] ). Нормальная концентрация фибриногена в плазме крови составляет 150–400 мг/дл, при этом уровни значительно ниже или выше этого диапазона связаны с патологическим кровотечением и/или тромбозом. Фибриноген имеет период полураспада из циркуляции ~4 дня. [12]
Образование тромбов
[ редактировать ]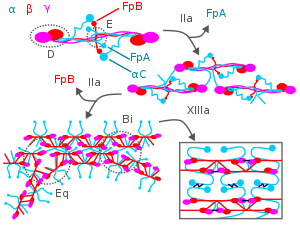
Во время свертывания крови тромбин атакует N-конец цепей Aα и Bβ фибриногена, образуя отдельные нити фибрина плюс два небольших полипептида , фибринопептиды A и B, полученные из этих соответствующих цепей. Отдельные нити фибрина затем полимеризуются и сшиваются с другими нитями фибрина под действием фактора XIIIa крови , образуя обширную взаимосвязанную сеть фибрина, которая является основой для формирования зрелого фибринового сгустка. [3] [7] [18] Помимо образования фибрина, фибриноген также способствует свертыванию крови, образуя мостики между тромбоцитами и активируя их посредством связывания с фибриногеновым рецептором их поверхностной мембраны GpIIb/IIIa . [18]
Фибрин участвует в ограничении образования тромбов и разрушении образовавшихся тромбов по крайней мере двумя важными механизмами. Во-первых, он обладает тремя сайтами связывания с низким сродством (два в E-домене фибрина и один в его D-домене) для тромбина; это связывание изолирует тромбин от воздействия на фибриноген. [18] Во-вторых, Аα-цепь фибрина ускоряет по меньшей мере в 100 раз количество плазмина, активированного тканевым активатором плазминогена ; плазмин разрушает тромбы. [5] [18] [3] [7] Атака плазмина на фибрин приводит к высвобождению D-димеров (также называемых DD-димерами). Обнаружение этих димеров в крови используется в качестве клинического теста на фибринолиз. [5]
Фибриногенные нарушения
[ редактировать ]Некоторые нарушения количества и/или качества фибриногена вызывают патологическое кровотечение, патологическое свертывание крови и/или отложение фибриногена в печени, почках и других тканях.
Врожденная афибриногенемия
[ редактировать ]Врожденная афибриногенемия — редкое и, как правило, аутосомно-рецессивное наследственное заболевание, при котором кровь не свертывается из-за недостатка фибриногена (обычно уровень фибриногена в плазме), но иногда обнаруживается на чрезвычайно низких уровнях, например <10 мг/дл. Это тяжелое заболевание обычно вызвано мутациями как в материнской, так и в отцовской копиях гена FGA, FGB или FBG . Мутации обладают практически полной генетической пенетрантностью , при этом практически у всех гомозиготных носителей наблюдаются частые, а иногда и опасные для жизни эпизоды кровотечений и/или тромбозов. Патологическое кровотечение возникает в раннем возрасте, например, часто наблюдается при рождении с чрезмерным кровотечением из пупка . [4]
Врожденная гипофибриногенемия
[ редактировать ]Врожденная гипофибриногенемия — редкое наследственное заболевание, при котором кровь не может нормально свертываться из-за снижения уровня фибриногена (фибриноген в плазме обычно <150, но >50 мг/дл). Заболевание отражает деструктивную мутацию только в одном из двух родительских генов FGA, FGB или FBG и имеет низкую степень генетической пенетрантности, т.е. только у некоторых членов семьи с дефектным геном когда-либо проявляются симптомы. Симптомы заболевания, которое чаще возникает у лиц с более низким уровнем фибриногена в плазме, включают эпизодические кровотечения и тромбозы, которые обычно начинаются в позднем детстве или в зрелом возрасте. [4]
Болезнь накопления фибриногена
[ редактировать ]Болезнь накопления фибрингогена – чрезвычайно редкое заболевание. Это форма врожденной гипофибриногенемии, при которой определенные наследственные мутации в одной копии гена FGG вызывают накопление продукта фибриногена в клетках печени и их повреждение. Заболевание не сопровождалось мутациями FGA или FGB . Симптомы этих мутаций FGG имеют низкий уровень пенетрантности. Уровни фибриногена в плазме (обычно <150, но >50 мг/дл), обнаруженные при этом заболевании, отражают фибриноген, вырабатываемый нормальным геном. Болезнь накопления фибриногена может привести к аномальному кровотечению и тромбозу, но иногда приводит к циррозу печени . [19]
Врожденная дисфибриногенемия
[ редактировать ]Врожденная дисфибриногенемия — редкое аутосомно-доминантное наследственное заболевание, при котором фибриноген плазмы состоит из дисфункционального фибриногена, образованного мутантным геном FGA, FGB или FBG, унаследованного от одного родителя, плюс нормальный фибриноген, образованный нормальным геном, унаследованным от другого родителя. Как отражение этой двойственности, уровни фибриногена в плазме, измеренные иммунологическими методами, являются нормальными (>150 мг/дл), но составляют c. На 50% ниже при измерении методами образования тромбов. Заболевание имеет пониженную пенетрантность , и только у некоторых людей с аномальным геном проявляются симптомы аномального кровотечения и тромбоза. [20]
Наследственный фибриногенный Аα-цепной амилоидоз
[ редактировать ]Наследственный фибриногенный Аα-цепочечный амилоидоз — крайне редкое наследственное заболевание, передающееся по аутосомно-доминантному типу и обусловленное мутацией в одной из двух копий гена FGA . Это форма врожденной дисфибриногенемии, при которой определенные мутации приводят к выработке аномального фибриногена, который циркулирует в крови и постепенно накапливается в почках. Такое накопление со временем приводит к одной из форм семейного амилоидоза почек . Уровни фибриногена в плазме аналогичны тем, которые наблюдаются при других формах врожденной дисфибриногенемии. Фибриногеновый амилоидоз Аα-цепи не связан с аномальным кровотечением или тромбозом. [21]
Приобретенная дисфибриногенемия
[ редактировать ]Приобретенная дисфибриногенемия — редкое заболевание, при котором циркулирующий фибриноген состоит, по крайней мере, частично, из дисфункционального фибриногена, обусловленного различными приобретенными заболеваниями. Одной из хорошо изученных причин этого расстройства является тяжелое заболевание печени , включая гепатому , хронический активный гепатит , цирроз печени и желтуху вследствие обструкции желчевыводящих путей . Больная печень синтезирует фибриноген, который имеет нормально функциональную аминокислотную последовательность, но неправильно гликозилирован (т.е. имеет неправильное количество остатков сахара), добавляемый к нему во время его прохождения через Гольджи. Неправильно гликозированный фибриноген является дисфункциональным и может вызывать патологические эпизоды кровотечения и/или свертывания крови. Другими, менее изученными причинами являются дискразии плазматических клеток и аутоиммунные заболевания , при которых циркулирующий аномальный иммуноглобулин или другой белок нарушает функцию фибриногена, а также редкие случаи рака и лекарств ( изотретиноин , глюкокортикоиды и противолейкемические препараты ). токсичности [18]
Врожденная гиподисфибриногенемия
[ редактировать ]Врожденная гиподисфибриногенемия — редкое наследственное заболевание, при котором низкие уровни (т.е. <150 мг/дл) иммунологически определяемого фибриногена плазмы состоят, по крайней мере, частично из дисфункционального фибриногена. Заболевание обычно отражает мутации в обоих наследственных генах фибриногена, один из которых продуцирует дисфункциональный фибриноген, а другой производит небольшое количество фибриногена. Заболевание, хотя и имеет пониженную пенетрантность , обычно протекает более тяжело, чем врожденная дисфибриногенемия, но, как и последнее заболевание, вызывает патологические эпизоды кровотечения и/или свертывания крови. [22]
Криофибриногенемия
[ редактировать ]Криофибриногенемия — приобретенное заболевание, при котором фибриноген осаждается при низких температурах и может привести к внутрисосудистому осаждению фибриногена, фибрина и других циркулирующих белков, тем самым вызывая инфаркт различных тканей и конечностей. Криоглобулонемия может возникать без признаков сопутствующего заболевания, т. е. первичной криоглобулинемии (также называемой эссенциальной криоглобулинемией), или, что гораздо чаще, при наличии признаков основного заболевания, т. е. вторичной криоглобулинемии. Вторичная криофибриноемия может развиваться у лиц с инфекцией ( около 12 % случаев), злокачественными или предраковыми заболеваниями (21 %), васкулитами (25 %) и аутоиммунными заболеваниями (42 %). В этих случаях криофибиногенема может вызывать или не вызывать повреждение тканей и/или другие симптомы, а фактическая причинно-следственная связь между этими заболеваниями и развитием криофибриногенемии неясна. Криофибриногенемия также может возникать в связи с приемом некоторых лекарств. [23] [24] [25] [26]
Приобретенная гипофибриногенемия
[ редактировать ]Приобретенная гипофибриногенемия — дефицит циркулирующего фибриногена вследствие его чрезмерного потребления, который может возникнуть в результате травмы , определенных фаз диссеминированного внутрисосудистого свертывания крови и сепсиса . Это также может произойти в результате гемодилюции в результате кровопотери и/или переливания эритроцитов или других заменителей цельной крови с низким содержанием фибриногена. [27]
Лабораторные испытания
[ редактировать ]Клинический анализ нарушений фибриногена обычно измеряет свертываемость крови, используя следующие последовательные этапы: [28] Более высокие уровни, среди прочего, связаны с сердечно-сосудистыми заболеваниями (>3,43 г/л). [ нужны разъяснения ] Его уровень может повышаться при любой форме воспаления , так как это белок острой фазы ; например, это особенно заметно в тканях десен человека на начальной стадии заболеваний пародонта . [29] [30]
- Свертываемость крови измеряется с использованием стандартных тестов, например, протромбинового времени , частичного тромбопластинового времени , тромбинового времени и/или рептилазного времени . Низкие уровни фибриногена и дисфункциональные фибриногены обычно продлевают это время, тогда как недостаток фибриногена (т.е. афибриногенемия) делает это время бесконечно продолжительным.
- Уровни фибриногена измеряют в плазме , выделенной из венозной крови с помощью иммуноанализа. [ нужна ссылка ] или с помощью анализов свертывания крови, таких как анализ фибриногена Клауса или методы, основанные на протромбине . [31] Нормальный уровень составляет около 1,5-3 г/л, в зависимости от используемого метода. Эти уровни нормальны при дисфибриногенемии (т.е. 1,5-3 г/л), снижены при гипофибриногенемии и гиподисфибриногенемии (т.е. <1,5 г/л) и отсутствуют (т.е. <0,02 г/л) при афибриногенемии.
- Функциональные уровни фибриногена измеряют в плазме, индуцированной свертыванием. Уровни свернувшегося фибриногена в этом тесте должны быть снижены при гипофибриногенемии, гиподисфибриногенемии и дисфибриногенемии и не обнаруживаться при афибриногенемии.
- Функциональные уровни фибриногена/антигенного фибриногена составляют <0,7 г/л при гипофибриногенемии, гиподисфибриногенемии и дисфиброгенемии и не применимы при афибриногенемии.
- Анализ фибриногена также можно проверить на образцах цельной крови с помощью тромбоэластометрии. Этот анализ исследует взаимодействие факторов свертывания крови, их ингибиторов, антикоагулянтов и клеток крови (в частности, тромбоцитов) во время свертывания и последующего фибринолиза, происходящего в цельной крови. Тест предоставляет информацию о гемостатической эффективности и максимальной прочности сгустка, а также дополнительную информацию о взаимодействии фибрина с тромбоцитами и скорости фибринолиза (см. Тромбоэластометрия ).
- Сканирующая электронная микроскопия и конфокальная лазерная сканирующая микроскопия сгустков, сформированных in vitro, могут дать информацию о плотности и архитектуре сгустков фибрина.
- Тест на поглощение фибриногена или сканирование фибриногена раньше использовались для выявления тромбоза глубоких вен . В этом методе радиоактивно меченный фибриноген, обычно радиоактивный йод людям вводится , который включается в тромб и обнаруживается с помощью сцинтиграфии .
Гиперфибриногенемия
[ редактировать ]Уровни функционально нормального фибриногена увеличиваются во время беременности в среднем до 4,5 грамм/литр (г/л) по сравнению со средним показателем 3 г/л у небеременных людей. Они также могут увеличиваться при различных формах рака, особенно при раке желудка , легких , простаты и яичников . В этих случаях гиперфибриногенемия может способствовать развитию патологического тромбоза. Особая картина мигрирующего тромбоза поверхностных вен , называемая синдромом Труссо , возникает при всех других признаках и симптомах этих видов рака и может предшествовать им. [7] [32] Гиперфибриногенемия также считается причиной стойкой легочной гипертензии у новорожденных. [33] и послеоперационный тромбоз. [34] Высокие уровни фибриногена были предложены в качестве предиктора геморрагических осложнений во время катетер-направленного тромболизиса при острой или подострой окклюзии периферической нативной артерии и артериального шунтирования. [35] Однако систематический обзор доступной литературы до января 2016 г. показал, что прогностическая ценность уровня фибриногена в плазме для прогнозирования геморрагических осложнений после катетер-направленного тромболизиса не доказана. [36]
История
[ редактировать ]Пол Моравиц в 1905 году описал фибриноген. [37]
Ссылки
[ редактировать ]- ^ Jump up to: а б с д де Мурлуз П., Казини А., Неерман-Арбез М. (сентябрь 2013 г.). «Врожденные нарушения фибриногена: обновленная информация» . Семинары по тромбозам и гемостазу . 39 (6): 585–595. дои : 10.1055/s-0033-1349222 . ПМИД 23852822 .
- ^ Цзян И, Дулитл РФ (июнь 2003 г.). «Эволюция свертывания крови позвоночных на основе сравнения геномов рыбы фугу и асцидии» . Труды Национальной академии наук Соединенных Штатов Америки . 100 (13): 7527–7532. Бибкод : 2003PNAS..100.7527J . дои : 10.1073/pnas.0932632100 . ПМК 164620 . ПМИД 12808152 .
- ^ Jump up to: а б с Мозессон М.В. (август 2005 г.). «Фибриноген и структура и функции фибрина» . Журнал тромбозов и гемостаза . 3 (8): 1894–1904. дои : 10.1111/j.1538-7836.2005.01365.x . ПМИД 16102057 . S2CID 22077267 .
- ^ Jump up to: а б с д Казини А., де Мурлуз П., Неерман-Арбез М. (июнь 2016 г.). «Клинические особенности и лечение врожденного дефицита фибриногена». Семинары по тромбозам и гемостазу . 42 (4): 366–374. дои : 10.1055/s-0036-1571339 . ПМИД 27019462 . S2CID 12038872 .
- ^ Jump up to: а б с Ундас А (сентябрь 2011 г.). «Приобретенная дисфибриногенемия при атеросклеротических заболеваниях сосудов». Польский архив внутренней медицины . 121 (9): 310–319. ПМИД 21952526 .
- ^ Давалос Д., Акассоглу К. (январь 2012 г.). «Фибриноген как ключевой регулятор воспаления при заболевании». Семинары по иммунопатологии . 34 (1): 43–62. дои : 10.1007/s00281-011-0290-8 . ПМИД 22037947 . S2CID 14997530 .
- ^ Jump up to: а б с д и Репетто О, Де Ре В (сентябрь 2017 г.). «Коагуляция и фибринолиз при раке желудка». Анналы Нью-Йоркской академии наук . 1404 (1): 27–48. Бибкод : 2017NYASA1404...27R . дои : 10.1111/nyas.13454 . ПМИД 28833193 . S2CID 10878584 .
- ^ Неерман-Арбез М., де Мурлуз П., Казини А. (июнь 2016 г.). «Лабораторно-генетическое исследование мутаций, объясняющих врожденные нарушения фибриногена». Семинары по тромбозам и гемостазу . 42 (4): 356–365. дои : 10.1055/s-0036-1571340 . ПМИД 27019463 . S2CID 12693693 .
- ^ Дюваль С., Ариенс РА (июль 2017 г.). «Вариации сращивания фибриногена и перекрестные сшивки: влияние на структуру/функцию фибрина и роль фибриногена γ' как тромбомбулина II» (PDF) . Матричная биология . 60–61: 8–15. дои : 10.1016/j.matbio.2016.09.010 . ПМИД 27784620 .
- ^ Jump up to: а б Ву Д, Неерман-Арбез М (июль 2007 г.). «Молекулярные механизмы, объясняющие дефицит фибриногена: от крупных делеций до внутриклеточной задержки неправильно свернутых белков» . Журнал тромбозов и гемостаза . 5 (Приложение 1): 125–131. дои : 10.1111/j.1538-7836.2007.02465.x . ПМИД 17635718 . S2CID 27354717 .
- ^ Jump up to: а б Фиш Р.Дж., Неерман-Арбез М. (сентябрь 2012 г.). «Регуляция гена фибриногена». Тромбоз и гемостаз . 108 (3): 419–426. дои : 10.1160/TH12-04-0273 . ПМИД 22836683 . S2CID 9763486 .
- ^ Jump up to: а б с Ассельта Р., Дуга С., Тенчини М.Л. (октябрь 2006 г.). «Молекулярная основа количественных нарушений фибриногена» . Журнал тромбозов и гемостаза . 4 (10): 2115–2129. дои : 10.1111/j.1538-7836.2006.02094.x . ПМИД 16999847 . S2CID 24223328 .
- ^ Jump up to: а б с д Топаз О и др. (2018). Сердечно-сосудистый тромб . Академическая пресса. стр. 31–43. ISBN 9780128126165 .
- ^ Холл CE, Slayter HS (январь 1959 г.). «Молекула фибриногена: ее размер, форма и способ полимеризации» . Журнал биофизической и биохимической цитологии . 5 (1): 11–16. дои : 10.1083/jcb.5.1.11 . ПМК 2224630 . ПМИД 13630928 .
- ^ Фантл П., Уорд Х.А. (сентябрь 1965 г.). «Молекулярная масса фибриногена человека, полученная на основе определения фосфора» . Биохимический журнал . 96 (3): 886–889. дои : 10.1042/bj0960886 . ПМЦ 1207232 . ПМИД 5862426 .
- ^ Марукко А., Фенолио И., Турчи Ф., Фубини Б. (2013). «Взаимодействие фибриногена и альбумина с наночастицами диоксида титана разных кристаллических фаз». Журнал физики . Серия конференций. 429 (1): 012014. Бибкод : 2013JPhCS.429a2014M . дои : 10.1088/1742-6596/429/1/012014 . hdl : 2318/130247 . S2CID 1575697 .
- ^ Чесла М., Адамчик З., Барбаш Ю., Василевска М. (июнь 2013 г.). «Механизмы адсорбции фибриногена на твердых субстратах при более низком pH». Ленгмюр . 29 (23): 7005–7016. дои : 10.1021/la4012789 . ПМИД 23621148 .
- ^ Jump up to: а б с д и Бессер М.В., Макдональд С.Г. (2016). «Приобретенная гипофибриногенемия: современные перспективы» . Журнал медицины крови . 7 : 217–225. дои : 10.2147/JBM.S90693 . ПМК 5045218 . ПМИД 27713652 .
- ^ Казини А., Соколлик С., Луковски С.В., Лурц Э., Рибланд С., де Мурлуз П., Неерман-Арбез М. (ноябрь 2015 г.). «Гипофибриногенемия и заболевания печени: новый случай фибриногена Aguadilla и обзор литературы». Гемофилия . 21 (6): 820–827. дои : 10.1111/хе.12719 . ПМИД 25990487 . S2CID 44911581 .
- ^ Казини А., Неерман-Арбез М., Ариенс Р.А., де Мурлуз П. (июнь 2015 г.). «Дисфибриногенемия: от молекулярных аномалий к клиническим проявлениям и лечению». Журнал тромбозов и гемостаза . 13 (6): 909–919. дои : 10.1111/jth.12916 . ПМИД 25816717 . S2CID 10955092 .
- ^ Гиллмор Дж.Д., Лахманн Х.Дж., Роучценио Д., Гилбертсон Дж.А., Цзэн Ч.Х., Лю Ж.Х. и др. (февраль 2009 г.). «Диагностика, патогенез, лечение и прогноз наследственного альфа-цепочечного амилоидоза фибриногена А» . Журнал Американского общества нефрологов . 20 (2): 444–451. дои : 10.1681/ASN.2008060614 . ПМК 2637055 . ПМИД 19073821 .
- ^ Казини А., Брюнгс Т., Лавеню-Бомблед С., Вилар Р., Неерман-Арбез М., де Мурлуз П. (май 2017 г.). «Генетика, диагностика и клинические особенности врожденной гиподисфибриногенемии: систематический обзор литературы и сообщение о новой мутации» . Журнал тромбозов и гемостаза . 15 (5): 876–888. дои : 10.1111/jth.13655 . ПМИД 28211264 .
- ^ Града А, Фаланга V (февраль 2017 г.). «Кожные язвы, индуцированные криофибриногенемией: обзор и критерии диагностики». Американский журнал клинической дерматологии . 18 (1): 97–104. дои : 10.1007/s40257-016-0228-y . ПМИД 27734332 . S2CID 39645385 .
- ^ Чен Ю, Сринивасан ГМ, Шоджания К, Ёсида ЭМ (июнь 2015 г.). «Криофибриногенемия после трансплантации печени: первый зарегистрированный случай после трансплантации и обзор литературы по нетрансплантационным заболеваниям на основе конкретных случаев». Экспериментальная и клиническая трансплантация . 13 (3): 290–294. дои : 10.6002/ect.2014.0013 . ПМИД 24679054 .
- ^ Кайми Дж., Канино Б., Ло Прести Р., Урсо С., Хоппс Е. (2017). «Клинические состояния, ответственные за осложнения гипервязкости и язв кожи». Клиническая гемореология и микроциркуляция . 67 (1): 25–34. дои : 10.3233/CH-160218 . hdl : 10447/238851 . ПМИД 28550239 .
- ^ Мишо М., Пурра Дж. (апрель 2013 г.). «Криофибриногенемия». Журнал клинической ревматологии . 19 (3): 142–148. дои : 10.1097/RHU.0b013e318289e06e . ПМИД 23519183 .
- ^ Фрис Д., Иннерхофер П., Шоберсбергер В. (апрель 2009 г.). «Время изменить методы коагуляции при массивных кровотечениях, связанных с травмой». Современное мнение в анестезиологии . 22 (2): 267–274. дои : 10.1097/ACO.0b013e32832678d9 . ПМИД 19390253 . S2CID 10615690 .
- ^ Ланг Т., Йоханнинг К., Мецлер Х., Пипенброк С., Соломон С., Рахе-Мейер Н., Танака К.А. (март 2009 г.). «Влияние уровня фибриногена на тромбоэластометрические показатели при наличии тромбоцитопении» . Анестезия и анальгезия . 108 (3): 751–758. дои : 10.1213/ane.0b013e3181966675 . ПМИД 19224779 . S2CID 11733489 .
- ^ Пейдж RC, Шредер HE (март 1976 г.). «Патогенез воспалительных заболеваний пародонта. Краткое содержание текущих работ». Лабораторные исследования; Журнал технических методов и патологии . 34 (3): 235–249. ПМИД 765622 .
- ^ Наглер М., Кремер Ховинга Х.А., Альберио Л., Петер-Салонен К., фон Тенгг-Коблик Х., Лоттаз Д. и др. (сентябрь 2016 г.). «Тромбоэмболия у пациентов с врожденной афибриногенемией. Данные долгосрочных наблюдений и систематический обзор» (PDF) . Тромбоз и гемостаз . 116 (4): 722–732. дои : 10.1160/TH16-02-0082 . ПМИД 27384135 . S2CID 4959738 .
- ^ Лори А.С., Макдональд С.Дж., Перди Дж., Маки И.Дж., Мачин С.Дж. (июнь 1998 г.). «Определение фибриногена по протромбиновому времени на Sysmex CA-6000» . Журнал клинической патологии . 51 (6): 462–466. дои : 10.1136/jcp.51.6.462 . ПМК 500750 . ПМИД 9771446 .
- ^ Сальви В (2003). Медикаментозные и хирургические диагностические нарушения при беременности . Издательство Jaypee Brothers. п. 5. ISBN 978-81-8061-090-5 . [ постоянная мертвая ссылка ]
- ^ Грейвс Э.Д., Редмонд Ч.Р., Аренсман Р.М. (март 1988 г.). «Стойкая легочная гипертензия у новорожденных». Грудь . 93 (3): 638–641. дои : 10.1378/сундук.93.3.638 . ПМИД 3277808 .
- ^ Мюллер Р., Мусикич П. (август 1987 г.). «Гемореология в хирургии - обзор». Ангиология . 38 (8): 581–592. дои : 10.1177/000331978703800802 . ПМИД 3307545 . S2CID 23209838 .
- ^ «Результаты проспективного рандомизированного исследования по оценке хирургического вмешательства и тромболизиса при ишемии нижних конечностей. Исследование STILE» . Анналы хирургии . 220 (3): 251–266, обсуждение 266–268. Сентябрь 1994 г. doi : 10.1097/00000658-199409000-00003 . ПМЦ 1234376 . ПМИД 8092895 .
- ^ Поортуис М.Х., Бранд EC, Хазенберг CE, Шутгенс Р.Е., Вестеринк Дж., Молл Ф.Л., де Борст Г.Дж. (май 2017 г.). «Уровень фибриногена в плазме как потенциальный предиктор геморрагических осложнений после катетер-направленного тромболизиса при окклюзиях периферических артерий» . Журнал сосудистой хирургии . 65 (5): 1519–1527.e26. дои : 10.1016/j.jvs.2016.11.025 . ПМИД 28274749 .
- ^ Исагирре Авила Р. (2005). «[Столетие доктрины свертывания крови]». Archivos de Cardiologia de Mexico (на испанском языке). 75 (Приложение 3): С3–118–29. ПМИД 16366177 .
Внешние ссылки
[ редактировать ]- Дженнифер МакДауэлл/Интерпро: Белок месяца: фибриноген .
- Питер Д'Эстахио/реактом: фибриноген → мономер фибрина + 2 фибринопептида А + 2 фибринопептида В
- Медицинская академия Хана (на YouTube): Свертывание крови 1. Как мы создаем тромбы?
- Обзор всей структурной информации, доступной в PDB для UniProt : P02671 (альфа-цепь фибриногена) в PDBe-KB .
- Обзор всей структурной информации, доступной в PDB для UniProt : P02675 (бета-цепь фибриногена) в PDBe-KB .
- Обзор всей структурной информации, доступной в PDB для UniProt : P02679 (гамма-цепь фибриногена) в PDBe-KB .