Церулоплазмин
| КП | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | CP , CP-2, церулоплазмин (ферроксидаза), церулоплазмин, AB073614 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | Опустить : 117700 ; МГИ : 88476 ; Гомологен : 75 ; Генные карты : CP ; ОМА : CP — ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Номер ЕС | 1.16.3.1 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Церулоплазмин (или церулоплазмин ) — ферроксидаза фермент , который у человека кодируется CP геном . [5] [6] [7]
Церулоплазмин является основным белком, переносящим медь, в крови и, кроме того, играет роль в метаболизме железа . Впервые он был описан в 1948 году. [8] Другой белок, гефестин , известен своей гомологией с церулоплазмином, а также участвует в метаболизме железа и, возможно, меди.
Функция
[ редактировать ]Церулоплазмин (ЦП) — фермент ( КФ 1.16.3.1 ), синтезируемый в печени, содержащий в своей структуре 6 атомов меди . [9] Церулоплазмин содержит более 95% всей меди в плазме здорового человека. [10] Остальное приходится на макроглобулины. Церулоплазмин проявляет медь-зависимую оксидазную активность, что связано с возможным окислением Fe. 2+ (двухвалентное железо) на Fe 3+ (трехвалентное железо), что способствует его транспортировке в плазме вместе с трансферрином , который может переносить железо только в трехвалентном состоянии. [11] Сообщается, что молекулярная масса человеческого церулоплазмина составляет 151 кДа.
Несмотря на обширные исследования, многое еще неизвестно о точных функциях CP, большинство функций приписываются CP, ориентированному на наличие центров Cu. К ним относятся транспорт меди для доставки Cu во внепеченочные ткани, активность аминоксидазы, которая контролирует уровень биогенных аминов в кишечных жидкостях и плазме, удаление кислорода и других свободных радикалов из плазмы, а также экспорт железа из клеток для транспорта через трансферрин . [12]
Известно, что мутации нарушают связывание меди с CP, нарушают метаболизм железа и вызывают перегрузку железом .
Церулоплазмин представляет собой относительно крупный фермент (~ 10 нм); больший размер предотвращает потерю связанной меди с мочой человека во время транспортировки.
Активная структура сайта
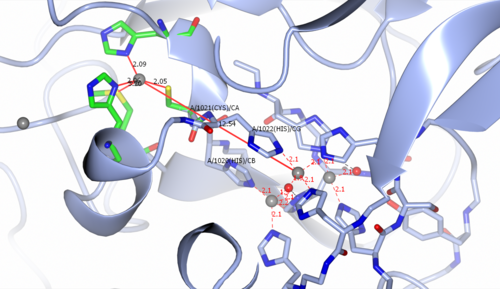
[ редактировать ]Мультимедный активный центр CP содержит моноядерную медь типа I (T1). [12] узел и трехъядерный медный центр на расстоянии ~ 12-13 Å (см. рисунок 2). Трикопперный центр состоит из двух ионов меди III типа (Т3) и одного иона меди II типа (Т2). Два иона меди Т3 соединены гидроксидным лигандом, в то время как другой гидроксидный лиганд связывает ион меди Т2 с белком. Центр Т1 соединен с трикопперным центром двумя остатками гистидина (His1020, His1022) и одним остатком Cys (1021). Субстрат связывается вблизи центра Т1 и окисляется Т1 Cu. 2+ ион, образующий восстановленный Cu + степень окисления. Уменьшенный T1 Cu + затем переносит электрон через один мостик Cys и два мостиковых остатка His к трикопперному центру. После того как четыре электрона передаются от подложки к медным центрам, O 2 связывается в трикопперном центре и подвергается четырехэлектронному восстановлению с образованием двух молекул воды. [12]
Регулирование
[ редактировать ]Цис -регуляторный элемент, называемый элементом GAIT, участвует в избирательном подавлении трансляции транскрипта церулоплазмина. [13] Замалчивание требует связывания цитозольного ингибиторного комплекса, называемого ИФН-гамма-активируемый ингибитор трансляции (GAIT), с элементом GAIT. [14]
Клиническое значение
[ редактировать ]Как и любой другой белок плазмы, его уровень снижается у пациентов с заболеваниями печени из-за снижения его синтезирующих способностей.
Механизмы низкого уровня церулоплазмина:
- Генетически низкая экспрессия генов ( ацерулоплазминемия )
- Уровень меди в целом низкий.
- Недоедание /дефицит микроэлементов в источнике пищи
- Токсичность цинка из-за дефицита меди
- Медь не проникает через кишечный барьер из-за дефицита АТФ7А ( болезнь Менкеса и синдром затылочного рога ).
- Доставка меди в просвет ЭР — сеть Гольджи отсутствует в гепатоцитах из-за отсутствия АТФ7В ( болезнь Вильсона ).
Доступность меди не влияет на трансляцию образующегося белка. Однако апофермент без меди нестабилен. Апоцерулоплазмин в значительной степени разлагается внутриклеточно в гепатоцитах , и небольшое количество, которое высвобождается, имеет короткий период полураспада из циркуляции - 5 часов по сравнению с 5,5 днями для голоцерулоплазмина.
Церулоплазмин можно измерить с помощью анализа крови; [15] это можно сделать с помощью иммуноанализа . Образец вращают и отделяют; он хранится при температуре около 4°C в течение трех дней. Этот тест предназначен для определения наличия признаков болезни Вильсона. Еще один тест, который можно провести, — это тест на уровень меди в моче; Было обнаружено, что этот метод менее точен, чем анализ крови. Также можно провести исследование ткани печени.
Мутации в гене церулоплазмина ( CP ), которые встречаются очень редко, могут привести к генетическому заболеванию ацерулоплазминемии , характеризующемуся гиперферритинемией с перегрузкой железом . В мозге эта перегрузка железом может привести к характерным неврологическим признакам и симптомам, таким как мозжечковая атаксия , прогрессирующая деменция и экстрапирамидные симптомы . Избыток железа может также откладываться в печени, поджелудочной железе и сетчатке, что приводит к циррозу печени , эндокринным нарушениям и потере зрения соответственно.
Дефицит
[ редактировать ]Уровни церулоплазмина ниже нормы могут указывать на следующее:
- Болезнь Вильсона (редкая болезнь накопления меди [частота в Великобритании 2 на 100 000]). [16]
- Болезнь Менкеса (синдром курчавых волос Менкеса) (редко – заболеваемость в Великобритании 1/100 000)
- меди Дефицит
- Ацерулоплазминемия [17]
- Токсичность цинка
Избыток
[ редактировать ]Уровни церулоплазмина, превышающие норму, могут указывать или наблюдаться при:
- токсичность меди / дефицит цинка
- беременность
- оральных контрацептивов прием [18]
- лимфома
- острое и хроническое воспаление (реактант острой фазы )
- ревматоидный артрит
- Стенокардия [19]
- болезнь Альцгеймера [20]
- Шизофрения [21]
- Обсессивно-компульсивное расстройство [22]
Эталонные диапазоны
[ редактировать ]Нормальная концентрация церулоплазмина в крови у человека составляет 20–50 мг/дл.

Ссылки
[ редактировать ]- ^ Перейти обратно: а б с GRCh38: Версия Ensembl 89: ENSG00000047457 – Ensembl , май 2017 г.
- ^ Перейти обратно: а б с GRCm38: выпуск Ensembl 89: ENSMUSG00000003617 – Ensembl , май 2017 г.
- ^ «Ссылка на Human PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Ссылка на Mouse PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ Такахаши Н., Ортель Т.Л., Патнэм Ф.В. (январь 1984 г.). «Одноцепочечная структура человеческого церулоплазмина: полная аминокислотная последовательность всей молекулы» . Труды Национальной академии наук Соединенных Штатов Америки . 81 (2): 390–4. Бибкод : 1984PNAS...81..390T . дои : 10.1073/pnas.81.2.390 . ПМЦ 344682 . ПМИД 6582496 .
- ^ Кощинский М.Л. , Фанк В.Д., ван Ост Б.А., МакГилливрей Р.Т. (июль 1986 г.). «Полная последовательность кДНК прецерулоплазмина человека» . Труды Национальной академии наук Соединенных Штатов Америки . 83 (14): 5086–90. Бибкод : 1986PNAS...83.5086K . дои : 10.1073/pnas.83.14.5086 . ПМЦ 323895 . ПМИД 2873574 .
- ^ Ройл Нью-Джерси, Ирвин Д.М., Кощинский М.Л., МакГилливрей Р.Т., Хамертон Дж.Л. (май 1987 г.). «Человеческие гены, кодирующие протромбин и церулоплазмин, сопоставляются с 11p11-q12 и 3q21-24 соответственно». Соматическая клетка и молекулярная генетика . 13 (3): 285–92. дои : 10.1007/BF01535211 . ПМИД 3474786 . S2CID 45686258 .
- ^ Холмберг К.Г., Лорел CB (1948). «Исследования сывороточной меди. II. Выделение Медьсодержащего белка и описание его свойств» . Acta Chem Scand . 2 : 550–56. doi : 10.3891/acta.chem.scand.02-0550 .
- ^ О'Брайен П.Дж., Брюс В.Р. (2009). Эндогенные токсины: мишени для лечения и профилактики заболеваний, набор из 2 томов . Джон Уайли и сыновья. стр. 405–6. ISBN 978-3-527-32363-0 .
- ^ Хеллман Н.Е., Гитлин Дж.Д. (2002). «Метаболизм и функция церулоплазмина». Ежегодный обзор питания . 22 : 439–58. дои : 10.1146/annurev.nutr.22.012502.114457 . ПМИД 12055353 .
- ^ Песня Д., Дунаиф Дж.Л. (2013). «Гомеостаз железа в сетчатке в норме и болезни» . Границы стареющей неврологии . 5:24 . дои : 10.3389/fnagi.2013.00024 . ПМЦ 3695389 . ПМИД 23825457 .
- ^ Перейти обратно: а б с Бертини I (2007). Биологическая неорганическая химия . Калифорния, США: Университетские научные книги. стр. 426–442. ISBN 978-1-891389-43-6 .
- ^ Сампат П., Мазумдер Б., Сешадри В., Фокс П.Л. (март 2003 г.). «Транскрипт-селективное трансляционное молчание гамма-интерфероном управляется новым структурным элементом в 3'-нетранслируемой области мРНК церулоплазмина» . Молекулярная и клеточная биология . 23 (5): 1509–19. дои : 10.1128/MCB.23.5.1509-1519.2003 . ПМК 151701 . ПМИД 12588972 .
- ^ Мазумдер Б., Сампат П., Фокс П.Л. (октябрь 2005 г.). «Регуляция экспрессии гена церулоплазмина макрофагов: одна парадигма 3'-UTR-опосредованного контроля трансляции» . Молекулы и клетки . 20 (2): 167–72. дои : 10.1016/S1016-8478(23)13213-4 . ПМИД 16267389 .
- ^ «Тест на церулоплазмин: медицинский тест MedlinePlus» . medlineplus.gov . Проверено 10 декабря 2021 г.
- ^ Шейнберг И.Х., Гитлин Д. (октябрь 1952 г.). «Дефицит церулоплазмина у пациентов с гепатолентикулярной дегенерацией (болезнь Вильсона)». Наука . 116 (3018): 484–5. Бибкод : 1952Sci...116..484S . дои : 10.1126/science.116.3018.484 . ПМИД 12994898 .
- ^ Гитлин Дж. Д. (сентябрь 1998 г.). «Ацерулоплазминемия» . Педиатрические исследования . 44 (3): 271–6. дои : 10.1203/00006450-199809000-00001 . ПМИД 9727700 .
- ^ Элькассабани Н.М., Мени ГМ, Дориа Р.Р., Маркуччи К. (апрель 2008 г.). «Возвращение к зеленой плазме» . Анестезиология . 108 (4): 764–5. дои : 10.1097/ALN.0b013e3181672668 . ПМИД 18362615 .
- ^ Зиакас А, Гаврилидис С, Сулиу Э, Джанноглу Г, Стилиадис И, Карвунис Х, Эфтимиадис Г, Моклас С, Вайона М.А., Хацитолиос А, Савопулос С, Пидония И, Пархаридис Г (2009). «Церулоплазмин является лучшим предиктором долгосрочного прогноза по сравнению с фибриногеном, СРБ и IL-6 у пациентов с тяжелой нестабильной стенокардией». Ангиология . 60 (1): 50–9. дои : 10.1177/0003319708314249 . ПМИД 18388036 . S2CID 843454 .
- ^ Луценко С., Гупта А., Беркхед Дж.Л., Зузель В. (август 2008 г.). «Клеточная многозадачность: двойная роль человеческих Cu-АТФаз в доставке кофакторов и внутриклеточном балансе меди» . Архив биохимии и биофизики . 476 (1): 22–32. дои : 10.1016/j.abb.2008.05.005 . ПМК 2556376 . ПМИД 18534184 .
- ^ Вольф Т.Л., Котун Дж., Мидор-Вудрафф Дж.Х. (сентябрь 2006 г.). «Плазменная медь, железо, церулоплазмин и активность ферроксидазы при шизофрении». Исследования шизофрении . 86 (1–3): 167–71. doi : 10.1016/j.schres.2006.05.027 . ПМИД 16842975 . S2CID 38267889 .
- ^ Вирит О, Селек С, Булут М, Савас ХА, Челик Х, Эрел О, Херкен Х (2008). «Высокие уровни церулоплазмина связаны с обсессивно-компульсивным расстройством: исследование случай-контроль» . Поведенческие и мозговые функции . 4:52 . дои : 10.1186/1744-9081-4-52 . ПМК 2596773 . ПМИД 19017404 .
Дальнейшее чтение
[ редактировать ]- Хеллман Н.Е., Гитлин Дж.Д. (2002). «Метаболизм и функция церулоплазмина». Ежегодный обзор питания . 22 : 439–58. дои : 10.1146/annurev.nutr.22.012502.114457 . ПМИД 12055353 .
- Мазумдер Б., Сешадри В., Фокс П.Л. (февраль 2003 г.). «Трансляционный контроль с помощью 3'-UTR: концы определяют средства». Тенденции биохимических наук . 28 (2): 91–8. дои : 10.1016/S0968-0004(03)00002-1 . ПМИД 12575997 .
- Джурджа Н., Константинеску М.И., Станчу Р., Сучу С., Муресан А. (февраль 2005 г.). «Церулоплазмин - реагент острой фазы или эндогенный антиоксидант? Случай сердечно-сосудистых заболеваний». Монитор медицинских наук . 11 (2): RA48-51. PMID 15668644 .
- Кингстон IB, Кингстон BL, Патнэм FW (декабрь 1977 г.). «Химические доказательства того, что протеолитическое расщепление вызывает гетерогенность, присутствующую в препаратах человеческого церулоплазмина» . Труды Национальной академии наук Соединенных Штатов Америки . 74 (12): 5377–81. Бибкод : 1977PNAS...74.5377K . дои : 10.1073/pnas.74.12.5377 . ПМК 431726 . ПМИД 146197 .
- Полосатов М.В., Климов П.К., Масевич К.Г., Самарцев М.А., Вюнш Э. (апрель 1979 г.). «Взаимодействие синтетического большого гастрина человека с белками крови человека и животных». Acta Hepato-Gastroenterologica . 26 (2): 154–9. ПМИД 463490 .
- Шильски М.Л., Стокерт Р.Дж., Поллард Дж.В. (декабрь 1992 г.). «Биосинтез церулоплазмина маткой человека» . Биохимический журнал . 288 (2): 657–61. дои : 10.1042/bj2880657 . ПМК 1132061 . ПМИД 1463466 .
- Уокер Ф.Дж., Фэй П.Дж. (февраль 1990 г.). «Характеристика взаимодействия белка С и церулоплазмина» . Журнал биологической химии . 265 (4): 1834–6. дои : 10.1016/S0021-9258(19)39903-X . ПМИД 2105310 .
- Флеминг Р.Э., Гитлин Дж.Д. (май 1990 г.). «Первичная структура крысиного церулоплазмина и анализ экспрессии тканеспецифичных генов во время развития» . Журнал биологической химии . 265 (13): 7701–7. дои : 10.1016/S0021-9258(19)39171-9 . ПМИД 2332446 .
- Ян Ф.М., Фридрихс В.Е., Капплс Р.Л., Бонифачо М.Дж., Сэнфорд Дж.А., Хортон В.А., Боуман Б.Х. (июнь 1990 г.). «Человеческий церулоплазмин. Тканеспецифическая экспрессия транскриптов, полученных путем альтернативного сплайсинга» . Журнал биологической химии . 265 (18): 10780–5. дои : 10.1016/S0021-9258(18)87015-6 . ПМИД 2355023 .
- Ян Ф., Нейлор С.Л., Лам Дж.Б., Катшоу С., МакКомбс Дж.Л., Наберхаус К.Х., МакГилл-младший, Адриан Г.С., Мур К.М., Барнетт Д.Р. (май 1986 г.). «Характеристика, картирование и экспрессия гена церулоплазмина человека» . Труды Национальной академии наук Соединенных Штатов Америки . 83 (10): 3257–61. Бибкод : 1986PNAS...83.3257Y . дои : 10.1073/pnas.83.10.3257 . ПМЦ 323492 . ПМИД 3486416 .
- Мерсер Дж. Ф., Граймс А. (июль 1986 г.). «Выделение клона кДНК церулоплазмина человека, который включает N-концевую лидерную последовательность». Письма ФЭБС . 203 (2): 185–90. дои : 10.1016/0014-5793(86)80739-6 . ПМИД 3755405 . S2CID 23472934 .
- Раск Л., Валтерссон С., Анунди Х., Квист С., Эрикссон У., Даллнер Г., Петерсон П.А. (январь 1983 г.). «Субклеточная локализация в нормальной и дефицитной по витамину А печени крыс сывороточных транспортных белков витамина А, альбумина, церулоплазмина и основных антигенов гистосовместимости класса I». Экспериментальные исследования клеток . 143 (1): 91–102. дои : 10.1016/0014-4827(83)90112-X . ПМИД 6337857 .
- Кресснер М.С., Стокерт Р.Дж., Морелл А.Г., Штернлиб I (1984). «Происхождение желчной меди». Гепатология . 4 (5): 867–70. дои : 10.1002/hep.1840040512 . ПМИД 6479854 . S2CID 43824397 .
- Такахаши Н., Бауман Р.А., Ортель Т.Л., Дулет Ф.Е., Ван CC, Патнэм Ф.В. (январь 1983 г.). «Внутренняя трипликация в структуре церулоплазмина человека» . Труды Национальной академии наук Соединенных Штатов Америки . 80 (1): 115–9. Бибкод : 1983ПНАС...80..115Т . дои : 10.1073/pnas.80.1.115 . ПМК 393320 . ПМИД 6571985 .
- Дулет Ф.Е., Патнэм Ф.В. (февраль 1981 г.). «Полная аминокислотная последовательность фрагмента человеческого церулоплазмина массой 50 000 дальтон» . Труды Национальной академии наук Соединенных Штатов Америки . 78 (2): 790–4. Бибкод : 1981PNAS...78..790D . дои : 10.1073/pnas.78.2.790 . ПМК 319888 . ПМИД 6940148 .
- Кингстон IB, Кингстон BL, Патнэм FW (апрель 1980 г.). «Первичная структура богатого гистидином протеолитического фрагмента человеческого церулоплазмина. I. Аминокислотная последовательность пептидов бромциана» . Журнал биологической химии . 255 (7): 2878–85. дои : 10.1016/S0021-9258(19)85822-2 . ПМИД 6987229 .
Внешние ссылки
[ редактировать ]- Запись GeneReviews/NCBI/NIH/UW об ацерулоплазминемии
- Записи OMIM об ацерулоплазминемии
- Обзор всей структурной информации, доступной в PDB для UniProt : P00450 (Человеческий церулоплазмин) в PDBe-KB .