СОД1
| СОД1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | SOD1 , ALS, ALS1, HEL-S-44, IPOA, SOD, hSod1, гомодимер, супероксиддисмутаза 1, растворимый, супероксиддисмутаза 1, STAHP | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | Опустить : 147450 ; МГИ : 98351 ; Гомологен : 392 ; GeneCards : SOD1 ; ОМА : СОД1 — ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Супероксиддисмутаза [Cu-Zn], также известная как супероксиддисмутаза 1 или hSod1, представляет собой фермент , который у человека кодируется геном , SOD1 расположенным на хромосоме 21 . SOD1 является одной из трех супероксиддисмутаз человека . [5] [6] Он участвует в апоптозе , семейном боковом амиотрофическом склерозе и болезни Паркинсона . [6] [7]
Структура
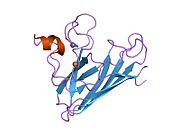
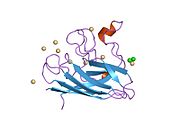
[ редактировать ]32 кДа SOD1 представляет собой гомодимер массой , который образует бета-цилиндр (β-цилиндр) и содержит внутримолекулярную дисульфидную связь и биядерный сайт Cu/Zn в каждой субъединице. центр Cu/Zn удерживает ионы меди и цинка и отвечает за катализацию диспропорционирования супероксида дикислород на перекись водорода и Этот . [8] [9] Процесс созревания этого белка сложен и до конца не изучен, он включает селективное связывание ионов меди и цинка, образование внутрисубъединичной дисульфидной связи между Cys-57 и Cys-146 и димеризацию двух субъединиц. Медный шаперон Sod1 (CCS) облегчает внедрение меди и окисление дисульфида. Хотя СОД1 синтезируется в цитозоле и может там созревать, фракция экспрессированного, но все еще незрелого СОД1, направленная в митохондрии, должна быть вставлена в межмембранное пространство. Там он образует дисульфидную связь, но не металлирование, необходимое для его созревания. [9] Зрелый белок очень стабилен. [10] но нестабилен в формах, не содержащих металлов и восстановленных дисульфидами. [8] [9] [10] Это проявляется in vitro, поскольку потеря ионов металлов приводит к усилению агрегации СОД1, а также на моделях заболеваний, где наблюдается низкое металлирование нерастворимого СОД1. Более того, восстановленные цистеины, экспонированные на поверхности, могут участвовать в дисульфидной сшивке и, следовательно, в агрегации. [8]
Функция
[ редактировать ]SOD1 связывает ионы меди и цинка и является одной из трех супероксиддисмутаз, ответственных за разрушение свободных супероксидных радикалов в организме. Кодируемый изофермент представляет собой растворимый цитоплазматический и митохондриальный белок межмембранного пространства, действующий как гомодимер для преобразования встречающихся в природе, но вредных супероксидных радикалов в молекулярный кислород и перекись водорода . [9] [11] Затем перекись водорода может расщепляться другим ферментом, называемым каталазой.
Предполагается, что SOD1 локализуется на внешней митохондриальной мембране (OMM), где будут генерироваться супероксидные анионы, или в межмембранном пространстве . Точные механизмы его локализации остаются неизвестными, но его агрегацию с OMM связывают с его ассоциацией с BCL-2. SOD1 дикого типа продемонстрировал антиапоптотические свойства в нейронных культурах, тогда как мутантный SOD1, как было замечено, способствует апоптозу в митохондриях спинного мозга, но не в митохондриях печени , хотя он одинаково экспрессируется в обоих. Две модели предполагают, что SOD1 ингибирует апоптоз, взаимодействуя с белками BCL-2 или самими митохондриями. [6]
Клиническое значение
[ редактировать ]Роль в окислительном стрессе
[ редактировать ]В частности, SOD1 играет решающую роль в высвобождении активных форм кислорода (АФК) во время окислительного стресса вследствие ишемически-реперфузионного повреждения , особенно в миокарде при сердечном приступе (также известном как ишемическая болезнь сердца ). Ишемическая болезнь сердца, возникающая в результате окклюзии одной из основных коронарных артерий , в настоящее время по-прежнему является ведущей причиной заболеваемости и смертности в западном обществе. [12] [13] Во время ишемии-реперфузии высвобождение АФК существенно способствует повреждению и гибели клеток посредством прямого воздействия на клетку, а также посредством апоптотических сигналов. Известно, что SOD1 обладает способностью ограничивать вредное воздействие АФК. Таким образом, SOD1 важен благодаря своим кардиопротекторным эффектам. [14] Кроме того, SOD1 участвует в кардиозащите от ишемически-реперфузионного повреждения, например, во время ишемического прекондиционирования сердца. [15] Хотя известно, что большой всплеск АФК приводит к повреждению клеток, умеренное высвобождение АФК из митохондрий, происходящее во время нелетальных коротких эпизодов ишемии, может играть значительную пусковую роль в путях передачи сигнала ишемического прекондиционирования, приводя к снижению повреждение клеток. Было даже замечено, что во время этого высвобождения АФК SOD1 играет важную роль, регулируя передачу сигналов апоптоза и гибель клеток.
В одном исследовании делеции гена были зарегистрированы в двух семейных случаях кератоконуса . [16] У мышей, лишенных SOD1, наблюдается повышенная возрастная потеря мышечной массы ( саркопения ), раннее развитие катаракты , дегенерация желтого пятна , инволюция тимуса , гепатоцеллюлярная карцинома и сокращение продолжительности жизни. [17] Исследования показывают, что повышенный уровень SOD1 может быть биомаркером хронической токсичности тяжелых металлов у женщин с длительными зубными пломбами из амальгамы. [18]
Боковой амиотрофический склероз (болезнь Лу Герига)
[ редактировать ]Мутации (более 150 выявленных на сегодняшний день) в этом гене связаны с семейным боковым амиотрофическим склерозом . [19] [20] [21] Однако некоторые данные также показывают, что SOD1 дикого типа в условиях клеточного стресса участвует в значительной части спорадических случаев БАС, которые составляют 90% пациентов с БАС. [22] Наиболее частые мутации — A4V (в США) и H46R (Япония). В Исландии только SOD1-G93S обнаружен . Наиболее изученная модель мыши БАС — G93A . Сообщалось о редких вариантах транскрипта этого гена. [11]
Практически все известные мутации SOD1, вызывающие БАС, действуют доминантно ; одной мутантной копии гена SOD1 достаточно, чтобы вызвать заболевание. Точный молекулярный механизм (или механизмы), с помощью которого мутации SOD1 вызывают заболевание, неизвестны. Похоже, это какое-то токсичное усиление функций. [21] поскольку многие мутанты SOD1, связанные с заболеванием (включая G93A и A4V), сохраняют ферментативную активность, а у мышей с нокаутом Sod1 не развивается БАС (хотя у них действительно наблюдается сильная возрастная дистальная моторная нейропатия).
БАС — нейродегенеративное заболевание , характеризующееся избирательной гибелью мотонейронов, вызывающей атрофию мышц . Продукт окисления ДНК ДНК 8-OHdG является общепризнанным маркером окислительного повреждения . 8-OHdG накапливается в митохондриях спинальных мотонейронов больных БАС. [23] У трансгенных мышей с БАС, несущих мутантный ген SOD1, 8-OHdG также накапливается в митохондриальной ДНК мотонейронов спинного мозга. [24] Эти данные позволяют предположить, что окислительное повреждение митохондриальной ДНК мотонейронов из-за изменения SOD1 может быть значимым фактором в этиологии БАС.
Мутация A4V
[ редактировать ]A4V ( аланин в кодоне 4 заменен на валин ) является наиболее распространенной мутацией, вызывающей БАС, в популяции США, причем примерно 50% пациентов с СОД1-БАС являются носителями мутации A4V. [25] [26] [27] Примерно 10 процентов всех случаев семейного БАС в США вызваны гетерозиготными мутациями A4V в SOD1. Мутация редко, если вообще когда-либо, встречается за пределами Америки.
Недавно было подсчитано, что мутация A4V произошла 540 поколений (~ 12 000 лет) назад. Гаплотип, окружающий мутацию, позволяет предположить, что мутация A4V возникла у азиатских предков коренных американцев, достигших Америки через Берингов пролив . [28]
Мутант A4V относится к WT-подобным мутантам. У пациентов с мутациями A4V наблюдается разный возраст начала заболевания, но одинаково быстрое течение заболевания со средней выживаемостью после начала заболевания 1,4 года (по сравнению с 3–5 годами при других доминантных мутациях SOD1, а в некоторых случаях, таких как H46R, значительно дольше). Эта выживаемость значительно короче, чем у немутантного БАС, связанного с SOD1.
Мутация H46R
[ редактировать ]H46R ( гистидин в кодоне 46 заменен на аргинин ) является наиболее распространенной мутацией, вызывающей БАС, в японском населении, причем около 40% японских пациентов с СОД1-БАС являются носителями этой мутации. H46R вызывает глубокую потерю связывания меди в активном сайте SOD1 , и поэтому H46R ферментативно неактивен. Течение заболевания этой мутации чрезвычайно длительное: типичное время от начала до смерти составляет более 15 лет. [29] Мышиные модели с этой мутацией не демонстрируют классической патологии митохондриальной вакуолизации, наблюдаемой у мышей ALS G93A и G37R, и, в отличие от мышей G93A, дефицит основного митохондриального антиоксидантного фермента, SOD2 , не влияет на течение их заболевания. [29]
Мутация G93A
[ редактировать ]G93A (глицин 93 заменен на аланин) — сравнительно редкая мутация, но она изучалась очень интенсивно, поскольку это была первая мутация, смоделированная на мышах. G93A представляет собой мутацию псевдо-WT, которая оставляет активность фермента неизменной. [27] Благодаря доступности мыши G93A из лаборатории Джексона , в этой модели было проведено множество исследований потенциальных мишеней лекарств и механизмов токсичности. По крайней мере, один частный исследовательский институт ( Институт развития терапии БАС ) проводит крупномасштабные проверки на наркотики исключительно на этой модели мышей. В настоящее время неизвестно, являются ли результаты специфичными для G93A или применимы ко всем мутациям SOD1, вызывающим БАС. Утверждалось, что определенные патологические особенности мыши G93A обусловлены артефактами сверхэкспрессии, особенно теми, которые связаны с митохондриальной вакуолизацией (мышь G93A, обычно используемая в лаборатории Джексона, имеет более 20 копий человеческого гена SOD1). [30] По крайней мере, одно исследование показало, что некоторые особенности патологии характерны для G93A и не могут быть экстраполированы на все мутации, вызывающие БАС. [29] Дальнейшие исследования показали, что патогенез моделей G93A и H46R четко различен; некоторые лекарства и генетические вмешательства, которые приносят пользу или вред в одной модели, оказывают либо противоположный эффект, либо не оказывают никакого эффекта в другой. [31] [32] [33]
Синдром Дауна
[ редактировать ]Синдром Дауна (СД) обычно вызывается утроением 21 хромосомы . Считается, что окислительный стресс является важным фактором, лежащим в основе патологий, связанных с СД. Окислительный стресс, по-видимому, обусловлен утроением и увеличением экспрессии гена SOD1, расположенного в хромосоме 21. Повышенная экспрессия SOD1, вероятно, вызывает увеличение выработки перекиси водорода, что приводит к увеличению повреждения клеток.
Уровни 8-OHdG в ДНК лиц с СД, измеренные в слюне , оказались значительно выше, чем в контрольных группах. [34] Уровни 8-OHdG также были повышены в лейкоцитах людей с СД по сравнению с контрольной группой. [35] Эти данные позволяют предположить, что окислительное повреждение ДНК может приводить к некоторым клиническим проявлениям СД.
Взаимодействия
[ редактировать ]Было показано, что SOD1 взаимодействует с CCS. [36] и Bcl-2 . [37] [38] [39] [40]
Ссылки
[ редактировать ]- ^ Jump up to: а б с GRCh38: Версия Ensembl 89: ENSG00000142168 – Ensembl , май 2017 г.
- ^ Jump up to: а б с GRCm38: выпуск Ensembl 89: ENSMUSG00000022982 – Ensembl , май 2017 г.
- ^ «Ссылка на Human PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Ссылка на Mouse PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ Милани П., Гальярди С., Кова Э., Середа С. (2011). «Транкрипционная и посттранскрипционная регуляция SOD1 и ее потенциальные последствия при БАС» . Международное исследование неврологии . 2011 : 458427. doi : 10.1155/2011/458427 . ПМК 3096450 . ПМИД 21603028 .
- ^ Jump up to: а б с Розен Д.Р., Сиддик Т., Паттерсон Д., Фиглевич Д.А., Сапп П., Хентати А. и др. (март 1993 г.). «Мутации в гене супероксиддисмутазы Cu/Zn связаны с семейным боковым амиотрофическим склерозом». Природа . 362 (6415): 59–62. Бибкод : 1993Natur.362...59R . дои : 10.1038/362059a0 . ПМИД 8446170 . S2CID 265436 .
- ^ Трист Б.Г., Hilton JB, Hare DJ, Crouch PJ, Double KL (апрель 2021 г.). «Супероксиддисмутаза 1 в здоровье и болезнях: как передовой антиоксидант становится нейротоксичным» . Ангеванде Хеми . 60 (17): 9215–9246. дои : 10.1002/anie.202000451 . ПМЦ 8247289 . ПМИД 32144830 .
- ^ Jump up to: а б с Эстасиу С.Г., Леаль СС, Кристован Ж.С., Фаиска П.Ф., Гомеш К.М. (февраль 2015 г.). «Связывание кальция с остатками привратника, фланкирующими склонные к агрегации сегменты, лежит в основе нефибриллярных амилоидных признаков супероксиддисмутазы 1 (SOD1)». Biochimica et Biophysical Acta (BBA) - Белки и протеомика . 1854 (2): 118–126. дои : 10.1016/j.bbapap.2014.11.005 . ПМИД 25463043 .
- ^ Jump up to: а б с д Си К., Сон С.Х., Дуразо А., Шэн Ю., Шоу Б.Ф., Цао X и др. (январь 2015 г.). «Понимание роли необычной дисульфидной связи в супероксиддисмутазе меди-цинка» . Журнал биологической химии . 290 (4): 2405–2418. дои : 10.1074/jbc.M114.588798 . ПМК 4303690 . ПМИД 25433341 .
- ^ Jump up to: а б Харе С.Д., Кэплоу М., Дохолян Н.В. (октябрь 2004 г.). «Константы скорости и равновесия для многоступенчатой последовательности реакций агрегации супероксиддисмутазы при боковом амиотрофическом склерозе» . Труды Национальной академии наук Соединенных Штатов Америки . 101 (42): 15094–15099. Бибкод : 2004PNAS..10115094K . дои : 10.1073/pnas.0406650101 . ПМК 524068 . ПМИД 15475574 .
- ^ Jump up to: а б «Ген Энтрез: супероксиддисмутаза 1 SOD1, растворимая (боковой амиотрофический склероз 1 (взрослый))» .
- ^ Мюррей CJ, Лопес AD (май 1997 г.). «Альтернативные прогнозы смертности и инвалидности по причинам на 1990–2020 годы: исследование глобального бремени болезней». Ланцет . 349 (9064): 1498–1504. дои : 10.1016/S0140-6736(96)07492-2 . ПМИД 9167458 . S2CID 10556268 .
- ^ Браунвальд Э., Клонер Р.А. (ноябрь 1985 г.). «Реперфузия миокарда: палка о двух концах?» . Журнал клинических исследований . 76 (5): 1713–1719. дои : 10.1172/JCI112160 . ПМК 424191 . ПМИД 4056048 .
- ^ Маслов Л.Н., Нарыжная Н.В., Подоксенов И., Прокудина Е.С., Горбунов А.С., Чжан И., Пей З. (январь 2015 г.). «[Активные формы кислорода являются триггерами и медиаторами повышения толерантности сердца к воздействию ишемии-реперфузии]». Российский физиологический журнал имени И. М. Сеченова . 101 (1): 3–24. ПМИД 25868322 .
- ^ Лием Д.А., Хонда Х.М., Чжан Дж., Ву Д., Пинг П. (декабрь 2007 г.). «Прошлый и современный курс кардиопротекции против ишемически-реперфузионного повреждения». Журнал прикладной физиологии . 103 (6): 2129–2136. doi : 10.1152/japplphysicalol.00383.2007 . ПМИД 17673563 . S2CID 24815784 .
- ^ Удар Н., Атилано С.Р., Браун DJ, Ольгин Б., Смолл К., Несберн AB, Кенни MC (август 2006 г.). «SOD1: ген-кандидат кератоконуса» . Исследовательская офтальмология и визуальные науки . 47 (8): 3345–3351. дои : 10.1167/iovs.05-1500 . ПМИД 16877401 .
- ^ Мюллер Ф.Л., Люстгартен М.С., Джанг Й., Ричардсон А., Ван Реммен Х. (август 2007 г.). «Тенденции в теориях окислительного старения». Свободно-радикальная биология и медицина . 43 (4): 477–503. doi : 10.1016/j.freeradbiomed.2007.03.034 . ПМИД 17640558 .
- ^ Кабанья-Муньос М.Э., Пармиджани-Искьердо Х.М., Браво-Гонсалес Л.А., Кьюнг Х.М., Мерино Дж.Дж. (июнь 2015 г.). «Повышенные уровни Zn/глутатиона и более высокая активность супероксиддисмутазы-1 как биомаркеры окислительного стресса у женщин с длительными зубными пломбами из амальгамы: корреляция между уровнями ртути/алюминия (в волосах) и антиоксидантными системами в плазме» . ПЛОС ОДИН . 10 (6): e0126339. Бибкод : 2015PLoSO..1026339C . дои : 10.1371/journal.pone.0126339 . ПМЦ 4468144 . ПМИД 26076368 .
- ^ Конвит РА (декабрь 2006 г.). «Профилактика семейного БАС: клинические испытания могут быть осуществимы, но оправдано ли исследование эффективности?» . Журнал неврологических наук . 251 (1–2): 1–2. дои : 10.1016/j.jns.2006.07.009 . ПМИД 17070848 . S2CID 33105812 .
- ^ Аль-Чалаби А., Ли П.Н. (август 2000 г.). «Последние достижения в области бокового амиотрофического склероза». Современное мнение в неврологии . 13 (4): 397–405. дои : 10.1097/00019052-200008000-00006 . ПМИД 10970056 . S2CID 21577500 .
- ^ Jump up to: а б Редлер Р.Л., Дохолян Н.В. (01.01.2012). «Сложная молекулярная биология бокового амиотрофического склероза (АЛС)». Молекулярная биология нейродегенеративных заболеваний . Прогресс молекулярной биологии и трансляционной науки. Том. 107. стр. 215–62. дои : 10.1016/B978-0-12-385883-2.00002-3 . ISBN 9780123858832 . ПМЦ 3605887 . ПМИД 22482452 .
- ^ Гальярди С., Кова Е., Дэвин А., Гуарески С., Абель К., Алвиси Е. и др. (август 2010 г.). «Экспрессия мРНК SOD1 при спорадическом боковом амиотрофическом склерозе». Нейробиология болезней . 39 (2): 198–203. дои : 10.1016/j.nbd.2010.04.008 . ПМИД 20399857 . S2CID 207065284 .
- ^ Кикучи Х., Фурута А., Нисиока К., Судзуки СО, Накабеппу Ю., Иваки Т. (апрель 2002 г.). «Нарушение ферментов репарации митохондриальной ДНК на фоне накопления 8-оксо-гуанина в спинальных мотонейронах при боковом амиотрофическом склерозе». Акта Нейропатологика . 103 (4): 408–414. дои : 10.1007/s00401-001-0480-x . ПМИД 11904761 . S2CID 2102463 .
- ^ Варита Х., Хаяши Т., Мураками Т., Манабэ Ю., Абэ К. (апрель 2001 г.). «Окислительное повреждение митохондриальной ДНК в мотонейронах спинного мозга трансгенных мышей с БАС». Исследования мозга. Молекулярные исследования мозга . 89 (1–2): 147–152. дои : 10.1016/S0169-328X(01)00029-8 . ПМИД 11311985 .
- ^ Розен Д.Р., Боулинг AC, Паттерсон Д., Усдин Т.Б., Сапп П., Мезей Е. и др. (июнь 1994 г.). «Частая мутация супероксиддисмутазы-1 от ala 4 до val связана с быстро прогрессирующим семейным боковым амиотрофическим склерозом». Молекулярная генетика человека . 3 (6): 981–987. дои : 10.1093/hmg/3.6.981 . ПМИД 7951249 .
- ^ Кудкович М.Е., Маккенна-Ясек Д., Сапп П.Е., Чин В., Геллер Б., Хайден Д.Л. и др. (февраль 1997 г.). «Эпидемиология мутаций супероксиддисмутазы при боковом амиотрофическом склерозе» . Анналы неврологии . 41 (2): 210–221. дои : 10.1002/ana.410410212 . ПМИД 9029070 . S2CID 25595595 .
- ^ Jump up to: а б Валентайн Дж. С., Харт П. Дж. (апрель 2003 г.). «Неправильно свернутый CuZnSOD и боковой амиотрофический склероз» . Труды Национальной академии наук Соединенных Штатов Америки . 100 (7): 3617–3622. Бибкод : 2003PNAS..100.3617V . дои : 10.1073/pnas.0730423100 . ПМК 152971 . ПМИД 12655070 .
- ^ Брум В.Дж., Джонсон Д.В., Аувартер К.Е., Иафрат А.Дж., Расс С., Аль-Чалаби А. и др. (январь 2008 г.). «БАС, опосредованный SOD1A4V: отсутствие тесно связанного гена-модификатора и происхождение из Азии». Письма по неврологии . 430 (3): 241–245. дои : 10.1016/j.neulet.2007.11.004 . ПМИД 18055113 . S2CID 46282375 .
- ^ Jump up to: а б с Мюллер Ф.Л., Лю Ю., Джерниган А., Борчелт Д., Ричардсон А., Ван Реммен Х. (сентябрь 2008 г.). «Дефицит MnSOD по-разному влияет на прогрессирование заболевания в двух разных моделях мышей с мутацией ALS». Мышцы и нервы . 38 (3): 1173–1183. дои : 10.1002/mus.21049 . ПМИД 18720509 . S2CID 23971601 .
- ^ Бергемальм Д., Йонссон П.А., Граффмо К.С., Андерсен П.М., Брэннстрем Т., Ренмарк А., Марклунд С.Л. (апрель 2006 г.). «Перегрузка стабильных и исключение нестабильных вариантов супероксиддисмутазы-1 человека в митохондриях мышиных моделей бокового амиотрофического склероза» . Журнал неврологии . 26 (16): 4147–4154. doi : 10.1523/JNEUROSCI.5461-05.2006 . ПМК 6673995 . ПМИД 16624935 .
- ^ Пан Л., Ёсии Ю., Отомо А., Огава Х., Ивасаки Ю., Шан Х.Ф., Хадано С. (2012). «Различные мутанты супероксиддисмутазы меди и цинка человека, SOD1G93A и SOD1H46R, оказывают выраженное вредное воздействие на общий фенотип мышей» . ПЛОС ОДИН . 7 (3): e33409. Бибкод : 2012PLoSO...733409P . дои : 10.1371/journal.pone.0033409 . ПМК 3306410 . ПМИД 22438926 .
- ^ Бхаттачарья А., Боков А., Мюллер Ф.Л., Джерниган А.Л., Маслин К., Диас В. и др. (август 2012 г.). «Ограничение в питании, но не рапамицин, продлевает начало заболевания и выживаемость мышиной модели БАС H46R/H48Q». Нейробиология старения . 33 (8): 1829–1832. doi : 10.1016/j.neurobiolaging.2011.06.002 . ПМИД 21763036 . S2CID 11227242 .
- ^ Варгас М.Р., Джонсон Д.А., Джонсон Дж.А. (сентябрь 2011 г.). «Снижение глутатиона ускоряет неврологический дефицит и митохондриальную патологию в семейной модели мышей hSOD1 (G93A), связанной с БАС» . Нейробиология болезней . 43 (3): 543–551. дои : 10.1016/j.nbd.2011.04.025 . ПМК 3139005 . ПМИД 21600285 .
- ^ Комацу Т., Дакёнг Ю., Ито А., Куросава К., Маехата Ю., Кубодера Т. и др. (сентябрь 2013 г.). «Повышение биомаркеров окислительного стресса в слюне пациентов с синдромом Дауна». Архивы оральной биологии . 58 (9): 1246–1250. дои : 10.1016/j.archorlbio.2013.03.017 . ПМИД 23714170 .
- ^ Паллардо Ф.В., Деган П., д'Искья М., Келли Ф.Дж., Заттерале А., Кальцоне Р. и др. (август 2006 г.). «Множественные доказательства прооксидантного состояния в раннем возрасте у пациентов с синдромом Дауна». Биогеронтология . 7 (4): 211–220. дои : 10.1007/s10522-006-9002-5 . ПМИД 16612664 . S2CID 13657691 .
- ^ Касарено Р.Л., Вагонер Д., Гитлин Дж.Д. (сентябрь 1998 г.). «Медный шаперон CCS напрямую взаимодействует с супероксиддисмутазой меди/цинка» . Журнал биологической химии . 273 (37): 23625–23628. дои : 10.1074/jbc.273.37.23625 . ПМИД 9726962 .
- ^ Пасинелли П., Белфорд М.Э., Леннон Н., Бачкай Б.Дж., Хайман Б.Т., Тротти Д., Браун Р.Х. (июль 2004 г.). «Мутантные белки SOD1, ассоциированные с боковым амиотрофическим склерозом, связываются и агрегируются с Bcl-2 в митохондриях спинного мозга» . Нейрон . 43 (1): 19–30. дои : 10.1016/j.neuron.2004.06.021 . ПМИД 15233914 . S2CID 18141051 .
- ^ Кова Е., Гирольди А., Гуарески С., Мадзини Г., Гальярди С., Дэвин А. и др. (октябрь 2010 г.). «G93A SOD1 изменяет клеточный цикл в клеточной модели бокового амиотрофического склероза». Сотовая сигнализация . 22 (10): 1477–1484. doi : 10.1016/j.cellsig.2010.05.016 . ПМИД 20561900 .
- ^ Середа С, Кова Е, Ди Пото С, Галли А, Мадзини Дж, Корато М, Черони М (ноябрь 2006 г.). «Влияние оксида азота на лимфоциты больных спорадическим боковым амиотрофическим склерозом: токсическая или защитная роль?». Неврологические науки . 27 (5): 312–316. дои : 10.1007/s10072-006-0702-z . ПМИД 17122939 . S2CID 25059353 .
- ^ Кова Е., Середа С., Галли А., Курти Д., Финотти С., Ди Пото С. и др. (май 2006 г.). «Модифицированная экспрессия белков Bcl-2 и SOD1 в лимфоцитах спорадических пациентов с БАС». Письма по неврологии . 399 (3): 186–190. дои : 10.1016/j.neulet.2006.01.057 . ПМИД 16495003 . S2CID 26076370 .
Дальнейшее чтение
[ редактировать ]- де Беллерош Дж., Оррелл Р., Кинг А. (ноябрь 1995 г.). «Семейный боковой амиотрофический склероз/болезнь двигательных нейронов (FALS): обзор текущих событий» . Журнал медицинской генетики . 32 (11): 841–847. дои : 10.1136/jmg.32.11.841 . ПМЦ 1051731 . ПМИД 8592323 .
- Черони М., Курти Д., Алимонти Д. (2002). «Боковой амиотрофический склероз и ген SOD1: обзор». Функциональная неврология . 16 (4 приложения): 171–180. ПМИД 11996514 .
- Зелько И.Н., Мариани Т.Дж., Фольц Р.Дж. (август 2002 г.). «Мультигенное семейство супероксиддисмутазы: сравнение структур, эволюции и экспрессии генов CuZn-SOD (SOD1), Mn-SOD (SOD2) и EC-SOD (SOD3)». Свободно-радикальная биология и медицина . 33 (3): 337–349. дои : 10.1016/S0891-5849(02)00905-X . ПМИД 12126755 .
- Хадано С. (июнь 2002 г.). «[Гены, вызывающие семейный боковой амиотрофический склероз]». Сэйкагаку. Журнал Японского биохимического общества . 74 (6): 483–489. ПМИД 12138710 .
- Нур Р., Миттал С., Икбал Дж. (сентябрь 2002 г.). «Супероксиддисмутаза - применение и значение для болезней человека». Монитор медицинских наук . 8 (9): RA210–RA215. ПМИД 12218958 .
- Поттер С.З., Валентайн Дж.С. (апрель 2003 г.). «Загадочная роль супероксиддисмутазы меди-цинка при боковом амиотрофическом склерозе (болезни Лу Герига)». Журнал биологической неорганической химии . 8 (4): 373–380. дои : 10.1007/s00775-003-0447-6 . ПМИД 12644909 . S2CID 22820101 .
- Ротилио Г., Аквилано К., Чириоло М.Р. (2004). «Взаимодействие супероксиддисмутазы Cu,Zn и синтазы оксида азота в нейродегенеративных процессах» . ИУБМБ Жизнь . 55 (10–11): 629–634. дои : 10.1080/15216540310001628717 . ПМИД 14711010 . S2CID 19518719 .
- Джафари-Шлюп Х.Ф., Хорис Дж., Майе-Портас В., Хэнд К., Руло Дж., Камю В. (январь 2004 г.). «[Нарушения гена супероксиддисмутазы 1 при семейном боковом амиотрофическом склерозе: корреляция фенотипа/генотипа. Французский опыт и обзор литературы]». Ревю Неврологии . 160 (1): 44–50. дои : 10.1016/S0035-3787(04)70846-2 . ПМИД 14978393 .
- Фарачи FM, Дидион С.П. (август 2004 г.). «Сосудистая защита: изоформы супероксиддисмутазы в сосудистой стенке» . Атеросклероз, тромбоз и сосудистая биология . 24 (8): 1367–1373. doi : 10.1161/01.ATV.0000133604.20182.cf . ПМИД 15166009 .
- Гальярди С., Оглиари П., Дэвин А., Корато М., Кова Е., Абель К. и др. (август 2011 г.). «Уровни мРНК флавинсодержащей монооксигеназы повышаются во всех областях мозга у мышей с мутацией SOD1». Исследования нейротоксичности . 20 (2): 150–158. дои : 10.1007/s12640-010-9230-y . ПМИД 21082301 . S2CID 21856030 .
- Баттистини С., Риччи С., Лотти Э.М., Бениньи М., Гальярди С., Зукко Р. и др. (июнь 2010 г.). «Тяжелый семейный БАС с новой мутацией экзона 4 (L106F) в гене SOD1». Журнал неврологических наук . 293 (1–2): 112–115. дои : 10.1016/j.jns.2010.03.009 . ПМИД 20385392 . S2CID 24895265 .
112-115. дерьмо 1






















![2nnx: Crystal Structure of the H46R, H48Q double mutant of human [Cu-Zn] Superoxide Dismutase](http://upload.wikimedia.org/wikipedia/commons/thumb/5/5f/PDB_2nnx_EBI.png/180px-PDB_2nnx_EBI.png)