Аргинин
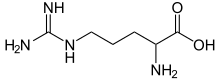 Скелетная формула аргинина | |||
| |||
| Имена | |||
|---|---|---|---|
| ИЮПАК имена Аргинин | |||
| Другие имена 2-амино-5-гуанидинопентановая кислота | |||
| Идентификаторы | |||
3D model ( JSmol ) | |||
| 3DMeet |
| ||
| 1725411, 1725412 Д , 1725413 Л | |||
| ЧЭБИ |
| ||
| ЧЕМБЛ |
| ||
| ХимическийПаук | |||
| Лекарственный Банк |
| ||
| Информационная карта ECHA | 100.000.738 | ||
| Номер ЕС |
| ||
| 364938 Д | |||
| |||
| КЕГГ |
| ||
| МеШ | Аргинин | ||
ПабХим CID | |||
| номер РТЭКС |
| ||
| НЕКОТОРЫЙ |
| ||
Панель управления CompTox ( EPA ) | |||
| Характеристики | |||
| С 6 Н 14 Н 4 О 2 | |||
| Молярная масса | 174.204 g·mol −1 | ||
| Появление | Белые кристаллы | ||
| Запах | Без запаха | ||
| Температура плавления | 260 °С; 500 °Ф; 533 К | ||
| Точка кипения | 368 ° С (694 ° F; 641 К) | ||
| 14,87 г/100 мл (20 °С) | |||
| Растворимость | слабо растворим в этаноле нерастворим в этиловом эфире | ||
| войти P | −1.652 | ||
| Кислотность ( pKa ) | 2,18 (карбоксил), 9,09 (амино), 13,8 (гуанидино) | ||
| Термохимия | |||
Теплоемкость ( С ) | 232,8 Дж.К. −1 моль −1 (при 23,7 °С) | ||
Стандартный моляр энтропия ( S ⦵ 298 ) | 250,6 Дж.К. −1 моль −1 | ||
Стандартная энтальпия образование (Δ f H ⦵ 298 ) | −624,9–−622,3 кДж моль −1 | ||
Стандартная энтальпия горение (Δ c H ⦵ 298 ) | −3,7396–−3,7370 МДж моль −1 | ||
| Фармакология | |||
| B05XB01 ( ВОЗ ) С | |||
| Опасности | |||
| СГС Маркировка : | |||
 | |||
| Предупреждение | |||
| H319 | |||
| П305+П351+П338 | |||
| Летальная доза или концентрация (LD, LC): | |||
ЛД 50 ( средняя доза ) | 5110 мг/кг (крыса, перорально) | ||
| Паспорт безопасности (SDS) | L-аргинин | ||
| Родственные соединения | |||
Родственные алкановые кислоты | |||
Родственные соединения | |||
| Страница дополнительных данных | |||
| Аргинин (страница данных) | |||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |||
Аргинин представляет собой аминокислоту с формулой (H 2 N)(HN)CN(H)(CH 2 ) 3 CH(NH 2 )CO 2 H. Молекула содержит гуанидиногруппу , присоединенную к стандартному аминокислотному каркасу. При физиологическом pH карбоновая кислота депротонируется (-CO 2 − ), и обе амино- и гуанидиногруппы протонируются, образуя катион. Только Энантиомер l- аргинина (обозначение Arg или R ) встречается в природе. [1] Остатки Arg являются обычными компонентами белков . Он кодируется кодонами CGU, CGC, CGA, CGG, AGA и AGG. [2] Гуанидиновая группа аргинина является предшественником биосинтеза оксида азота . [3] Как и все аминокислоты, это белое водорастворимое твердое вещество.
Однобуквенный символ R был присвоен аргинину из-за его фонетического сходства. [4]
История
[ редактировать ]Аргинин был впервые выделен в 1886 году из проростков желтого люпина немецким химиком Эрнстом Шульце и его помощником Эрнстом Штайгером. [5] [6] Он назвал его от греческого árgyros (ἄργυρος), что означает «серебро» из-за серебристо-белого цвета кристаллов нитрата аргинина. [7] В 1897 году Шульце и Эрнст Винтерштейн (1865–1949) определили структуру аргинина. [8] Шульце и Винтерштейн синтезировали аргинин из орнитина и цианамида в 1899 году. [9] но некоторые сомнения относительно структуры аргинина сохранялись. [10] до синтеза Соренсена в 1910 году. [11]
Источники
[ редактировать ]Производство
[ редактировать ]Его традиционно получают путем гидролиза различных дешевых источников белка, например желатина . [12] Его получают в промышленных масштабах путем ферментации. Таким образом можно получить 25-35 г/л, используя глюкозу в качестве источника углерода. [13]
Диетические источники
[ редактировать ]Аргинин классифицируется как полунезаменимая или условно незаменимая аминокислота , в зависимости от стадии развития и состояния здоровья человека. [14] Недоношенные дети не способны синтезировать аргинин внутри организма, что делает эту аминокислоту жизненно важной для них. [15] Большинству здоровых людей не требуется принимать аргинин, поскольку он входит в состав всех белковосодержащих продуктов. [16] и может синтезироваться в организме из глутамина через цитруллин . [17] [18] Кроме того, диетический аргинин необходим здоровым людям, временно находящимся в состоянии физиологического стресса, например, во время восстановления после ожогов, травм или сепсиса. [18] или если какое-либо из основных мест биосинтеза аргинина, тонкий кишечник и почки , имеют сниженную функцию, поскольку тонкий кишечник выполняет первый этап процесса синтеза, а почки - второй. [3]
Аргинин является незаменимой аминокислотой для птиц, так как у них нет цикла мочевины . [19] Для некоторых хищников, например кошек, собак [20] и хорькам аргинин необходим, [3] потому что после еды их высокоэффективный катаболизм белков производит большое количество аммиака , который необходимо переработать в цикле мочевины, и если аргинина недостаточно, результирующая токсичность аммиака может быть смертельной. [21] На практике это не проблема, поскольку мясо содержит достаточно аргинина, чтобы избежать такой ситуации. [21]
Животные источники аргинина включают мясо, молочные продукты и яйца. [22] [23] а растительные источники включают семена всех типов, например, зерновые, бобы и орехи. [23]
Биосинтез
[ редактировать ]Аргинин синтезируется из цитруллина в цикле мочевины путем последовательного действия цитозольных ферментов аргининосукцинатсинтетазы и аргининосукцинатлиазы . Это энергетически затратный процесс, поскольку на каждую молекулу аргининосукцината синтезируемую одна молекула аденозинтрифосфата (АТФ) гидролизуется до аденозинмонофосфата (АМФ), потребляя два эквивалента АТФ. [ нужна ссылка ]
Пути, связывающие аргинин, глутамин и пролин , двунаправлены. Таким образом, чистое использование или производство этих аминокислот сильно зависит от типа клеток и стадии развития. [ нужна ссылка ]

Аргинин вырабатывается организмом следующим образом. Эпителиальные клетки тонкой кишки вырабатывают цитруллин, в первую очередь из глутамина и глутамата , который секретируется в кровоток, который доставляет его к клеткам проксимальных канальцев почек , которые экстрагируют цитруллин и превращают его в аргинин, который возвращается в кровь. . Это означает, что нарушение функции тонкой кишки или почек может снизить синтез аргинина и, таким образом, создать диетическую потребность в аргинине. Для такого человека аргинин станет «необходимым».
Синтез аргинина из цитруллина также происходит на низком уровне во многих других клетках, и способность клеток к синтезу аргинина может заметно увеличиваться в условиях, которые увеличивают выработку индуцибельной синтазы оксида азота (NOS) . Это позволяет цитруллину, побочному продукту производства оксида азота, катализируемого NOS, перерабатываться в аргинин по пути, известному как путь цитруллин-оксид азота (цитруллин-NO) или путь аргинин-цитруллин. Об этом свидетельствует тот факт, что во многих типах клеток синтез оксида азота может в некоторой степени поддерживаться цитруллином, а не только аргинином. Однако эта рециркуляция не является количественной, поскольку цитруллин накапливается в клетках, продуцирующих оксид азота, вместе с нитратами и нитритами , стабильными конечными продуктами распада оксида азота. [24]
Функция
[ редактировать ]Аргинин играет важную роль в делении клеток , заживлении ран , удалении аммиака из организма, иммунной функции , [25] и выброс гормонов. [14] [26] [27] Является предшественником синтеза оксида азота (NO), [28] что делает его важным в регуляции артериального давления . [29] [30] Аргинин необходим для функционирования Т-клеток в организме и может привести к нарушению их регуляции, если он истощен. [31] [32]
Белки
[ редактировать ]Боковая цепь аргинина является амфипатической , поскольку при физиологическом pH она содержит положительно заряженную гуанидиниевую группу, которая является высокополярной, на конце гидрофобной алифатической углеводородной цепи. Поскольку глобулярные белки имеют гидрофобную внутреннюю часть и гидрофильную поверхность, [33] аргинин обычно находится снаружи белка, где гидрофильная головная группа может взаимодействовать с полярным окружением, например, принимая участие в образовании водородных связей и солевых мостиков. [34] По этой причине его часто обнаруживают на границе раздела двух белков. [35] Алифатическая часть боковой цепи иногда остается под поверхностью белка. [34]
Остатки аргинина в белках могут деиминироваться ферментами PAD с образованием цитруллина в процессе посттрансляционной модификации , называемом цитруллинированием . Это важно для развития плода, является частью нормального иммунного процесса, а также контроля экспрессии генов, но также важен при аутоиммунных заболеваниях . [36] Другая посттрансляционная модификация аргинина включает метилирование протеин- метилтрансферазами . [37]
Предшественник
[ редактировать ]Аргинин является непосредственным предшественником оксида азота, важной сигнальной молекулы, которая может действовать как вторичный мессенджер , а также как межклеточный мессенджер, регулирующий расширение сосудов, а также участвующий в реакции иммунной системы на инфекцию. [ нужна ссылка ]
Аргинин также является предшественником мочевины , орнитина и агматина ; необходим для синтеза креатина ; а также может быть использован для синтеза полиаминов (главным образом через орнитин и в меньшей степени через агматин, цитруллин и глутамат). Присутствие асимметричного диметиларгинина (АДМА), близкого родственника, ингибирует реакцию оксида азота; поэтому ADMA считается маркером сосудистых заболеваний , так же как L -аргинин считается признаком здорового эндотелия . [38]
Структура
[ редактировать ]
Аминокислотная аргинина боковая цепь состоит из 3-углеродной алифатической прямой цепи, дистальный конец которой закрыт гуанидиновой группой, имеющей p K a 13,8. [39] и поэтому всегда протонирован и положительно заряжен при физиологическом pH. Из-за сопряжения двойной связи с неподеленными парами азота положительный заряд делокализуется, что позволяет образовывать множественные водородные связи .
Исследовать
[ редактировать ]Гормон роста
[ редактировать ]Аргинин, вводимый внутривенно, используется в тестах на стимуляцию гормона роста. [40] потому что он стимулирует секрецию гормона роста . [41] Обзор клинических испытаний показал, что пероральный аргинин увеличивает выработку гормона роста, но снижает секрецию гормона роста, которая обычно связана с физическими упражнениями. [42] Однако более недавнее исследование показало, что, хотя пероральный аргинин повышал уровень L -аргинина в плазме, он не вызывал повышения уровня гормона роста. [43]
Вирус простого герпеса (герпес)
[ редактировать ]в клетках человека в аминокислотах, Исследования, проведенные в 1964 году по изучению потребностей вируса простого герпеса показали, что «...отсутствие аргинина или гистидина и, возможно, присутствие лизина заметно мешают синтезу вируса», но пришли к выводу, что «нет готового объяснения». доступны для любого из этих наблюдений». [44]
Дальнейшие обзоры приходят к выводу, что «эффективность лизина при губном герпесе может заключаться больше в профилактике, чем в лечении». и что «использование лизина для уменьшения тяжести или продолжительности вспышек» не поддерживается, хотя необходимы дальнейшие исследования. [45] Исследование 2017 года пришло к выводу, что «клиницисты могли бы рассмотреть возможность информирования пациентов о теоретической роли добавок лизина в профилактике язв простого герпеса, но научных данных недостаточно, чтобы подтвердить это. Пациентов с сердечно-сосудистыми заболеваниями или заболеваниями желчного пузыря следует предупреждать и предупреждать о теоретические риски». [46]
Повышенное артериальное давление
[ редактировать ]Мета-анализ показал, что L -аргинин снижает кровяное давление по совокупным оценкам 5,4 мм рт. ст. для систолического кровяного давления и 2,7 мм рт. ст. для диастолического кровяного давления. [47]
Дополнение с L -аргинин снижает диастолическое артериальное давление и продлевает беременность у женщин с гестационной гипертензией , включая женщин с повышенным артериальным давлением как часть преэклампсии . Он не снизил систолическое артериальное давление и не улучшил вес при рождении . [48]
Шизофрения
[ редактировать ]Как жидкостная хроматография, так и жидкостная хроматография/масс-спектрометрический анализ показали, что ткань мозга умерших людей с шизофренией демонстрирует измененный метаболизм аргинина. Анализы также подтвердили значительное снижение уровня γ-аминомасляной кислоты (ГАМК), но увеличение концентрации агматина и соотношения глутамат/ГАМК в случаях шизофрении. Регрессионный анализ показал положительную корреляцию между активностью аргиназы и возрастом начала заболевания, а также между уровнем L-орнитина и продолжительностью заболевания. Более того, кластерный анализ показал, что L-аргинин и его основные метаболиты L-цитруллин, L-орнитин и агматин образуют отдельные группы, которые были изменены в группе больных шизофренией. Несмотря на это, биологическая основа шизофрении до сих пор плохо изучена, ряд факторов, таких как гиперфункция дофамина, глутаматергическая гипофункция, ГАМКергический дефицит, дисфункция холинергической системы, уязвимость к стрессу и нарушения нервного развития, связаны с этиологией и/или патофизиологией шизофрении. болезнь. [49]
Феномен Рейно
[ редактировать ]Было показано, что пероральный L-аргинин обращает вспять некроз пальцев при синдроме Рейно. [50]
Безопасность и потенциальное лекарственное взаимодействие
[ редактировать ]L-аргинин признан безопасным (GRAS-статус) при приеме до 20 граммов в день. [51] L-аргинин содержится во многих продуктах, таких как рыба, птица и молочные продукты, и используется в качестве пищевой добавки. [52] Он может взаимодействовать с различными отпускаемыми по рецепту лекарствами и растительными добавками. [52]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ «Номенклатура и символика аминокислот и пептидов» . Совместная комиссия IUPAC-IUB по биохимической номенклатуре. 1983. Архивировано из оригинала 9 октября 2008 года . Проверено 5 марта 2018 г.
- ^ Совместная комиссия IUPAC-IUBMB по биохимической номенклатуре. «Номенклатура и символика аминокислот и пептидов» . Рекомендации по органической и биохимической номенклатуре, символам и терминологии и т. д . Архивировано из оригинала 29 мая 2007 года . Проверено 17 мая 2007 г.
- ^ Jump up to: а б с Игнарро ЖЖ (13 сентября 2000 г.). Оксид азота: биология и патобиология . Академическая пресса. п. 189. ИСБН 978-0-08-052503-7 .
- ^ «Комиссия IUPAC-IUB по биохимической номенклатуре. Однобуквенное обозначение аминокислотных последовательностей» . Журнал биологической химии . 243 (13): 3557–3559. 10 июля 1968 г. doi : 10.1016/S0021-9258(19)34176-6 .
- ^ Апель Ф (июль 2015 г.). «Биография фон Эрнста Шульце» (PDF) . Архивировано из оригинала (PDF) 17 ноября 2015 года . Проверено 6 ноября 2017 г.
- ^ Шульце Э., Штайгер Э (1887). « На аргинине». Журнал физиологической химии . 11 (1–2): 43–65.
- ^ «БИОЭТИМОЛОГИЯ: ПРОИСХОЖДЕНИЕ В БИОМЕДИЦИНСКИХ ТЕРМИНАХ: аргинин (Arg R)» . Проверено 25 июля 2019 г.
- ^ Шульце Э., Винтерштейн Э (сентябрь 1897 г.). «О продукте расщепления аргинина» . Отчеты Немецкого химического общества (на немецком языке). 30 (3): 2879–2882. дои : 10.1002/cber.18970300389 . Структура аргинина представлена на стр. 2882.
- ^ Шульце Э., Винтерштейн Э (октябрь 1899 г.). «О конституции аргинина» . Отчеты Немецкого химического общества (на немецком языке). 32 (3): 3191–3194. дои : 10.1002/cber.18990320385 .
- ^ Коэн Дж. Б. (1919). Органическая химия для продвинутых студентов, Часть 3 (2-е изд.). Нью-Йорк, Нью-Йорк, США: Longmans, Green & Co. 140.
- ^ Зельренсен С.П. (январь 1910 г.). О синтезе рацемического амино - δ- аргинина ( α - « гуанидо -н- валериановой кислоты) и изомерной α-гуанидо-δ-амино -н- валериановой кислоты». Отчеты Немецкого химического общества (на немецком языке). 43 (1): 643–651. дои : 10.1002/cber.191004301109 .
- ^ Бранд Э, Сандберг М (1932). «Д-аргинина гидрохлорид». Орг. Синтез . 12 :4. дои : 10.15227/orgsyn.012.0004 .
- ^ Драуз, Карлхайнц; Грейсон, Ян; Климанн, Аксель; и др. (2006). «Аминокислоты». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a02_057.pub2 . ISBN 978-3527306732 .
{{cite encyclopedia}}: Неизвестный параметр|name-list-format=проигнорировал(|name-list-style=предложил) ( помощь ) - ^ Jump up to: а б Тапьеро Х., Мате Г., Куврёр П., Тью К.Д. (ноябрь 2002 г.). «L-Аргинин». (обзор). Биомедицина и фармакотерапия . 56 (9): 439–445. дои : 10.1016/s0753-3322(02)00284-6 . ПМИД 12481980 .
- ^ Ву Джи, Джагер Л.А., Базер Ф.В., Роудс Дж.М. (август 2004 г.). «Дефицит аргинина у недоношенных детей: биохимические механизмы и последствия для питания» . (обзор). Журнал пищевой биохимии . 15 (8): 442–51. дои : 10.1016/j.jnutbio.2003.11.010 . ПМИД 15302078 .
- ^ «Лекарственные препараты и добавки аргинина» . Клиника Мэйо . Проверено 15 января 2015 г.
- ^ Шкипер А (1998). Справочник диетолога по энтеральному и парентеральному питанию . Джонс и Бартлетт Обучение. п. 76. ИСБН 978-0-8342-0920-6 .
- ^ Jump up to: а б Борласе BC (1994). Энтеральное питание . Джонс и Бартлетт Обучение. п. 48. ИСБН 978-0-412-98471-6 .
- ^ Фридленд Р.А., Бриггс С. (06 декабря 2012 г.). Биохимический подход к питанию . Springer Science & Business Media. п. 45. ИСБН 9789400957329 .
- ^ Потребность собак в питательных веществах . Пресса национальных академий. 1985. с. 65. ИСБН 978-0-309-03496-8 .
- ^ Jump up to: а б Вортингер А., Бернс К. (11 июня 2015 г.). Питание и управление заболеваниями для ветеринарных техников и медсестер . Джон Уайли и сыновья. п. 232. ИСБН 978-1-118-81108-5 .
- ^ Спано М.А., Краскал Л.Дж., Томас Д.Т. (30 августа 2017 г.). Питание для спорта, физических упражнений и здоровья . Кинетика человека. п. 240. ИСБН 978-1-4504-1487-6 .
- ^ Jump up to: а б Уотсон Р.Р., Зибади С. (28 ноября 2012 г.). Биоактивные пищевые факторы и растительные экстракты в дерматологии . Springer Science & Business Media. п. 75. ИСБН 978-1-62703-167-7 .
- ^ Моррис С.М. (октябрь 2004 г.). «Ферменты метаболизма аргинина» . (обзор). Журнал питания . 134 (10 Доп.): 2743S–2747S, обсуждение 2765S–2767S. дои : 10.1093/jn/134.10.2743S . PMID 15465778 .
- ^ Мауро С., Фрезза С. (13 июля 2015 г.). Метаболические проблемы иммунных клеток в здоровье и болезнях . Фронтирс Медиа С.А. п. 17. ISBN 9782889196227 .
- ^ Стехмиллер Дж. К., Чилдресс Б., Коуэн Л. (февраль 2005 г.). «Добавки аргинина и заживление ран». (обзор). Питание в клинической практике . 20 (1): 52–61. дои : 10.1177/011542650502000152 . ПМИД 16207646 .
- ^ Витте М.Б., Барбул А. (2003). «Физиология аргинина и его значение для заживления ран». (обзор). Заживление и регенерация ран . 11 (6): 419–23. дои : 10.1046/j.1524-475X.2003.11605.x . ПМИД 14617280 . S2CID 21239136 .
- ^ Эндрю П.Дж., Майер Б. (август 1999 г.). «Ферментативная функция синтаз оксида азота» . (обзор). Сердечно-сосудистые исследования . 43 (3): 521–31. дои : 10.1016/S0008-6363(99)00115-7 . ПМИД 10690324 .
- ^ Гекче Н. (октябрь 2004 г.). «L-аргинин и гипертония» . Журнал питания . 134 (10 дополнений): 2807S–2811S, обсуждение 2818S–2819S. дои : 10.1093/jn/134.10.2807S . PMID 15465790 .
- ^ Кибе Р., Курихара С., Сакаи Ю. и др. (2014). «Повышение уровня полиаминов в просвете толстой кишки, вырабатываемых кишечной микробиотой, задерживает старение у мышей» . Научные отчеты . 4 (4548): 4548. Бибкод : 2014NatSR...4E4548K . дои : 10.1038/srep04548 . ПМК 4070089 . ПМИД 24686447 .
- ^ Банерджи, Кастури; Чаттопадхьяй, Агнибха; Банерджи, Сатарупа (01 июля 2022 г.). «Понимание связи стволовых клеток с развитием плода и канцерогенезом во время беременности» . Достижения в области биологии рака: метастазы . 4 : 100042. doi : 10.1016/j.adcanc.2022.100042 . ISSN 2667-3940 . S2CID 248485831 .
- ^ Родригес, Пауло К.; Кичено, Дэвид Г.; Очоа, Аугусто К. (05 октября 2006 г.). «Наличие l-аргинина регулирует развитие клеточного цикла Т-лимфоцитов» . Кровь . 109 (4): 1568–1573. дои : 10.1182/blood-2006-06-031856 . ISSN 0006-4971 . ПМК 1794048 . ПМИД 17023580 .
- ^ Мэтьюз К.К., Ван Холде К.Э., Ахерн К.Г. (2000). Биохимия (3-е изд.). Сан-Франциско, Калифорния: Бенджамин Каммингс. стр. 180 . ISBN 978-0805330663 . OCLC 42290721 .
- ^ Jump up to: а б Барнс М.Р. (16 апреля 2007 г.). Биоинформатика для генетиков: учебник по биоинформатике для анализа генетических данных . Джон Уайли и сыновья. п. 326. ИСБН 9780470026199 .
- ^ Клеантхаус С (2000). Белково-белковое распознавание . Издательство Оксфордского университета. п. 13. ISBN 9780199637607 .
- ^ Гриффитс и Анвин, 2016 , с. 275.
- ^ Гриффитс и Анвин, 2016 , с. 176.
- ^ Гамбарделла Дж., Хондкар В., Морелли М.Б., Ван Х, Сантулли Дж., Тримарко В. (август 2020 г.). «Аргинин и эндотелиальная функция» . Биомедицины . 8 (8): 277. doi : 10.3390/biomedicines8080277 . ПМК 7460461 . ПМИД 32781796 .
- ^ Fitch CA, Platzer G, Okon M и др. (май 2015 г.). «Аргинин: новый взгляд на значение pKa» . Белковая наука . 24 (5): 752–61. дои : 10.1002/pro.2647 . ПМЦ 4420524 . ПМИД 25808204 .
- ^ Энциклопедия MedlinePlus : Тест на стимуляцию гормона роста
- ^ Альба-Рот Дж., Мюллер О.А., Шополь Дж., фон Вердер К. (декабрь 1988 г.). «Аргинин стимулирует секрецию гормона роста, подавляя секрецию эндогенного соматостатина». Журнал клинической эндокринологии и метаболизма . 67 (6): 1186–9. doi : 10.1210/jcem-67-6-1186 . ПМИД 2903866 . S2CID 7488757 .
- ^ Каналей Дж. А. (январь 2008 г.). «Гормон роста, аргинин и физические упражнения». Текущее мнение о клиническом питании и метаболической помощи . 11 (1): 50–4. дои : 10.1097/MCO.0b013e3282f2b0ad . ПМИД 18090659 . S2CID 22842434 .
- ^ Forbes SC, Bell GJ (июнь 2011 г.). «Острые эффекты перорального приема низких и высоких доз L-аргинина у молодых активных мужчин в состоянии покоя». Прикладная физиология, питание и обмен веществ . 36 (3): 405–11. дои : 10.1139/ч11-035 . ПМИД 21574873 .
- ^ Танкерсли RW (март 1964 г.). «Потребность в аминокислотах вируса простого герпеса в клетках человека» . Журнал бактериологии . 87 (3): 609–613. дои : 10.1128/jb.87.3.609-613.1964 . ПМК 277062 . ПМИД 14127578 .
- ^ Томблин Ф.А., Лукас К.Х. (февраль 2001 г.). «Лизин для лечения губного герпеса» . Американский журнал аптеки системы здравоохранения . 58 (4): 298–300, 304. doi : 10.1093/ajhp/58.4.298 . ПМИД 11225166 .
- ^ Майлоо В.Дж., Рампес С. (июнь 2017 г.). «Лизин для профилактики простого герпеса: обзор фактических данных» . Интегративная медицина . 16 (3): 42–46. ПМК 6419779 . ПМИД 30881246 .
- ^ Дун Цзюй, Цинь Л.К., Чжан Цз и др. (декабрь 2011 г.). «Влияние перорального приема L-аргинина на артериальное давление: метаанализ рандомизированных двойных слепых плацебо-контролируемых исследований». обзор. Американский кардиологический журнал . 162 (6): 959–65. дои : 10.1016/j.ahj.2011.09.012 . ПМИД 22137067 .
- ^ Гуй С., Цзя Дж., Ню С. и др. (март 2014 г.). «Добавка аргинина для улучшения материнских и неонатальных исходов при гипертоническом расстройстве беременности: систематический обзор» . (обзор). Журнал системы ренин-ангиотензин-альдостерон . 15 (1): 88–96. дои : 10.1177/1470320313475910 . ПМИД 23435582 .
- ^ Лю П., Цзин Ю., Колли Н.Д. и др. (август 2016 г.). «Измененный метаболизм аргинина в мозге при шизофрении» . Трансляционная психиатрия . 6 (8): е871. дои : 10.1038/tp.2016.144 . ПМК 5022089 . ПМИД 27529679 .
- ^ Рембольд, Кристофер М.; Айерс, Карлос Р. (февраль 2003 г.). «Пероральный L-аргинин может обратить вспять некроз пальцев при феномене Рейно» . Молекулярная и клеточная биохимия . 244 (1–2): 139–141. дои : 10.1023/А:1022422932108 . ISSN 0300-8177 . ПМИД 12701823 . S2CID 30249281 .
- ^ Шао А., Хэткок Дж. Н. (апрель 2008 г.). «Оценка риска для аминокислот таурина, L-глютамина и L-аргинина». Нормативная токсикология и фармакология . 50 (3): 376–99. дои : 10.1016/j.yrtph.2008.01.004 . ПМИД 18325648 .
- ^ Jump up to: а б «L-аргинин» . MedlinePlus, Национальные институты здравоохранения США. 13 октября 2021 г. Проверено 27 мая 2021 г.
Источники
[ редактировать ]- Гриффитс-младший, Анвин Р.Д. (2016). Анализ посттрансляционных модификаций белков методом масс-спектрометрии . Джон Уайли и сыновья. ISBN 978-1-119-25088-3 .