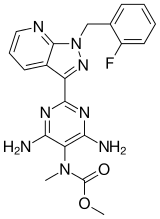
Риоцигуат
 | |
 | |
| Клинические данные | |
|---|---|
| Торговые названия | Дыхательный проход |
| Другие имена | ЗАЛИВ 63-2521 |
| AHFS / Drugs.com | Монография |
| Данные лицензии | |
| Беременность категория |
|
| Маршруты администрация | Через рот |
| код АТС | |
| Юридический статус | |
| Юридический статус |
|
| Фармакокинетические данные | |
| Биодоступность | 94% |
| Связывание с белками | 95% |
| Метаболизм | CYP1A1 , CYP3A4 , CYP2C8 , CYP2J2 |
| Метаболиты | N -десметилриоцигуат (активный), глюкуронид (неактивный) |
| Период полувыведения | 12 ч (пациенты); 7 ч (здоровые люди) [ 4 ] |
| Экскреция | 33–45% через почки , 48–59% через желчные протоки |
| Идентификаторы | |
| Номер CAS | |
| ИЮФАР/БПС | |
| Лекарственный Банк | |
| ХимическийПаук | |
| НЕКОТОРЫЙ | |
| КЕГГ | |
| КЭБ | |
| Панель управления CompTox ( EPA ) | |
| Информационная карта ECHA | 100.169.606 |
| Химические и физические данные | |
| Формула | С 20 Ч 19 Ф Н 8 О 2 |
| Молярная масса | 422.424 g·mol −1 |
| 3D model ( JSmol ) | |
| | |
Риоцигуат , продаваемый под торговой маркой Adempas , представляет собой препарат компании Bayer , который является стимулятором растворимой гуанилатциклазы (рГЦ). Его применяют для лечения двух форм легочной гипертензии (ЛГ): хронической тромбоэмболической легочной гипертензии (ХТЭЛГ) и легочной артериальной гипертензии (ЛАГ). Риоцигуат является первым препаратом класса стимуляторов рГЦ. [ 5 ] Период полувыведения препарата составляет 12 часов, он уменьшает одышку, связанную с легочной артериальной гипертензией.
Он доступен в виде непатентованного лекарства . [ 6 ]
Противопоказания
[ редактировать ]Риоцигуат может нанести вред плоду и поэтому противопоказан беременным женщинам. [ 4 ]
Вещество также противопоказано при легочной гипертензии в сочетании с идиопатической интерстициальной пневмонией (ПГ-ИИП). Клиническое исследование риоцигуата с этой целью было преждевременно прекращено, поскольку оно увеличивало серьезные побочные эффекты и смертность у пациентов с легочной гипертензией, вызванной идиопатической интерстициальной пневмонией, по сравнению с плацебо . [ 7 ]
Побочные эффекты
[ редактировать ]Серьезные побочные эффекты в клинических исследованиях включали кровотечение. Также наблюдались гипотония (пониженное кровяное давление), головная боль и желудочно-кишечные расстройства . [ 4 ]
Взаимодействия
[ редактировать ]Нитраты и ингибиторы фосфодиэстеразы (в том числе ингибиторы ФДЭ5 ) усиливают гипотензивный (снижающий артериальное давление) эффект риоцигуата. Поэтому сочетание таких препаратов противопоказано. Уровни риоцигуата в крови снижаются при курении табака и сильных индукторах печеночного фермента CYP3A4 и повышаются при применении сильных ингибиторов цитохрома . [ 4 ]
Химия и механизм действия
[ редактировать ]У здоровых людей оксид азота (NO) действует как сигнальная молекула на гладкомышечные клетки сосудов, вызывая расширение сосудов . NO связывается с растворимой гуанилатциклазой (рГЦ) и опосредует синтез вторичного мессенджера циклического гуанозинмонофосфата (цГМФ). sGC образует гетеродимеры , состоящие из более крупной альфа-субъединицы и меньшей бета-субъединицы, связывающей гем. Синтезированный цГМФ действует как вторичный мессенджер и активирует цГМФ-зависимую протеинкиназу (протеинкиназу G), регулируя цитозольную концентрацию ионов кальция . Это изменяет актина и миозина сократительную способность , что приводит к расширению сосудов. NO вырабатывается ферментом эндотелиальной синтетазой оксида азота ( eNOS ). У больных легочной артериальной гипертензией уровни eNOS снижены. Это приводит к общему снижению уровня NO, вырабатываемого эндотелиальными клетками, и снижению вазодилатации гладкомышечных клеток. NO также снижает рост гладкомышечных клеток легких и противодействует ингибированию тромбоцитов — фактору, который играет ключевую роль в патогенезе ЛАГ. [ 8 ] В отличие от NO- и гем-независимых активаторов рГЦ, таких как цинацигуат , стимулятор рГЦ риоцигуат напрямую стимулирует активность рГЦ, независимо от NO. [ 9 ] а также действует в синергии с NO, оказывая антиагрегационный, антипролиферативный и сосудорасширяющий эффекты. [ 10 ] [ 11 ]
Фармакология
[ редактировать ]Риоцигуат в концентрации от 0,1 до 100 мкМ дозозависимо стимулирует активность рГЦ до 73 раз. Кроме того, он действует синергически с диэтиламином/NO, донором NO, увеличивая активность рГЦ in vitro до 112 раз. [ 12 ] Исследование фазы I показало, что риоцигуат быстро всасывается, а максимальная концентрация в плазме достигается через 0,5–1,5 часа. [ 13 ] Средний период полувыведения составляет 5–10 часов. [ 13 ] Также было показано, что концентрации риоцигуата в плазме весьма различаются у разных пациентов, что указывает на то, что для клинического применения, вероятно, необходимо титровать препарат специально для каждого человека.
История
[ редактировать ]Открытие
[ редактировать ]Первый независимый от оксида азота (NO) и гем -зависимый стимулятор рГЦ, YC-1, синтетическое производное бензилиндазола , был описан в 1978 году. [ 14 ] Характеристика, проведенная 20 лет спустя, показала, что YC-1 не только увеличивает активность рГЦ, но и действует синергично с NO, стимулируя рГЦ. Однако YC-1 был относительно слабым сосудорасширяющим средством и имел побочные эффекты. [ нечеткий ] Поэтому начался поиск новых соединений индазола, которые были бы более мощными и более специфичными стимуляторами рГЦ. Результатом стала идентификация BAY 41-2272 и BAY 41–8543. [ 15 ] Оба соединения были протестированы в различных доклинических исследованиях на различных моделях животных и, по-видимому, улучшают системную артериальную оксигенацию. Для улучшения фармакологического и фармакокинетического профиля был проверен еще 1000 соединений, что привело к открытию риоцигуата. [ 9 ] [ 16 ] Риоцигуат был протестирован на моделях заболеваний мышей и крыс, где он эффективно снижал легочную гипертензию и обращал вспять связанную с ней гипертрофию правых отделов сердца и ремоделирование желудочков .
Для изучения и оценки различных аспектов риоцигуата было проведено несколько клинических испытаний, некоторые из них все еще продолжаются. [ 17 ]
Клинические испытания I фазы
[ редактировать ]Одно из первых исследований было направлено на проверку профиля безопасности, фармакокинетики и фармакодинамики однократных пероральных доз риоцигуата (0,25–5 мг). В ходе рандомизированного плацебо-контролируемого исследования 58 здоровых мужчин получали риоцигуат перорально (раствор для перорального применения или таблетки с немедленным высвобождением). Дозы риоцигуата повышали поэтапно, и риоцигуат хорошо переносился до 2,5 мг. [ 13 ]
Клинические исследования фазы II
[ редактировать ]Исследование , подтверждающее концепцию , о котором сообщил Центр легких Университета Гиссена , было первым небольшим исследованием (с участием 4 пациентов с ЛАГ) по изучению безопасности, переносимости, фармакокинетики и параметров эффективности. [ 10 ] Препарат хорошо переносился и превосходил NO по эффективности и продолжительности действия.
В открытом неконтролируемом исследовании II фазы риоцигуата у 75 взрослых пациентов (42 с ХТЭЛГ и 33 с ЛАГ, все из функционального класса II или III Всемирной организации здравоохранения (ВОЗ) оценивались безопасность и переносимость, а также влияние на гемодинамика, толерантность к физической нагрузке и функциональный класс. Риоцигуат давали три раза в день в течение 12 недель. Дозы титрулись с 2-недельными интервалами от 1,0 мг три раза в день до максимальной 2,5 мг три раза в день. Риоцигуат имел благоприятный профиль безопасности, а также значительно улучшал выносливость к физической нагрузке и параметры гемодинамики, такие как сопротивление легочных сосудов, сердечный выброс и давление в легочной артерии, по сравнению с исходными значениями. [ 18 ]
Кроме того, проводится II фаза исследования риоцигуата у пациентов с другими формами ЛГ, например, связанными с интерстициальным заболеванием легких (ПГ-ИЗЛ). [ 19 ]
Клинические исследования III фазы
[ редактировать ]Испытания III фазы риоцигуата представляют собой многоцентровые исследования. Программа исследования включала крупную рандомизированную двойную слепую плацебо-контролируемую фазу основного исследования (CHEST-1 и PATENT-1), а также открытые расширения этих исследований (CHEST-2 и PATENT-2). Подробности этих исследований опубликованы на сайте ClinicalTrials.gov , реестре исследований, который ведется Национальными институтами здравоохранения (NIH). [ 17 ]
ГРУДЬ
[ редактировать ]Исследование хронической тромбоэмболической при легочной гипертензии sGC -S стимулятора (CHEST) представляло собой рандомизированное плацебо-контролируемое исследование, направленное на анализ эффективности и безопасности риоцигуата у пациентов с ХТЭЛГ. [ 20 ] После 16-недельного лечения риоцигуатом способность пациента к физической нагрузке оценивалась путем измерения изменений в тесте шестиминутной ходьбы (6-MWT). [ 21 ] Пациентам, завершившим CHEST-1, было предложено принять участие в расширенном исследовании CHEST-2. Первый промежуточный анализ CHEST-2 показал, что риоцигуат хорошо переносится и имеет хороший долгосрочный профиль безопасности у пациентов с ХТЭЛГ. [ 22 ]
ПАТЕНТ
[ редактировать ]Исследование легочной (PATENT) представляло собой артериальной гипертензии . sGC-Stimulator Trial рандомизированное плацебо-контролируемое исследование, в котором изучалась эффективность и безопасность риоцигуата у пациентов с ЛАГ После 12-недельного лечения способность пациента к физической нагрузке оценивалась путем измерения изменения 6-MWT. [ 23 ] Пациентам, завершившим PATENT-1, было предложено принять участие в расширенном исследовании PATENT-2. [ 24 ] Первый промежуточный анализ PATENT-2 показал, что через год долгосрочного применения риоцигуат хорошо переносился пациентами с ЛАГ и демонстрировал устойчивые преимущества при 6MWD и ВОЗ FC. Профиль безопасности риоцигуата в ПАТЕНТ-2 был аналогичен профилю безопасности, наблюдаемому в ПАТЕНТ-1.
Другие исследования
[ редактировать ]Влияние риоцигуата на костный метаболизм
[ редактировать ]В этом рандомизированном двойном слепом плацебо-контролируемом исследовании фазы I изучалось влияние риоцигуата, принимаемого в виде таблеток с немедленным высвобождением (IR) по 2,5 мг два раза в день в течение 14 дней, на костный метаболизм. [ 25 ] Влияние на формирование костей наблюдалось у растущих, молодых и подростковых крыс. У молодых крыс изменения заключались в утолщении трабекулярной кости, гиперостозе и ремоделировании метафизарной и диафизарной кости, тогда как у крыс-подростков наблюдалось общее увеличение костной массы. С другой стороны, у взрослых крыс подобных эффектов не наблюдалось.
Исследование взаимодействия с силденафилом
[ редактировать ]В этом исследовании изучались безопасность, переносимость, фармакокинетика и влияние на легочную и системную гемодинамику однократных доз 0,5 и 1 мг риоцигуата у пациентов с ЛАГ и стабильного лечения силденафилом (20 мг трижды в день) в нерандомизированном неконтролируемом исследовании. [ 26 ] Исследование выявило потенциально неблагоприятные сигналы безопасности при применении силденафила в сочетании с риоцигуатом и не выявило доказательств положительного соотношения польза/риск. Поэтому одновременное применение риоцигуата с ингибиторами фосфодиэстеразы-5 противопоказано.
Ссылки
[ редактировать ]- ^ «Список всех лекарств с предупреждениями о черном ящике, полученный FDA (используйте ссылки «Загрузить полные результаты» и «Просмотреть запрос»).» . nctr-crs.fda.gov . FDA . Проверено 22 октября 2023 г.
- ^ «Лекарства, отпускаемые по рецепту: регистрация новых химических веществ в Австралии, 2014 г.» . Управление терапевтических товаров (TGA) . 21 июня 2022 г. Проверено 10 апреля 2023 г.
- ^ «Адемпас ЭПАР» . Европейское агентство лекарственных средств (EMA) . 20 декабря 2007 года . Проверено 10 августа 2024 г.
- ^ Jump up to: а б с д Риоцигуат Профессиональная информация о препарате FDA
- ^ «Фон Риоцигуат» . Байер ХелсКеа. Архивировано из оригинала 18 июля 2011 года . Проверено 15 декабря 2009 г.
- ^ «Первые одобрения генерических лекарств в 2022 году» . США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) . 3 марта 2023 года. Архивировано из оригинала 30 июня 2023 года . Проверено 30 июня 2023 г.
- ^ «Адемпас не применять у пациентов с легочной гипертензией, вызванной идиопатической интерстициальной пневмонией» . Европейское агентство по лекарственным средствам . 24 июня 2016 г.
- ^ Гиаид А., Салех Д. (июль 1995 г.). «Снижение экспрессии эндотелиальной синтазы оксида азота в легких пациентов с легочной гипертензией» . Медицинский журнал Новой Англии . 333 (4): 214–21. дои : 10.1056/NEJM199507273330403 . ПМИД 7540722 .
- ^ Jump up to: а б Евгенов О.В., Пахер П., Шмидт П.М., Хаско Г., Шмидт Х.Х., Сташ Дж.П. (сентябрь 2006 г.). «NO-независимые стимуляторы и активаторы растворимой гуанилатциклазы: открытие и терапевтический потенциал» . Обзоры природы. Открытие наркотиков . 5 (9): 755–68. дои : 10.1038/nrd2038 . ПМК 2225477 . ПМИД 16955067 .
- ^ Jump up to: а б Гриммингер Ф., Вейманн Г., Фрей Р., Восвинкель Р., Тамм М., Белков Д. и др. (апрель 2009 г.). «Первое острое гемодинамическое исследование растворимого стимулятора гуанилатциклазы риоцигуата при легочной гипертензии» . Европейский респираторный журнал . 33 (4): 785–92. дои : 10.1183/09031936.00039808 . ПМИД 19129292 .
{{cite journal}}: CS1 maint: переопределенная настройка ( ссылка ) - ^ Сташ Дж. П., Хоббс А. Дж. (2009). «NO-независимые, гем-зависимые стимуляторы растворимой гуанилатциклазы». CGMP: Генераторы, эффекторы и терапевтические последствия . Справочник по экспериментальной фармакологии. Том. 191. стр. 277–308. дои : 10.1007/978-3-540-68964-5_13 . ISBN 978-3-540-68960-7 . ПМИД 19089334 .
- ^ Шермули Р.Т., Сташ Дж.П., Пуламсетти С.С., Миддендорф Р., Мюллер Д., Шлютер К.Д. и др. (октябрь 2008 г.). «Экспрессия и функция растворимой гуанилатциклазы при легочной артериальной гипертензии» . Европейский респираторный журнал . 32 (4): 881–91. дои : 10.1183/09031936.00114407 . ПМИД 18550612 .
{{cite journal}}: CS1 maint: переопределенная настройка ( ссылка ) - ^ Jump up to: а б с Фрей Р., Мюк В., Унгер С., Артмайер-Брандт У., Вейманн Г., Венсинг Г. (декабрь 2008 г.). «Фармакокинетика, фармакодинамика, переносимость и безопасность растворимого активатора гуанилатциклазы цинацигуата (BAY 58-2667) у здоровых добровольцев мужского пола». Журнал клинической фармакологии . 48 (12): 1400–10. дои : 10.1177/0091270008322906 . ПМИД 18779378 . S2CID 206433961 .
- ^ Ёсина С., Танака А., Куо С.К. (март 1978 г.). "[Исследования гетероциклических соединений. XXXVI. Синтез производных фуро[3,2-с]пиразола. (4) Синтез 1,3-дифенилфуро[3,2-с]пиразол-5-карбоксальдегида и его производных (авторский перевод) )]" . Якугаку Дзасси (на японском языке). 98 (3): 272–9. дои : 10.1248/yakushi1947.98.3_272 . ПМИД 650406 .
- ^ Сташ Дж.П., Беккер Э.М., Алонсо-Алия С., Апелер Х., Дембовский К., Фойрер А. и др. (март 2001 г.). «NO-независимый регуляторный сайт растворимой гуанилатциклазы». Природа . 410 (6825): 212–5. Бибкод : 2001Natur.410..212S . дои : 10.1038/35065611 . ПМИД 11242081 . S2CID 4402074 .
{{cite journal}}: CS1 maint: переопределенная настройка ( ссылка ) - ^ Миттендорф Дж., Вейганд С., Алонсо-Алия С., Бишофф Е., Фойрер А., Гериш М. и др. (май 2009 г.). «Открытие риоцигуата (BAY 63-2521): мощного перорального стимулятора растворимой гуанилатциклазы для лечения легочной гипертензии» . ХимМедХим . 4 (5): 853–65. дои : 10.1002/cmdc.200900014 . ПМЦ 3313366 . ПМИД 19263460 .
{{cite journal}}: CS1 maint: переопределенная настройка ( ссылка ) - ^ Jump up to: а б ClinicalTrials.gov : Риоцигуат
- ^ «Международная конференция ATS» . Американское торакальное общество. 2009. Архивировано из оригинала 30 декабря 2009 года.
- ^ Номер клинического исследования NCT00694850 «Влияние нескольких доз BAY 63-2521 на безопасность, переносимость, фармакокинетику и фармакодинамику у пациентов с легочной гипертензией, связанной с интерстициальным заболеванием легких (ИЗЛ)» на сайте ClinicalTrials.gov.
- ^ Гофрани Х.А., Д'Армини А.М., Гриммингер Ф., Хопер М.М., Янса П., Ким Н.Х. и др. (июль 2013 г.). «Риоцигуат для лечения хронической тромбоэмболической легочной гипертензии» (PDF) . Медицинский журнал Новой Англии . 369 (4): 319–29. дои : 10.1056/NEJMoa1209657 . hdl : 10044/1/19669 . ПМИД 23883377 .
{{cite journal}}: CS1 maint: переопределенная настройка ( ссылка ) - ^ Номер клинического исследования NCT00855465 «Исследование по оценке эффективности и безопасности перорального применения BAY63-2521 у пациентов с CTEPH» на сайте ClinicalTrials.gov.
- ^ Номер клинического исследования NCT00910429 для «BAY63-2521 - Долгосрочное расширенное исследование у пациентов с хронической тромбоэмболической легочной гипертензией» на сайте ClinicalTrials.gov.
- ^ Номер клинического исследования NCT00810693 «Исследование по оценке эффективности и безопасности перорального приема BAY63-2521 у пациентов с легочной артериальной гипертензией (ЛАГ)» на сайте ClinicalTrials.gov.
- ^ Номер клинического исследования NCT00863681 для «BAY63-2521: Долгосрочное расширенное исследование у пациентов с легочной артериальной гипертензией» на сайте ClinicalTrials.gov.
- ^ Номер клинического исследования NCT00855660 «Влияние риоцигуата на костный метаболизм» на сайте ClinicalTrials.gov.
- ^ Номер клинического исследования NCT00680654 «Исследование взаимодействия у пациентов с легочной гипертензией и стабильным лечением силденафила в дозе 20 мг три раза в день» на сайте ClinicalTrials.gov.