Ингибитор ферментов

Ингибитор фермента – это молекула , которая связывается с ферментом и блокирует его активность . Ферменты — белки , ускоряющие химические реакции необходимые для жизни , в которых молекулы субстрата превращаются в продукты . [1] Фермент облегчает специфическую химическую реакцию, связывая субстрат с его активным центром , специализированной областью фермента, которая ускоряет наиболее трудную стадию реакции .
Ингибитор фермента останавливает («ингибирует») этот процесс либо путем связывания с активным центром фермента (таким образом предотвращая связывание самого субстрата), либо путем связывания с другим участком фермента, так что катализ реакции ферментом блокируется. Ингибиторы ферментов могут связываться обратимо или необратимо. Необратимые ингибиторы образуют химическую связь с ферментом, так что фермент ингибируется до тех пор, пока химическая связь не будет разорвана. Напротив, обратимые ингибиторы связываются нековалентно и могут спонтанно покинуть фермент, позволяя ферменту возобновить свою функцию. Обратимые ингибиторы вызывают различные типы ингибирования в зависимости от того, связываются ли они с ферментом, комплексом фермент-субстрат или с обоими.
Ингибиторы ферментов играют важную роль во всех клетках, поскольку они обычно специфичны для каждого фермента и служат для контроля активности этого фермента. Например, ферменты метаболического пути могут ингибироваться молекулами, образующимися на более поздних стадиях этого пути, тем самым ограничивая выработку молекул, которые больше не нужны. Этот тип отрицательной обратной связи является важным способом поддержания баланса в клетке . [2] Ингибиторы ферментов также контролируют основные ферменты, такие как протеазы или нуклеазы , которые, если их не остановить, могут повредить клетку. Многие яды , вырабатываемые животными и растениями, являются ингибиторами ферментов, которые блокируют активность важнейших ферментов у добычи или хищников .
Многие молекулы лекарств являются ингибиторами ферментов, которые ингибируют аберрантный человеческий фермент или фермент, критически важный для выживания патогена, такого как вирус , бактерия или паразит . Примеры включают метотрексат (используемый в химиотерапии и при лечении ревматического артрита ) и ингибиторы протеазы, используемые для лечения ВИЧ/СПИДа . Поскольку ингибиторы антипатогенов обычно нацелены только на один фермент, такие препараты высокоспецифичны и обычно вызывают мало побочных эффектов у людей, при условии, что аналогичного у людей не обнаружено фермента. (Это часто так, поскольку такие патогены и люди . генетически далеки ) Лекарственные ингибиторы ферментов часто имеют низкие константы диссоциации , а это означает, что для ингибирования фермента требуется лишь незначительное количество ингибитора. Низкая концентрация ингибитора фермента снижает риск поражения печени и почек и других побочных реакций на лекарственные препараты у человека. Следовательно, открытие и усовершенствование ингибиторов ферментов является активной областью исследований в биохимии и фармакологии. .
Структурные классы [ править ]
Ингибиторы ферментов представляют собой химически разнообразный набор веществ, размеры которых варьируются от органических небольших молекул до макромолекулярных белков .
Маломолекулярные ингибиторы включают основные первичные метаболиты , которые ингибируют вышестоящие ферменты, продуцирующие эти метаболиты. Это обеспечивает петлю отрицательной обратной связи, которая предотвращает чрезмерное производство метаболитов и, таким образом, поддерживает клеточный гомеостаз (постоянные внутренние условия). [3] [2] Низкомолекулярные ингибиторы ферментов также включают вторичные метаболиты , которые не являются существенными для организма, который их производит, но дают организму эволюционное преимущество, заключающееся в том, что их можно использовать для отпугивания хищников или конкурирующих организмов или для обездвиживания добычи. [4] Кроме того, многие лекарства представляют собой низкомолекулярные ингибиторы ферментов, которые воздействуют на ферменты, модифицирующие заболевание у пациента. [1] : 5 или ферменты патогенов, которые необходимы для роста и размножения патогена. [5]
Помимо небольших молекул, некоторые белки действуют как ингибиторы ферментов. Наиболее ярким примером являются серпины ( сериновая протеаза ингибиторах) , . в которые вырабатываются животными для защиты от нежелательной активации ферментов и растениями для предотвращения нападения хищников [6] Другой класс белков-ингибиторов — это ингибиторы рибонуклеаз , которые связываются с рибонуклеазами в одном из самых тесных известных межбелковых взаимодействий . [7] Особым случаем белковых ингибиторов ферментов являются зимогены , содержащие аутоингибирующий N-концевой пептид, который связывается с активным центром фермента и внутримолекулярно блокирует его активность в качестве защитного механизма против неконтролируемого катализа. N-концевой пептид отщепляется (отщепляется) от предшественника фермента зимогена другим ферментом с высвобождением активного фермента. [8]
Сайт связывания ингибиторов с ферментами чаще всего является тем же сайтом, который связывает субстрат фермента. Эти ингибиторы активного центра известны как ингибиторы ортостерической («регулярной» ориентации). [9] Механизм ортостерического ингибирования заключается просто в предотвращении связывания субстрата с ферментом посредством прямой конкуренции, что, в свою очередь, не позволяет ферменту катализировать превращение субстратов в продукты. Альтернативно, ингибитор может связываться с сайтом, удаленным от активного центра фермента. Они известны как аллостерические («альтернативной» ориентации) ингибиторы. [9] Механизмы аллостерического ингибирования разнообразны и включают изменение конформации (формы) фермента таким образом, что он больше не может связывать субстрат ( кинетически неотличим от конкурентного ортостерического ингибирования). [10] или, альтернативно, стабилизировать связывание субстрата с ферментом, но зафиксировать фермент в конформации, которая больше не является каталитически активной. [11]
ингибиторы Обратимые
Обратимые ингибиторы прикрепляются к ферментам с помощью нековалентных взаимодействий, таких как водородные связи , гидрофобные взаимодействия и ионные связи . [12] Множественные слабые связи между ингибитором и активным центром фермента объединяются, образуя прочное и специфическое связывание.
В отличие от необратимых ингибиторов, обратимые ингибиторы обычно не вступают в химические реакции при связывании с ферментом и могут быть легко удалены путем разведения или диализа . Особым случаем являются ковалентные обратимые ингибиторы , которые образуют химическую связь с ферментом, но эту связь можно расщепить, поэтому ингибирование становится полностью обратимым. [13]
Обратимые ингибиторы обычно делятся на четыре типа, предложенные Клеландом в 1963 году. [14] Их классифицируют в соответствии с влиянием ингибитора на V max (максимальную скорость реакции, катализируемой ферментом) и K m (концентрацию субстрата, приводящую к половине максимальной активности фермента), поскольку концентрация субстрата фермента варьируется. [15] [16]
Конкурсный [ править ]
При конкурентном ингибировании субстрат и ингибитор не могут связываться с ферментом одновременно. [17] : 134 Обычно это происходит из-за того, что ингибитор имеет сродство к активному центру фермента, с которым также связывается субстрат; субстрат и ингибитор конкурируют за доступ к активному центру фермента. Этот тип ингибирования можно преодолеть за счет достаточно высоких концентраций субстрата ( V max остается постоянным), т. е. вытесняя ингибитор. [17] : 134–135 Однако кажущаяся K m требуется более высокая концентрация субстрата будет увеличиваться, поскольку для достижения точки K m , или половина V max . Конкурентные ингибиторы часто схожи по структуре с реальным субстратом (см., например, рисунок «Метотрексат в сравнении с фолатом» в разделе «Лекарственные препараты» ). [17] : 134
Неконкурентоспособный [ править ]
При неконкурентном ингибировании ингибитор связывается только с фермент-субстратным комплексом. [17] : 139 Этот тип ингибирования приводит к уменьшению V max (максимальная скорость снижается в результате удаления активированного комплекса) и уменьшению K m (из-за лучшей эффективности связывания в результате принципа Ле Шателье и эффективного устранения ES-комплекса, что снижает K m, что указывает на более высокую аффинность связывания). [18] Неконкурентное ингибирование встречается редко. [17] : 139 [19]
Внеконкурентный [ править ]
При неконкурентном ингибировании связывание ингибитора с ферментом снижает его активность , но не влияет на связывание субстрата. [16] Этот тип ингибитора связывается с равным сродством как со свободным ферментом, так и с фермент-субстратным комплексом. Его можно рассматривать как обладающий способностью к конкурентным и неконкурентным ингибиторам, но без предпочтения какому-либо типу. В результате степень ингибирования зависит только от концентрации ингибитора. V max уменьшится из-за неспособности реакции протекать столь же эффективно, но K m останется прежним, поскольку фактическое связывание субстрата, по определению, все равно будет функционировать должным образом. [20]
Смешанный [ править ]
При смешанном ингибировании ингибитор может связываться с ферментом независимо от того, уже связался ли субстрат. Следовательно, смешанное ингибирование представляет собой комбинацию конкурентного и неконкурентного ингибирования. [16] Кроме того, сродство ингибитора к свободному ферменту и комплексу фермент-субстрат может различаться. [17] : 136–139 При увеличении концентрации субстрата [S] этот тип ингибирования можно уменьшить (за счет конкурентного вклада), но не преодолеть полностью (из-за неконкурентного компонента). [21] : 381–382 Хотя ингибиторы смешанного типа могут связываться в активном центре, этот тип ингибирования обычно является результатом аллостерического эффекта, когда ингибитор связывается с другим сайтом фермента. Связывание ингибитора с этим аллостерическим сайтом изменяет конформацию (то есть третичную структуру или трехмерную форму) фермента, так что сродство субстрата к активному центру снижается. [22]
Эти четыре типа ингибирования можно также отличить по влиянию увеличения концентрации субстрата [S] на степень ингибирования, вызываемого данным количеством ингибитора. При конкурентном ингибировании степень ингибирования снижается с увеличением [S], при неконкурентном ингибировании степень ингибирования не изменяется, а при неконкурентном (также называемом антиконкурентным) ингибировании степень ингибирования увеличивается с увеличением [S]. [23]
Количественное описание [ править ]
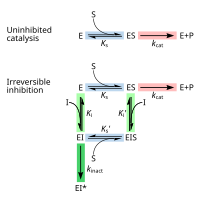
ингибитора Обратимое ингибирование можно описать количественно с точки зрения связывания с ферментом и комплексом фермент-субстрат, а также его влияния на кинетические константы фермента. [24] : 6 В классической схеме Михаэлиса-Ментена (показанной на схеме «механизма ингибирования») фермент (E) связывается со своим субстратом (S) с образованием фермент-субстратного комплекса ES. При катализе этот комплекс распадается с высвобождением продукта P и свободного фермента. [24] : 55 Ингибитор (I) может связываться либо с E, либо с ES с константами диссоциации K i или K i ' соответственно. [24] : 87
- Конкурентные ингибиторы могут связываться с E, но не с ES. Конкурентное ингибирование увеличивает K m (т.е. ингибитор препятствует связыванию субстрата), но не влияет на V max (ингибитор не препятствует катализу в ES, поскольку не может связываться с ES). [24] : 102
- Неконкурентные ингибиторы связываются с ES. Неконкурентное ингибирование снижает как Km , и Vmax так . Ингибитор влияет на связывание субстрата, увеличивая сродство фермента к субстрату (уменьшая K m ), а также препятствуя катализу (уменьшая V max ). [24] : 106
- Неконкурентные ингибиторы имеют одинаковое сродство к Е и ES ( K i = Ki ' ). Неконкурентное ингибирование не изменяет K m (т. е. не влияет на связывание субстрата), но уменьшает V max (т. е. связывание ингибитора затрудняет катализ). [24] : 97
- Ингибиторы смешанного типа связываются как с Е, так и с ES, но их сродство к этим двум формам фермента различно ( K i ≠ K i '). Таким образом, ингибиторы смешанного типа влияют на связывание субстрата (увеличивают или уменьшают K m ) и затрудняют катализ в комплексе ES (снижают V max ). [25] : 63–64
Когда фермент имеет несколько субстратов, ингибиторы могут проявлять разные типы ингибирования в зависимости от того, какой субстрат рассматривается. Это происходит из-за того, что активный сайт содержит два разных сайта связывания внутри активного сайта, по одному для каждого субстрата. Например, ингибитор может конкурировать с субстратом А за первый сайт связывания, но быть неконкурентным ингибитором по отношению к субстрату В во втором сайте связывания. [26]
Традиционно обратимые ингибиторы ферментов классифицируются как конкурентные, неконкурентные и неконкурентные в зависимости от их влияния на K m и V max . [14] Эти три типа ингибирования возникают соответственно в результате связывания ингибитора только с ферментом Е в отсутствие субстрата S, с фермент-субстратным комплексом ES или с обоими. Разделение этих классов возникает из-за проблемы их создания и приводит к необходимости использовать две разные константы привязки для одного события привязки. [27] Далее предполагается, что связывание ингибитора с ферментом приводит к 100% ингибированию, и не учитывается возможность частичного ингибирования. [27] Общая форма ингибирующего термина также скрывает взаимосвязь между связыванием ингибитора с ферментом и его связью с любым другим связывающим термином, будь то уравнение Михаэлиса-Ментен или кривая доза-эффект, связанная со связыванием лиганда с рецептором. Чтобы продемонстрировать взаимосвязь, можно провести следующую перестановку: [28]
Эта перегруппировка демонстрирует, что, как и в уравнении Михаэлиса-Ментен, максимальная скорость реакции зависит от доли популяции фермента, взаимодействующей с его субстратом.
доля популяции ферментов, связанная с субстратом
доля популяции ферментов, связанная ингибитором
Эффект ингибитора зависит от процента популяции ферментов, взаимодействующих с ингибитором. Единственная проблема с этим уравнением в его нынешней форме заключается в том, что оно предполагает абсолютное ингибирование фермента при связывании ингибитора, хотя на самом деле может быть широкий диапазон эффектов от 100% ингибирования обмена субстрата до отсутствия ингибирования. Чтобы учесть это, уравнение можно легко изменить, чтобы учесть различные степени ингибирования, включив в него член дельта V max . [29] : 361
или
Этот термин затем может определять остаточную ферментативную активность, присутствующую, когда ингибитор взаимодействует с отдельными ферментами в популяции. Однако включение этого термина имеет дополнительную ценность, поскольку допускает возможность активации, если вторичный член V max окажется выше начального. Чтобы учесть возможность активации, обозначения можно затем переписать, заменив ингибитор «I» термином-модификатором (стимулятор или ингибитор), обозначенным здесь как «X». [28] : уравнение 13
Хотя эта терминология приводит к упрощенному способу рассмотрения кинетических эффектов, связанных с максимальной скоростью уравнения Михаэлиса-Ментен, она выдвигает на первый план потенциальные проблемы с термином, используемым для описания эффектов, связанных с K m . K относящийся m, к сродству фермента к субстрату, в большинстве случаев должен относиться к потенциальным изменениям в сайте связывания фермента, которые могут быть непосредственно результатом взаимодействия ингибитора фермента. Таким образом, термин, аналогичный термину delta V max , предложенному выше для модуляции V max, должен быть подходящим в большинстве ситуаций: [28] : уравнение 14
Константы диссоциации [ править ]
![Двумерные графики концентрации 1/[S] (ось x) и 1/V (ось y), демонстрирующие, что при изменении концентрации ингибитора линии конкурентных ингибиторов пересекаются в одной точке на оси y, а неконкурентные ингибиторы пересекаются. по оси X, а смешанные ингибиторы пересекают точку, которая не находится ни на одной из осей.](http://upload.wikimedia.org/wikipedia/commons/thumb/b/ba/Inhibition_diagrams-1-.png/220px-Inhibition_diagrams-1-.png)
Ингибитор фермента характеризуется константой диссоциации K i , концентрацией, при которой ингибитор наполовину занимает фермент. При неконкурентном ингибировании ингибитор также может связываться с комплексом фермент-субстрат, и присутствие связанного субстрата может изменить сродство ингибитора к ферменту, что приводит к появлению второй константы диссоциации K i '. Следовательно, i и Ki ' K — константы диссоциации ингибитора фермента и фермент-субстратного комплекса соответственно. [30] : Глоссарий Константу фермента-ингибитора K i можно измерить непосредственно различными методами; Одним из особенно точных методов является изотермическая титровальная калориметрия , при которой ингибитор титруется раствором фермента и измеряется выделяемое или поглощаемое тепло. [31] Однако другую константу диссоциации K i ' трудно измерить напрямую, поскольку комплекс фермент-субстрат недолговечен и вступает в химическую реакцию с образованием продукта. Следовательно, K i ' обычно измеряется косвенно, путем наблюдения за активностью фермента при различных концентрациях субстрата и ингибитора и аппроксимации данных с помощью нелинейной регрессии. [32] к модифицированному уравнению Михаэлиса–Ментен . [21]
где модифицирующие факторы α и α’ определяются концентрацией ингибитора и двумя его константами диссоциации.
Таким образом, в присутствии ингибитора эффективные K m и V max фермента становятся (α/α') K m и (1/α') V max соответственно. Однако модифицированное уравнение Михаэлиса-Ментен предполагает, что связывание ингибитора с ферментом достигло равновесия, что может быть очень медленным процессом для ингибиторов с субнаномолярными константами диссоциации. В этих случаях ингибирование становится фактически необратимым, поэтому более практично рассматривать такие ингибиторы с сильным связыванием как необратимые (см. Ниже ).
Влияние различных типов обратимых ингибиторов ферментов на ферментативную активность можно визуализировать с помощью графических представлений уравнения Михаэлиса-Ментен, таких как графики Лайнуивера-Берка , Иди-Хофсти или Хейнса-Вульфа . [17] : 140–144 Иллюстрацией служат три графика Лайнуивера-Бёрка, изображенные на рисунке диаграмм Лайнуивера-Бёрка . На верхней диаграмме линии конкурентного ингибирования пересекаются по оси y , показывая, что такие ингибиторы не влияют на V max . На нижней диаграмме линии неконкурентного ингибирования пересекаются по оси x , показывая, что эти ингибиторы не влияют на K m . может быть трудно точно оценить K i и K i ', Однако, поскольку по таким графикам [33] эти константы целесообразно оценивать с помощью более надежных методов нелинейной регрессии. [33]
Особые случаи [ править ]
Частично конкурентный [ править ]
Механизм частично конкурентного ингибирования аналогичен механизму неконкурентного, за исключением того, что комплекс ЭИС обладает каталитической активностью, которая может быть ниже или даже выше (частично конкурентная активация), чем у фермент-субстратного (ЭС) комплекса. Это ингибирование обычно демонстрирует более низкое значение V max , но неизменяемое значение K m . [18]
Субстрат или продукт [ править ]
Ингибирование субстрата или продукта – это когда субстрат или продукт фермента также действуют как ингибитор. Это ингибирование может иметь конкурентный, неконкурентный или смешанный характер. При ингибировании субстрата происходит прогрессивное снижение активности при высоких концентрациях субстрата, возможно, из-за фермента, имеющего два конкурирующих сайта связывания субстрата. При низком уровне субстрата сайт с высоким сродством занят и нормальная кинетика наблюдается . Однако при более высоких концентрациях второй ингибирующий сайт оказывается занятым, ингибируя фермент. [34] Ингибирование продукта (либо собственного продукта фермента, либо продукта фермента, находящегося ниже по ходу его метаболического пути) часто является регуляторной особенностью метаболизма и может быть формой отрицательной обратной связи . [2]
Медленно-плотно [ править ]
Медленно-сильное ингибирование происходит, когда исходный комплекс фермент-ингибитор EI подвергается конформационной изомерии (изменению формы) со вторым, более прочно удерживаемым комплексом, EI*, но общий процесс ингибирования обратим. Это проявляется в медленно нарастающем ингибировании ферментов. В этих условиях традиционная кинетика Михаэлиса-Ментен дает ложное значение K i , которое зависит от времени. Истинное значение K i можно получить путем более сложного анализа констант скорости включения ( k on ) и выключения ( k off ) ассоциации ингибитора с кинетикой, аналогичной необратимому ингибированию . [17] : 168
Мультисубстратные аналоги [ править ]
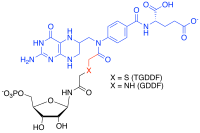
Мультисубстратные аналоговые ингибиторы представляют собой селективные ингибиторы с высоким сродством, которые можно получить для ферментов, которые катализируют реакции с более чем одним субстратом, улавливая энергию связи каждого из этих субстратов в одну молекулу. [35] [36] Например, в реакциях переноса формила при биосинтезе пуринов мощный мультисубстратный ингибитор аддукта (MAI) к глицинамидрибонуклеотидной (GAR) ТФазе был получен синтетически путем соединения аналогов субстрата GAR и кофактора N-10-формилтетрагидрофолата вместе с продуцировать тиоглицинамидрибонуклеотиддидеазафолат (TGDDF), [37] или ферментативно из природного субстрата GAR с получением GDDF. [38] Здесь субнаномолярная константа диссоциации (KD) TGDDF была больше, чем прогнозировалось, предположительно из-за полученных энтропийных преимуществ и/или положительных взаимодействий, приобретенных через атомы, связывающие компоненты. Также наблюдалось, что MAI производятся в клетках в результате реакций пролекарств, таких как изониазид. [39] или лиганды-ингибиторы ферментов (например, PTC124 ) [40] с клеточными кофакторами, такими как никотинамидадениндинуклеотид (НАДН) и аденозинтрифосфат (АТФ) соответственно. [41]
Примеры [ править ]
Поскольку ферменты научились прочно связывать свои субстраты, а большинство обратимых ингибиторов связываются в активном центре ферментов, неудивительно, что некоторые из этих ингибиторов поразительно похожи по структуре на субстраты своих мишеней. Яркими примерами являются ингибиторы дигидрофолатредуктазы (DHFR). [42] Другими примерами подобных субстратов являются ингибиторы протеазы , терапевтически эффективный класс антиретровирусных препаратов, используемых для лечения ВИЧ/СПИДа . [43] [44] Структура ритонавира , пептидомиметического (пептидомимического) ингибитора протеазы, содержащего три пептидные связи , как показано на рисунке «конкурентного ингибирования» выше. Поскольку этот препарат напоминает пептид, который является субстратом протеазы ВИЧ, он конкурирует с субстратом в активном центре фермента. [45]
Ингибиторы ферментов часто разрабатываются для имитации переходного состояния или промежуточного продукта реакции, катализируемой ферментом. [46] Это гарантирует, что ингибитор использует эффект стабилизации переходного состояния фермента, что приводит к лучшему сродству связывания (более низкому K i ), чем конструкции на основе субстрата. Примером такого ингибитора переходного состояния является противовирусный препарат осельтамивир ; этот препарат имитирует планарную природу кольцевого иона оксония в реакции вирусного фермента нейраминидазы . [47]
Однако не все ингибиторы основаны на структурах субстратов. Например, структура другого ингибитора протеазы ВИЧ, типранавира, не основана на пептиде и не имеет явного структурного сходства с белковым субстратом. Эти непептидные ингибиторы могут быть более стабильными, чем ингибиторы, содержащие пептидные связи, поскольку они не являются субстратами для пептидаз и с меньшей вероятностью подвергаются деградации. [48]
При разработке лекарств важно учитывать концентрации субстратов, воздействию которых подвергаются целевые ферменты. Например, некоторые ингибиторы протеинкиназ имеют химическую структуру, подобную АТФ, одному из субстратов этих ферментов. [49] Однако лекарствам, которые являются простыми конкурентными ингибиторами, придется конкурировать с высокими концентрациями АТФ в клетке. Протеинкиназы также могут ингибироваться за счет конкуренции в местах связывания, где киназы взаимодействуют с белками-субстратами, и большинство белков присутствуют внутри клеток в концентрациях, намного меньших, чем концентрация АТФ. Как следствие, если два ингибитора протеинкиназы связываются в активном центре с одинаковым сродством, но только один должен конкурировать с АТФ, то конкурентный ингибитор в сайте связывания белка будет более эффективно ингибировать фермент. [50]
Необратимые ингибиторы [ править ]
Типы [ править ]
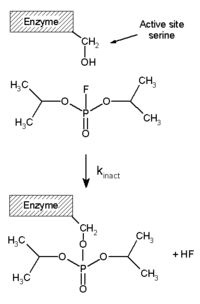
Необратимые ингибиторы ковалентно связываются с ферментом, и поэтому этот тип ингибирования не может быть легко обращен вспять. [51] Необратимые ингибиторы часто содержат реакционноспособные функциональные группы, такие как азотистые иприты , альдегиды , галогеналканы , алкены , акцепторы Михаэля , фенилсульфонаты или фторфосфонаты . [52] Эти электрофильные группы реагируют с боковыми цепями аминокислот с образованием ковалентных аддуктов . [51] Модифицированные остатки представляют собой остатки, боковые цепи которых содержат нуклеофилы, такие как гидроксильные или сульфгидрильные группы; к ним относятся аминокислоты серин (который реагирует с ДФП , см. схему «Реакция ДФП»), а также цистеин , треонин или тирозин . [53]
Необратимое ингибирование отличается от необратимой инактивации ферментов. [54] Необратимые ингибиторы обычно специфичны для одного класса ферментов и не инактивируют все белки; они действуют не путем разрушения структуры белка , а путем специфического изменения активного центра своей мишени. Например, экстремальные значения pH или температуры обычно вызывают денатурацию всей структуры белка, но это неспецифический эффект. Точно так же некоторые неспецифические химические обработки разрушают структуру белка: например, нагревание в концентрированной соляной кислоте гидролизует пептидные связи, удерживающие белки вместе, высвобождая свободные аминокислоты. [55]
Необратимые ингибиторы обладают ингибированием, зависящим от времени, и поэтому их эффективность не может быть охарактеризована значением IC 50 . Это связано с тем, что количество активного фермента при данной концентрации необратимого ингибитора будет различным в зависимости от того, как долго ингибитор предварительно инкубируется с ферментом. Вместо этого k obs /[ I ], используются значения [56] где k obs — наблюдаемая скорость инактивации псевдопервого порядка (полученная путем построения логарифма % активности в зависимости от времени), а [ I ] — концентрация ингибитора. Параметр k obs /[ I ] действителен до тех пор, пока ингибитор не насыщает связывание с ферментом (в этом случае k obs = k inact ), где k inact — скорость инактивации.
Измерение [ править ]
Необратимые ингибиторы сначала образуют обратимый нековалентный комплекс с ферментом (EI или ESI). Впоследствии между ферментом и ингибитором происходит химическая реакция с образованием ковалентно модифицированного «тупикового комплекса» EI* (необратимого ковалентного комплекса). Скорость образования ЭИ* называется скоростью инактивации или k инакт . [13] Поскольку образование ЭИ может конкурировать с ЭС, связывание необратимых ингибиторов можно предотвратить путем конкуренции либо с субстратом, либо со вторым обратимым ингибитором. Этот защитный эффект является убедительным свидетельством специфической реакции необратимого ингибитора с активным центром.
Стадии связывания и инактивации этой реакции исследуются путем инкубации фермента с ингибитором и анализа степени активности, остающейся с течением времени. Активность будет снижаться в зависимости от времени, обычно после экспоненциального затухания . Сопоставление этих данных с уравнением скорости дает скорость инактивации при этой концентрации ингибитора. Это делается при нескольких различных концентрациях ингибитора. скорость инактивации будет насыщаемой, и подгонка этой кривой даст k inact и Ki Если задействован обратимый комплекс EI , . [57]
Другой метод, широко используемый в этих анализах, — масс-спектрометрия . Здесь точное измерение массы немодифицированного нативного фермента и инактивированного фермента дает увеличение массы, вызванное реакцией с ингибитором, и показывает стехиометрию реакции. [58] Обычно это делается с помощью масс-спектрометра MALDI-TOF . [59] В дополнительном методе массовый фингерпринтинг пептидов включает переваривание нативного и модифицированного белка протеазой, такой как трипсин . В результате будет получен набор пептидов , которые можно будет проанализировать с помощью масс-спектрометра. Пептид, масса которого изменится после реакции с ингибитором, будет тем пептидом, который содержит сайт модификации. [60]
Медленное связывание [ править ]
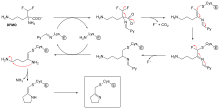
Не все необратимые ингибиторы образуют ковалентные аддукты со своими ферментами-мишенями. Некоторые обратимые ингибиторы настолько прочно связываются с ферментом-мишенью, что практически необратимы. Эти ингибиторы с сильным связыванием могут демонстрировать кинетику, аналогичную кинетике ковалентных необратимых ингибиторов. В этих случаях некоторые из этих ингибиторов быстро связываются с ферментом в виде комплекса EI с низким сродством, который затем подвергается более медленной перегруппировке в очень прочно связанный комплекс EI* (см. диаграмму «механизма необратимого ингибирования»). Такое кинетическое поведение называется медленным связыванием. [62] Эта медленная перегруппировка после связывания часто включает в себя конформационные изменения , когда фермент «сжимается» вокруг молекулы ингибитора. Примеры ингибиторов медленного связывания включают некоторые важные препараты, такие как метотрексат , [63] аллопуринол , [64] и активированная форма ацикловира . [65]
Несколько примеров [ править ]

Диизопропилфторфосфат (ДФП) является примером необратимого ингибитора протеаз (см. схему «Реакция ДФП»). Фермент гидролизует связь фосфор-фтор, но фосфатный остаток остается связанным с серином в активном центре , дезактивируя его. [67] Аналогичным образом, ДФП также реагирует с активным центром ацетилхолинэстеразы в синапсах нейронов и, следовательно, является мощным нейротоксином со смертельной дозой менее 100 мг. [68]
Суицидное торможение — это необычный тип необратимого торможения, при котором фермент превращает ингибитор в активную форму в его активном центре. [69] Примером может служить ингибитор полиаминов биосинтеза α-дифторметилорнитин (ДФМО), который является аналогом аминокислоты орнитина и применяется для лечения африканского трипаносомоза (сонной болезни). Орнитиндекарбоксилаза может катализировать декарбоксилирование ДФМО вместо орнитина (см. Диаграмму «Механизм ингибитора ДФМО»). Однако за этой реакцией декарбоксилирования следует отщепление атома фтора, что превращает этот каталитический промежуточный продукт в конъюгированный имин , высокоэлектрофильный вид. Эта реактивная форма DFMO затем реагирует либо с остатком цистеина, либо с лизином в активном центре, необратимо инактивируя фермент. [61]
Поскольку необратимое ингибирование часто включает первоначальное образование комплекса нековалентного ингибитора фермента (ЭИ), [13] иногда ингибитор может связываться с ферментом более чем одним способом. Например, на рисунке, показывающем трипанотионредуктазу простейшего человеческого паразита Trypanosoma cruzi две молекулы ингибитора, называемого хинакриновым ипритом , в ее активном центре связаны . Верхняя молекула связана обратимо, а нижняя — ковалентно, поскольку она прореагировала с аминокислотным остатком через свою азотистую ипритную группу. [70]
Приложения [ править ]
Ингибиторы ферментов встречаются в природе. [71] а также производятся искусственно в лаборатории. [72] Природные ингибиторы ферментов регулируют многие метаболические процессы и необходимы для жизни. [3] [1] Кроме того, яды естественного происхождения часто представляют собой ингибиторы ферментов, которые были разработаны для использования в качестве токсичных агентов против хищников, добычи и конкурирующих организмов. [4] Эти природные токсины включают в себя некоторые из наиболее ядовитых известных веществ. [73] Искусственные ингибиторы часто используются в качестве лекарств, но также могут представлять собой инсектициды, такие как малатион , гербициды, такие как глифосат , [74] или дезинфицирующие средства, такие как триклозан . Другие искусственные ингибиторы ферментов блокируют ацетилхолинэстеразу , фермент, расщепляющий ацетилхолин , и используются в качестве нервно-паралитических агентов в химической войне . [75]
регуляция Метаболическая
Ингибирование ферментов является общей особенностью контроля метаболических путей в клетках. [3] Метаболический поток через путь часто регулируется метаболитами этого пути , действующими как ингибиторы и усилители ферментов этого же пути. Гликолитический путь является классическим примером. [76] Этот катаболический путь потребляет глюкозу и производит АТФ , НАДН и пируват . Ключевым этапом регуляции гликолиза является ранняя реакция пути, катализируемая фосфофруктокиназой-1 (PFK1). Когда уровень АТФ повышается, АТФ связывается с аллостерическим сайтом в PFK1, снижая скорость ферментативной реакции; гликолиз ингибируется и выработка АТФ падает. Этот контроль отрицательной обратной связи помогает поддерживать постоянную концентрацию АТФ в клетке. Однако метаболические пути регулируются не только посредством ингибирования, поскольку не менее важна активация ферментов. Что касается PFK1, фруктозо-2,6-бисфосфат и АДФ являются примерами метаболитов, которые являются аллостерическими активаторами. [77]
Физиологическое ингибирование ферментов также может быть вызвано специфическими белковыми ингибиторами. Этот механизм происходит в поджелудочной железе , которая синтезирует множество пищеварительных ферментов-предшественников, известных как зимогены . Многие из них активируются протеазой трипсина , поэтому важно ингибировать активность трипсина в поджелудочной железе, чтобы предотвратить самопереваривание органа. Одним из способов контроля активности трипсина является выработка специфического и мощного белка- ингибитора трипсина в поджелудочной железе. Этот ингибитор прочно связывается с трипсином, предотвращая активность трипсина, которая в противном случае была бы вредна для органа. [78] Хотя ингибитор трипсина представляет собой белок, он избегает гидролиза протеазой в качестве субстрата за счет исключения воды из активного центра трипсина и дестабилизации переходного состояния. [79] Другие примеры физиологических белков-ингибиторов ферментов включают барстар- ингибитор бактериальной рибонуклеазы барназы . [80]
Природные яды [ править ]

Животные и растения научились синтезировать огромное количество ядовитых продуктов, включая вторичные метаболиты . [81] пептиды и белки [82] которые могут действовать как ингибиторы. Природные токсины обычно представляют собой небольшие органические молекулы и настолько разнообразны, что, вероятно, существуют естественные ингибиторы большинства метаболических процессов. [83] Метаболические процессы, на которые воздействуют природные яды, охватывают не только ферменты метаболических путей, но и могут включать ингибирование функций рецепторов, каналов и структурных белков в клетке. Например, паклитаксел (таксол), органическая молекула, обнаруженная в тихоокеанском тисе , прочно связывается с тубулина димерами и ингибирует их сборку в микротрубочки в цитоскелете . [84]
Многие природные яды действуют как нейротоксины , которые могут вызывать паралич, приводящий к смерти, и действуют для защиты от хищников или при охоте и поимке добычи. Некоторые из этих природных ингибиторов, [85] несмотря на свои токсичные свойства, они ценны для терапевтического применения в более низких дозах. [86] Примером нейротоксина являются гликоалкалоиды растений семейства Пасленовые (включая картофель , томаты и баклажаны ), которые являются ингибиторами ацетилхолинэстеразы . Ингибирование этого фермента вызывает неконтролируемое увеличение уровня нейротрансмиттера ацетилхолина, мышечный паралич и затем смерть. Нейротоксичность также может быть результатом ингибирования рецепторов; например, атропин из паслена смертоносного ( Atropa belladonna ), который действует как конкурентный антагонист мускариновых рецепторов ацетилхолина . [87]
Хотя многие природные токсины являются вторичными метаболитами, к этим ядам также относятся пептиды и белки. Примером токсичного пептида является альфа-аманитин , который встречается у родственников смертного гриба. Это мощный ингибитор ферментов, в данном случае предотвращающий РНК-полимеразы II . транскрипцию ДНК ферментом [88] Водорослевой токсин микроцистин также является пептидом и является ингибитором протеинфосфатаз . [89] Этот токсин может загрязнять источники воды после цветения водорослей и является известным канцерогеном, который также может вызвать острое кровотечение в печени и смерть при более высоких дозах. [90]
Белки также могут быть природными ядами или антипитательными веществами , такими как ингибиторы трипсина (обсуждаемые выше в разделе «метаболическая регуляция»), которые содержатся в некоторых бобовых . [91] Менее распространенным классом токсинов являются токсичные ферменты: они действуют как необратимые ингибиторы ферментов-мишеней и действуют путем химической модификации ферментов-субстратов. Примером является рицин , чрезвычайно мощный белковый токсин, обнаруженный в бобах касторового масла . [92] Этот фермент представляет собой гликозидазу , инактивирующую рибосомы. [93] Поскольку рицин является каталитическим необратимым ингибитором, это позволяет всего лишь одной молекуле рицина убить клетку. [94]
Наркотики [ править ]

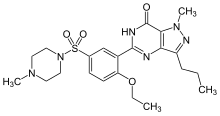
Ингибиторы ферментов чаще всего используются в качестве лекарств для лечения заболеваний. Многие из этих ингибиторов нацелены на человеческий фермент и направлены на коррекцию патологического состояния. Например, аспирин — широко используемый препарат, который действует как ингибитор фермента циклооксигеназы . [95] Это ингибирование, в свою очередь, подавляет выработку провоспалительных простагландинов , и, таким образом, аспирин можно использовать для уменьшения боли, лихорадки и воспаления. [95]
По состоянию на 2017 год [update] около 29% одобренных лекарств являются ингибиторами ферментов. [96] из которых примерно одна пятая являются ингибиторами киназ . [96] Примечательным классом мишеней киназных лекарств являются рецепторные тирозинкиназы , которые являются важными ферментами, регулирующими рост клеток ; их чрезмерная активация может привести к раку. Следовательно, ингибиторы киназы, такие как иматиниб, часто используются для лечения злокачественных новообразований. [97] Янус-киназы являются еще одним ярким примером мишени лекарственных ферментов. Ингибиторы Янус-киназы блокируют выработку воспалительных цитокинов и, следовательно, эти ингибиторы используются для лечения различных воспалительных заболеваний , включая артрит , астму и болезнь Крона . [98]
Пример структурного сходства некоторых ингибиторов с субстратами ферментов, на которые они нацелены, можно увидеть на рисунке, сравнивающем препарат метотрексат с фолиевой кислотой . Фолиевая кислота представляет собой окисленную форму субстрата дигидрофолатредуктазы , фермента, который сильно ингибируется метотрексатом. Метотрексат блокирует действие дигидрофолатредуктазы и тем самым останавливает биосинтез тимидина . [42] Этот блок биосинтеза нуклеотидов избирательно токсичен для быстро растущих клеток, поэтому метотрексат часто используют при химиотерапии рака. [99]
Распространенным средством лечения эректильной дисфункции является силденафил (Виагра). [100] Это соединение является мощным ингибитором цГМФ-специфической фосфодиэстеразы типа 5 , фермента, который разрушает сигнальную молекулу циклического гуанозинмонофосфата . [101] Эта сигнальная молекула вызывает расслабление гладких мышц и обеспечивает приток крови в пещеристые тела , что вызывает эрекцию. Поскольку препарат снижает активность фермента, останавливающего сигнал, этот сигнал сохраняется в течение более длительного периода времени.
Антибиотики [ править ]

Лекарства также используются для ингибирования ферментов, необходимых для выживания патогенов. Например, бактерии окружены толстой клеточной стенкой , состоящей из сетчатого полимера, называемого пептидогликаном . Многие антибиотики , такие как пенициллин и ванкомицин, ингибируют ферменты, которые производят, а затем сшивают цепи этого полимера вместе. [102] [103] Это приводит к тому, что клеточная стенка теряет прочность и бактерии лопаются. На рисунке молекула пенициллина (показана в форме шарика и палочки) связана со своей мишенью — транспептидазой бактерий Streptomyces R61 (белок показан в виде ленточной диаграммы ).
антибиотиков Разработка облегчается, когда фермент, необходимый для выживания патогена, отсутствует или сильно отличается у людей. [104] Человек не вырабатывает пептидогликан, поэтому антибиотики, ингибирующие этот процесс, избирательно токсичны для бактерий. [105] Избирательная токсичность антибиотиков также достигается за счет использования различий в структуре рибосом бактерий . [106] или как они производят жирные кислоты . [107]
Противовирусные препараты [ править ]
Препараты, ингибирующие ферменты, необходимые для репликации вирусов, эффективны при лечении вирусных инфекций. [108] Противовирусные препараты включают ингибиторы протеазы, используемые для лечения ВИЧ/СПИДа. [109] и гепатит С , [110] ингибиторы обратной транскриптазы, нацеленные на ВИЧ/СПИД, [111] ингибиторы нейраминидазы, нацеленные на грипп , [112] и ингибиторы терминазы, нацеленные на цитомегаловирус человека . [113]
Пестициды [ править ]
Многие пестициды являются ингибиторами ферментов. [114] Ацетилхолинэстераза (АХЭ) — это фермент, обнаруженный у животных, от насекомых до человека. Он необходим для функционирования нервных клеток благодаря механизму расщепления нейромедиатора ацетилхолина на его составляющие — ацетат и холин . [115] Это несколько необычно для нейротрансмиттеров, поскольку большинство из них, включая серотонин , дофамин и норадреналин , всасываются из синаптической щели , а не расщепляются. Большое количество ингибиторов АХЭ используется как в медицине, так и в сельском хозяйстве. [116] Обратимые конкурентные ингибиторы, такие как эдрофоний , физостигмин и неостигмин , используются при лечении миастении гравис. [117] и в анестезии для отмены мышечной блокады. [118] Карбаматные пестициды также являются примерами обратимых ингибиторов АХЭ. Фосфорорганические пестициды , такие как малатион , паратион и хлорпирифос, необратимо ингибируют ацетилхолинэстеразу. [119]
Гербициды [ править ]
Гербицид глифосат является ингибитором 3-фосфошикимат-1-карбоксивинилтрансферазы . [120] другие гербициды, такие как сульфонилмочевины, ингибируют фермент ацетолактатсинтазу . [121] Оба фермента необходимы растениям для производства аминокислот с разветвленной цепью . Гербициды ингибируют многие другие ферменты, в том числе ферменты, необходимые для биосинтеза липидов и каротиноидов , а также процессов фотосинтеза и окислительного фосфорилирования . [122]
и дизайн Открытие

Новые лекарства являются продуктом длительного процесса разработки лекарств , первым шагом которого часто является открытие нового ингибитора фермента. [123] Существует два принципиальных подхода к обнаружению этих ингибиторов. [124]
Первый общий метод — это рациональный дизайн лекарств, основанный на имитации переходного состояния химической реакции, катализируемой ферментом. [125] Разработанный ингибитор часто очень похож на субстрат, за исключением того, что часть субстрата, подвергающаяся химической реакции, заменена химически стабильной функциональной группой , напоминающей переходное состояние. Поскольку фермент эволюционировал для стабилизации переходного состояния, аналоги переходного состояния обычно обладают более высоким сродством к ферменту по сравнению с субстратом и, следовательно, являются эффективными ингибиторами. [46]
Второй способ обнаружения новых ингибиторов ферментов — это высокопроизводительный скрининг больших библиотек структурно разнообразных соединений для выявления молекул, которые связываются с ферментом. Этот метод был расширен и теперь включает виртуальный скрининг баз данных различных молекул с использованием компьютеров. [126] [127] после чего следует экспериментальное подтверждение привязки попаданий виртуального скрининга. [128] Дополнительные подходы, которые могут обеспечить новые отправные точки для ингибиторов, включают обнаружение свинцов на основе фрагментов. [129] и химические библиотеки, закодированные ДНК (DEL). [130]
Результаты любого из вышеперечисленных подходов могут быть оптимизированы для связывания с высоким сродством, которое эффективно ингибирует фермент. [131] Компьютерные методы прогнозирования ориентации связывания и сродства ингибитора к ферменту, такие как молекулярный докинг [132] и молекулярная механика может использоваться для оказания помощи в процессе оптимизации. [133] Новые ингибиторы используются для получения кристаллографических структур фермента в комплексе ингибитор/фермент, чтобы показать, как молекула связывается с активным центром, что позволяет вносить изменения в ингибитор для оптимизации связывания в процессе, известном как разработка лекарств на основе структуры. . [1] : 66 Этот цикл испытаний и улучшений повторяется до тех пор, пока не будет получен достаточно мощный ингибитор.
См. также [ править ]
- Протеомика, основанная на активности - раздел протеомики , который использует ковалентные ингибиторы ферментов в качестве репортеров для мониторинга активности ферментов.
- Антиметаболит – ингибитор ферментов, который препятствует росту и делению клеток.
- Аналог переходного состояния - тип ингибитора фермента, имитирующий переходное состояние химической реакции, катализируемой ферментом.
Ссылки [ править ]
- ↑ Перейти обратно: Перейти обратно: а б с д Коупленд РА (март 2013 г.). «Почему ферменты являются мишенями для лекарств? Ферменты необходимы для жизни». Оценка ингибиторов ферментов при открытии лекарств: Руководство для медицинских химиков и фармакологов (второе изд.). John Wiley & Sons, Inc., стр. 1–23. дои : 10.1002/9781118540398.ch1 . ISBN 978-1-118-48813-3 .
- ↑ Перейти обратно: Перейти обратно: а б с Сауро HM (февраль 2017 г.). «Контроль и регулирование путей посредством отрицательной обратной связи» . Журнал Королевского общества, Интерфейс . 14 (127): 1–13. дои : 10.1098/rsif.2016.0848 . ПМЦ 5332569 . ПМИД 28202588 .
- ↑ Перейти обратно: Перейти обратно: а б с Плакстон WC (2004). «Принципы метаболического контроля» . В Стори КБ (ред.). Функциональный метаболизм: регуляция и адаптация . Хобокен, Нью-Джерси: John Wiley & Sons. стр. 1–24 (12). ISBN 978-0-471-67557-0 . Архивировано из оригинала 28 марта 2023 года . Проверено 14 апреля 2022 г.
- ↑ Перейти обратно: Перейти обратно: а б Хефнер Б. (июнь 2003 г.). «Лекарства из глубин: морские натуральные продукты как кандидаты в лекарства». Открытие наркотиков сегодня . 8 (12): 536–44. дои : 10.1016/s1359-6446(03)02713-2 . ПМИД 12821301 .
- ^ Гуалерци CO, Брэнди Л., Фаббретти А., Пон CL (2013). Антибиотики: мишени, механизмы и устойчивость . Хобокен: Джон Уайли и сыновья. ISBN 978-3-527-65970-8 .
- ^ Санраттана В., Маас К., де Маат С. (2019). «СЕРПИНЫ-От ловушки к лечению» . Границы в медицине . 6:25 . doi : 10.3389/fmed.2019.00025 . ПМК 6379291 . ПМИД 30809526 .
- ^ Шапиро Р., Валле Б.Л. (февраль 1991 г.). «Взаимодействие плацентарной рибонуклеазы человека с ингибитором плацентарной рибонуклеазы». Биохимия . 30 (8): 2246–2255. дои : 10.1021/bi00222a030 . ПМИД 1998683 .
- ^ Бун Л., Угарте-Берзал Э., Вандоорен Дж., Опденаккер Г. (апрель 2020 г.). «Структуры пропептидов протеаз, механизмы активации и функции». Критические обзоры по биохимии и молекулярной биологии . 55 (2): 111–165. дои : 10.1080/10409238.2020.1742090 . ПМИД 32290726 . S2CID 215772580 .
- ↑ Перейти обратно: Перейти обратно: а б Рыдзевский Р.М. (2010). «Глава 7.2.1: Конкуренция и аллостерия» . Открытие лекарств в реальном мире: Руководство химика по биотехнологическим и фармацевтическим исследованиям (1-е изд.). Амстердам: Эльзевир. стр. 281–285. ISBN 978-0-08-091488-6 . Архивировано из оригинала 28 марта 2023 года . Проверено 20 июля 2022 г.
- ^ Якубик Дж., Рандакова А., Эль-Факахани Э.Э., Долежал В. (2019). «Анализ равновесного связывания ортостерического индикатора и двух аллостерических модуляторов» . ПЛОС ОДИН . 14 (3): e0214255. Бибкод : 2019PLoSO..1414255J . дои : 10.1371/journal.pone.0214255 . ПМК 6436737 . ПМИД 30917186 .
- ^ Патрик Г.Л. (2013). «Глава 7: Ферменты как мишени для лекарств» . Введение в медицинскую химию (Пятое изд.). Оксфорд, Великобритания: Издательство Оксфордского университета. п. 90. ИСБН 978-0-19-969739-7 . Архивировано из оригинала 20 июля 2022 года . Проверено 20 июля 2022 г.
- ^ Куриян Дж., Конфорти Б., Веммер Д. (2012). «Молекулярное распознавание: термодинамика связывания» . Молекулы жизни: физические и химические принципы (первое изд.). Бока-Ратон, Флорида: Garland Science. стр. 531–580. ISBN 978-1-135-08892-7 . Архивировано из оригинала 7 июня 2022 года . Проверено 7 июня 2022 г.
- ↑ Перейти обратно: Перейти обратно: а б с Тули А., Фаст W (июнь 2018 г.). «Таксономия ковалентных ингибиторов» . Биохимия . 57 (24): 3326–3337. doi : 10.1021/acs.biochem.8b00315 . ПМК 6016374 . ПМИД 29689165 .
- ↑ Перейти обратно: Перейти обратно: а б Клеланд В.В. (февраль 1963 г.). «Кинетика ферментативно-катализируемых реакций с двумя или более субстратами или продуктами. II. Ингибирование: номенклатура и теория». Biochimica et Biophysical Acta (BBA) — Специализированный отдел по энзимологическим вопросам . 67 : 173–187. дои : 10.1016/0926-6569(63)90226-8 . ПМИД 14021668 .
- ^ Берг Дж., Тимочко Дж., Страйер Л. (2002). Биохимия . WH Фриман и компания. ISBN 978-0-7167-4955-4 . Архивировано из оригинала 26 сентября 2009 года . Проверено 31 августа 2017 г.
- ↑ Перейти обратно: Перейти обратно: а б с «Виды торможения» . Центр трансляционной терапии НИЗ. Архивировано из оригинала 8 сентября 2011 года . Проверено 2 апреля 2012 г.
- ↑ Перейти обратно: Перейти обратно: а б с д и ж г час Корниш-Боуден А (2012). Основы кинетики ферментов (4-е изд.). Вайнхайм: Wiley-VCH. ISBN 978-3-527-66549-5 .
- ↑ Перейти обратно: Перейти обратно: а б Сигел И.Х. (1993). Кинетика ферментов: поведение и анализ ферментных систем быстрого равновесия и стационарного состояния (новое изд.). Уайли-Интерсайенс. ISBN 978-0-471-30309-1 .
- ^ Палмер Т., Боннер П.Л. (2007). «Ингибирование ферментов». Ферменты: биохимия, биотехнология, клиническая химия (2-е изд.). Издательство Вудхед. стр. 126–152 (135). дои : 10.1533/9780857099921.2.126 . ISBN 978-1-904275-27-5 .
- ^ Делоун КП, Альсаюри К (сентябрь 2021 г.). «Физиология: неконкурентный ингибитор» . СтатПерлс . Остров сокровищ (Флорида): StatPearls Publishing. п. 31424826. PMID 31424826 . Архивировано из оригинала 28 ноября 2021 года . Проверено 3 апреля 2022 г.
- ↑ Перейти обратно: Перейти обратно: а б Воет Д., Воет Дж.Г., Пратт К.В. (2016). «Глава 12: Кинетика ферментов, ингибирование и контроль». Основы биохимии: жизнь на молекулярном уровне (Пятое изд.). Хобокен, Нью-Джерси: Уайли. стр. 361–401. ISBN 978-1-118-91840-1 .
- ^ Букер С.М., Бориак-Сьодин П.А., Коупленд Р.А. (июнь 2019 г.). «Взаимодействие фермента и ингибитора и простой и быстрый метод определения модальности ингибирования» . Открытие SLAS: развитие исследований и разработок в области биологических наук . 24 (5): 515–522 (516). дои : 10.1177/2472555219829898 . ПМИД 30811960 . S2CID 73480979 .
В некоторых случаях ингибитор может связываться с отдельным участком фермента, который находится в аллостерической связи с карманом связывания субстрата. Во многих случаях аллостерические соединения, конкурирующие с субстратом, приводят к конформационным изменениям фермента, которые изменяют способность фермента связывать субстрат.
- ^ Лейдлер К.Дж. (1978). Физическая химия с биологическими приложениями . Бенджамин/Каммингс. п. 437. ИСБН 978-0-8053-5680-9 .
- ↑ Перейти обратно: Перейти обратно: а б с д и ж Биссвангер Х (2017). Кинетика ферментов: принципы и методы (3-е изд.). Ньюарк: John Wiley & Sons, Incorporated. ISBN 978-3-527-80647-8 .
- ^ Марангони АГ (2003 г.). «Обратимое ингибирование ферментов». Кинетика ферментов: современный подход . Хобокен, Нью-Джерси: Wiley-Interscience. стр. 61–69. ISBN 978-0-471-15985-8 .
- ^ Сигел И.Х. (1993). Кинетика ферментов: поведение и анализ ферментных систем быстрого равновесия и стационарного состояния (новое изд.). Уайли – Межнаучный. ISBN 978-0-471-30309-1 .
- ↑ Перейти обратно: Перейти обратно: а б Уолш Р., Мартин Э., Дарвеш С. (декабрь 2011 г.). «Ограничения традиционных классификаций ингибиторов». Интегративная биология . 3 (12): 1197–1201. дои : 10.1039/c1ib00053e . ПМИД 22038120 .
- ↑ Перейти обратно: Перейти обратно: а б с Уолш Р., Мартин Э., Дарвеш С. (май 2007 г.). «Универсальное уравнение для описания кинетики обратимого ингибирования и активации ферментов: моделирование бета-галактозидазы и бутирилхолинэстеразы». Biochimica et Biophysical Acta (BBA) – Общие предметы . 1770 (5): 733–746. дои : 10.1016/j.bbagen.2007.01.001 . ПМИД 17307293 .
- ^ Уолш Р. (май 2012 г.). «Альтернативные перспективы моделирования кинетики ферментов». Медицинская химия и дизайн лекарств. (16). ИнТех: 357–372.
- ^ Стрелоу Дж., Дью В., Иверсен П.В., Брукс П.Б., Рэддинг Дж.А., МакГи Дж. и др. (октябрь 2012 г.). «Анализ механизма действия ферментов» . В Маркосян С., Гроссман А., Бримакомб К. и др. (ред.). Руководство по проведению анализа . Eli Lilly & Company и Национальный центр развития трансляционных наук. ПМИД 22553872 . Архивировано из оригинала 15 июня 2022 года . Проверено 9 апреля 2022 г.
- ^ Холдгейт, Джорджия (июль 2001 г.). «Сделать крутые лекарства горячими: изотермическая титровальная калориметрия как инструмент для изучения энергетики связывания». БиоТехники . 31 (1): 164–6, 168, 170 пассим. ПМИД 11464510 .
- ^ Лезербарроу Р.Дж. (декабрь 1990 г.). «Использование линейной и нелинейной регрессии для соответствия биохимическим данным». Тенденции биохимических наук . 15 (12): 455–458. дои : 10.1016/0968-0004(90)90295-М . ПМИД 2077683 .
- ↑ Перейти обратно: Перейти обратно: а б Ценг С.Дж., Сюй Дж.П. (август 1990 г.). «Сравнение процедур оценки параметров модели Михаэлиса-Ментен». Журнал теоретической биологии . 145 (4): 457–464. Бибкод : 1990JThBi.145..457T . дои : 10.1016/S0022-5193(05)80481-3 . ПМИД 2246896 .
- ^ Диксон М., Уэбб ЕС, Торн С.Дж., Типтон К.Ф. (1979). Ферменты (3-е изд.). Лондон: Лонгман. п. 126. ИСБН 978-0-470-20745-1 .
- ^ Радзичка А., Вулфенден Р. (1995). «Переходное состояние и мультисубстратные аналоговые ингибиторы». Кинетика и механизм ферментов. Часть D: Развитие динамики ферментов . Методы энзимологии. Том. 249. стр. 284–312. дои : 10.1016/0076-6879(95)49039-6 . ISBN 9780121821500 . ПМИД 7791615 .
- ^ Шиффер К.Ф., Берк Дж.Ф., Бесараб А., Ласкер Н., Сименхофф М.Л. (январь 1977 г.). «Фракция клиренса амилазы/креатинина у пациентов, находящихся на хроническом гемодиализе». Анналы внутренней медицины . 86 (1): 65–66. дои : 10.7326/0003-4819-86-1-65 . ПМИД 319722 .
- ^ Инглезе Дж., Блатчли Р.А., Бенкович С.Дж. (май 1989 г.). «Мультисубстратный аддукт-ингибитор пуринового фермента биосинтеза с пикомолярной константой диссоциации». Журнал медицинской химии . 32 (5): 937–940. дои : 10.1021/jm00125a002 . ПМИД 2709379 .
- ^ Инглезе Дж., Бенкович С.Дж. (1991). «Мультисубстратные аддуктные ингибиторы глицинамидрибонуклеотидтрансформилазы: синтетические и ферментативные». Тетраэдр . 47 (14–15): 2351–2364. дои : 10.1016/S0040-4020(01)81773-7 .
- ^ Розварски Д.А., Грант Г.А., Бартон Д.Х., Джейкобс В.Р., Саккеттини Дж.К. (январь 1998 г.). «Модификация НАДН мишени изониазида (InhA) из микобактерии туберкулеза». Наука . 279 (5347): 98–102. Бибкод : 1998Sci...279...98R . дои : 10.1126/science.279.5347.98 . ПМИД 9417034 .
- ^ Олд Д.С., Ловелл С., Торн Н., Леа В.А., Мэлони Дж., Шен М. и др. (март 2010 г.). «Молекулярные основы высокоаффинного связывания и стабилизации люциферазы светлячков с помощью PTC124» . Труды Национальной академии наук Соединенных Штатов Америки . 107 (11): 4878–4883. Бибкод : 2010PNAS..107.4878A . дои : 10.1073/pnas.0909141107 . ПМК 2841876 . ПМИД 20194791 .
- ^ Ле Кальвес П.Б., Скотт С.Дж., Миго М.Э. (декабрь 2009 г.). «Мультисубстратные ингибиторы аддуктов: разработка лекарств и биологические инструменты». Журнал ингибирования ферментов и медицинской химии . 24 (6): 1291–318. дои : 10.3109/14756360902843809 . ПМИД 19912064 . S2CID 21808708 .
- ↑ Перейти обратно: Перейти обратно: а б Авендано К., Менендес Х.К. (июнь 2015 г.). «Глава 2.5: Ингибиторы дигидрофолатредуктазы». Медицинская химия противораковых препаратов . Эльзевир. стр. 54–58. ISBN 978-0-444-62667-7 .
- ^ Сюй Дж.Т., Ван Х.К., Чен Г.В., Ши С.Р. (2006). «Открытие противовирусных препаратов, нацеленных на вирусные протеазы». Текущий фармацевтический дизайн . 12 (11): 1301–1314. дои : 10.2174/138161206776361110 . ПМИД 16611117 .
- ^ Агбовуро А.А., Хьюстон В.М., Гэмбл AB, Тиндалл Дж.Д. (июль 2018 г.). «Протеазы и ингибиторы протеаз при инфекционных заболеваниях». Обзоры медицинских исследований . 38 (4): 1295–1331. дои : 10.1002/мед.21475 . ПМИД 29149530 . S2CID 25269012 .
- ^ Цю С, Лю ЗП (2011). «Последние разработки пептидомиметических ингибиторов протеазы ВИЧ-1». Современная медицинская химия . 18 (29): 4513–37. дои : 10.2174/092986711797287566 . ПМИД 21864279 .
- ↑ Перейти обратно: Перейти обратно: а б Шрамм В.Л. (ноябрь 2018 г.). «Ферментативные переходные состояния и разработка лекарств» . Химические обзоры . 118 (22): 11194–11258. doi : 10.1021/acs.chemrev.8b00369 . ПМК 6615489 . ПМИД 30335982 .
- ^ Лью В., Чен Икс, Ким К.У. (июнь 2000 г.). «Открытие и разработка GS 4104 (осельтамивир): перорально активного ингибитора нейраминидазы гриппа». Современная медицинская химия . 7 (6): 663–672. дои : 10.2174/0929867003374886 . ПМИД 10702632 .
- ^ Фишер ПМ (октябрь 2003 г.). «Разработка, синтез и применение стереохимических и направленных изомеров пептидов: критический обзор». Современная наука о белках и пептидах . 4 (5): 339–356. дои : 10.2174/1389203033487054 . ПМИД 14529528 .
- ^ Брин М.Е., Зельнер М.Б. (январь 2015 г.). «Низкомолекулярные субстратные ингибиторы сайтов фосфорилирования протеинкиназ: подходы и проблемы» . АКС Химическая биология . 10 (1): 175–89. дои : 10.1021/cb5008376 . ПМК 4301090 . ПМИД 25494294 .
- ^ Богоевич М.А., Барр Р.К., Кеттерман А.Дж. (декабрь 2005 г.). «Пептидные ингибиторы протеинкиназ: открытие, характеристика и использование». Biochimica et Biophysical Acta (BBA) - Белки и протеомика . 1754 (1–2): 79–99. дои : 10.1016/j.bbapap.2005.07.025 . ПМИД 16182621 .
- ↑ Перейти обратно: Перейти обратно: а б Патрик Г.Л. (2017). «Ферменты как мишени для лекарств» . Введение в медицинскую химию (Шестое изд.). Оксфорд, Соединенное Королевство: Издательство Оксфордского университета. п. 95. ИСБН 978-0-19-874969-1 . Архивировано из оригинала 28 марта 2023 года . Проверено 3 июня 2022 г.
- ^ Герингер М., Лауфер С.А. (июнь 2019 г.). «Новые и вновь возникающие боеголовки для направленных ковалентных ингибиторов: применение в медицинской химии и химической биологии». Журнал медицинской химии . 62 (12): 5673–5724. doi : 10.1021/acs.jmedchem.8b01153 . ПМИД 30565923 . S2CID 56480231 .
- ^ Лундблад Р.Л. (2004). Химические реагенты для модификации белков (3-е изд.). ЦРК Пресс. ISBN 978-0-8493-1983-9 .
- ^ Полакович М., Врабель П., Балеш В. (январь 1998 г.). «Подходы к улучшению идентификации механизмов инактивации ферментов». Прогресс в биотехнологии . 15 . Эльзевир: 77–82. дои : 10.1016/S0921-0423(98)80013-0 . ISBN 978-0-444-82970-2 .
Инактивацию фермента обычно объясняют как химический процесс, включающий несколько явлений, таких как агрегация, диссоциация на субъединицы или денатурация (конформационные изменения), которые происходят одновременно во время инактивации определенного фермента.
- ^ Прайс Н., Хамес Б., Риквуд Д. (1996). Белки LabFax . Научные издательства БИОС. ISBN 978-0-12-564710-6 .
- ^ Адам Г.К., Краватт Б.Ф., Соренсен Э.Дж. (январь 2001 г.). «Профилирование специфической реактивности протеома с помощью зондов, основанных на ненаправленной активности» . Химия и биология . 8 (1): 81–95. дои : 10.1016/S1074-5521(00)90060-7 . ПМИД 11182321 .
- ^ Маурер Т., Фунг Х.Л. (2000). «Сравнение методов анализа кинетических данных по механизму инактивации ферментов: применение к синтазе оксида азота» . AAPS PharmSci . 2 (1): 68–77. дои : 10.1208/ps020108 . ПМК 2751003 . ПМИД 11741224 .
- ^ Лу Дж.А., ДеДжон Д.Е., Дю П., Стивенсон Т.И., Огорзалек Лу Р.Р. (июль 1999 г.). «Применение масс-спектрометрии для идентификации и характеристики целей». Обзоры медицинских исследований . 19 (4): 307–319. doi : 10.1002/(SICI)1098-1128(199907)19:4<307::AID-MED4>3.0.CO;2-2 . ПМИД 10398927 . S2CID 11766917 .
- ^ Пурич Д.Л. (2010). «Необратимое ингибирование ферментов агентами аффинной маркировки» . Кинетика ферментов: катализ и контроль: справочник по теории и передовым методам . Сан-Диего, Калифорния: Elsevier Academic. п. 542. ИСБН 978-0-12-380925-4 . Архивировано из оригинала 20 июля 2022 года . Проверено 20 июля 2022 г.
- ^ Сибилле Э., Бана Э., Чауни В., Дидерих М., Багрель Д., Шамбо П. (ноябрь 2012 г.). «Разработка скринингового теста с использованием матричной лазерной десорбции / ионизации и масс-спектрометрии для выявления обратимых и необратимых ингибиторов фосфатаз CDC25». Аналитическая биохимия . 430 (1): 83–91. дои : 10.1016/j.ab.2012.08.006 . ПМИД 22902804 .
- ↑ Перейти обратно: Перейти обратно: а б Пулен Р., Лу Л., Акерманн Б., Бей П., Пегг А.Е. (январь 1992 г.). «Механизм необратимой инактивации орнитиндекарбоксилазы мыши альфа-дифторметилорнитином. Характеристика последовательностей в сайтах связывания ингибитора и кофермента» . Журнал биологической химии . 267 (1): 150–158. дои : 10.1016/S0021-9258(18)48472-4 . ПМИД 1730582 .
- ^ Шедлачек С.Е., Дагглби Р.Г. (1995). «[6] Кинетика медленных и сильносвязывающих ингибиторов». Кинетика медленных и сильносвязывающих ингибиторов . Методы энзимологии. Том. 249. стр. 144–80. дои : 10.1016/0076-6879(95)49034-5 . ISBN 978-0-12-182150-0 . ПМИД 7791610 .
- ^ Стоун С.Р., Моррисон Дж.Ф. (февраль 1986 г.). «Механизм ингибирования дигидрофолатредуктазы из бактериальных и позвоночных источников различными классами аналогов фолата». Biochimica et Biophysical Acta (BBA) - Структура белка и молекулярная энзимология . 869 (3): 275–285. дои : 10.1016/0167-4838(86)90067-1 . ПМИД 3511964 .
- ^ Пик Ф.М., МакГартолл М.А., Брей Р.К. (январь 1971 г.). «Реакция формальдегида и метанола с ксантиноксидазой» . Европейский журнал биохимии . 18 (1): 65–72. дои : 10.1111/j.1432-1033.1971.tb01215.x . ПМИД 4322209 .
- ^ Рирдон Дж. Э. (ноябрь 1989 г.). «Взаимодействие вируса простого герпеса типа 1 и ДНК-полимеразы человека с аналогами 2'-дезоксигуанозин-5'-трифосфата. Кинетика включения в ДНК и индукция ингибирования» . Журнал биологической химии . 264 (32): 19039–19044. дои : 10.1016/S0021-9258(19)47263-3 . ПМИД 2553730 .
- ^ PDB : 1GXF ; Сараванамуту А., Викерс Т.Дж., Бонд К.С., Петерсон М.Р., Хантер В.Н., Фэрламб А.Х. (июль 2004 г.). «Два взаимодействующих сайта связывания производных хинакрина в активном центре трипанотионредуктазы: шаблон для разработки лекарств» . Журнал биологической химии . 279 (28): 29493–500. дои : 10.1074/jbc.M403187200 . ПМК 3491871 . ПМИД 15102853 .
- ^ Коэн Дж.А., Остербан Р.А., Берендс Ф. (1967). «[81] Фосфорорганические соединения» . Структура фермента . Методы энзимологии. Том. 11. С. 686–702. дои : 10.1016/S0076-6879(67)11085-9 . ISBN 978-0-12-181860-9 . Архивировано из оригинала 28 февраля 2018 года.
- ^ Бреннер Г.М. (2000). Фармакология (1-е изд.). Филадельфия, Пенсильвания: В. Б. Сондерс. ISBN 978-0-7216-7757-6 .
- ^ Уолш, Коннектикут (1984). «Суицидные субстраты, инактиваторы ферментов на основе механизма: последние разработки». Ежегодный обзор биохимии . 53 : 493–535. дои : 10.1146/annurev.bi.53.070184.002425 . ПМИД 6433782 .
- ^ Сараванамуту А., Викерс Т.Дж., Бонд К.С., Петерсон М.Р., Хантер В.Н., Фэрламб А.Х. (июль 2004 г.). «Два взаимодействующих сайта связывания производных хинакрина в активном центре трипанотионредуктазы: шаблон для разработки лекарств» . Журнал биологической химии . 279 (28): 29493–29500. дои : 10.1074/jbc.M403187200 . ПМК 3491871 . ПМИД 15102853 .
- ^ Перейра Д.М., Андраде К., Валентау П., Андраде П.Б. (октябрь 2017 г.). «Натуральные продукты как ингибиторы ферментов». (PDF) . Натуральные продукты, нацеленные на клинически значимые ферменты (первое издание). Wiley-VCH Verlag GmbH & Co. KGaA. ISBN 978-3-527-34205-1 . Архивировано (PDF) из оригинала 5 декабря 2022 года . Проверено 3 апреля 2022 г.
- ^ Хиратаке Дж (2005). «Ингибиторы ферментов как химические инструменты для изучения ферментативного катализа: рациональный дизайн, синтез и применение». Химическая запись . 5 (4). Нью-Йорк, штат Нью-Йорк: 209–28. дои : 10.1002/tcr.20045 . ПМИД 16041744 .
- ^ Страница C, Питчфорд С. (2021). «Яды, токсины, яды и травы» . Сжатая электронная книга Дейла по фармакологии (Третье изд.). Филадельфия, Пенсильвания: Elsevier Health Sciences. стр. 153–155. ISBN 978-0-7020-7819-4 . Архивировано из оригинала 25 апреля 2013 года . Проверено 3 июня 2022 г.
- ^ Стенерсен Дж (2004). «Глава 5: Специфические ингибиторы ферментов» . Химические пестициды. Механизм действия и токсикология . Бока-Ратон: CRC Press. стр. 73–114. ISBN 978-0-203-64683-0 . Архивировано из оригинала 28 марта 2023 года . Проверено 14 апреля 2022 г.
- ^ Грейтхаус Б., Зара Ф., Брэди М.Ф. (сентябрь 2021 г.). «Токсичность ингибиторов ацетилхолинэстеразы» . StatPearls [Интернет] . Остров сокровищ (Флорида): StatPearls Publishing. ПМИД 30571049 . Архивировано из оригинала 17 января 2023 года . Проверено 14 апреля 2022 г.
- ^ Оренсио-Трехо М., Утрилла Х., Фернандес-Сандовал М.Т., Уэрта-Беристейн Г., Госсет Г., Мартинес А. (2010). «Инженерия ферментативного метаболизма Escherichia coli» . В Кордес М., Виттманн С., Крулл Р. (ред.). Биосистемная инженерия II: связь клеточных сетей и биопроцессов . Берлин: Springer Science & Business Media. стр. 77–78. ISBN 978-3-642-13865-2 .
- ^ Окар Д.А., Ланге А.Дж. (1999). «Фруктозо-2,6-бисфосфат и контроль углеводного обмена у эукариот». Биофакторы . 10 (1): 1–14. дои : 10.1002/biof.5520100101 . ПМИД 10475585 . S2CID 24586866 .
- ^ Прайс, Северная Каролина, Стивенс Л. (1999). Основы энзимологии: клеточная и молекулярная биология каталитических белков (3-е изд.). Издательство Оксфордского университета. ISBN 978-0-19-850229-6 .
- ^ Смит Т.П. (август 2004 г.). «Варианты субстрата в сравнении с аналогами переходного состояния как нековалентными обратимыми ингибиторами ферментов» . Биоорганическая и медицинская химия . 12 (15): 4081–4088. дои : 10.1016/j.bmc.2004.05.041 . ПМИД 15246086 . Архивировано из оригинала 28 марта 2023 года . Проверено 14 апреля 2022 г.
- ^ Хартли Р.В. (ноябрь 1989 г.). «Барназа и барстар: два маленьких белка, которые складываются и соединяются друг с другом». Тенденции биохимических наук . 14 (11): 450–454. дои : 10.1016/0968-0004(89)90104-7 . ПМИД 2696173 .
- ^ Махешвари В.Л. (2022). Натуральные продукты как ингибиторы ферментов . Сингапур: Спрингер. ISBN 978-981-19-0932-0 .
- ^ Бирк Ю. (2003). Ингибиторы протеазы растений: значение в питании, защите растений, профилактике рака и генной инженерии . Берлин: Шпрингер. ISBN 978-3-540-00118-8 .
- ^ Тан Дж., Джилленхол С., Соехарто Д.Д. (март 2006 г.). «Биоразнообразие как источник противораковых препаратов». Текущие цели по борьбе с наркотиками . 7 (3): 265–277. дои : 10.2174/138945006776054942 . ПМИД 16515527 .
- ^ Абал М., Андреу Дж.М., Барасоайн I (июнь 2003 г.). «Таксаны: мишени для микротрубочек и центросом, а также механизмы действия, зависящие от клеточного цикла». Текущие цели в области лекарств от рака . 3 (3): 193–203. дои : 10.2174/1568009033481967 . ПМИД 12769688 .
- ^ Хостеттманн К., Борлоз А., Урбен А., Марстон А. (2006). «Натуральные ингибиторы ацетилхолинэстеразы». Современная органическая химия . 10 (8): 825–847. дои : 10.2174/138527206776894410 .
- ^ Найт Р., Хондокер М., Мэгилл Н., Стюарт Р., Ландау С. (2018). «Систематический обзор и метаанализ эффективности ингибиторов ацетилхолинэстеразы и мемантина в лечении когнитивных симптомов деменции» . Деменция и гериатрические когнитивные расстройства . 45 (3–4): 131–151. дои : 10.1159/000486546 . ПМИД 29734182 . S2CID 13701908 .
- ^ ДеФрейтс Л.Дж., Хоэнс Дж.Д., Сакорнбут Э.Л., Гласкок Д.Г., Тью А.Р. (январь 2005 г.). «Антимускариновая интоксикация, возникающая в результате приема семян лунного цветка». Анналы фармакотерапии . 39 (1): 173–176. дои : 10.1345/aph.1D536 . ПМИД 15572604 . S2CID 36465515 .
- ^ Веттер Дж. (январь 1998 г.). «Токсины Amanita phalloides». Токсикон . 36 (1): 13–24. Бибкод : 1998Txcn...36...13В . дои : 10.1016/S0041-0101(97)00074-3 . ПМИД 9604278 .
- ^ Холмс К.Ф., Мейнс Дж.Т., Перро К.Р., Доусон Дж.Ф., Джеймс М.Н. (ноябрь 2002 г.). «Молекулярная энзимология, лежащая в основе регуляции протеинфосфатазы-1 природными токсинами». Современная медицинская химия . 9 (22): 1981–1989. дои : 10.2174/0929867023368827 . ПМИД 12369866 .
- ^ Бишофф К. (октябрь 2001 г.). «Токсикология микроцистина-LR: возникновение, токсикокинетика, токсикодинамика, диагностика и лечение». Ветеринарная и человеческая токсикология . 43 (5): 294–297. ПМИД 11577938 .
- ^ Savage GP, Morrison SC (2003). «Ингибиторы трипсина». В Кабальеро Б (ред.). Энциклопедия пищевых наук и питания (второе изд.). Академическая пресса. стр. 5878–5884. дои : 10.1016/B0-12-227055-X/00934-2 . ISBN 978-0-12-227055-0 .
- ^ Полито Л., Бортолотти М., Баттелли М.Г., Калафато Дж., Болоньези А. (июнь 2019 г.). «Рицин: древняя история вневременного растительного токсина» . Токсины . 11 (6): 324. doi : 10.3390/toxins11060324 . ПМК 6628454 . ПМИД 31174319 .
- ^ Сова-Рогозиньска Н, Соминка Х, Новаковска-Голацка Ю, Сандвиг К, Сломиньска-Воеводска М (июнь 2019 г.). «Внутриклеточный транспорт и цитотоксичность белкового токсина рицина» . Токсины . 11 (6): 350. doi : 10.3390/toxins11060350 . ПМК 6628406 . ПМИД 31216687 .
- ^ Хартли М.Р., Лорд Дж.М. (сентябрь 2004 г.). «Цитотоксические рибосомы-инактивирующие лектины растений». Biochimica et Biophysical Acta (BBA) - Белки и протеомика . 1701 (1–2): 1–14. дои : 10.1016/j.bbapap.2004.06.004 . ПМИД 15450171 .
- ↑ Перейти обратно: Перейти обратно: а б Финкель Р., Кубедду Л.С., Кларк М.А. (2009). «Глава 41: Противовоспалительные препараты» . Фармакология (4-е изд.). Филадельфия: Липпинкотт Уильямс и Уилкинс. стр. 499–518 (502). ISBN 978-0-7817-7155-9 . Архивировано из оригинала 28 марта 2023 года . Проверено 14 апреля 2022 г.
- ↑ Перейти обратно: Перейти обратно: а б Сантос Р., Урсу О., Голтон А., Бенто А.П., Донади Р.С., Болога К.Г. и др. (январь 2017 г.). «Полная карта целей молекулярных лекарств» . Обзоры природы. Открытие наркотиков . 16 (1): 19–34 (рис. 1В). дои : 10.1038/nrd.2016.230 . ПМК 6314433 . ПМИД 27910877 .
Рисунок 1C: Клинический успех привилегированных классов семейства белков (% одобренных препаратов, нацеленных на каждый целевой класс): редуктаза 7,62, киназа 5,94, протеаза 3,35, гидролаза 2,76, НПТаза 2,09, трансфераза 1,92, лиаза 1,59, изомераза 1,51, фосфодиэстераза 1,50, цитохром p450 0,84 , Эпигенетический ластик 0,33, Общее количество ферментов-мишеней одобренных препаратов = 29,45%
- ^ Каннайян Р., Махадеван Д. (декабрь 2018 г.). «Комплексный обзор ингибиторов протеинкиназы для терапии рака» . Экспертный обзор противораковой терапии . 18 (12): 1249–1270. дои : 10.1080/14737140.2018.1527688 . ПМК 6322661 . ПМИД 30259761 .
- ^ МакЛорнан Д.П., Поуп Дж.Э., Готлиб Дж., Харрисон К.Н. (август 2021 г.). «Текущий и будущий статус ингибиторов JAK». Ланцет . 398 (10302): 803–816. дои : 10.1016/S0140-6736(21)00438-4 . ПМИД 34454676 . S2CID 237311419 .
- ^ Макгуайр Джей-Джей (2003). «Противораковые антифолаты: современное состояние и будущие направления». Текущий фармацевтический дизайн . 9 (31): 2593–2613. дои : 10.2174/1381612033453712 . ПМИД 14529544 .
- ^ Гольдштейн И., Бернетт А.Л., Розен Р.К., Парк П.В., Стечер В.Дж. (январь 2019 г.). «По счастливой случайности история силденафила: неожиданная пероральная терапия эректильной дисфункции». Обзоры сексуальной медицины . 7 (1): 115–128. дои : 10.1016/j.sxmr.2018.06.005 . ПМИД 30301707 . S2CID 52945888 .
- ^ Магги М., Филиппи С., Ледда Ф., Маджини А., Форти Дж. (август 2000 г.). «Эректильная дисфункция: от биохимической фармакологии к достижениям медицинской терапии» . Европейский журнал эндокринологии . 143 (2): 143–154. дои : 10.1530/axis.0.1430143 . ПМИД 10913932 .
- ^ Кокрейн С.А., Лоханс, Коннектикут (май 2020 г.). «Разрушение клеточной стенки: стратегии открытия антибиотиков, нацеленных на бактериальные транспептидазы» . Европейский журнал медицинской химии . 194 : 112262. doi : 10.1016/j.ejmech.2020.112262 . ПМИД 32248005 . S2CID 214809706 . Архивировано из оригинала 28 марта 2023 года . Проверено 20 июля 2022 г.
- ^ Буйнак Ж.Д. (сентябрь 2007 г.). «Разрезание и сшивание: сшивание пептидогликана при сборке бактериальной клеточной стенки». АКС Химическая биология . 2 (9): 602–5. дои : 10.1021/cb700182u . ПМИД 17894443 .
- ^ Дальхофф А (февраль 2021 г.). «Избирательная токсичность антибактериальных средств – все еще актуальная концепция, или мы упускаем шансы и игнорируем риски?» . Инфекция . 49 (1): 29–56. дои : 10.1007/s15010-020-01536-y . ПМЦ 7851017 . ПМИД 33367978 .
- ^ Мобли Х (13 марта 2006 г.). «Как антибиотики убивают бактериальные клетки, но не человеческие клетки?» . Научный американец . 294 (6): 98. PMID 16711368 . Архивировано из оригинала 9 апреля 2022 года . Проверено 9 апреля 2022 г.
- ^ Чжан Л., Хэ Дж., Бай Л., Жуань С., Ян Т., Луо Ю. (июль 2021 г.). «Антибактериальные агенты, нацеленные на рибосомы: достижения, проблемы и возможности». Обзоры медицинских исследований . 41 (4): 1855–1889. дои : 10.1002/мед.21780 . ПМИД 33501747 . S2CID 231761270 .
- ^ Яо Дж., Rock CO (ноябрь 2017 г.). «Бактериальный метаболизм жирных кислот в современном открытии антибиотиков» . Biochimica et Biophysical Acta (BBA) - Молекулярная и клеточная биология липидов . 1862 (11): 1300–1309. дои : 10.1016/j.bbalip.2016.09.014 . ПМК 5364071 . ПМИД 27668701 .
- ^ Ли Джи, Цзин Икс, Пан, Чжан П, Де Клерк Э (2021). «Противовирусная классификация». В Бэмфорде Д., Цукермане Массачусетса (ред.). Энциклопедия вирусологии . Том. 5 (4-е изд.). Амстердам: Академическая пресса. стр. 129–130. дои : 10.1016/B978-0-12-814515-9.00126-0 . ISBN 978-0-12-814516-6 . OCLC 1240584737 .
- ^ Вошавар С (2019). «Ингибиторы протеазы для лечения ВИЧ/СПИДа: последние достижения и будущие проблемы». Актуальные темы медицинской химии . 19 (18): 1571–1598. дои : 10.2174/1568026619666190619115243 . ПМИД 31237209 . S2CID 195356119 .
- ^ де Леу П., Стефан С. (апрель 2018 г.). «Терапия ингибиторами протеазы при инфекции вируса гепатита С». Экспертное заключение по фармакотерапии . 19 (6): 577–587. дои : 10.1080/14656566.2018.1454428 . ПМИД 29595065 . S2CID 4489039 .
- ^ Ли Джи, Ван Ю, Де Клерк Э (апрель 2022 г.). «Одобренные ингибиторы обратной транскриптазы ВИЧ за последнее десятилетие» . Акта Фармацевтика Синика Б. 12 (4): 1567–1590. дои : 10.1016/j.apsb.2021.11.009 . ПМЦ 9279714 . ПМИД 35847492 .
- ^ Губарева Л., Мохан Т. (январь 2022 г.). «Противовирусные препараты, нацеленные на нейраминидазу» . Перспективы Колд-Спринг-Харбора в медицине . 12 (1): а038455. doi : 10.1101/cshperspect.a038455 . ПМЦ 8725622 . ПМИД 32152244 . S2CID 212651676 .
- ^ Джентри Б.Г., Богнер Э., Драк Дж.К. (январь 2019 г.). «Нацеливание на терминазу: важный шаг вперед в лечении и профилактике цитомегаловирусных инфекций человека». Противовирусные исследования . 161 : 116–124. дои : 10.1016/j.antiviral.2018.11.005 . ПМИД 30472161 . S2CID 53763831 .
- ^ Кур Р.Дж., Дороу Х.В. (1976). Карбаматные инсектициды: химия, биохимия и токсикология . Кливленд: CRC Press. ISBN 978-0-87819-052-2 .
- ^ Stone TW (октябрь 2020 г.). Нейротрансмиттеры и нейромодуляторы ЦНС: ацетилхолин (1-е изд.). Бока-Ратон: CRC Press. ISBN 978-1-00-009898-3 .
- ^ Гупта RC (2006). «Классификация и использование органофосфатов и карбаматов» . В Гупта RC (ред.). Токсикология фосфорорганических и карбаматных соединений . Амстердам: Elsevier Academic Press. стр. 5–24. ISBN 978-0-08-054310-9 . Архивировано из оригинала 21 июля 2022 года . Проверено 21 июля 2022 г.
- ^ Фармакидис С., Паснур М., Димачки М.М., Барон Р.Дж. (май 2018 г.). «Лечение миастении Гравис» . Неврологические клиники . 36 (2): 311–337. дои : 10.1016/j.ncl.2018.01.011 . ПМК 6690491 . ПМИД 29655452 .
- ^ Баттерворт Дж. Ф., И. В., Макки Д. К., Васник Дж. Д., ред. (2013). «Глава 12. Ингибиторы холинэстеразы и другие фармакологические антагонисты нейромышечных блокаторов». Клиническая анестезиология Моргана и Михаила (5-е изд.). МакГроу Хилл. Архивировано из оригинала 30 июня 2022 года . Проверено 9 апреля 2022 г.
- ^ Тапа С., Льв М., Сюй Х (2017). «Ацетилхолинэстераза: основная мишень для лекарств и инсектицидов». Мини-обзоры по медицинской химии . 17 (17): 1665–1676. дои : 10.2174/1389557517666170120153930 . ПМИД 28117022 .
- ^ Тан С., Эванс Р., Сингх Б. (март 2006 г.). «Гербицидные ингибиторы биосинтеза аминокислот и гербицидоустойчивые культуры». Аминокислоты . 30 (2): 195–204. дои : 10.1007/s00726-005-0254-1 . ПМИД 16547651 . S2CID 2358278 .
- ^ Хираи К., Учида А., Оно Р. (2012). «Основные пути синтеза современных классов гербицидов и агрохимических характеристик» . В Бёгер П., Вакабаяши К., Хираи К. (ред.). Классы гербицидов в развитии . Springer Science & Business Media. стр. 179–195. дои : 10.1007/978-3-642-59416-8_10 . ISBN 978-3-642-59416-8 . Архивировано из оригинала 27 июня 2022 года . Проверено 27 июня 2022 г.
Глава 10.2.1: Ингибиторы сульфонилмочевины ацетолактатсинтазы
- ^ Герцог С.О. (июль 1990 г.). «Обзор механизмов действия гербицидов» . Перспективы гигиены окружающей среды . 87 : 263–271. дои : 10.2307/3431034 . JSTOR 3431034 . ПМЦ 1567841 . ПМИД 1980104 .
- ^ Гангули АК, Аллури СС (12 сентября 2021 г.). «Глава 2: Ингибиторы ферментов». Медицинская химия: взгляд на то, как открываются лекарства . Бока-Ратон, Флорида: CRC Press. стр. 29–68. ISBN 978-1-00-043721-8 .
- ^ Руфер AC (апрель 2021 г.). «Открытие лекарств для ферментов» . Открытие наркотиков сегодня . 26 (4): 875–886. дои : 10.1016/j.drudis.2021.01.006 . ПМИД 33454380 . S2CID 231633284 .
- ^ Линдквист Р.Н. (октябрь 2013 г.). «Дизайн ингибиторов ферментов: аналоги переходного состояния». В Ариенс Э.Дж. (ред.). Дизайн лекарств: Медицинская химия: Серия монографий . Том. 5. Эльзевир. стр. 24–80.
- ^ Скапен Дж. (2006). «Структурная биология и открытие лекарств». Текущий фармацевтический дизайн . 12 (17): 2087–2097. дои : 10.2174/138161206777585201 . ПМИД 16796557 .
- ^ Гольке Х., Клебе Г. (август 2002 г.). «Подходы к описанию и прогнозированию сродства связывания низкомолекулярных лигандов с макромолекулярными рецепторами». Ангеванде Хеми . 41 (15): 2644–2676. doi : 10.1002/1521-3773(20020802)41:15<2644::AID-ANIE2644>3.0.CO;2-O . ПМИД 12203463 .
- ^ Коппитц М., Эйс К. (июнь 2006 г.). «Автоматизированная медицинская химия». Открытие наркотиков сегодня . 11 (11–12): 561–568. дои : 10.1016/j.drudis.2006.04.005 . ПМИД 16713909 .
- ^ Чулли А., Абелл С. (декабрь 2007 г.). «Фрагментарные подходы к ингибированию ферментов» . Современное мнение в области биотехнологии . 18 (6): 489–96. дои : 10.1016/j.copbio.2007.09.003 . ПМЦ 4441723 . ПМИД 17959370 .
- ^ Сатц А.Л., Куай Л., Пэн Икс (май 2021 г.). «Отбор и проверка химических библиотек, кодируемых ДНК, на предмет ферментов и клеточных мишеней» . Письма по биоорганической и медицинской химии . 39 : 127851. doi : 10.1016/j.bmcl.2021.127851 . ПМИД 33631371 . S2CID 232059044 .
- ^ Перес О, Пенья Дж, Фернандес-Вега В, Скампавиа Л, Спайсер Т (2019). «Глава 4: Высокопроизводительный скрининг». Открытие и разработка лекарств . Бока-Ратон, Флорида: CRC Press. стр. 47–69. ISBN 978-1-315-11347-0 .
- ^ Скарпино А., Ференци Г.Г., Кесеру Г.М. (2020). «Ковалентная стыковка в открытии лекарств: объем и ограничения». Текущий фармацевтический дизайн . 26 (44): 5684–5699. дои : 10.2174/1381612824999201105164942 . ПМИД 33155894 . S2CID 226271153 .
- ^ Эльсэссер Б., Геттиг П. (март 2021 г.). «Механизмы действия протеолитических ферментов и их ингибирование в исследованиях КМ/ММ» . Международный журнал молекулярных наук . 22 (6): 3232. doi : 10.3390/ijms22063232 . ПМЦ 8004986 . ПМИД 33810118 .
Внешние ссылки [ править ]
- «БРЕНДА» . Архивировано из оригинала 1 апреля 2022 года. , База данных ферментов со списками известных ингибиторов для каждой записи.
- «ПабХим» . Национальный центр биотехнологической информации . Национальная медицинская библиотека. База данных препаратов и ингибиторов ферментов
- «Символика и терминология в кинетике ферментов» . Архивировано из оригинала 20 июня 2006 г. Рекомендации Номенклатурного комитета Международного биохимического союза (NC-IUB) по терминологии ингибирования ферментов.
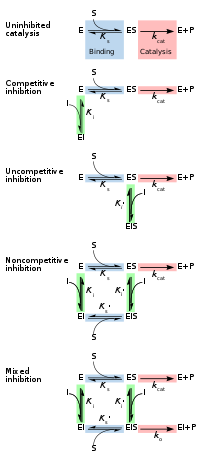

![{\displaystyle {\begin{aligned}{\cfrac {V_{\max }}{1+{\cfrac {\ce {[I]}}{K_{i}}}}}&={V_{\max }}\left({\cfrac {K_{i}}{K_{i}+[{\ce {I}}]}}\right)&&{\text{умножить на }}{\cfrac {K_{i }}{K_{i}}}=1\\&={V_{\max }}\left({\cfrac {K_{i}+[{\ce {I}}]-[{\ce {I }}]}{K_{i}+[{\ce {I}}]}}\right)&&{\text{add }}[{\ce {I}}]-[{\ce {I}} ]=0{\text{ в числитель}}\\&={V_{\max }}\left(1- {\cfrac {[{\ce {I}}]}{K_{i}+[{\ ce {I}}]}}\right)&&{\text{simplify }}{\cfrac {K_{i}+[{\ce {I}}]}{K_{i}+[{\ce {I }}]}}=1\\&=V_{\max }-V_{\max }{\cfrac {\ce {[I]}}{K_{i}+[{\ce {I}}]} }&&{\text{умножить на }}V_{\max }\end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/37eda4dec307f8acfca89b2d8f4811474ea764ec)
![{\displaystyle {\cfrac {\ce {[S]}}{[{\ce {S}}]+K_{m}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/eb08dd139085a394e6e7370f47ebfa255f1ad685)
![{\displaystyle {\cfrac {\ce {[I]}}{[{\ce {I}}]+K_{i}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9ed50a1f7a5f2c52f406b52263916ab48b268e07)
![{\displaystyle V_{\max }-\Delta V_{\max }{\cfrac {\ce {[I]}}{[{\ce {I}}]+K_{i}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7dff424ec79284c3a1cea14f0f82b0eaace53c69)
![{\displaystyle V_{\max 1}-(V_{\max 1}-V_{\max 2}){\cfrac {\ce {[I]}}{[{\ce {I}}]+K_{ я}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f3874623edd9524ba2741fe448927bf5cf0ab257)
![{\displaystyle V_{\max 1}-(V_{\max 1}-V_{\max 2}){\cfrac {\ce {[X]}}{[{\ce {X}}]+K_{ х}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/306d44733a89308883053e3b8372a8cf9ce0239b)
![{\displaystyle K_{m1}-(K_{m1}-K_{m2}){\cfrac {\ce {[X]}}{[{\ce {X}}]+K_{x}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/cb4e0de216e1e625bb803ee725bf85c9989a15f5)
![{\displaystyle V={\frac {V_{max}[S]}{\alpha K_{m}+\alpha ^{\prime }[S]}}={\frac {(1/\alpha ^{\ prime })V_{max}[S]}{(\alpha /\alpha ^{\prime })K_{m}+[S]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4a8f0a9dda1d308de7f090f99c2833f944f11a09)
![{\displaystyle \alpha =1+{\frac {[I]}{K_{i}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/57fcf54938a9784f9313437681b220079ff43ee5)
![{\displaystyle \alpha ^{\prime }=1+{\frac {[I]}{K_{i}^{\prime }}}.}](https://wikimedia.org/api/rest_v1/media/math/render/svg/65bf16742482cae7b0743781f47c327ddcf537e3)